第三节 水是常用的溶剂 同步测试
图片预览


文档简介
水和溶液
1.[2014·台州]2013年底,浙江省委、省政府发出了“治污水、防洪水、排涝水、保供水、抓节水”的五水共治动员令。下列做法与“五水共治”行动相符合的是 ( C )
A.围湖造田
B.随意倾倒生活垃圾
C.及时拧紧水龙头
D.工业废水直接排入河流
2.[2014·苏州]下列有关“配制50 g溶质质量分数为6%的氯化钠溶液”的操作错误的是 ( C )
A.使用托盘天平前,要先取下支撑托盘的垫圈,再调节天平平衡
B.称取氯化钠前,要在天平两端的托盘上分别放质量相同的纸片
C.移动游码使其右侧对齐3 g的刻度线,然后将氯化钠加到天平的右盘上
D.取用规格为50 mL的量筒量取47 mL水,快到所需刻度时改用胶头滴管
定容
【解析】 移动游码使其左侧对齐3 g的刻度线,因为游码对准左侧刻度线读数。
3.[2014·佛山]一种抗生素为粉末状固体,每瓶含0.5 g,注射时应配成质量分数为20%的溶液,则使用时每瓶至少需加入蒸馏水 ( B )
A.1.5 mL B.2 mL
C.3 mL D.4 mL
【解析】 溶液质量=0.5 g/20%=2.5 g,溶剂质量=2.5 g-0.5 g=2 g。
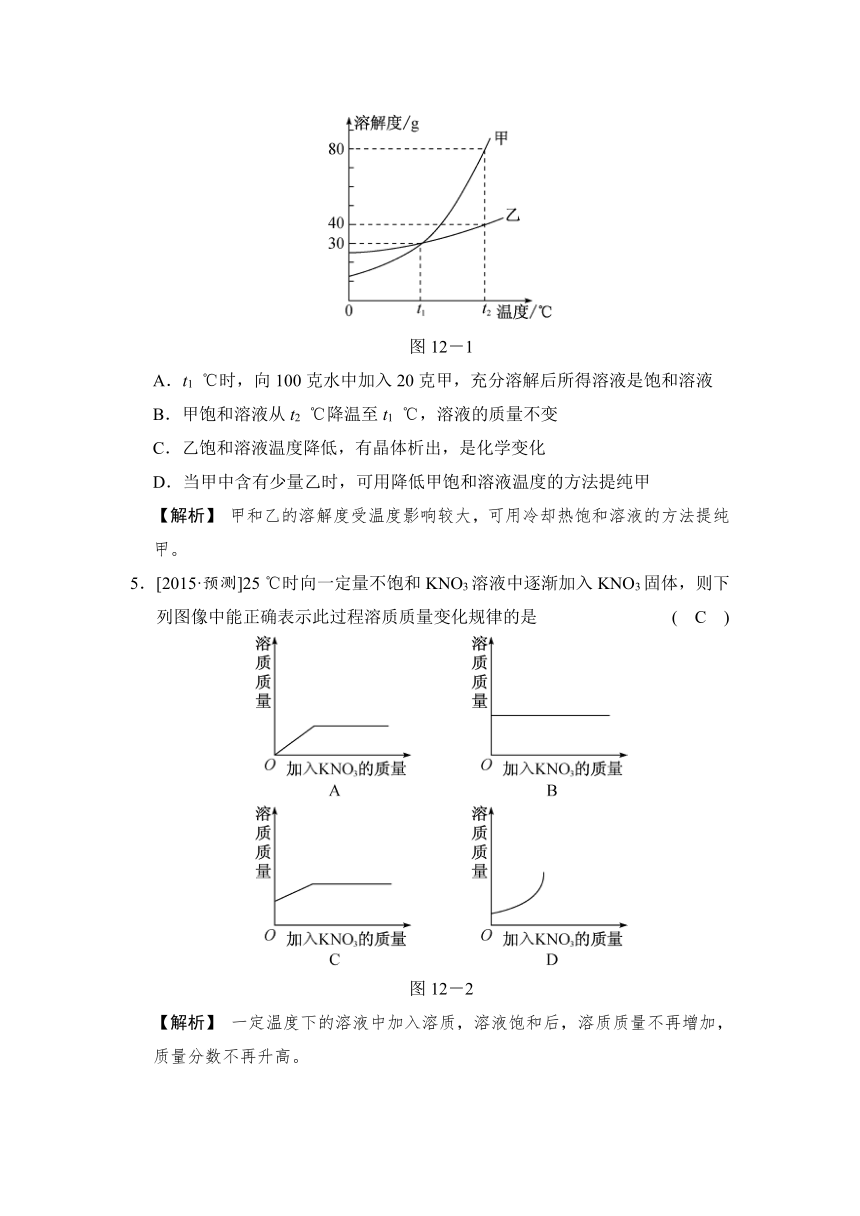
4.[2014·金华]如图12-1所示是甲、乙两种固体物质的溶解度曲线。下列说法正确的是 ( D )
图12-1
A.t1 ℃时,向100克水中加入20克甲,充分溶解后所得溶液是饱和溶液
B.甲饱和溶液从t2 ℃降温至t1 ℃,溶液的质量不变
C.乙饱和溶液温度降低,有晶体析出,是化学变化
D.当甲中含有少量乙时,可用降低甲饱和溶液温度的方法提纯甲
【解析】 甲和乙的溶解度受温度影响较大,可用冷却热饱和溶液的方法提纯甲。
5.[2015·预测]25 ℃时向一定量不饱和KNO3溶液中逐渐加入KNO3固体,则下列图像中能正确表示此过程溶质质量变化规律的是 ( C )
图12-2
【解析】 一定温度下的溶液中加入溶质,溶液饱和后,溶质质量不再增加,质量分数不再升高。
6.[2015·预测]下表是NaCl、KNO3在不同温度时的溶解度:
温度/℃ 10 20 30 40 50 60
溶解度/g NaCl 35.8 36.0 36.3 36.6 37.0 37.3
KNO3 20.4 31.6 45.8 63.9 85.5 110
据此数据,判断下列说法错误的是 ( C )
A.KNO3和NaCl的溶解度曲线在20 ℃-30 ℃温度范围内会相交
B.在60 ℃时,KNO3的饱和溶液100 g加入95 g KNO3后,溶液中溶质的质量分数为52.38%
C.在20 ℃时,NaCl和KNO3固体各35 g分别加入两只各盛有100 g水的烧杯中,均不能形成饱和溶液
D.从含有少量NaCl的KNO3饱和溶液中得到较多的KNO3晶体,通常可采用冷却热饱和溶液的方法
【解析】 饱和溶液中加入硝酸钾,不能继续溶解,20℃时硝酸钾的溶解度是31.6克,20℃时35克硝酸钾加入100克水后形成饱和溶液。
7.[2014·邵阳]在电解水的实验中可以直接观察到的现象是 ( D )
A.水是由氢、氧元素组成
B.有氢气和氧气产生,且体积比为2∶1
C.每个水分子是由两个氢原子和一个氧原子构成
D.两电极均冒气泡,阴极管内气体与阳极管内气体的体积比约为2∶1
【解析】 描述实验现象一般不描述物质名称,水电解产生氢气、氧气需要检验,不能观察得出。
8.[2014·重庆]自然界里水的三态(固态、液态、气态)循环过程中没有发生变化的是 ( A )
A.水的化学性质 B.水分子之间的间隔
C.水的物理性质 D.水分子的运动速率
【解析】 水循环过程是由于水的三态变化引起,该过程中水的化学性质不变。
9.[2014·江西]下面是“粗盐中难溶性杂质的去除”的实验操作示意图:
图12-3
(1)仪器a的名称__铁架台__;
(2)操作A中托盘两边各放一张大小相同的纸片,其作用是__防止腐蚀天平的托盘(或污染药品)__;
(3)操作B中还需要用到的仪器是__胶头滴管__;
(4)操作C过滤时倒入液体的液面要低于滤纸边缘主要是为了防止(填序号)__C__;
A.过滤速度慢
B.滤纸破损
C.杂质未经过滤就进入滤液
(5)图中部分操作有错误,其中有的错误会导致精盐产率明显偏低,其原因是__未用玻璃棒搅拌,造成液滴飞溅__。
INCLUDEPICTURE "../../../B组.eps" \* MERGEFORMAT
10.[2013·资阳]t ℃时,向一支盛有0.15 g熟石灰的烧杯中加入50 g水,充分振荡后静置,烧杯底部仍有未溶解的白色固体。下列相关叙述正确的是( C )
A.升高温度上层清液变为不饱和溶液
B.t ℃时,熟石灰的溶解度为0.3 g
C.烧杯中溶液的质量小于50.15 g
D.上层清液中溶质质量分数大于0.3%
【解析】 氢氧化钙的溶解度随着温度的升高而降低。
11.[2013·达州]A、B两物质的溶解度曲线如图12-4所示,请根据曲线回答下列问题:
(1)t1 ℃时,A的饱和溶液中溶质与溶液质量比__S∶(100+S)__;
(2)若B中含有少量A,应用__蒸发结晶__法提纯B;
(3)若将A的饱和溶液从t2 ℃降温到t1 ℃时,一定不会发生改变的是__B__。
A.溶解度 B.溶剂质量
C.溶质质量 D.溶质质量分数
INCLUDEPICTURE "../../../C组.eps" \* MERGEFORMAT
12.[2014·济宁]如图12-5所示为硝酸钾和氯化钠两种物质的饱和溶液的质量分数随温度变化的曲线,M、N分别是50 ℃时硝酸钾和氯化钠质量分数随温度变化曲线上的点。分析曲线得到的以下结论中,正确的是 ( B )
图12-5
A.50 ℃时,M、N之间任一点表示的溶液一定是硝酸钾和氯化钠的饱和溶液
B.50 ℃时,其他条件不变,升温至60 ℃,M点向右平移,硝酸钾的溶解度增大
C.50 ℃时,其他条件不变,降温至40 ℃,N点向右平移,氯化钠的溶解度减小
D.50 ℃时,向两饱和溶液添加溶质,M点不动,硝酸钾和氯化钠的溶解度增大
【解析】 该坐标图像的纵坐标表示溶质质量分数,但在一定温度下,饱和溶液的质量分数最大。
13.[2013·重庆]t2 ℃时,将等质量的a、b两种可溶性固体分别加入盛有相同质量水的烧杯中,充分搅拌后的现象如图12-6(1)所示,a、b两种物质的溶解度曲线如图12-6(2)所示。请结合图示回答下列问题:
(1) (2)
图12-6
(1)图(1)中,__a__(填“a”或“b”)物质的溶解一定达到了饱和状态。
(2)图(2)中,__乙__(填“甲”或“乙”)表示a的溶解度曲线。
(3)将图1中a溶液的温度从t2 ℃降低到t1 ℃,所得溶液与原溶液相比较,通常没有发生变化的是__B__(填序号)。
A.溶液的浓度 B.溶剂的质量 C.溶解度
14.[2014·乐山]向26.4 g硫酸钠和碳酸钠的混合物中滴加硫酸溶液,直到不再产生气体为止(假设气体全部逸出),共用去98 g质量分数为10%的硫酸溶液。求:
(1)原混合物中碳酸钠的质量。
(2)反应后溶液中溶质的质量分数。
【答案】 (1)10.6 g (2)25%
【解析】 (1)设原混合物中碳酸钠的质量为x,生成Na2SO4的质量为y,生成CO2质量为z。
Na2CO3+H2SO4―→Na2SO4+CO2↑+H2O
106 98 142 44
x 98 g×10% y z
=, x=10.6 g;
=, y=14.2 g;
=, z=4.4 g,
原混合物中Na2SO4的质量为26.4 g-10.6 g=15.8 g。
(2)反应后溶液中Na2SO4的总质量为
15.8 g+14.2 g=30 g,
反应后溶液的质量分数为
×100%=25%。
图12-4
1.[2014·台州]2013年底,浙江省委、省政府发出了“治污水、防洪水、排涝水、保供水、抓节水”的五水共治动员令。下列做法与“五水共治”行动相符合的是 ( C )
A.围湖造田
B.随意倾倒生活垃圾
C.及时拧紧水龙头
D.工业废水直接排入河流
2.[2014·苏州]下列有关“配制50 g溶质质量分数为6%的氯化钠溶液”的操作错误的是 ( C )
A.使用托盘天平前,要先取下支撑托盘的垫圈,再调节天平平衡
B.称取氯化钠前,要在天平两端的托盘上分别放质量相同的纸片
C.移动游码使其右侧对齐3 g的刻度线,然后将氯化钠加到天平的右盘上
D.取用规格为50 mL的量筒量取47 mL水,快到所需刻度时改用胶头滴管
定容
【解析】 移动游码使其左侧对齐3 g的刻度线,因为游码对准左侧刻度线读数。
3.[2014·佛山]一种抗生素为粉末状固体,每瓶含0.5 g,注射时应配成质量分数为20%的溶液,则使用时每瓶至少需加入蒸馏水 ( B )
A.1.5 mL B.2 mL
C.3 mL D.4 mL
【解析】 溶液质量=0.5 g/20%=2.5 g,溶剂质量=2.5 g-0.5 g=2 g。
4.[2014·金华]如图12-1所示是甲、乙两种固体物质的溶解度曲线。下列说法正确的是 ( D )
图12-1
A.t1 ℃时,向100克水中加入20克甲,充分溶解后所得溶液是饱和溶液
B.甲饱和溶液从t2 ℃降温至t1 ℃,溶液的质量不变
C.乙饱和溶液温度降低,有晶体析出,是化学变化
D.当甲中含有少量乙时,可用降低甲饱和溶液温度的方法提纯甲
【解析】 甲和乙的溶解度受温度影响较大,可用冷却热饱和溶液的方法提纯甲。
5.[2015·预测]25 ℃时向一定量不饱和KNO3溶液中逐渐加入KNO3固体,则下列图像中能正确表示此过程溶质质量变化规律的是 ( C )
图12-2
【解析】 一定温度下的溶液中加入溶质,溶液饱和后,溶质质量不再增加,质量分数不再升高。
6.[2015·预测]下表是NaCl、KNO3在不同温度时的溶解度:
温度/℃ 10 20 30 40 50 60
溶解度/g NaCl 35.8 36.0 36.3 36.6 37.0 37.3
KNO3 20.4 31.6 45.8 63.9 85.5 110
据此数据,判断下列说法错误的是 ( C )
A.KNO3和NaCl的溶解度曲线在20 ℃-30 ℃温度范围内会相交
B.在60 ℃时,KNO3的饱和溶液100 g加入95 g KNO3后,溶液中溶质的质量分数为52.38%
C.在20 ℃时,NaCl和KNO3固体各35 g分别加入两只各盛有100 g水的烧杯中,均不能形成饱和溶液
D.从含有少量NaCl的KNO3饱和溶液中得到较多的KNO3晶体,通常可采用冷却热饱和溶液的方法
【解析】 饱和溶液中加入硝酸钾,不能继续溶解,20℃时硝酸钾的溶解度是31.6克,20℃时35克硝酸钾加入100克水后形成饱和溶液。
7.[2014·邵阳]在电解水的实验中可以直接观察到的现象是 ( D )
A.水是由氢、氧元素组成
B.有氢气和氧气产生,且体积比为2∶1
C.每个水分子是由两个氢原子和一个氧原子构成
D.两电极均冒气泡,阴极管内气体与阳极管内气体的体积比约为2∶1
【解析】 描述实验现象一般不描述物质名称,水电解产生氢气、氧气需要检验,不能观察得出。
8.[2014·重庆]自然界里水的三态(固态、液态、气态)循环过程中没有发生变化的是 ( A )
A.水的化学性质 B.水分子之间的间隔
C.水的物理性质 D.水分子的运动速率
【解析】 水循环过程是由于水的三态变化引起,该过程中水的化学性质不变。
9.[2014·江西]下面是“粗盐中难溶性杂质的去除”的实验操作示意图:
图12-3
(1)仪器a的名称__铁架台__;
(2)操作A中托盘两边各放一张大小相同的纸片,其作用是__防止腐蚀天平的托盘(或污染药品)__;
(3)操作B中还需要用到的仪器是__胶头滴管__;
(4)操作C过滤时倒入液体的液面要低于滤纸边缘主要是为了防止(填序号)__C__;
A.过滤速度慢
B.滤纸破损
C.杂质未经过滤就进入滤液
(5)图中部分操作有错误,其中有的错误会导致精盐产率明显偏低,其原因是__未用玻璃棒搅拌,造成液滴飞溅__。
INCLUDEPICTURE "../../../B组.eps" \* MERGEFORMAT
10.[2013·资阳]t ℃时,向一支盛有0.15 g熟石灰的烧杯中加入50 g水,充分振荡后静置,烧杯底部仍有未溶解的白色固体。下列相关叙述正确的是( C )
A.升高温度上层清液变为不饱和溶液
B.t ℃时,熟石灰的溶解度为0.3 g
C.烧杯中溶液的质量小于50.15 g
D.上层清液中溶质质量分数大于0.3%
【解析】 氢氧化钙的溶解度随着温度的升高而降低。
11.[2013·达州]A、B两物质的溶解度曲线如图12-4所示,请根据曲线回答下列问题:
(1)t1 ℃时,A的饱和溶液中溶质与溶液质量比__S∶(100+S)__;
(2)若B中含有少量A,应用__蒸发结晶__法提纯B;
(3)若将A的饱和溶液从t2 ℃降温到t1 ℃时,一定不会发生改变的是__B__。
A.溶解度 B.溶剂质量
C.溶质质量 D.溶质质量分数
INCLUDEPICTURE "../../../C组.eps" \* MERGEFORMAT
12.[2014·济宁]如图12-5所示为硝酸钾和氯化钠两种物质的饱和溶液的质量分数随温度变化的曲线,M、N分别是50 ℃时硝酸钾和氯化钠质量分数随温度变化曲线上的点。分析曲线得到的以下结论中,正确的是 ( B )
图12-5
A.50 ℃时,M、N之间任一点表示的溶液一定是硝酸钾和氯化钠的饱和溶液
B.50 ℃时,其他条件不变,升温至60 ℃,M点向右平移,硝酸钾的溶解度增大
C.50 ℃时,其他条件不变,降温至40 ℃,N点向右平移,氯化钠的溶解度减小
D.50 ℃时,向两饱和溶液添加溶质,M点不动,硝酸钾和氯化钠的溶解度增大
【解析】 该坐标图像的纵坐标表示溶质质量分数,但在一定温度下,饱和溶液的质量分数最大。
13.[2013·重庆]t2 ℃时,将等质量的a、b两种可溶性固体分别加入盛有相同质量水的烧杯中,充分搅拌后的现象如图12-6(1)所示,a、b两种物质的溶解度曲线如图12-6(2)所示。请结合图示回答下列问题:
(1) (2)
图12-6
(1)图(1)中,__a__(填“a”或“b”)物质的溶解一定达到了饱和状态。
(2)图(2)中,__乙__(填“甲”或“乙”)表示a的溶解度曲线。
(3)将图1中a溶液的温度从t2 ℃降低到t1 ℃,所得溶液与原溶液相比较,通常没有发生变化的是__B__(填序号)。
A.溶液的浓度 B.溶剂的质量 C.溶解度
14.[2014·乐山]向26.4 g硫酸钠和碳酸钠的混合物中滴加硫酸溶液,直到不再产生气体为止(假设气体全部逸出),共用去98 g质量分数为10%的硫酸溶液。求:
(1)原混合物中碳酸钠的质量。
(2)反应后溶液中溶质的质量分数。
【答案】 (1)10.6 g (2)25%
【解析】 (1)设原混合物中碳酸钠的质量为x,生成Na2SO4的质量为y,生成CO2质量为z。
Na2CO3+H2SO4―→Na2SO4+CO2↑+H2O
106 98 142 44
x 98 g×10% y z
=, x=10.6 g;
=, y=14.2 g;
=, z=4.4 g,
原混合物中Na2SO4的质量为26.4 g-10.6 g=15.8 g。
(2)反应后溶液中Na2SO4的总质量为
15.8 g+14.2 g=30 g,
反应后溶液的质量分数为
×100%=25%。
图12-4
同课章节目录
- 第1章 水
- 1 地球上的水
- 2 水的三态变化
- 3 水是常用的溶剂
- 4 配制溶液
- 5 水的组成
- 6 水资源的利用和保护
- 第2章 空气
- 1 空气的存在
- 2 空气的成分
- 3 氧气
- 4 二氧化碳
- 5 保护大气圈
- 第3章 阳光
- 1 太阳辐射能
- 2 阳光的传播
- 3 阳光的组成
- 第4章 土壤
- 1 土壤的组成和性状
- 2 土壤与植物
- 3 人类活动与土壤
- 第5章 生态系统
- 1 种群和群落
- 2 生态系统
- 3 生物圈
- 第6章 动物和人的生殖与发育
- 1 动物的生殖与发育
- 2 人的生殖与发育
- 第7章 植物和微生物的生殖与发育
- 1 绿色开花植物的有性生殖和发育
- 2 种子的萌发和幼苗形成
- 3 植物的无性生殖
- 4 细菌和真菌的繁殖
