2.1 课时1 原子核外电子的运动特征(23页)课件 2024-2025学年高二化学苏教版(2019)选择性必修第二册
文档属性
| 名称 | 2.1 课时1 原子核外电子的运动特征(23页)课件 2024-2025学年高二化学苏教版(2019)选择性必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-22 11:42:05 | ||
图片预览




文档简介
(共23张PPT)
原子核外电子的运动特征
1.了解人类对原子结构的认知历程
2.认识原子核外电子的运动特征
3.理解原子轨道和能级的概念
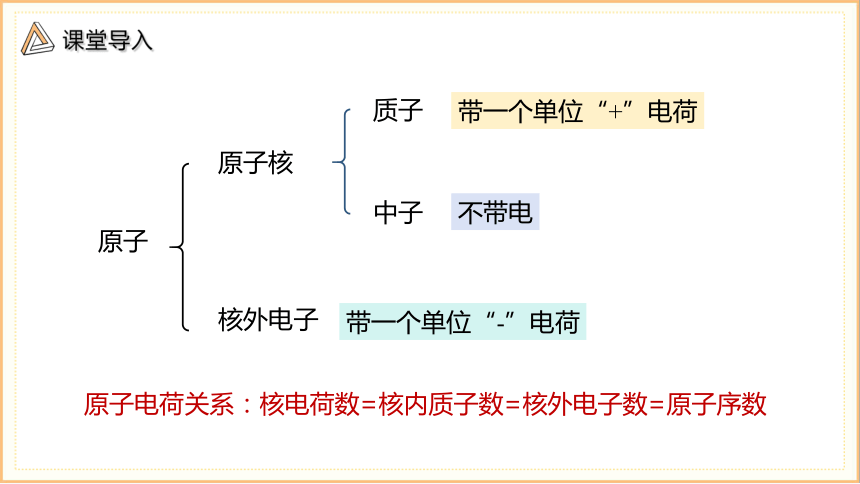
原子
原子核
核外电子
质子
中子
带一个单位“+”电荷
带一个单位“-”电荷
不带电
原子电荷关系:
核电荷数=核内质子数=核外电子数=原子序数
人类对原子结构的认识
实心球模型
19世纪,英国科学家道尔顿提出了近代原子论,认为原子有质量,不可分割。
人类对原子结构的认识
葡萄干面包模型
19世纪末,英国物理学家汤姆生发现了电子,他推测这种粒子是均匀地嵌在云状的正电荷球体中,于是提出了“葡萄干面包式”的原子结构模型,并将这种粒子命名为电子。
人类对原子结构的认识
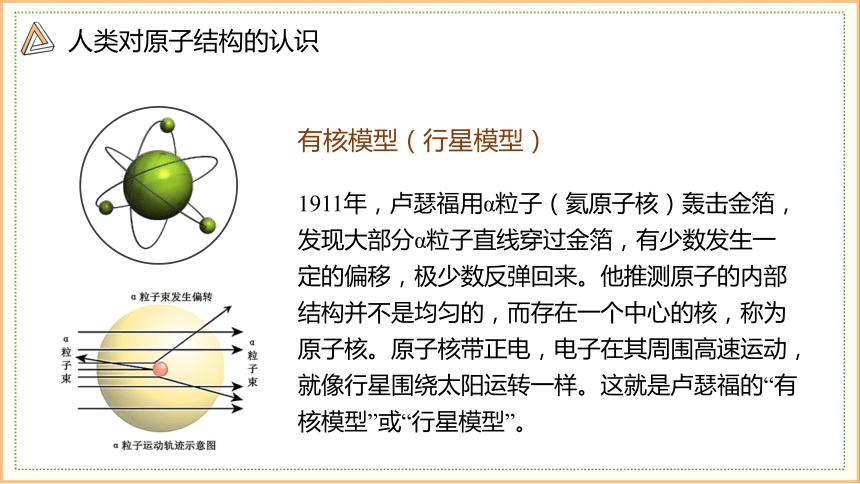
有核模型(行星模型)
1911年,卢瑟福用α粒子(氦原子核)轰击金箔,发现大部分α粒子直线穿过金箔,有少数发生一定的偏移,极少数反弹回来。他推测原子的内部结构并不是均匀的,而存在一个中心的核,称为原子核。原子核带正电,电子在其周围高速运动,就像行星围绕太阳运转一样。这就是卢瑟福的“有核模型”或“行星模型”。
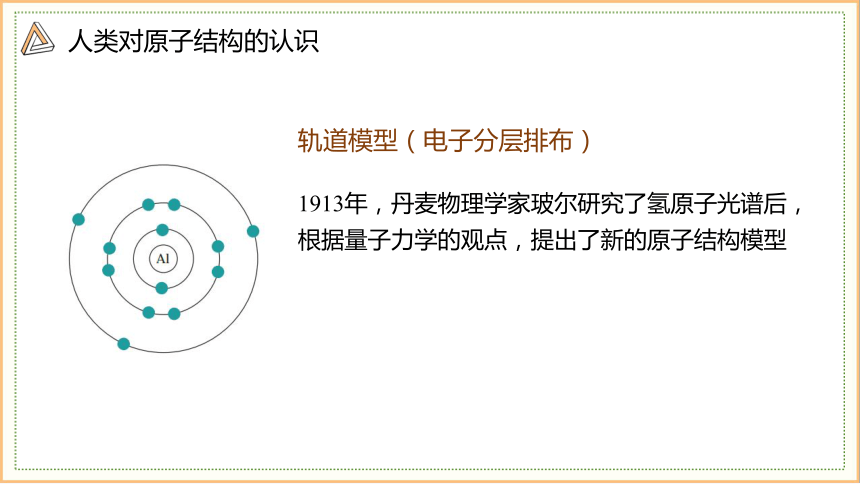
轨道模型(电子分层排布)
1913年,丹麦物理学家玻尔研究了氢原子光谱后,根据量子力学的观点,提出了新的原子结构模型
人类对原子结构的认识
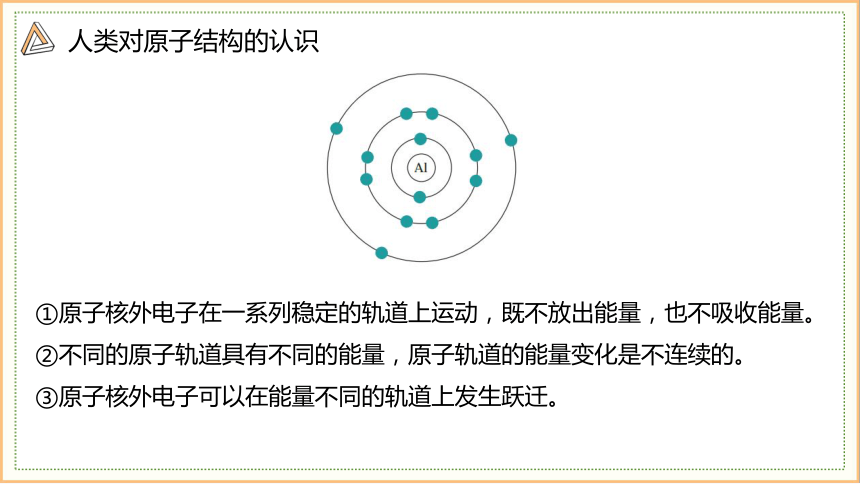
①原子核外电子在一系列稳定的轨道上运动,既不放出能量,也不吸收能量。
②不同的原子轨道具有不同的能量,原子轨道的能量变化是不连续的。
③原子核外电子可以在能量不同的轨道上发生跃迁。
人类对原子结构的认识
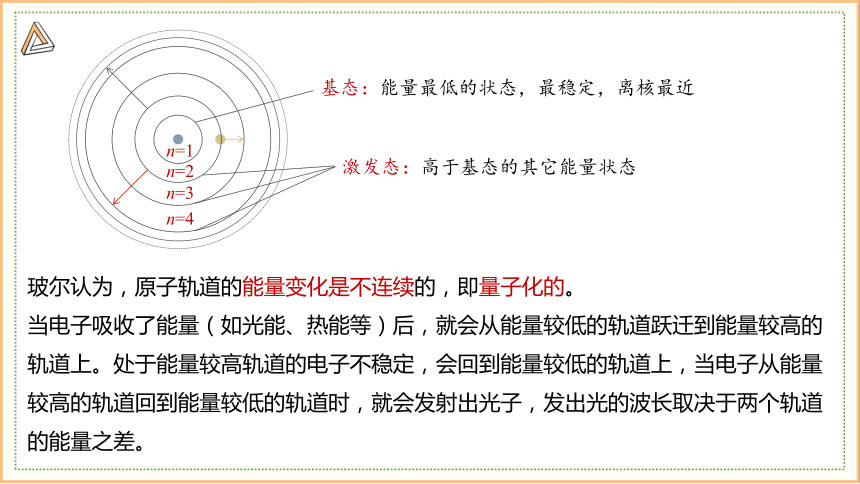
n=1
n=2
n=3
n=4
基态:能量最低的状态,最稳定,离核最近
激发态:高于基态的其它能量状态
玻尔认为,原子轨道的能量变化是不连续的,即量子化的。
当电子吸收了能量(如光能、热能等)后,就会从能量较低的轨道跃迁到能量较高的轨道上。处于能量较高轨道的电子不稳定,会回到能量较低的轨道上,当电子从能量较高的轨道回到能量较低的轨道时,就会发射出光子,发出光的波长取决于两个轨道的能量之差。
科学家采用统计方法来描述电子在原子核外某一区域出现的机会。电子在原子核外空间出现的机会是有规律的。
氢原子的核外电子,当处于能量最低状态时(简称基态),电子主要在原子核周围的球形区域内运动。
运动区域距离核近,电子出现的机会大
运动区域距离核远,电子出现的机会小
电子层
根据电子的能量差异和主要运动区域的不同,认为核外电子处于不同的电子层上,用n表示
分层标准 电子离核的远近 电子层(n) 1 2 3 4 5 6 7
符号 __ __ __ __ __ __ __
能量 _______ 离核 _______ K
L
M
N
O
P
Q
低→高
近→远
能级与原子轨道
电子在原子核外的一个空间运动状态称为一个原子轨道。原子轨道是用量子力学描述电子在原子核外空间运动的主要区域。
原子轨道用表示电子层的n和表示原子轨道形状的s、p、d、f 结合起来共同表示。
如1s、2s、2p(2px、2py、2pz)、3d等。
电子层与能级之间的关系
1.能级是用电子层序数(1/2/3等)与原子轨道形状(s/p/d/f等)组合起来表示的。
2.任意能层的能级总是从s能级开始的,且能级数=该能层序数。
如第一能层只能有1个能级(1s),第二能层有2个能级(2s,2p),第三能层有3个能级(3s,3p,3d)以此类推
能级与原子轨道
轨道的类型不同,能量不同,形状也不同。
原子轨道
球形对称,一个原子轨道;
n越大,原子轨道的半径越大。
s 轨道:
p 轨道:
p 电子云轮廓图是纺锤形的。每个p能级都有3个相互垂直的电子云,分别称为px、py,和pz,右下标x、y、z分别是p电子云在直角坐标系里的取向。
d轨道和f轨道:
原子轨道
d轨道有5个伸展方向(5个轨道)
f轨道有7个伸展方向(7个轨道)
原子轨道的类型
原子轨道 形状 延伸方向 轨道数 可容纳的
电子数
s
p
d
f
球形
1
1
2
纺锤形
3
3
6
5
5
10
7
7
14
原子轨道的伸展方向=原子轨道数
原子轨道
原子轨道能量高低规律
2.形状相同的原子轨道能量的高低:1s<2s<3s<4s…
1.处于相同电子层的原子轨道能量的高低:ns<np<nd<nf。
3.电子层和形状均相同的原子轨道的能量相等,如2px、2py、2pz轨道的能量相等。
比较下列多电子原子的原子轨道的能量高低。
(1)1s、3d
(2)3s、3p、3d
(3)2p、3p、4p
2.将下列多电子原子的原子轨道按轨道能量由高到低的顺序排列。
1s、4p、2s、3s、5f、4s。
电子自旋
原子核外电子的自旋可以有两种不同的状态,通常人们用向上的箭头“↑”和向下的箭头“↓”来表示这两种不同的自旋状态。
“电子自旋”并非真像地球绕轴自转一样,它只是代表电子的两种不同状态。
人类对原子结构的认识
原子核外电子的运动特征
发展历程
波尔模型理论
电子云
电子层
原子轨道与能级
电子自旋
D
1. 下列有关电子云和原子轨道的说法正确的是( )
A.原子核外的电子像云雾一样笼罩在原子核周围,故称电子云
B.s能级的原子轨道呈球形,处在该轨道上的电子只能在球壳内运动
C.氢原子的电子云中,小点表示电子的运动轨迹
D.与s电子原子轨道相同,p电子原子轨道的平均半径随电子层的增大而增大
2.下图是s轨道、p轨道的原子轨道图。试回答下列问题:
(1)s轨道呈____形,每个s轨道有___个原子轨道;
p轨道呈______形,每个p轨道有___个原子轨道。
(2)s轨道的原子轨道、p轨道的原子轨道的半径
与____________有关,____________越大,原子
轨道半径越大。
球
1
纺锤
3
电子层序数
电子层序数
原子核外电子的运动特征
1.了解人类对原子结构的认知历程
2.认识原子核外电子的运动特征
3.理解原子轨道和能级的概念
原子
原子核
核外电子
质子
中子
带一个单位“+”电荷
带一个单位“-”电荷
不带电
原子电荷关系:
核电荷数=核内质子数=核外电子数=原子序数
人类对原子结构的认识
实心球模型
19世纪,英国科学家道尔顿提出了近代原子论,认为原子有质量,不可分割。
人类对原子结构的认识
葡萄干面包模型
19世纪末,英国物理学家汤姆生发现了电子,他推测这种粒子是均匀地嵌在云状的正电荷球体中,于是提出了“葡萄干面包式”的原子结构模型,并将这种粒子命名为电子。
人类对原子结构的认识
有核模型(行星模型)
1911年,卢瑟福用α粒子(氦原子核)轰击金箔,发现大部分α粒子直线穿过金箔,有少数发生一定的偏移,极少数反弹回来。他推测原子的内部结构并不是均匀的,而存在一个中心的核,称为原子核。原子核带正电,电子在其周围高速运动,就像行星围绕太阳运转一样。这就是卢瑟福的“有核模型”或“行星模型”。
轨道模型(电子分层排布)
1913年,丹麦物理学家玻尔研究了氢原子光谱后,根据量子力学的观点,提出了新的原子结构模型
人类对原子结构的认识
①原子核外电子在一系列稳定的轨道上运动,既不放出能量,也不吸收能量。
②不同的原子轨道具有不同的能量,原子轨道的能量变化是不连续的。
③原子核外电子可以在能量不同的轨道上发生跃迁。
人类对原子结构的认识
n=1
n=2
n=3
n=4
基态:能量最低的状态,最稳定,离核最近
激发态:高于基态的其它能量状态
玻尔认为,原子轨道的能量变化是不连续的,即量子化的。
当电子吸收了能量(如光能、热能等)后,就会从能量较低的轨道跃迁到能量较高的轨道上。处于能量较高轨道的电子不稳定,会回到能量较低的轨道上,当电子从能量较高的轨道回到能量较低的轨道时,就会发射出光子,发出光的波长取决于两个轨道的能量之差。
科学家采用统计方法来描述电子在原子核外某一区域出现的机会。电子在原子核外空间出现的机会是有规律的。
氢原子的核外电子,当处于能量最低状态时(简称基态),电子主要在原子核周围的球形区域内运动。
运动区域距离核近,电子出现的机会大
运动区域距离核远,电子出现的机会小
电子层
根据电子的能量差异和主要运动区域的不同,认为核外电子处于不同的电子层上,用n表示
分层标准 电子离核的远近 电子层(n) 1 2 3 4 5 6 7
符号 __ __ __ __ __ __ __
能量 _______ 离核 _______ K
L
M
N
O
P
Q
低→高
近→远
能级与原子轨道
电子在原子核外的一个空间运动状态称为一个原子轨道。原子轨道是用量子力学描述电子在原子核外空间运动的主要区域。
原子轨道用表示电子层的n和表示原子轨道形状的s、p、d、f 结合起来共同表示。
如1s、2s、2p(2px、2py、2pz)、3d等。
电子层与能级之间的关系
1.能级是用电子层序数(1/2/3等)与原子轨道形状(s/p/d/f等)组合起来表示的。
2.任意能层的能级总是从s能级开始的,且能级数=该能层序数。
如第一能层只能有1个能级(1s),第二能层有2个能级(2s,2p),第三能层有3个能级(3s,3p,3d)以此类推
能级与原子轨道
轨道的类型不同,能量不同,形状也不同。
原子轨道
球形对称,一个原子轨道;
n越大,原子轨道的半径越大。
s 轨道:
p 轨道:
p 电子云轮廓图是纺锤形的。每个p能级都有3个相互垂直的电子云,分别称为px、py,和pz,右下标x、y、z分别是p电子云在直角坐标系里的取向。
d轨道和f轨道:
原子轨道
d轨道有5个伸展方向(5个轨道)
f轨道有7个伸展方向(7个轨道)
原子轨道的类型
原子轨道 形状 延伸方向 轨道数 可容纳的
电子数
s
p
d
f
球形
1
1
2
纺锤形
3
3
6
5
5
10
7
7
14
原子轨道的伸展方向=原子轨道数
原子轨道
原子轨道能量高低规律
2.形状相同的原子轨道能量的高低:1s<2s<3s<4s…
1.处于相同电子层的原子轨道能量的高低:ns<np<nd<nf。
3.电子层和形状均相同的原子轨道的能量相等,如2px、2py、2pz轨道的能量相等。
比较下列多电子原子的原子轨道的能量高低。
(1)1s、3d
(2)3s、3p、3d
(3)2p、3p、4p
2.将下列多电子原子的原子轨道按轨道能量由高到低的顺序排列。
1s、4p、2s、3s、5f、4s。
电子自旋
原子核外电子的自旋可以有两种不同的状态,通常人们用向上的箭头“↑”和向下的箭头“↓”来表示这两种不同的自旋状态。
“电子自旋”并非真像地球绕轴自转一样,它只是代表电子的两种不同状态。
人类对原子结构的认识
原子核外电子的运动特征
发展历程
波尔模型理论
电子云
电子层
原子轨道与能级
电子自旋
D
1. 下列有关电子云和原子轨道的说法正确的是( )
A.原子核外的电子像云雾一样笼罩在原子核周围,故称电子云
B.s能级的原子轨道呈球形,处在该轨道上的电子只能在球壳内运动
C.氢原子的电子云中,小点表示电子的运动轨迹
D.与s电子原子轨道相同,p电子原子轨道的平均半径随电子层的增大而增大
2.下图是s轨道、p轨道的原子轨道图。试回答下列问题:
(1)s轨道呈____形,每个s轨道有___个原子轨道;
p轨道呈______形,每个p轨道有___个原子轨道。
(2)s轨道的原子轨道、p轨道的原子轨道的半径
与____________有关,____________越大,原子
轨道半径越大。
球
1
纺锤
3
电子层序数
电子层序数
