2.1 课时2 原子核外电子的排布(28页)课件 2024-2025学年高二化学苏教版(2019)选择性必修第二册
文档属性
| 名称 | 2.1 课时2 原子核外电子的排布(28页)课件 2024-2025学年高二化学苏教版(2019)选择性必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-22 11:44:00 | ||
图片预览






文档简介
(共28张PPT)
专题2 原子结构与元素性质
原子核外电子的排布
1.从微观层面理解原子的组成及结构,了解核外电子的排布规则,培养宏观辨识与微观探析的化学学科核心素养。
2.能结合能量最低原理、泡利不相容原理和洪特规则书写和说明1~36号元素基态原子的核外电子排布式和轨道表示式,发展证据推理与模型认知的化学学科核心素养。
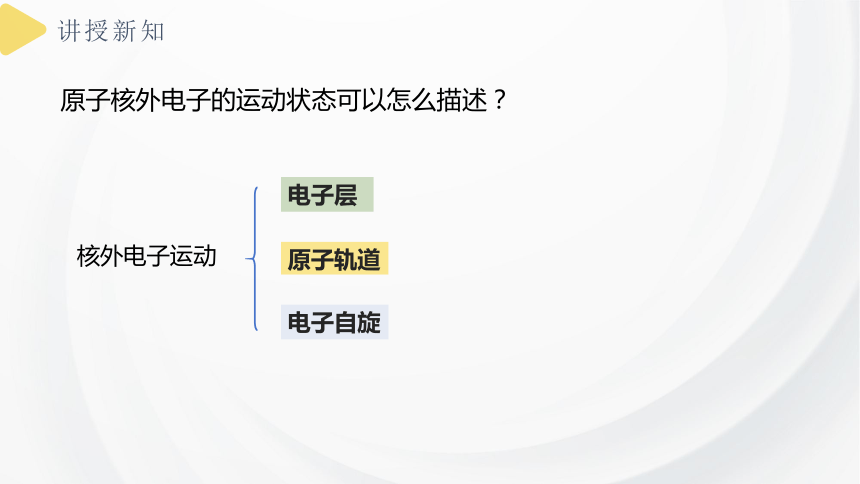
原子核外电子的运动状态可以怎么描述?
核外电子运动
电子层
原子轨道
电子自旋
一、原子核外电子排布的构造原理
科学家经过研究发现,电子是按顺序填充的,填满一个能级之后再填下一个能级,这种规律称为构造原理。
轨道能量排列顺序
“能级交错”现象
排布遵循两个原理一个规则
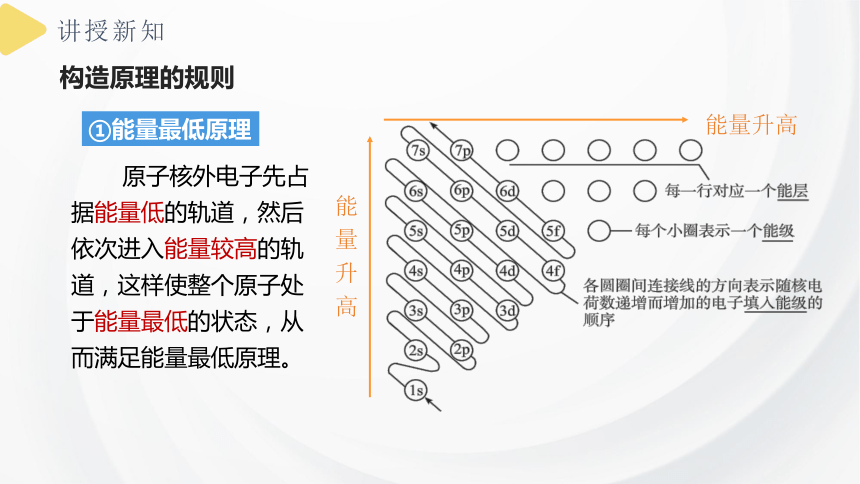
构造原理的规则
①能量最低原理
原子核外电子先占据能量低的轨道,然后依次进入能量较高的轨道,这样使整个原子处于能量最低的状态,从而满足能量最低原理。
能量升高
能量升高
7
6
5
4
3
2
1
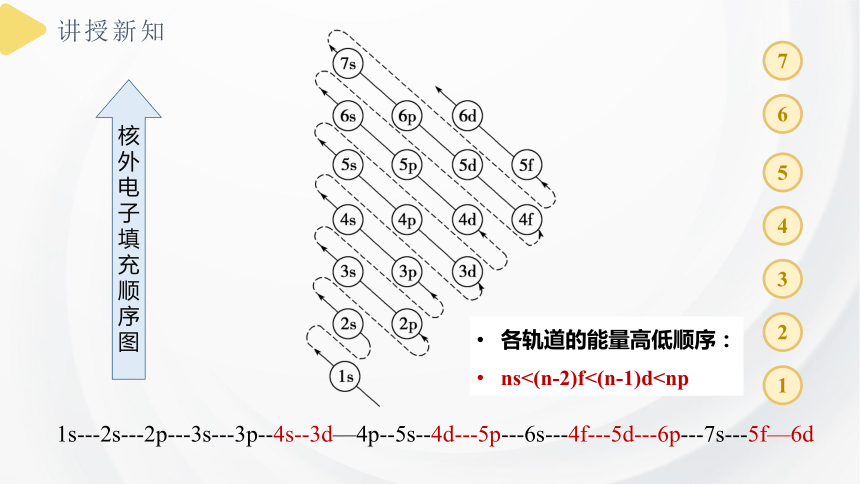
1s---2s---2p---3s---3p--4s--3d—4p--5s--4d---5p---6s---4f---5d---6p---7s---5f—6d
各轨道的能量高低顺序:
ns<(n-2)f<(n-1)d核
外
电
子
填
充
顺
序
图
构造原理的规则
②泡利不相容原理
每个原子轨道最多容纳两个自旋状态不同的电子。
每一种运动状态的电子只有一个。
由于每一个原子轨道包括两种运动状态,所以每一个原子轨道最多只能容纳两个自旋方向相反的电子。
因为s、p、d、f轨道的原子轨道数分别为1,3,5,7个,所以s、p、d、f各原子轨道分别最多能容纳2,6,10,14个电子。
1
2
3
He
3p
3s
2p
2s
1s
↑↓
能量
构造原理的规则
③洪特规则
原子核外电子在能量相同的各个轨道上排布时,电子尽可能分占在不同的原子轨道上,且自旋状态相同,这样整个原子的能量最低,这个规则称为洪特规则。
写出基态碳原子可能的轨道表示式
② C
1s
↑↑
↑↓
↑↓
2s
2p
① C
1s
↑↓
↑↓
↑↓
2s
2p
2p
③ C
↑
1s
↑
↑↓
↑↓
2s
2p
④ C
↓
1s
↑
↑↓
↑↓
2s
√
③洪特规则特例
光谱实验发现,能量相同的原子轨道在全满、半满和全空条件时,
体系能量较低,原子较稳定。
相对稳定的状态
全充满:p6、d10、f14
半充满:p3、d5、f7
全空:p0、d0、f0
二、电子排布式
将能级所容纳的电子数标在该能级符号的右上角,并将电子层低的能级写在左边,得到的式子为电子排布式。
Na
1s22s22p63s1
能层 K L M N 最多电子数 能级
填充电子数
请写出25Mn和35Br的电子排布式和原子结构示意图
方法总结:1.主族元素:0族元素加法或改写法
2.先写内层最外层,再写次外层
3.先写各能层能级电子排布,再分层书写结构示意图
二、简化电子排布式
可以把内层电子已达到稀有气体结构的部分写成“原子实”
Na
1s22s22p63s1
熟记0族元素的原子序数
→[Ne]3s1
元素 名称 元素 符号 原子序数 各电子层的电子数 K 1 L 2 M 3 N 4 O 5 P 6 最外层电子数
氦 He 2 2 2
氖 Ne 10 2 8 8
氩 Ar 18 2 8 8 8
氪 Kr 36 2 8 18 8 8
氙 Xe 54 2 8 18 18 8 8
氡 Rn 86 2 8 18 32 18 8 8
O :
Si :
Fe :
试写出8O、 14Si 、26Fe的简化电子排布式。
[He] 2s22p4
[Ne]3s23p2
[Ar]3d64s2
元素 名称 元素 符号 原子序数
氦 He 2
氖 Ne 10
氩 Ar 18
氪 Kr 36
氙 Xe 54
氡 Rn 86
三、轨道表示式(电子排布图)
每一个原子轨道用一个方框表示,在方框内标明基态原子核外电子分布的式子,是表述电子排布的一种图式。
↑↓
1s 2s 2p 3s
↑↓
↑
↑↓
↑↓
↑↓
1s22s22p63s1
Na
各轨道按照离核由近到远,从左到右依次排列。
方框(也可用圆圈)表示原子轨道
能量相同的原子轨道的方框相连
用箭头表示处于特定自旋方向的电子。
轨道表示式的书写步骤
①元素符号;
②轨道框(一个轨道一个框,能量相同的轨道连在一起)
s:1 ,p:3 , d:5 , f:7;
③电子及自旋状态(↑、↓)。
Mg:
画出下列元素的轨道表示式:
C:
Na:
3d 4s
↑↓
↑
↑
↑
↑
3d 4s
↑
↑
↑
↑
↑
↑
只有一组全满的原子轨道
有两组半满
的原子轨道
写出 24Cr 轨道表示式
↑↓
1s 2s 2p 3s 3p
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
1s 2s 2p 3s 3p
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
洪特规则特例:
能量相同的原子轨道在全充满(如p6和d10)、半充满(如p3和d5)和全空(如p0和d0)状态时,体系的能量较低,原子较稳定。
A
B
写出 29Cu 轨道表示式
29Cu
电子排布式
1s22s22p63s23p63d104s1
29Cu
写出铁原子、铁离子和亚铁离子的电子轨道排布式,想想铁离子和亚铁离子谁更稳定?为什么?
Fe2+
Fe3+
26Fe
1s 2s 2p 3s 3p 3d 4s
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
↑
↑
↑
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
↑
↑
↑
1s 2s 2p 3s 3p 3d
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
↑
↑
↑
↑
1s 2s 2p 3s 3p 3d
四、外围电子排布式
在化学反应中,一般是原子的外围电子(对于主族元素的原子而言,外围电子就是最外层电子)发生变化。所以,描述原子核外电子排布时,也可以仅写出原子的外围电子排布式(价层电子排布式)。
试根据课本所给的1~36号元素外围电子排布图,总结1~36号元素价电子排布规律
8O: 13Al:
2s22p4
3s23p1
价电子
对于主族和零族:价电子就是最外层电子
例如:Cl的价层电子排布式为3s23p5
对于副族和第VIII族元:最外层电子+次外层部分电子
例如:Cr的价层电子排布式为3d54s1。
写出29Cu的价层电子排布式和价层电子轨道表示式(价层电子排布图)
价层电子排布式:
价层电子的轨道表示式:
3d 4s
↑
↑↓
↑↓
↑↓
↑↓
↑↓
3d104s1
(1) Al: 1s2 2s22p6 3s13p2
(2) Cl: 1s2 2s22p6 3s23p5
(3) S: 1s2 2s22p6 3s33p3
(4) K: 1s2 2s22p6 3s23p63d1
(5) Ne: 1s2 2s22p6
判断下列原子的电子排布式是否正确;如不正确,说明它违反了什么原理?
能量最低原理
正确
泡利不相容原理
能量最低原理
正确
五、电子跃迁与原子光谱
在通常情况下,原子核外电子的排布总是使整个原子处于能量最低的状态。
1.基态原子与激发态原子
处于最低能量状态的原子叫基态原子;
当基态原子的电子吸收能量后,电子会跃迁到较高能级成为激发态原子。
基态氢原子
K
L
M
N
激发态氢原子
K
L
M
N
能量
不同原子的电子发生跃迁时可以吸收不同的光,用光谱仪可以摄取各种原子吸收光谱。
五、电子跃迁与原子光谱
能量
K
L
M
N
当电子从较高能量的状态跃迁至较低能量的状态,乃至基态时,会释放能量。
光
K
L
M
N
光是电子跃迁释放能量的重要形式之一。
不同原子的电子发生跃迁时可以发射不同的光,用光谱仪可以摄取各种原子的发射光谱。
各种原子的吸收光谱或发射光谱,总称为原子光谱。
锂、氦、汞的吸收光谱
锂、氦、汞的发射光谱
原子光谱的应用
He 氦
不同元素的焰色试验
检验元素
烟火
发现新元素
各种原子的吸收光谱或发射光谱,总称为原子光谱。
锂、氦、汞的吸收光谱
锂、氦、汞的发射光谱
低能量轨道电子
吸收能量
高能量轨道电子
原子吸收光谱
低能量轨道电子
释放能量
原子发射光谱
原子核外电子排布遵循的原理和规则
原子核外电子排布的表示式
能量最低原理
泡利不相容原理
洪特规则
电子排布式、价电子排布式
轨道表示式(电子排布图)
原子结构示意图
全满、半满、全空相对稳定
专题2 原子结构与元素性质
原子核外电子的排布
1.从微观层面理解原子的组成及结构,了解核外电子的排布规则,培养宏观辨识与微观探析的化学学科核心素养。
2.能结合能量最低原理、泡利不相容原理和洪特规则书写和说明1~36号元素基态原子的核外电子排布式和轨道表示式,发展证据推理与模型认知的化学学科核心素养。
原子核外电子的运动状态可以怎么描述?
核外电子运动
电子层
原子轨道
电子自旋
一、原子核外电子排布的构造原理
科学家经过研究发现,电子是按顺序填充的,填满一个能级之后再填下一个能级,这种规律称为构造原理。
轨道能量排列顺序
“能级交错”现象
排布遵循两个原理一个规则
构造原理的规则
①能量最低原理
原子核外电子先占据能量低的轨道,然后依次进入能量较高的轨道,这样使整个原子处于能量最低的状态,从而满足能量最低原理。
能量升高
能量升高
7
6
5
4
3
2
1
1s---2s---2p---3s---3p--4s--3d—4p--5s--4d---5p---6s---4f---5d---6p---7s---5f—6d
各轨道的能量高低顺序:
ns<(n-2)f<(n-1)d
外
电
子
填
充
顺
序
图
构造原理的规则
②泡利不相容原理
每个原子轨道最多容纳两个自旋状态不同的电子。
每一种运动状态的电子只有一个。
由于每一个原子轨道包括两种运动状态,所以每一个原子轨道最多只能容纳两个自旋方向相反的电子。
因为s、p、d、f轨道的原子轨道数分别为1,3,5,7个,所以s、p、d、f各原子轨道分别最多能容纳2,6,10,14个电子。
1
2
3
He
3p
3s
2p
2s
1s
↑↓
能量
构造原理的规则
③洪特规则
原子核外电子在能量相同的各个轨道上排布时,电子尽可能分占在不同的原子轨道上,且自旋状态相同,这样整个原子的能量最低,这个规则称为洪特规则。
写出基态碳原子可能的轨道表示式
② C
1s
↑↑
↑↓
↑↓
2s
2p
① C
1s
↑↓
↑↓
↑↓
2s
2p
2p
③ C
↑
1s
↑
↑↓
↑↓
2s
2p
④ C
↓
1s
↑
↑↓
↑↓
2s
√
③洪特规则特例
光谱实验发现,能量相同的原子轨道在全满、半满和全空条件时,
体系能量较低,原子较稳定。
相对稳定的状态
全充满:p6、d10、f14
半充满:p3、d5、f7
全空:p0、d0、f0
二、电子排布式
将能级所容纳的电子数标在该能级符号的右上角,并将电子层低的能级写在左边,得到的式子为电子排布式。
Na
1s22s22p63s1
能层 K L M N 最多电子数 能级
填充电子数
请写出25Mn和35Br的电子排布式和原子结构示意图
方法总结:1.主族元素:0族元素加法或改写法
2.先写内层最外层,再写次外层
3.先写各能层能级电子排布,再分层书写结构示意图
二、简化电子排布式
可以把内层电子已达到稀有气体结构的部分写成“原子实”
Na
1s22s22p63s1
熟记0族元素的原子序数
→[Ne]3s1
元素 名称 元素 符号 原子序数 各电子层的电子数 K 1 L 2 M 3 N 4 O 5 P 6 最外层电子数
氦 He 2 2 2
氖 Ne 10 2 8 8
氩 Ar 18 2 8 8 8
氪 Kr 36 2 8 18 8 8
氙 Xe 54 2 8 18 18 8 8
氡 Rn 86 2 8 18 32 18 8 8
O :
Si :
Fe :
试写出8O、 14Si 、26Fe的简化电子排布式。
[He] 2s22p4
[Ne]3s23p2
[Ar]3d64s2
元素 名称 元素 符号 原子序数
氦 He 2
氖 Ne 10
氩 Ar 18
氪 Kr 36
氙 Xe 54
氡 Rn 86
三、轨道表示式(电子排布图)
每一个原子轨道用一个方框表示,在方框内标明基态原子核外电子分布的式子,是表述电子排布的一种图式。
↑↓
1s 2s 2p 3s
↑↓
↑
↑↓
↑↓
↑↓
1s22s22p63s1
Na
各轨道按照离核由近到远,从左到右依次排列。
方框(也可用圆圈)表示原子轨道
能量相同的原子轨道的方框相连
用箭头表示处于特定自旋方向的电子。
轨道表示式的书写步骤
①元素符号;
②轨道框(一个轨道一个框,能量相同的轨道连在一起)
s:1 ,p:3 , d:5 , f:7;
③电子及自旋状态(↑、↓)。
Mg:
画出下列元素的轨道表示式:
C:
Na:
3d 4s
↑↓
↑
↑
↑
↑
3d 4s
↑
↑
↑
↑
↑
↑
只有一组全满的原子轨道
有两组半满
的原子轨道
写出 24Cr 轨道表示式
↑↓
1s 2s 2p 3s 3p
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
1s 2s 2p 3s 3p
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
洪特规则特例:
能量相同的原子轨道在全充满(如p6和d10)、半充满(如p3和d5)和全空(如p0和d0)状态时,体系的能量较低,原子较稳定。
A
B
写出 29Cu 轨道表示式
29Cu
电子排布式
1s22s22p63s23p63d104s1
29Cu
写出铁原子、铁离子和亚铁离子的电子轨道排布式,想想铁离子和亚铁离子谁更稳定?为什么?
Fe2+
Fe3+
26Fe
1s 2s 2p 3s 3p 3d 4s
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
↑
↑
↑
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
↑
↑
↑
1s 2s 2p 3s 3p 3d
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
↑
↑
↑
↑
1s 2s 2p 3s 3p 3d
四、外围电子排布式
在化学反应中,一般是原子的外围电子(对于主族元素的原子而言,外围电子就是最外层电子)发生变化。所以,描述原子核外电子排布时,也可以仅写出原子的外围电子排布式(价层电子排布式)。
试根据课本所给的1~36号元素外围电子排布图,总结1~36号元素价电子排布规律
8O: 13Al:
2s22p4
3s23p1
价电子
对于主族和零族:价电子就是最外层电子
例如:Cl的价层电子排布式为3s23p5
对于副族和第VIII族元:最外层电子+次外层部分电子
例如:Cr的价层电子排布式为3d54s1。
写出29Cu的价层电子排布式和价层电子轨道表示式(价层电子排布图)
价层电子排布式:
价层电子的轨道表示式:
3d 4s
↑
↑↓
↑↓
↑↓
↑↓
↑↓
3d104s1
(1) Al: 1s2 2s22p6 3s13p2
(2) Cl: 1s2 2s22p6 3s23p5
(3) S: 1s2 2s22p6 3s33p3
(4) K: 1s2 2s22p6 3s23p63d1
(5) Ne: 1s2 2s22p6
判断下列原子的电子排布式是否正确;如不正确,说明它违反了什么原理?
能量最低原理
正确
泡利不相容原理
能量最低原理
正确
五、电子跃迁与原子光谱
在通常情况下,原子核外电子的排布总是使整个原子处于能量最低的状态。
1.基态原子与激发态原子
处于最低能量状态的原子叫基态原子;
当基态原子的电子吸收能量后,电子会跃迁到较高能级成为激发态原子。
基态氢原子
K
L
M
N
激发态氢原子
K
L
M
N
能量
不同原子的电子发生跃迁时可以吸收不同的光,用光谱仪可以摄取各种原子吸收光谱。
五、电子跃迁与原子光谱
能量
K
L
M
N
当电子从较高能量的状态跃迁至较低能量的状态,乃至基态时,会释放能量。
光
K
L
M
N
光是电子跃迁释放能量的重要形式之一。
不同原子的电子发生跃迁时可以发射不同的光,用光谱仪可以摄取各种原子的发射光谱。
各种原子的吸收光谱或发射光谱,总称为原子光谱。
锂、氦、汞的吸收光谱
锂、氦、汞的发射光谱
原子光谱的应用
He 氦
不同元素的焰色试验
检验元素
烟火
发现新元素
各种原子的吸收光谱或发射光谱,总称为原子光谱。
锂、氦、汞的吸收光谱
锂、氦、汞的发射光谱
低能量轨道电子
吸收能量
高能量轨道电子
原子吸收光谱
低能量轨道电子
释放能量
原子发射光谱
原子核外电子排布遵循的原理和规则
原子核外电子排布的表示式
能量最低原理
泡利不相容原理
洪特规则
电子排布式、价电子排布式
轨道表示式(电子排布图)
原子结构示意图
全满、半满、全空相对稳定
