8.2 常见的酸和碱 第3课时 常见的碱 碱的化学性质 同步练(含答案) 2024-2025学年化学科粤版九年级下册
文档属性
| 名称 | 8.2 常见的酸和碱 第3课时 常见的碱 碱的化学性质 同步练(含答案) 2024-2025学年化学科粤版九年级下册 |  | |
| 格式 | docx | ||
| 文件大小 | 250.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-24 22:44:59 | ||
图片预览

文档简介
第3课时 常见的碱 碱的化学性质
氢氧化钠、氢氧化钙的特性和用途
1.下列有关NaOH说法错误的是 ( )
A.NaOH固体溶解时放出热量
B.NaOH包装箱上张贴的标识是
C.NaOH是所有气体的干燥剂
D.NaOH应密封保存
2.下列物质的名称或俗名表示的不是同一种物质的是 ( )
A.碳酸钙、大理石、生石灰
B.氢氧化钙、熟石灰、消石灰
C.氧化钙、生石灰
D.氢氧化钠、火碱、烧碱
3.下列有关氢氧化钙的叙述错误的是 ( )
A.物质制备:工业上,用生石灰与水反应制取氢氧化钙
B.物理性质:氢氧化钙微溶于水,可配制出澄清石灰水
C.化学性质:澄清石灰水可检验呼出气体中存在的二氧化碳
D.常见用途:农业上,氢氧化钙可用于改良碱性土壤等
碱的化学性质
4.下列物质存在烧杯中一段时间后,烧杯内的物质质量增加且变质的是 ( )
①浓盐酸 ②烧碱 ③生石灰 ④澄清石灰水
A.②③④ B.①②③ C.②③ D.①④
5.NaOH和Ca(OH)2都是常见的碱。下列关于它们的说法正确的是 ( )
A.NaOH有腐蚀性,Ca(OH)2没有腐蚀性
B.都易溶于水,且溶于水后都放出热量
C.它们的溶液都能用于检验CO2气体
D.它们的溶液都能和CO2发生反应
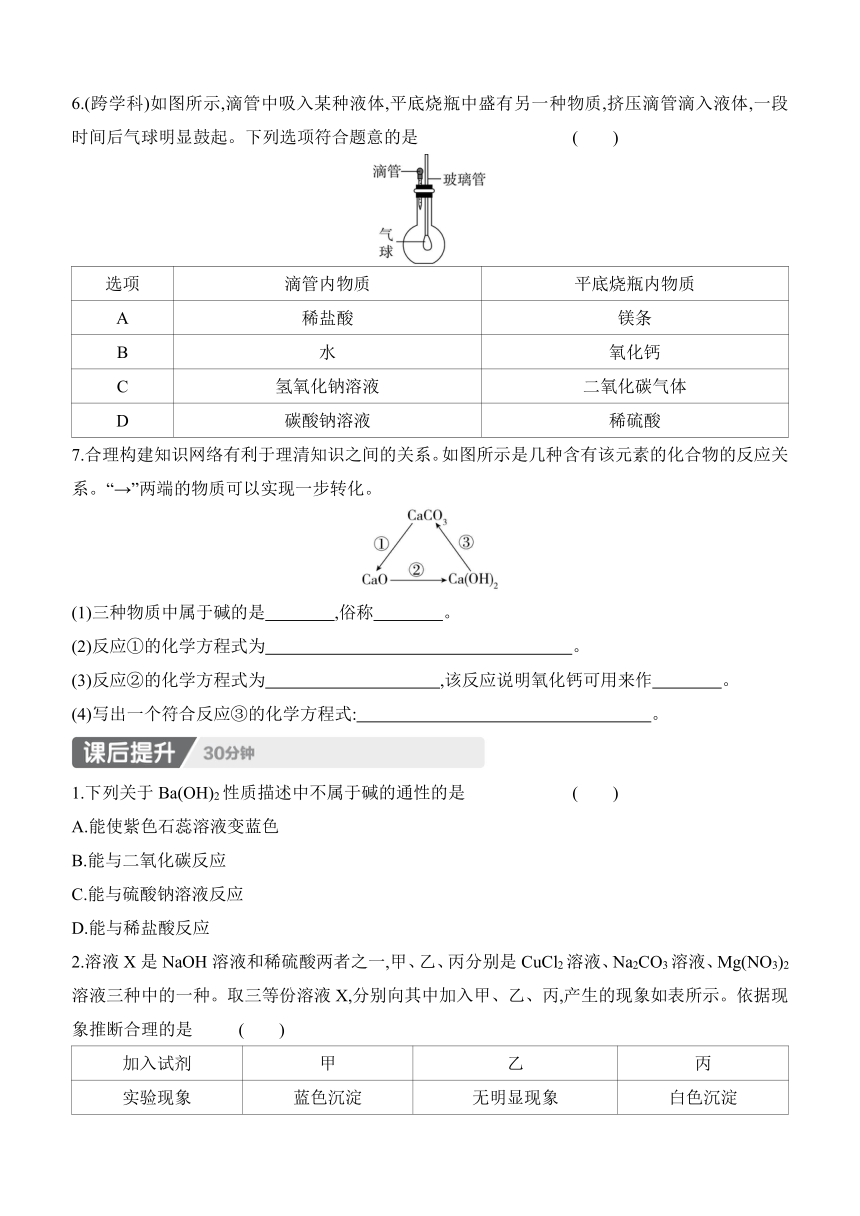
6.(跨学科)如图所示,滴管中吸入某种液体,平底烧瓶中盛有另一种物质,挤压滴管滴入液体,一段时间后气球明显鼓起。下列选项符合题意的是 ( )
选项 滴管内物质 平底烧瓶内物质
A 稀盐酸 镁条
B 水 氧化钙
C 氢氧化钠溶液 二氧化碳气体
D 碳酸钠溶液 稀硫酸
7.合理构建知识网络有利于理清知识之间的关系。如图所示是几种含有该元素的化合物的反应关系。“→”两端的物质可以实现一步转化。
(1)三种物质中属于碱的是 ,俗称 。
(2)反应①的化学方程式为 。
(3)反应②的化学方程式为 ,该反应说明氧化钙可用来作 。
(4)写出一个符合反应③的化学方程式: 。
1.下列关于Ba(OH)2性质描述中不属于碱的通性的是 ( )
A.能使紫色石蕊溶液变蓝色
B.能与二氧化碳反应
C.能与硫酸钠溶液反应
D.能与稀盐酸反应
2.溶液X是NaOH溶液和稀硫酸两者之一,甲、乙、丙分别是CuCl2溶液、Na2CO3溶液、Mg(NO3)2溶液三种中的一种。取三等份溶液X,分别向其中加入甲、乙、丙,产生的现象如表所示。依据现象推断合理的是 ( )
加入试剂 甲 乙 丙
实验现象 蓝色沉淀 无明显现象 白色沉淀
A.溶液X一定是稀硫酸
B.白色沉淀是BaSO4
C.乙试剂是Na2CO3溶液
D.可以向氢氧化钠溶液和稀硫酸中通入CO2区分两种溶液
3.(新考向)燃煤电厂常利用NaOH溶液处理烟气,实现“碳捕集”,其主要转化流程如下。
请回答下列问题:
(1)溶液X中的溶质一定有 。
(2)写出烟气通入氢氧化钠溶液中所发生反应的化学方程式: 。
(3)写出干冰的一种用途: 。
(4)上述流程中可循环使用的物质有溶液X和 。
4.某兴趣小组在学习碱的性质时进行的探究活动,请按要求回答问题。
(1)实验一:将氢氧化钠暴露在空气中,一段时间后观察到表面潮湿,说明氢氧化钠容易吸收 ,所以氢氧化钠在实验室可用作 。
(2)二氧化碳通入氢氧化钠溶液中没有明显的现象,于是同学们设计了实验二,从以下两个方面进行验证是否有化学反应发生。
①反应物的减少:振荡A瓶观察到 ,得出结论发生了化学变化,有同学提出要补充如B瓶所示实验,瓶中的液体试剂是 ,振荡,通过比较 ,证明二氧化碳能与氢氧化钠溶液反应。同学们又做了如图C瓶的实验,分析实验现象简述用饱和氢氧化钠溶液吸收二氧化碳是因为 。
②有新物质生成:取适量A瓶中反应后的液体于A1、A2两个试管中,向A1中滴加了足量的稀盐酸,观察到 ,A2中产生白色沉淀,反应的化学方程式是 。
(3)实验三中的现象是 ,反应的化学方程式为 。
5.(科学思维)实验小组用传感器研究水或NaOH溶液(NaOH溶于和①等量的水中)分别吸收CO2的效果,实验装置及测定结果如图所示。下列说法不正确的是 ( )
A.曲线①是CO2溶解和CO2与水反应的综合结果
B.对比曲线①和②,可说明CO2可能与NaOH溶液发生了反应
C.NaOH溶液吸收CO2的效果比水好
D.若选用与①等量水配制的石灰水进行实验,其曲线在①上方
【详解答案】
课堂达标
1.C 解析:氢氧化钠固体溶于水,放出热量,故A说法正确;氢氧化钠具有强腐蚀性,属于腐蚀品,故B说法正确;氢氧化钠易吸收水分而潮解,可用作某些气体的干燥剂,但是不是所有气体的干燥剂,氢氧化钠显碱性,不能干燥二氧化碳、二氧化硫等酸性气体,故C说法错误;氢氧化钠易吸收水分而潮解,易吸收二氧化碳而变质,所以氢氧化钠应该密封保存,故D说法正确。故选C。
2.A 解析:大理石是混合物,其主要成分是碳酸钙,生石灰是氧化钙的俗名。
3.D 解析:工业上,用生石灰与水反应制取氢氧化钙,A正确;氢氧化钙微溶于水,可配制出澄清石灰水,B正确;呼出气体中含有二氧化碳,二氧化碳能使澄清石灰水变浑浊,因此可以用澄清石灰水检验,C正确;氢氧化钙属于碱,农业上,氢氧化钙可用于改良酸性土壤等,D错误。
4.A 解析:浓盐酸有挥发性,放置在空气中质量会减少;烧碱易潮解,溶于水会与空气中的二氧化碳反应生成碳酸钠,质量会增加且变质;生石灰与空气中的水反应生成氢氧化钙,质量会增加且变质;澄清石灰水与空气中的二氧化碳反应生成碳酸钙和水,质量会增加且变质。
5.D 解析:A.NaOH有腐蚀性,Ca(OH)2也具有腐蚀性,故选项说法错误。B.氢氧化钠易溶于水,氢氧化钙微溶于水且温度没有明显变化,故选项说法错误。C.二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,能用于检验CO2气体;二氧化碳与氢氧化钠溶液反应生成碳酸钠和水,反应无明显变化,不能用于检验CO2气体,故选项说法错误。故选D。
6.C 解析:滴管中吸入某种液体,平底烧瓶中盛有另一种物质,挤压滴管滴入液体,一段时间后气球明显鼓起,说明瓶内压强变小。稀盐酸和镁条反应生成氢气,瓶内压强变大;水和氧化钙反应放热,瓶内压强变大;氢氧化钠能和二氧化碳反应,气体减少,瓶内压强变小;碳酸钠和稀硫酸反应生成二氧化碳,瓶内压强变大。
7.(1)氢氧化钙[或Ca(OH)2] 熟石灰
(2)CaCO3CaO+CO2↑
(3)CaO+H2OCa(OH)2 干燥剂
(4)Ca(OH)2+CO2CaCO3↓+H2O(合理即可)
课后提升
1.C 解析:A.Ba(OH)2能使紫色石蕊溶液变为蓝色,氢氧化钠、氢氧化钙等其他碱也能使紫色石蕊溶液变为蓝色,属于碱的通性,故选项不符合题意。B.Ba(OH)2能与二氧化碳反应生成碳酸钡和水,氢氧化钠、氢氧化钙等其他碱也能与二氧化碳反应生成盐和水,属于碱的通性,故选项不符合题意。C.氢氧化钡能与Na2SO4溶液反应生成BaSO4沉淀,氢氧化钠、氢氧化钙等碱不能与硫酸钠反应,不属于碱的通性,故选项符合题意。D.Ba(OH)2能与盐酸反应生成氯化钡和水,氢氧化钠、氢氧化钙等其他碱也能与稀盐酸反应生成盐和水,属于碱的通性,故选项不符合题意。故选C。
2.C 解析:氢氧化钠与氯化铜反应生成氢氧化铜沉淀和氯化钠,氢氧化钠和硝酸镁反应生成氢氧化镁沉淀和硝酸钠,稀硫酸与CuCl2溶液、Mg(NO3)2溶液不反应,与Na2CO3溶液反应产生气体,则X一定是氢氧化钠,和甲反应产生蓝色沉淀,和乙没有明显现象,和丙反应产生白色沉淀氢氧化镁,所以,甲是氯化铜,乙是碳酸钠,丙是硝酸镁;向氢氧化钠溶液和稀硫酸中通入CO2均没有现象,不能区分两种溶液。
3.(1)NaOH(或氢氧化钠)
(2)CO2+2NaOHNa2CO3+H2O
(3)人工降雨(作制冷剂)
(4)CaO(或氧化钙)
解析:由实验流程图可知,溶液X是石灰乳中的氢氧化钙与碳酸钠溶液反应后的物质,氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,故溶液X中的溶质是氢氧化钠;题述流程中溶液X中的氢氧化钠可再次用于吸收二氧化碳,碳酸钙分解生成的氧化钙也可以和水反应制成石灰乳与碳酸钠溶液反应,故题述流程中可循环使用的物质有溶液X和氧化钙。
4.(1)水分(H2O) 干燥剂
(2)①塑料瓶变瘪 100 mL的水 A瓶和B瓶变瘪程度的大小 相同体积的饱和氢氧化钠溶液和石灰水,氢氧化钠溶液吸收二氧化碳的量多 ②有气泡产生
Ca(OH)2+Na2CO3CaCO3↓+2NaOH
(3)产生蓝色沉淀 2NaOH+CuSO4Cu(OH)2↓+Na2SO4
5.D 解析:二氧化碳能溶于水,且与水反应生成碳酸,气体体积减小,压强减小,曲线①是CO2溶解和CO2与水反应的综合结果;二氧化碳能与氢氧化钠反应生成碳酸钠和水,对比曲线①和②,可说明CO2能与NaOH反应;对比曲线①和②,②中二氧化碳浓度减小的多,说明NaOH溶液吸收CO2的效果比水好;若选用等量水配制的石灰水进行实验,其曲线在①下方,在②上方,这是因为氢氧化钙溶液吸收效果比水好,比氢氧化钠溶液差。
氢氧化钠、氢氧化钙的特性和用途
1.下列有关NaOH说法错误的是 ( )
A.NaOH固体溶解时放出热量
B.NaOH包装箱上张贴的标识是
C.NaOH是所有气体的干燥剂
D.NaOH应密封保存
2.下列物质的名称或俗名表示的不是同一种物质的是 ( )
A.碳酸钙、大理石、生石灰
B.氢氧化钙、熟石灰、消石灰
C.氧化钙、生石灰
D.氢氧化钠、火碱、烧碱
3.下列有关氢氧化钙的叙述错误的是 ( )
A.物质制备:工业上,用生石灰与水反应制取氢氧化钙
B.物理性质:氢氧化钙微溶于水,可配制出澄清石灰水
C.化学性质:澄清石灰水可检验呼出气体中存在的二氧化碳
D.常见用途:农业上,氢氧化钙可用于改良碱性土壤等
碱的化学性质
4.下列物质存在烧杯中一段时间后,烧杯内的物质质量增加且变质的是 ( )
①浓盐酸 ②烧碱 ③生石灰 ④澄清石灰水
A.②③④ B.①②③ C.②③ D.①④
5.NaOH和Ca(OH)2都是常见的碱。下列关于它们的说法正确的是 ( )
A.NaOH有腐蚀性,Ca(OH)2没有腐蚀性
B.都易溶于水,且溶于水后都放出热量
C.它们的溶液都能用于检验CO2气体
D.它们的溶液都能和CO2发生反应
6.(跨学科)如图所示,滴管中吸入某种液体,平底烧瓶中盛有另一种物质,挤压滴管滴入液体,一段时间后气球明显鼓起。下列选项符合题意的是 ( )
选项 滴管内物质 平底烧瓶内物质
A 稀盐酸 镁条
B 水 氧化钙
C 氢氧化钠溶液 二氧化碳气体
D 碳酸钠溶液 稀硫酸
7.合理构建知识网络有利于理清知识之间的关系。如图所示是几种含有该元素的化合物的反应关系。“→”两端的物质可以实现一步转化。
(1)三种物质中属于碱的是 ,俗称 。
(2)反应①的化学方程式为 。
(3)反应②的化学方程式为 ,该反应说明氧化钙可用来作 。
(4)写出一个符合反应③的化学方程式: 。
1.下列关于Ba(OH)2性质描述中不属于碱的通性的是 ( )
A.能使紫色石蕊溶液变蓝色
B.能与二氧化碳反应
C.能与硫酸钠溶液反应
D.能与稀盐酸反应
2.溶液X是NaOH溶液和稀硫酸两者之一,甲、乙、丙分别是CuCl2溶液、Na2CO3溶液、Mg(NO3)2溶液三种中的一种。取三等份溶液X,分别向其中加入甲、乙、丙,产生的现象如表所示。依据现象推断合理的是 ( )
加入试剂 甲 乙 丙
实验现象 蓝色沉淀 无明显现象 白色沉淀
A.溶液X一定是稀硫酸
B.白色沉淀是BaSO4
C.乙试剂是Na2CO3溶液
D.可以向氢氧化钠溶液和稀硫酸中通入CO2区分两种溶液
3.(新考向)燃煤电厂常利用NaOH溶液处理烟气,实现“碳捕集”,其主要转化流程如下。
请回答下列问题:
(1)溶液X中的溶质一定有 。
(2)写出烟气通入氢氧化钠溶液中所发生反应的化学方程式: 。
(3)写出干冰的一种用途: 。
(4)上述流程中可循环使用的物质有溶液X和 。
4.某兴趣小组在学习碱的性质时进行的探究活动,请按要求回答问题。
(1)实验一:将氢氧化钠暴露在空气中,一段时间后观察到表面潮湿,说明氢氧化钠容易吸收 ,所以氢氧化钠在实验室可用作 。
(2)二氧化碳通入氢氧化钠溶液中没有明显的现象,于是同学们设计了实验二,从以下两个方面进行验证是否有化学反应发生。
①反应物的减少:振荡A瓶观察到 ,得出结论发生了化学变化,有同学提出要补充如B瓶所示实验,瓶中的液体试剂是 ,振荡,通过比较 ,证明二氧化碳能与氢氧化钠溶液反应。同学们又做了如图C瓶的实验,分析实验现象简述用饱和氢氧化钠溶液吸收二氧化碳是因为 。
②有新物质生成:取适量A瓶中反应后的液体于A1、A2两个试管中,向A1中滴加了足量的稀盐酸,观察到 ,A2中产生白色沉淀,反应的化学方程式是 。
(3)实验三中的现象是 ,反应的化学方程式为 。
5.(科学思维)实验小组用传感器研究水或NaOH溶液(NaOH溶于和①等量的水中)分别吸收CO2的效果,实验装置及测定结果如图所示。下列说法不正确的是 ( )
A.曲线①是CO2溶解和CO2与水反应的综合结果
B.对比曲线①和②,可说明CO2可能与NaOH溶液发生了反应
C.NaOH溶液吸收CO2的效果比水好
D.若选用与①等量水配制的石灰水进行实验,其曲线在①上方
【详解答案】
课堂达标
1.C 解析:氢氧化钠固体溶于水,放出热量,故A说法正确;氢氧化钠具有强腐蚀性,属于腐蚀品,故B说法正确;氢氧化钠易吸收水分而潮解,可用作某些气体的干燥剂,但是不是所有气体的干燥剂,氢氧化钠显碱性,不能干燥二氧化碳、二氧化硫等酸性气体,故C说法错误;氢氧化钠易吸收水分而潮解,易吸收二氧化碳而变质,所以氢氧化钠应该密封保存,故D说法正确。故选C。
2.A 解析:大理石是混合物,其主要成分是碳酸钙,生石灰是氧化钙的俗名。
3.D 解析:工业上,用生石灰与水反应制取氢氧化钙,A正确;氢氧化钙微溶于水,可配制出澄清石灰水,B正确;呼出气体中含有二氧化碳,二氧化碳能使澄清石灰水变浑浊,因此可以用澄清石灰水检验,C正确;氢氧化钙属于碱,农业上,氢氧化钙可用于改良酸性土壤等,D错误。
4.A 解析:浓盐酸有挥发性,放置在空气中质量会减少;烧碱易潮解,溶于水会与空气中的二氧化碳反应生成碳酸钠,质量会增加且变质;生石灰与空气中的水反应生成氢氧化钙,质量会增加且变质;澄清石灰水与空气中的二氧化碳反应生成碳酸钙和水,质量会增加且变质。
5.D 解析:A.NaOH有腐蚀性,Ca(OH)2也具有腐蚀性,故选项说法错误。B.氢氧化钠易溶于水,氢氧化钙微溶于水且温度没有明显变化,故选项说法错误。C.二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,能用于检验CO2气体;二氧化碳与氢氧化钠溶液反应生成碳酸钠和水,反应无明显变化,不能用于检验CO2气体,故选项说法错误。故选D。
6.C 解析:滴管中吸入某种液体,平底烧瓶中盛有另一种物质,挤压滴管滴入液体,一段时间后气球明显鼓起,说明瓶内压强变小。稀盐酸和镁条反应生成氢气,瓶内压强变大;水和氧化钙反应放热,瓶内压强变大;氢氧化钠能和二氧化碳反应,气体减少,瓶内压强变小;碳酸钠和稀硫酸反应生成二氧化碳,瓶内压强变大。
7.(1)氢氧化钙[或Ca(OH)2] 熟石灰
(2)CaCO3CaO+CO2↑
(3)CaO+H2OCa(OH)2 干燥剂
(4)Ca(OH)2+CO2CaCO3↓+H2O(合理即可)
课后提升
1.C 解析:A.Ba(OH)2能使紫色石蕊溶液变为蓝色,氢氧化钠、氢氧化钙等其他碱也能使紫色石蕊溶液变为蓝色,属于碱的通性,故选项不符合题意。B.Ba(OH)2能与二氧化碳反应生成碳酸钡和水,氢氧化钠、氢氧化钙等其他碱也能与二氧化碳反应生成盐和水,属于碱的通性,故选项不符合题意。C.氢氧化钡能与Na2SO4溶液反应生成BaSO4沉淀,氢氧化钠、氢氧化钙等碱不能与硫酸钠反应,不属于碱的通性,故选项符合题意。D.Ba(OH)2能与盐酸反应生成氯化钡和水,氢氧化钠、氢氧化钙等其他碱也能与稀盐酸反应生成盐和水,属于碱的通性,故选项不符合题意。故选C。
2.C 解析:氢氧化钠与氯化铜反应生成氢氧化铜沉淀和氯化钠,氢氧化钠和硝酸镁反应生成氢氧化镁沉淀和硝酸钠,稀硫酸与CuCl2溶液、Mg(NO3)2溶液不反应,与Na2CO3溶液反应产生气体,则X一定是氢氧化钠,和甲反应产生蓝色沉淀,和乙没有明显现象,和丙反应产生白色沉淀氢氧化镁,所以,甲是氯化铜,乙是碳酸钠,丙是硝酸镁;向氢氧化钠溶液和稀硫酸中通入CO2均没有现象,不能区分两种溶液。
3.(1)NaOH(或氢氧化钠)
(2)CO2+2NaOHNa2CO3+H2O
(3)人工降雨(作制冷剂)
(4)CaO(或氧化钙)
解析:由实验流程图可知,溶液X是石灰乳中的氢氧化钙与碳酸钠溶液反应后的物质,氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,故溶液X中的溶质是氢氧化钠;题述流程中溶液X中的氢氧化钠可再次用于吸收二氧化碳,碳酸钙分解生成的氧化钙也可以和水反应制成石灰乳与碳酸钠溶液反应,故题述流程中可循环使用的物质有溶液X和氧化钙。
4.(1)水分(H2O) 干燥剂
(2)①塑料瓶变瘪 100 mL的水 A瓶和B瓶变瘪程度的大小 相同体积的饱和氢氧化钠溶液和石灰水,氢氧化钠溶液吸收二氧化碳的量多 ②有气泡产生
Ca(OH)2+Na2CO3CaCO3↓+2NaOH
(3)产生蓝色沉淀 2NaOH+CuSO4Cu(OH)2↓+Na2SO4
5.D 解析:二氧化碳能溶于水,且与水反应生成碳酸,气体体积减小,压强减小,曲线①是CO2溶解和CO2与水反应的综合结果;二氧化碳能与氢氧化钠反应生成碳酸钠和水,对比曲线①和②,可说明CO2能与NaOH反应;对比曲线①和②,②中二氧化碳浓度减小的多,说明NaOH溶液吸收CO2的效果比水好;若选用等量水配制的石灰水进行实验,其曲线在①下方,在②上方,这是因为氢氧化钙溶液吸收效果比水好,比氢氧化钠溶液差。
