8.3 酸和碱反应 同步练(含答案) 2024-2025学年化学科粤版九年级下册
文档属性
| 名称 | 8.3 酸和碱反应 同步练(含答案) 2024-2025学年化学科粤版九年级下册 |
|
|
| 格式 | docx | ||
| 文件大小 | 320.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-24 22:45:45 | ||
图片预览

文档简介
8.3 酸和碱反应
酸和碱各自有相似化学性质的原因
1.氢氧化钠、氢氧化钙的溶液都具有相似化学性质,其原因是 ( )
A.都能解离出金属离子
B.都含有氢元素和氧元素
C.都能使无色酚酞溶液变成红色
D.溶液中都含有OH-
中和反应和复分解反应
2.下列反应属于中和反应的是 ( )
A.2NaOH+CO2Na2CO3+H2O
B.CaCO3+2HClCaCl2+H2O+CO2↑
C.2HCl+Ca(OH)2CaCl2+2H2O
D.CuO+H2SO4CuSO4+H2O
3.下列反应中不属于复分解反应的是 ( )
A.KOH+HClKCl+H2O
B.BaCl2+H2SO4BaSO4↓+2HCl
C.Ca(OH)2+CO2CaCO3↓+H2O
D.Na2CO3+2HCl2NaCl+H2O+CO2↑
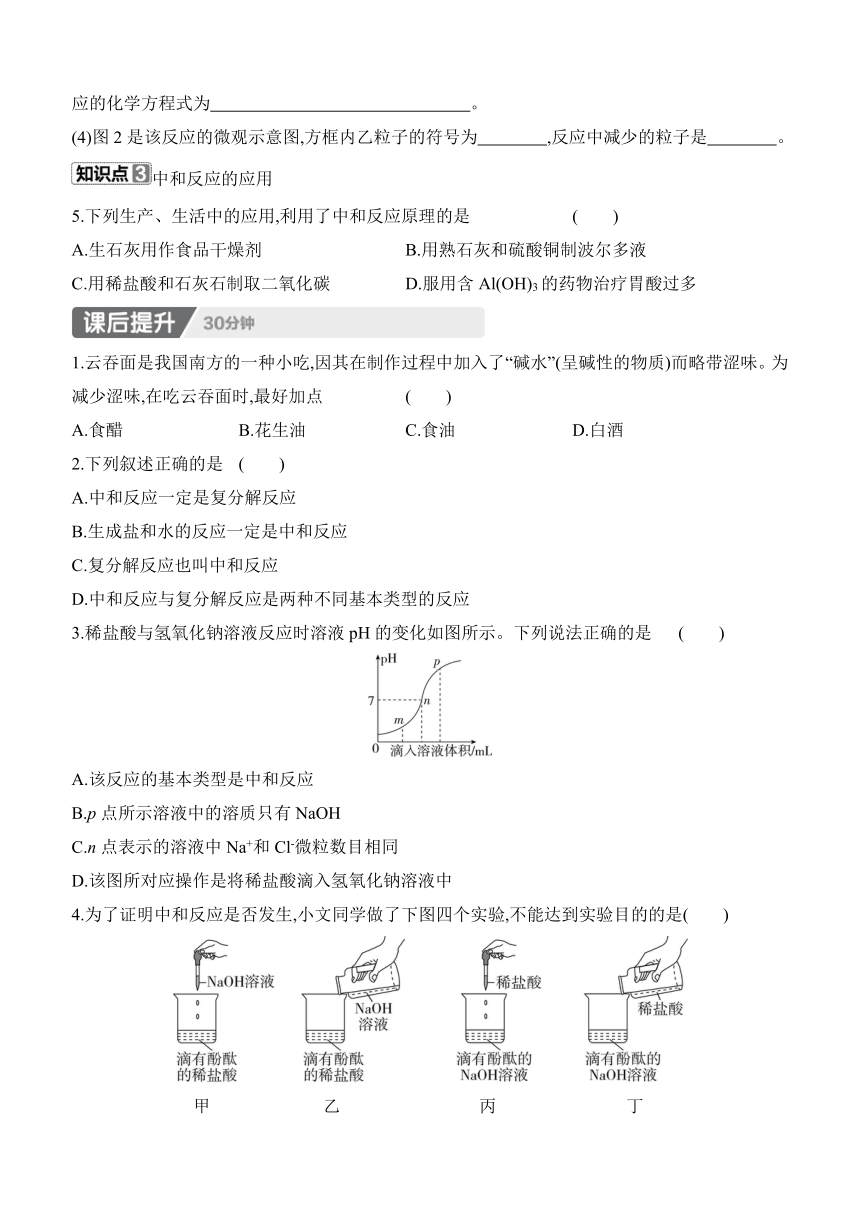
4.小红同学在一定量的氢氧化钠溶液中加入一定量的稀硫酸,没有观察到明显的现象。为了验证两种物质是否发生了化学反应,小红同学设计如下的实验。
(1)实验A中加入酚酞后溶液呈 色。
(2)实验B中当加入一定量的稀硫酸观察到的现象是 。
(3)实验C向烧杯中滴加氢氧化钠溶液观察到的现象是 ,说明B烧杯中滴加稀硫酸后含有酚酞,没有 (填化学式),验证了氢氧化钠溶液与稀硫酸发生了化学反应,该反应的化学方程式为 。
(4)图2是该反应的微观示意图,方框内乙粒子的符号为 ,反应中减少的粒子是 。
中和反应的应用
5.下列生产、生活中的应用,利用了中和反应原理的是 ( )
A.生石灰用作食品干燥剂 B.用熟石灰和硫酸铜制波尔多液
C.用稀盐酸和石灰石制取二氧化碳 D.服用含Al(OH)3的药物治疗胃酸过多
1.云吞面是我国南方的一种小吃,因其在制作过程中加入了“碱水”(呈碱性的物质)而略带涩味。为减少涩味,在吃云吞面时,最好加点 ( )
A.食醋 B.花生油 C.食油 D.白酒
2.下列叙述正确的是 ( )
A.中和反应一定是复分解反应
B.生成盐和水的反应一定是中和反应
C.复分解反应也叫中和反应
D.中和反应与复分解反应是两种不同基本类型的反应
3.稀盐酸与氢氧化钠溶液反应时溶液pH的变化如图所示。下列说法正确的是 ( )
A.该反应的基本类型是中和反应
B.p点所示溶液中的溶质只有NaOH
C.n点表示的溶液中Na+和Cl-微粒数目相同
D.该图所对应操作是将稀盐酸滴入氢氧化钠溶液中
4.为了证明中和反应是否发生,小文同学做了下图四个实验,不能达到实验目的的是( )
甲 乙 丙 丁
A.甲实验中,溶液仍为无色 B.乙实验中,溶液由无色变为红色
C.丙实验中,溶液由红色变为无色 D.丁实验中,溶液由红色变为无色
5.(2024烟台中考)某兴趣小组借助数字技术探究“稀盐酸与氢氧化钠溶液反应”,图1所示是室温下稀盐酸与稀氢氧化钠溶液反应的实验装置,图2是反应过程中的pH变化曲线。
(1)根据图2曲线判断,图1中的溶液B是 。
(2)图2中a点所示的溶液pH (填“<”“>”或“=”)7,溶液呈现 (填“酸性”“碱性”或“中性”)。
(3)c点所示的溶液中Na+个数与Cl-个数关系是n(Na+) (填“>”“<”或“=”)n(Cl-)。
(4)a点到b点pH变化的微观本质是 。
6.(科学思维)中和反应是一类重要的化学反应。某同学利用图1装置研究稀盐酸与氢氧化钠溶液反应的过程,并用pH和温度传感器测量反应过程中相关物理量的变化情况,得到图2和图3。
(1)烧杯中发生反应的化学方程式为 。
(2)仪器A中溶液的溶质是 (填化学式)。
(3)图3中V的数值最接近 (填“6”“12”或“16”)。
(4)下列说法错误的是 (填字母)。
A.图2中b点所示溶液中的溶质是NaCl和NaOH
B.取图2中d点所示溶液加热蒸干所得固体为纯净物
C.图2中c→d所示溶液中NaCl的质量不断增加
D.图3中e→f变化趋势可说明该反应是放热反应
【详解答案】
课堂达标
1.D 2.C
3.C 解析:该反应不是两种化合物相互交换成分生成两种新的化合物的反应,不属于复分解反应。
4.(1)红 (2)溶液由红色逐渐变为无色
(3)溶液由无色变为红色 NaOH H2SO4+2NaOHNa2SO4+2H2O
(4)S H+和OH-
解析:分析题图2微观粒子,可知硫酸与氢氧化钠恰好反应生成硫酸钠和水,其中甲表示的粒子是Na+,乙表示的粒子是S,该反应的微观实质是H+和OH-结合生成H2O。
5.D 解析:生石灰用作食品干燥剂是因为氧化钙能与水反应生成氢氧化钙,不是利用中和反应原理;用熟石灰和硫酸铜制波尔多液是氢氧化钙和硫酸铜反应生成氢氧化铜沉淀和硫酸钙,不是利用中和反应原理;稀盐酸和石灰石反应是酸与盐的反应,不属于中和反应;胃液中含有盐酸,服用含Al(OH)3的药物治疗胃酸过多,是因为氢氧化铝和盐酸反应生成氯化铝和水,利用了中和反应原理。
课后提升
1.A
2.A 解析:中和反应一定是复分解反应;生成盐和水的反应不一定就是中和反应,如碱性氧化物和酸反应也生成盐和水,但不是中和反应;复分解反应包含中和反应,它的范围比中和反应广,中和反应属于复分解反应。
3.C 解析:中和反应不是基本反应类型;p点时溶液的pH大于7,显碱性,氢氧化钠溶液过量,则p点所示溶液中的溶质为NaOH、NaCl;n点时溶液的pH等于7,HCl和NaOH恰好完全反应,溶液中的溶质是NaCl,则n点表示的溶液中Na+和Cl-微粒数目相同;图像中pH的变化是从小于7逐渐增大到大于7,可知原溶液显酸性,然后不断地加入碱性溶液,使pH增大,说明是把氢氧化钠溶液滴加到稀盐酸中。
4.B 解析:A.氢氧化钠溶液显碱性,能使酚酞变红,加入氢氧化钠溶液后溶液仍为无色,说明氢氧化钠消失了,可说明氢氧化钠和稀盐酸发生了反应,故正确。B.氢氧化钠溶液显碱性,能使酚酞变红,加入氢氧化钠溶液后溶液由无色变为红色,无法说明有反应物消失,也无法证明有新物质生成,故不正确。C.氢氧化钠溶液能使酚酞变红,滴入稀盐酸,氢氧化钠与稀盐酸反应生成氯化钠和水,红色溶液变为无色,说明氢氧化钠不存在了,和盐酸反应了,故正确。D.氢氧化钠溶液使酚酞变红,向烧杯中倒入稀盐酸,氢氧化钠与稀盐酸反应生成氯化钠和水,红色溶液变为无色,酚酞在酸性和中性溶液中都是无色,即使盐酸过量,溶液是无色的,证明了氢氧化钠消失了,和稀盐酸反应了,故正确。故选B。
5.(1)稀盐酸 (2)> 碱性
(3)< (4)H+和OH-结合生成水分子
解析:(1)由题图2可知,烧杯中溶液的pH大于7,呈碱性,故该实验为稀盐酸加入氢氧化钠溶液中,则题图1中的溶液B为稀盐酸。(2)由题图2可知,a点所示的溶液pH>7,溶液呈碱性。(3)氢氧化钠与稀盐酸反应生成氯化钠和水,c点时,溶液pH<7,说明此时溶液呈酸性,溶液中存在稀盐酸,此时溶液中溶质为氯化钠和HCl,则c点所示的溶液中Na+个数与Cl-个数关系是n(Na+)6.(1)NaOH+HClNaCl+H2O
(2)HCl (3)12 (4)C
解析:(1)烧杯中发生的反应是氢氧化钠与稀盐酸反应生成氯化钠和水。(2)由反应的pH图像变化可知,一开始溶液的pH大于7,呈碱性,因此烧杯中为氢氧化钠溶液,仪器A中为稀盐酸溶液。(3)从题图3中可以看出,当体积为V mL时温度不再升高,也就是两者刚好完全反应生成中性的氯化钠溶液,此时溶液的pH为7,从题图2可以判断出此时盐酸的体积为12 mL。(4)从题图2可以看出,b点时烧杯中的氢氧化钠溶液过剩,溶液中的溶质为生成的氯化钠和过量的氢氧化钠;题图2中d点时稀盐酸过量,溶液中的溶质为生成的氯化钠和过量的氯化氢,加热蒸干,氯化氢逸散到空气中,剩余固体只含有氯化钠,为纯净物;题图2中c点时,溶液的pH等于7,呈中性,两种物质恰好完全反应,再向烧杯中滴加稀盐酸,溶质氯化钠的质量不变,氯化氢的质量增加;题图3中e→f的温度变化为逐渐升高,原因为稀盐酸和氢氧化钠溶液发生中和反应,该反应为放热反应。
酸和碱各自有相似化学性质的原因
1.氢氧化钠、氢氧化钙的溶液都具有相似化学性质,其原因是 ( )
A.都能解离出金属离子
B.都含有氢元素和氧元素
C.都能使无色酚酞溶液变成红色
D.溶液中都含有OH-
中和反应和复分解反应
2.下列反应属于中和反应的是 ( )
A.2NaOH+CO2Na2CO3+H2O
B.CaCO3+2HClCaCl2+H2O+CO2↑
C.2HCl+Ca(OH)2CaCl2+2H2O
D.CuO+H2SO4CuSO4+H2O
3.下列反应中不属于复分解反应的是 ( )
A.KOH+HClKCl+H2O
B.BaCl2+H2SO4BaSO4↓+2HCl
C.Ca(OH)2+CO2CaCO3↓+H2O
D.Na2CO3+2HCl2NaCl+H2O+CO2↑
4.小红同学在一定量的氢氧化钠溶液中加入一定量的稀硫酸,没有观察到明显的现象。为了验证两种物质是否发生了化学反应,小红同学设计如下的实验。
(1)实验A中加入酚酞后溶液呈 色。
(2)实验B中当加入一定量的稀硫酸观察到的现象是 。
(3)实验C向烧杯中滴加氢氧化钠溶液观察到的现象是 ,说明B烧杯中滴加稀硫酸后含有酚酞,没有 (填化学式),验证了氢氧化钠溶液与稀硫酸发生了化学反应,该反应的化学方程式为 。
(4)图2是该反应的微观示意图,方框内乙粒子的符号为 ,反应中减少的粒子是 。
中和反应的应用
5.下列生产、生活中的应用,利用了中和反应原理的是 ( )
A.生石灰用作食品干燥剂 B.用熟石灰和硫酸铜制波尔多液
C.用稀盐酸和石灰石制取二氧化碳 D.服用含Al(OH)3的药物治疗胃酸过多
1.云吞面是我国南方的一种小吃,因其在制作过程中加入了“碱水”(呈碱性的物质)而略带涩味。为减少涩味,在吃云吞面时,最好加点 ( )
A.食醋 B.花生油 C.食油 D.白酒
2.下列叙述正确的是 ( )
A.中和反应一定是复分解反应
B.生成盐和水的反应一定是中和反应
C.复分解反应也叫中和反应
D.中和反应与复分解反应是两种不同基本类型的反应
3.稀盐酸与氢氧化钠溶液反应时溶液pH的变化如图所示。下列说法正确的是 ( )
A.该反应的基本类型是中和反应
B.p点所示溶液中的溶质只有NaOH
C.n点表示的溶液中Na+和Cl-微粒数目相同
D.该图所对应操作是将稀盐酸滴入氢氧化钠溶液中
4.为了证明中和反应是否发生,小文同学做了下图四个实验,不能达到实验目的的是( )
甲 乙 丙 丁
A.甲实验中,溶液仍为无色 B.乙实验中,溶液由无色变为红色
C.丙实验中,溶液由红色变为无色 D.丁实验中,溶液由红色变为无色
5.(2024烟台中考)某兴趣小组借助数字技术探究“稀盐酸与氢氧化钠溶液反应”,图1所示是室温下稀盐酸与稀氢氧化钠溶液反应的实验装置,图2是反应过程中的pH变化曲线。
(1)根据图2曲线判断,图1中的溶液B是 。
(2)图2中a点所示的溶液pH (填“<”“>”或“=”)7,溶液呈现 (填“酸性”“碱性”或“中性”)。
(3)c点所示的溶液中Na+个数与Cl-个数关系是n(Na+) (填“>”“<”或“=”)n(Cl-)。
(4)a点到b点pH变化的微观本质是 。
6.(科学思维)中和反应是一类重要的化学反应。某同学利用图1装置研究稀盐酸与氢氧化钠溶液反应的过程,并用pH和温度传感器测量反应过程中相关物理量的变化情况,得到图2和图3。
(1)烧杯中发生反应的化学方程式为 。
(2)仪器A中溶液的溶质是 (填化学式)。
(3)图3中V的数值最接近 (填“6”“12”或“16”)。
(4)下列说法错误的是 (填字母)。
A.图2中b点所示溶液中的溶质是NaCl和NaOH
B.取图2中d点所示溶液加热蒸干所得固体为纯净物
C.图2中c→d所示溶液中NaCl的质量不断增加
D.图3中e→f变化趋势可说明该反应是放热反应
【详解答案】
课堂达标
1.D 2.C
3.C 解析:该反应不是两种化合物相互交换成分生成两种新的化合物的反应,不属于复分解反应。
4.(1)红 (2)溶液由红色逐渐变为无色
(3)溶液由无色变为红色 NaOH H2SO4+2NaOHNa2SO4+2H2O
(4)S H+和OH-
解析:分析题图2微观粒子,可知硫酸与氢氧化钠恰好反应生成硫酸钠和水,其中甲表示的粒子是Na+,乙表示的粒子是S,该反应的微观实质是H+和OH-结合生成H2O。
5.D 解析:生石灰用作食品干燥剂是因为氧化钙能与水反应生成氢氧化钙,不是利用中和反应原理;用熟石灰和硫酸铜制波尔多液是氢氧化钙和硫酸铜反应生成氢氧化铜沉淀和硫酸钙,不是利用中和反应原理;稀盐酸和石灰石反应是酸与盐的反应,不属于中和反应;胃液中含有盐酸,服用含Al(OH)3的药物治疗胃酸过多,是因为氢氧化铝和盐酸反应生成氯化铝和水,利用了中和反应原理。
课后提升
1.A
2.A 解析:中和反应一定是复分解反应;生成盐和水的反应不一定就是中和反应,如碱性氧化物和酸反应也生成盐和水,但不是中和反应;复分解反应包含中和反应,它的范围比中和反应广,中和反应属于复分解反应。
3.C 解析:中和反应不是基本反应类型;p点时溶液的pH大于7,显碱性,氢氧化钠溶液过量,则p点所示溶液中的溶质为NaOH、NaCl;n点时溶液的pH等于7,HCl和NaOH恰好完全反应,溶液中的溶质是NaCl,则n点表示的溶液中Na+和Cl-微粒数目相同;图像中pH的变化是从小于7逐渐增大到大于7,可知原溶液显酸性,然后不断地加入碱性溶液,使pH增大,说明是把氢氧化钠溶液滴加到稀盐酸中。
4.B 解析:A.氢氧化钠溶液显碱性,能使酚酞变红,加入氢氧化钠溶液后溶液仍为无色,说明氢氧化钠消失了,可说明氢氧化钠和稀盐酸发生了反应,故正确。B.氢氧化钠溶液显碱性,能使酚酞变红,加入氢氧化钠溶液后溶液由无色变为红色,无法说明有反应物消失,也无法证明有新物质生成,故不正确。C.氢氧化钠溶液能使酚酞变红,滴入稀盐酸,氢氧化钠与稀盐酸反应生成氯化钠和水,红色溶液变为无色,说明氢氧化钠不存在了,和盐酸反应了,故正确。D.氢氧化钠溶液使酚酞变红,向烧杯中倒入稀盐酸,氢氧化钠与稀盐酸反应生成氯化钠和水,红色溶液变为无色,酚酞在酸性和中性溶液中都是无色,即使盐酸过量,溶液是无色的,证明了氢氧化钠消失了,和稀盐酸反应了,故正确。故选B。
5.(1)稀盐酸 (2)> 碱性
(3)< (4)H+和OH-结合生成水分子
解析:(1)由题图2可知,烧杯中溶液的pH大于7,呈碱性,故该实验为稀盐酸加入氢氧化钠溶液中,则题图1中的溶液B为稀盐酸。(2)由题图2可知,a点所示的溶液pH>7,溶液呈碱性。(3)氢氧化钠与稀盐酸反应生成氯化钠和水,c点时,溶液pH<7,说明此时溶液呈酸性,溶液中存在稀盐酸,此时溶液中溶质为氯化钠和HCl,则c点所示的溶液中Na+个数与Cl-个数关系是n(Na+)
(2)HCl (3)12 (4)C
解析:(1)烧杯中发生的反应是氢氧化钠与稀盐酸反应生成氯化钠和水。(2)由反应的pH图像变化可知,一开始溶液的pH大于7,呈碱性,因此烧杯中为氢氧化钠溶液,仪器A中为稀盐酸溶液。(3)从题图3中可以看出,当体积为V mL时温度不再升高,也就是两者刚好完全反应生成中性的氯化钠溶液,此时溶液的pH为7,从题图2可以判断出此时盐酸的体积为12 mL。(4)从题图2可以看出,b点时烧杯中的氢氧化钠溶液过剩,溶液中的溶质为生成的氯化钠和过量的氢氧化钠;题图2中d点时稀盐酸过量,溶液中的溶质为生成的氯化钠和过量的氯化氢,加热蒸干,氯化氢逸散到空气中,剩余固体只含有氯化钠,为纯净物;题图2中c点时,溶液的pH等于7,呈中性,两种物质恰好完全反应,再向烧杯中滴加稀盐酸,溶质氯化钠的质量不变,氯化氢的质量增加;题图3中e→f的温度变化为逐渐升高,原因为稀盐酸和氢氧化钠溶液发生中和反应,该反应为放热反应。
