题型七 有机化合物——高考化学二轮复习题型归纳与解题技巧(共30张PPT)
文档属性
| 名称 | 题型七 有机化合物——高考化学二轮复习题型归纳与解题技巧(共30张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 763.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-24 19:41:57 | ||
图片预览









文档简介
(共30张PPT)
2025届高考化学二轮复习题型归纳与解题技巧
题型七 有机化合物
有机物组成、结构
1.C、H、O、N、X(X=F、Cl、Br、I)等常见原子成键特点
(1)碳原子成键特点
C最外层4个电子,差4个达到8电子稳定结构,所以C形成4个共价键;具体类型有①四个单键: (烷烃与环烷烃均为此结构),②两个单键+一个双键: (烯烃为此种结构),③一个单键+一个三键: (炔烃为这种结构),④两个双键: C (CO2为此结构、有机物中这种结构一般不稳定),⑤三个单键+1/6大π键: (芳香烃及其衍生物为此结构)。
(2)氢原子及卤素原子(X)成键特点:H差1个电子达2电子稳定结构,X是第ⅦA族,差1个电子达8电子稳定结构,所以H、X一般只能形成单键,也就是—H和 —X,所以H、X只能处在分子的“端位”一般不能成环。
有机物组成、结构
(3)O原子成键特点:O是第ⅥA族,最外层6个电子,差 2个电子达8电子稳定结构,所以一般可以形成2个共价键,也就是 O或—O—。
(4)N原子成键特点
N是第ⅤA族,最外层5个电子,差3个电子达8电子稳定结构,所以N一般可以形成3个共价键,也就是
①一个三键:≡N(N2或氰基就是此结构),
②一个单键+一个双键:—N (嘧啶、嘌呤含有此结构),
③三个单键: (氨气、氨基有此结构),注意铵根结构较特殊:[ ]+存在一个“配位键”所以形成4个共价键。
(5)C、N、O均可成环,也可以成链,但H、X不能成环。
有机物组成、结构
2.有机物原子共线、共面问题
(1)数学背景知识
①某条直线与某个平面有两个公共点,则该直线属于该平面。
②两个平面若存在三个不共线的公共点,则两个平面是同一个平面。
③若两个平面具有两个公共点(或三个共线的公共点),则两平面相交或是同一个平面。
(2)化学背景知识
① 结构属于四面体构型(若四个成键原子相同一般为正四面体,不同则为变形四面体),一旦出现此种结构则所有原子不可能共线,也不可能共面。
②凡是双键( 或 ) 部位一定属于平面构型。
③凡是三键(—C≡C—或—C≡N)部位一定属于直线构型。
④凡是苯环( )部位所有原子一定共平面;另外苯环“对位”的2个C和2个H一定共直线。
⑤链状化合物中所有碳原子一定不共线,因为键角为 109.5°,所以排列是锯齿状的。
有机物组成、结构
(3)解题技巧
一要注意:是什么原子(C还是H或O等)共线或共面;是可能还是一定;是最多还是最少。
二要注意:单键可以旋转(绕键轴旋转),这个就像方向盘,比如CH4的结构
,注意环状结构的单键旋转不会造成构型改变。
三要注意:分析共线、共面问题时要找到上述共线、共面的典型结构,并整理成与真实结构一样的形式。
比如 结构要整理成正四面体形“ ”(注意为了看出四面体立体结构,所以加了虚线轮廓);双键整理成 , ;三键整理成—C≡C—或—C≡N;苯环共线部分(对位)整理成 。
有机物组成、结构
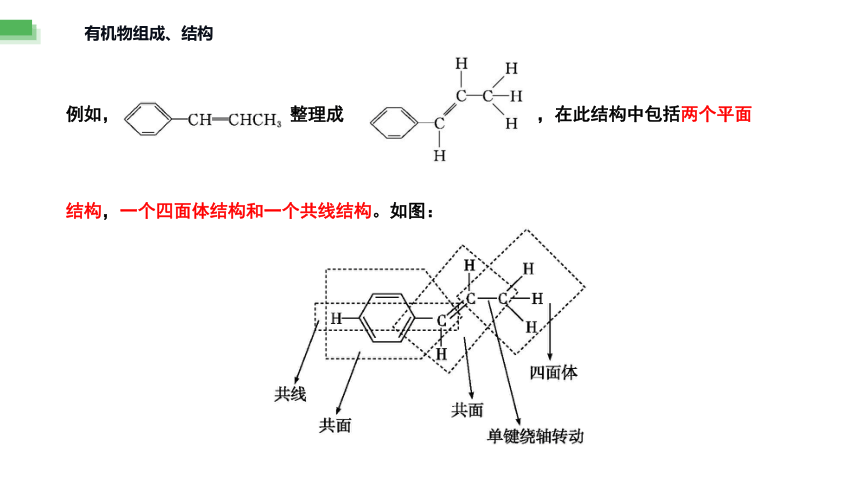
例如, 整理成 ,在此结构中包括两个平面
结构,一个四面体结构和一个共线结构。如图:
同分异构体数目判断
1.基本思路
(1)首先观察C、H数量关系大致判断结构有无双键、三键、环状结构或苯环。
(2)分链状结构和环状结构分别考虑异构
①链状:先分析碳链异构,再分析官能团位置异构,最后分析官能团种类异构。
②环状:先分析3元环,再分析4元环……一般最多6元环。把其他原子连到环上。
③苯环结构:要一个侧链,两个侧链,三个侧链分别考虑;两个侧链要考虑邻、间、对异构;三个侧链要运用先定后动法来考虑。
(3)要注意结构简式尽量整理成对称结构,要注意等效H和等效C取代不会产生同分异构,要注意H一般不会造成异构,可以先把H删除只分析C骨架构造,最后根据C的4键结构补H(规律:键不够H来凑)。
(4)等效氢:同一个C上的H或处于对称位置的不同C上的H称为等效氢,注意分析等效H时,单键可以旋转,双键不可以旋转,要运用空间想象能力去分析,不能在平面上考虑问题。
同分异构体数目判断
2.取代法和插入法的运用
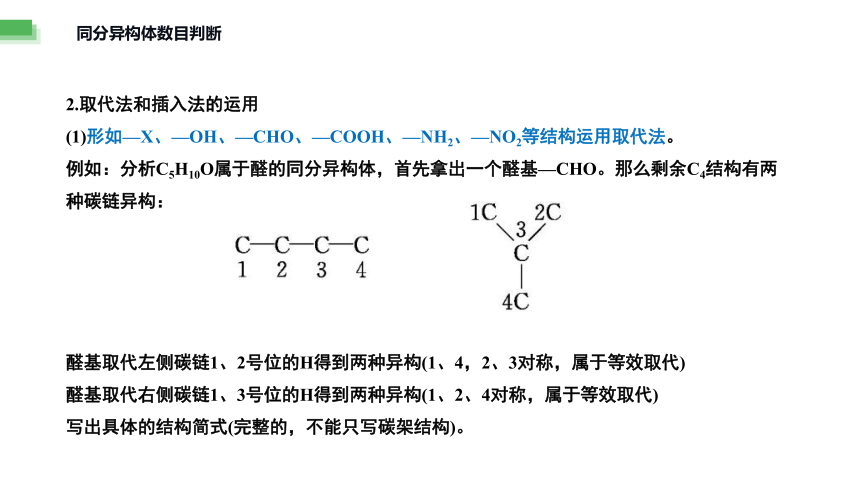
(1)形如—X、—OH、—CHO、—COOH、—NH2、—NO2等结构运用取代法。
例如:分析C5H10O属于醛的同分异构体,首先拿出一个醛基—CHO。那么剩余C4结构有两种碳链异构:
醛基取代左侧碳链1、2号位的H得到两种异构(1、4,2、3对称,属于等效取代)
醛基取代右侧碳链1、3号位的H得到两种异构(1、2、4对称,属于等效取代)
写出具体的结构简式(完整的,不能只写碳架结构)。
同分异构体数目判断
(2)形如 、—C≡C—、 、 、 等结构运用
插入法,前四者插入部分为 、≡、 、—O—,均为对称结构,最后一个
酯基插入部分为 (注意此基团左右不对称,所以有正插、反插两种形式,当插入位置是左右对称的话只有一种插入形式),另外酯基还要进行取代法分析,把C那一端连接H后,即变为甲酸酯基(HCOO—)这种结构,用O另一端的半键去取代不同H。
同分异构体数目判断
例如:分析C4H8属于烯烃的同分异构体,首先碳链异构是
双键( )插入左侧碳链1、2号间与2、3号间(1、2号与3、4号等效)得到2种异构体;
然后插入右侧碳链1、3号间(2、3号,4、3号与1、3号等效)又得到1种同分异构体。所以共3种异构体:
同分异构体数目判断
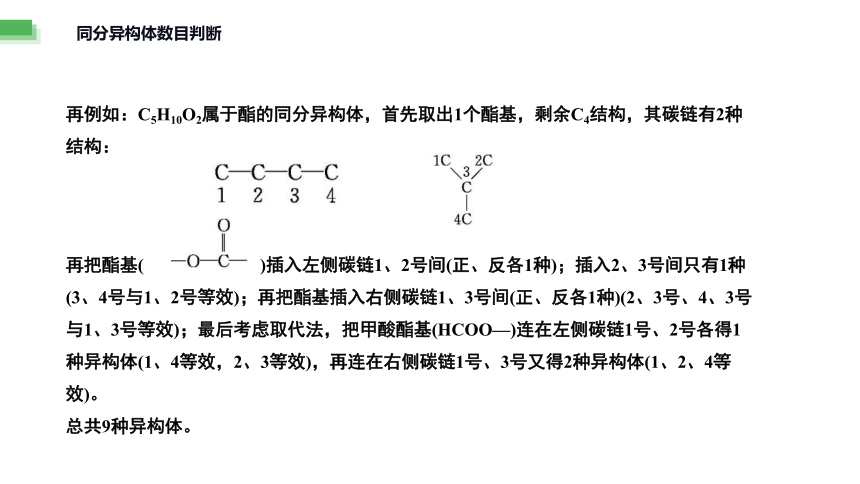
再例如:C5H10O2属于酯的同分异构体,首先取出1个酯基,剩余C4结构,其碳链有2种结构:
再把酯基( )插入左侧碳链1、2号间(正、反各1种);插入2、3号间只有1种(3、4号与1、2号等效);再把酯基插入右侧碳链1、3号间(正、反各1种)(2、3号、4、3号与1、3号等效);最后考虑取代法,把甲酸酯基(HCOO—)连在左侧碳链1号、2号各得1种异构体(1、4等效,2、3等效),再连在右侧碳链1号、3号又得2种异构体(1、2、4等效)。
总共9种异构体。
同分异构体数目判断
3.替代法的运用
对于多元取代物(三种以上)同分异构体种类分析一般用“替代法”。
例如:苯环上有“6个取代位置(即6个H)”,那么一取代物种类=五取代物种类,二取代物种类=四取代物种类,所以分析五取代物或四取代物时可以分析其一取代物种类或二取代物种类来达到化繁为简的目的。
有机物的性质
1.有机物的物理性质
(1)常见亲水基:羟基、醛基、羧基、氨基;
常见憎水基:烃基、卤素原子、硝基、酯基等。
凡是含有亲水基且憎水基相对质量较小(比如甲基、乙基等)的有机物一般都易溶于水。
(2)通常烃类、酯类、一元脂肪醇类、常见醛类密度小于水;硝基苯、四氯化碳、溴苯、苯酚、乙酸等密度大于水。
(3)C4以下的烃通常条件下为气体(新戊烷为气体),随着分子中碳原子数目的增多,各类有机物的同系物熔点、沸点逐渐升高。
同分异构体的支链越多,熔点、沸点越低。
有机物的性质
2.有机物的化学性质
(1)能与酸性高锰酸钾反应的有机物:含碳碳双键、碳碳三键的有机物,一级醇、二级醇,苯环侧链α碳连接H原子的有机物,醛基化合物,酚类。
(2)能与溴反应的有机物:烃类与溴蒸气光照取代,苯及其同系物与液溴在铁粉催化下可以取代苯环上的氢原子,酚羟基邻、对位碳原子上的氢原子与浓溴水发生取代,碳碳双键和碳碳三键与溴(溴水或溴的四氯化碳均可)发生加成反应,溴水可以把醛基氧化为羧基。
(3)有机氧化反应
①剧烈氧化:即与O2发生燃烧,除了多数卤代烃之外,大多数有机物均能燃烧;
②催化氧化:一级醇催化氧化为醛,二级醇催化氧化为酮,三级醇不能催化氧化,醛催化氧化为羧酸;
③弱氧化剂氧化:含有醛基的物质一般能被新制氢氧化铜悬浊液或银氨溶液氧化为羧基;④强氧化剂氧化:酸性高锰酸钾或重铬酸钾氧化(上面已总结)。
有机物的性质
(4)能与氢氧化钠反应的有机物含有的官能团:
酯基,羧基,酚羟基,卤素原子(普通酯基、羧基、酚羟基、卤素原子一般与NaOH按物质的量之比1∶1反应,特殊的酚酯及连在苯环上的卤素原子与NaOH按1∶2反应)。
(5)能与Na2CO3反应的有机物含有的官能团:羧基(生成二氧化碳,羧基不足产生NaHCO3)、酚羟基(仅能生成NaHCO3)。
(6)能与NaHCO3反应的有机物含有的官能团:仅羧基(产生二氧化碳)。
(7)能与Na反应的有机物含有的官能团:醇羟基、酚羟基、羧基均可(产生H2)。
(8)能与H2反应的有机物含有的官能团:碳碳双键(1∶1加H2)、碳碳三键(1∶2加H2)、苯环(1∶3加H2)、醛基(1∶1加H2生成一级醇)、酮羰基(1∶1加H2生成二级醇)
[注意:酯基和羧基中碳氧双键一般不能与氢气加成]。
有机物的性质
(9)有机反应类型
①取代反应:几乎所有有机物均能发生取代反应;
②加成反应:烯烃、炔烃、苯环、醛基、酮羰基可以发生加成反应;
③消去反应:卤代烃和醇类可以发生消去反应(必须有β-H);
④聚合反应:含有双官能团(且可反应)的有机物一般发生“缩聚反应”,含有碳碳双键或碳碳三键的有机物(某些羰基也可以)可以发生“加聚反应”,共轭二烯烃还可以发生1,2-加聚和1,4-加聚。
题型训练
题型训练
题型训练
A
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
谢谢观看
2025届高考化学二轮复习题型归纳与解题技巧
题型七 有机化合物
有机物组成、结构
1.C、H、O、N、X(X=F、Cl、Br、I)等常见原子成键特点
(1)碳原子成键特点
C最外层4个电子,差4个达到8电子稳定结构,所以C形成4个共价键;具体类型有①四个单键: (烷烃与环烷烃均为此结构),②两个单键+一个双键: (烯烃为此种结构),③一个单键+一个三键: (炔烃为这种结构),④两个双键: C (CO2为此结构、有机物中这种结构一般不稳定),⑤三个单键+1/6大π键: (芳香烃及其衍生物为此结构)。
(2)氢原子及卤素原子(X)成键特点:H差1个电子达2电子稳定结构,X是第ⅦA族,差1个电子达8电子稳定结构,所以H、X一般只能形成单键,也就是—H和 —X,所以H、X只能处在分子的“端位”一般不能成环。
有机物组成、结构
(3)O原子成键特点:O是第ⅥA族,最外层6个电子,差 2个电子达8电子稳定结构,所以一般可以形成2个共价键,也就是 O或—O—。
(4)N原子成键特点
N是第ⅤA族,最外层5个电子,差3个电子达8电子稳定结构,所以N一般可以形成3个共价键,也就是
①一个三键:≡N(N2或氰基就是此结构),
②一个单键+一个双键:—N (嘧啶、嘌呤含有此结构),
③三个单键: (氨气、氨基有此结构),注意铵根结构较特殊:[ ]+存在一个“配位键”所以形成4个共价键。
(5)C、N、O均可成环,也可以成链,但H、X不能成环。
有机物组成、结构
2.有机物原子共线、共面问题
(1)数学背景知识
①某条直线与某个平面有两个公共点,则该直线属于该平面。
②两个平面若存在三个不共线的公共点,则两个平面是同一个平面。
③若两个平面具有两个公共点(或三个共线的公共点),则两平面相交或是同一个平面。
(2)化学背景知识
① 结构属于四面体构型(若四个成键原子相同一般为正四面体,不同则为变形四面体),一旦出现此种结构则所有原子不可能共线,也不可能共面。
②凡是双键( 或 ) 部位一定属于平面构型。
③凡是三键(—C≡C—或—C≡N)部位一定属于直线构型。
④凡是苯环( )部位所有原子一定共平面;另外苯环“对位”的2个C和2个H一定共直线。
⑤链状化合物中所有碳原子一定不共线,因为键角为 109.5°,所以排列是锯齿状的。
有机物组成、结构
(3)解题技巧
一要注意:是什么原子(C还是H或O等)共线或共面;是可能还是一定;是最多还是最少。
二要注意:单键可以旋转(绕键轴旋转),这个就像方向盘,比如CH4的结构
,注意环状结构的单键旋转不会造成构型改变。
三要注意:分析共线、共面问题时要找到上述共线、共面的典型结构,并整理成与真实结构一样的形式。
比如 结构要整理成正四面体形“ ”(注意为了看出四面体立体结构,所以加了虚线轮廓);双键整理成 , ;三键整理成—C≡C—或—C≡N;苯环共线部分(对位)整理成 。
有机物组成、结构
例如, 整理成 ,在此结构中包括两个平面
结构,一个四面体结构和一个共线结构。如图:
同分异构体数目判断
1.基本思路
(1)首先观察C、H数量关系大致判断结构有无双键、三键、环状结构或苯环。
(2)分链状结构和环状结构分别考虑异构
①链状:先分析碳链异构,再分析官能团位置异构,最后分析官能团种类异构。
②环状:先分析3元环,再分析4元环……一般最多6元环。把其他原子连到环上。
③苯环结构:要一个侧链,两个侧链,三个侧链分别考虑;两个侧链要考虑邻、间、对异构;三个侧链要运用先定后动法来考虑。
(3)要注意结构简式尽量整理成对称结构,要注意等效H和等效C取代不会产生同分异构,要注意H一般不会造成异构,可以先把H删除只分析C骨架构造,最后根据C的4键结构补H(规律:键不够H来凑)。
(4)等效氢:同一个C上的H或处于对称位置的不同C上的H称为等效氢,注意分析等效H时,单键可以旋转,双键不可以旋转,要运用空间想象能力去分析,不能在平面上考虑问题。
同分异构体数目判断
2.取代法和插入法的运用
(1)形如—X、—OH、—CHO、—COOH、—NH2、—NO2等结构运用取代法。
例如:分析C5H10O属于醛的同分异构体,首先拿出一个醛基—CHO。那么剩余C4结构有两种碳链异构:
醛基取代左侧碳链1、2号位的H得到两种异构(1、4,2、3对称,属于等效取代)
醛基取代右侧碳链1、3号位的H得到两种异构(1、2、4对称,属于等效取代)
写出具体的结构简式(完整的,不能只写碳架结构)。
同分异构体数目判断
(2)形如 、—C≡C—、 、 、 等结构运用
插入法,前四者插入部分为 、≡、 、—O—,均为对称结构,最后一个
酯基插入部分为 (注意此基团左右不对称,所以有正插、反插两种形式,当插入位置是左右对称的话只有一种插入形式),另外酯基还要进行取代法分析,把C那一端连接H后,即变为甲酸酯基(HCOO—)这种结构,用O另一端的半键去取代不同H。
同分异构体数目判断
例如:分析C4H8属于烯烃的同分异构体,首先碳链异构是
双键( )插入左侧碳链1、2号间与2、3号间(1、2号与3、4号等效)得到2种异构体;
然后插入右侧碳链1、3号间(2、3号,4、3号与1、3号等效)又得到1种同分异构体。所以共3种异构体:
同分异构体数目判断
再例如:C5H10O2属于酯的同分异构体,首先取出1个酯基,剩余C4结构,其碳链有2种结构:
再把酯基( )插入左侧碳链1、2号间(正、反各1种);插入2、3号间只有1种(3、4号与1、2号等效);再把酯基插入右侧碳链1、3号间(正、反各1种)(2、3号、4、3号与1、3号等效);最后考虑取代法,把甲酸酯基(HCOO—)连在左侧碳链1号、2号各得1种异构体(1、4等效,2、3等效),再连在右侧碳链1号、3号又得2种异构体(1、2、4等效)。
总共9种异构体。
同分异构体数目判断
3.替代法的运用
对于多元取代物(三种以上)同分异构体种类分析一般用“替代法”。
例如:苯环上有“6个取代位置(即6个H)”,那么一取代物种类=五取代物种类,二取代物种类=四取代物种类,所以分析五取代物或四取代物时可以分析其一取代物种类或二取代物种类来达到化繁为简的目的。
有机物的性质
1.有机物的物理性质
(1)常见亲水基:羟基、醛基、羧基、氨基;
常见憎水基:烃基、卤素原子、硝基、酯基等。
凡是含有亲水基且憎水基相对质量较小(比如甲基、乙基等)的有机物一般都易溶于水。
(2)通常烃类、酯类、一元脂肪醇类、常见醛类密度小于水;硝基苯、四氯化碳、溴苯、苯酚、乙酸等密度大于水。
(3)C4以下的烃通常条件下为气体(新戊烷为气体),随着分子中碳原子数目的增多,各类有机物的同系物熔点、沸点逐渐升高。
同分异构体的支链越多,熔点、沸点越低。
有机物的性质
2.有机物的化学性质
(1)能与酸性高锰酸钾反应的有机物:含碳碳双键、碳碳三键的有机物,一级醇、二级醇,苯环侧链α碳连接H原子的有机物,醛基化合物,酚类。
(2)能与溴反应的有机物:烃类与溴蒸气光照取代,苯及其同系物与液溴在铁粉催化下可以取代苯环上的氢原子,酚羟基邻、对位碳原子上的氢原子与浓溴水发生取代,碳碳双键和碳碳三键与溴(溴水或溴的四氯化碳均可)发生加成反应,溴水可以把醛基氧化为羧基。
(3)有机氧化反应
①剧烈氧化:即与O2发生燃烧,除了多数卤代烃之外,大多数有机物均能燃烧;
②催化氧化:一级醇催化氧化为醛,二级醇催化氧化为酮,三级醇不能催化氧化,醛催化氧化为羧酸;
③弱氧化剂氧化:含有醛基的物质一般能被新制氢氧化铜悬浊液或银氨溶液氧化为羧基;④强氧化剂氧化:酸性高锰酸钾或重铬酸钾氧化(上面已总结)。
有机物的性质
(4)能与氢氧化钠反应的有机物含有的官能团:
酯基,羧基,酚羟基,卤素原子(普通酯基、羧基、酚羟基、卤素原子一般与NaOH按物质的量之比1∶1反应,特殊的酚酯及连在苯环上的卤素原子与NaOH按1∶2反应)。
(5)能与Na2CO3反应的有机物含有的官能团:羧基(生成二氧化碳,羧基不足产生NaHCO3)、酚羟基(仅能生成NaHCO3)。
(6)能与NaHCO3反应的有机物含有的官能团:仅羧基(产生二氧化碳)。
(7)能与Na反应的有机物含有的官能团:醇羟基、酚羟基、羧基均可(产生H2)。
(8)能与H2反应的有机物含有的官能团:碳碳双键(1∶1加H2)、碳碳三键(1∶2加H2)、苯环(1∶3加H2)、醛基(1∶1加H2生成一级醇)、酮羰基(1∶1加H2生成二级醇)
[注意:酯基和羧基中碳氧双键一般不能与氢气加成]。
有机物的性质
(9)有机反应类型
①取代反应:几乎所有有机物均能发生取代反应;
②加成反应:烯烃、炔烃、苯环、醛基、酮羰基可以发生加成反应;
③消去反应:卤代烃和醇类可以发生消去反应(必须有β-H);
④聚合反应:含有双官能团(且可反应)的有机物一般发生“缩聚反应”,含有碳碳双键或碳碳三键的有机物(某些羰基也可以)可以发生“加聚反应”,共轭二烯烃还可以发生1,2-加聚和1,4-加聚。
题型训练
题型训练
题型训练
A
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
谢谢观看
同课章节目录
