题型十 无机化学工艺流程——高考化学二轮复习题型归纳与解题技巧(共35张PPT)
文档属性
| 名称 | 题型十 无机化学工艺流程——高考化学二轮复习题型归纳与解题技巧(共35张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 765.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-24 19:52:42 | ||
图片预览










文档简介
(共35张PPT)
2025届高考化学二轮复习题型归纳与解题技巧
题型十 无机化学工艺流程
原料预处理
1.原料预处理的目的
(1)原料经过预处理主要是除去不必要的杂质,净化所需要的原料。
(2)原料中的目标物质(不易除去的杂质)转化为易于化学处理的物质。
2.原料的预处理措施
原料预处理
1.常用仪器使用
原料预处理
3.浸出率(浸取率)
实际浸取量与理论浸取量的比值(固体溶解后,离子在溶液中含量的多少)。
4.提高浸出率的方法
适当升温(加热)、搅拌、粉碎(研磨)、增大反应物(酸、碱)的浓度等
反应条件的控制
通过控制一定的反应条件,来达到提高物质转化率或更彻底除去杂质的目的。
反应条件最常见的是溶液的pH、反应的温度、反应物的配料比等。
1.控制溶液的酸碱性(pH)的目的
(1)增强物质的氧化性(增强MnO4-、NO3-的氧化性)。
(2)通过控制溶液的pH可以除去某些金属离子。
①如:要除去溶液中含有的Fe3+、Al3+,可调节溶液的pH使之转变为Fe(OH)3、Al(OH)3沉淀。[若有Fe2+,需先用氧化剂(H2O2等)把Fe2+氧化为Fe3+]
②调节pH所需的物质一般应满足两点:能与H+反应,使溶液pH增大;不引入新杂质。例如:若要除去Cu2+溶液中混有的Fe3+,可加入CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3等物质来调节溶液的pH。
反应条件的控制
2.控制反应的温度
(1)控制反应温度的目的
(2)控制反应物温度的方法:水浴、油浴、冰水浴、沙浴等。
反应条件的控制
3.调节反应物的浓度(配料比)
(1)通过控制反应物的浓度,控制反应的类型,有利于目标反应的进行。
(2)根据需要选择适宜浓度,控制一定的反应速率,使平衡向利于目标产物生成的方向进行。
(3)反应物过量,能保证反应的完全发生或提高其他物质的转化率,但会给后续操作带来除杂问题。
4.加入氧化剂、还原剂
完成溶液中离子的转化,需要根据题目信息(溶液中离子的氧化性、还原性)判断加入试剂的作用。
如加入H2O2或NaClO等,把Fe2+转化为Fe3+。
陌生方程式的书写
在工艺流程题中常出现过渡金属元素的转化,所以有关的氧化还原反应方程式、离子方程式的书写成为必出的考查点,有时也会涉及非氧化还原反应、电极反应式的书写。
陌生方程式的书写
1.氧化还原反应方程式、离子方程式的书写
(1)了解常见氧化剂、还原剂,当在题目中出现时能联想到其氧化性、还原性
①常见氧化剂:Na2O2、Fe3+、NO2、HNO3(浓)、HNO3(稀)、O2、O3、H2O2、H2SO4(浓)、Cl2、Br2、HClO、NaClO、Ca(ClO)2、KMnO4(H+)、KClO3等。
②常见还原剂:Fe2+、SO2、H2SO3、Na2SO3、NaHSO3、SO32-、H2S、Na2S、NaHS、S2-、HI、NaI、I-等。
③注意H2O2既有氧化性,也有还原性。绝大多数情境下作氧化剂,但遇到强氧化剂时也可能作还原剂。
④注意题目中给出的提示信息、暗示信息。如要制备某金属较高价态化合物,意味着其低价离子有还原性。
陌生方程式的书写
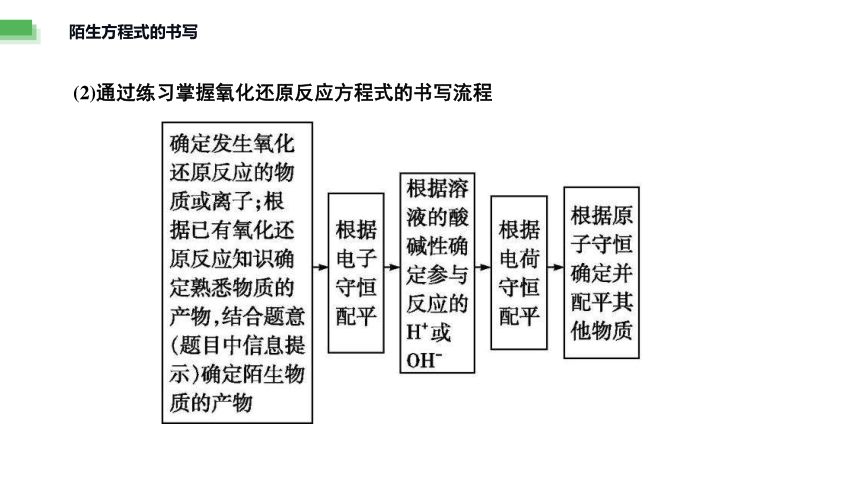
(2)通过练习掌握氧化还原反应方程式的书写流程
陌生方程式的书写
(3)缺项化学方程式的配平
配平化学方程式时,有时要用H+、OH-、H2O来使化学方程式两边电荷及原子守恒,总的原则是酸性溶液中不能出现OH-,碱性溶液中不能出现H+,具体方法如下:
陌生方程式的书写
2.非氧化还原反应方程式的书写
(1)广义的水解反应
广义的水解是指化合物中的正电性原子或原子团与“OH”结合,负电性原子或原子团与“H”结合形成两种新的物质。
(2)酸(酸式盐)与碱可发生反应,强酸与弱酸盐反应生成强酸盐与弱酸。
(3)铵盐、弱酸酸式盐、难溶氢氧化物、难溶碳酸盐受热后的分解反应。
(4)多元弱酸盐与其多元弱酸反应生成其酸式盐。
陌生方程式的书写
3.电极反应式的书写
(1)原电池的电极反应都是自发氧化还原反应的半反应,其书写思路为:
①负极反应先考虑还原剂失电子后的合理产物(碳元素酸性条件下生成CO2、碱性条件下以C存在),然后考虑产物与电解质是否反应。
②正极反应则先考虑氧化剂得电子后的合理产物,然后考虑产物与电解质是否反应。
(2)电解池中的阳极有最强的氧化能力,阴极有最强的还原能力,所以可以发生平常不能发生的一些氧化还原反应,同时考虑得失电子后的产物与电解液可能发生的反应。
(3)由于离子在电极上的放电顺序除了与离子氧化还原性有关外,还与离子浓度等因素有关,所以有些电极反应需要结合题目的信息完成。
物质的分离与提纯
1.化工流程中常用分离操作
物质的分离与提纯
1.化工流程中常用分离操作
物质的分离与提纯
2.分离提纯中操作的答题规范
(1)结晶操作
从溶液中得到带结晶水的晶体的操作是:蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(2)沉淀、过滤
①沉淀剂过量的判断
把反应后的混合物静置一段时间,吸取少量上层清液,置于一洁净的试管中,再滴加少量的沉淀剂,若没有沉淀生成,则证明沉淀剂已过量。
②沉淀洗涤操作
向过滤得到的沉淀上慢慢加入适量蒸馏水至刚好浸没沉淀,然后静置,让其自然流下,重复以上操作2~3次,直至洗涤干净。为了减少沉淀的溶解,可用冰水或有机溶剂洗涤。
③检验沉淀洗涤干净
取少量最后一次洗涤液,置于一洁净的试管中,再滴加少量的检验试剂,若没有特征现象出现,则证明沉淀已洗涤干净。
物质的分离与提纯
3.沉淀洗涤时洗涤剂的选择
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
谢谢观看
2025届高考化学二轮复习题型归纳与解题技巧
题型十 无机化学工艺流程
原料预处理
1.原料预处理的目的
(1)原料经过预处理主要是除去不必要的杂质,净化所需要的原料。
(2)原料中的目标物质(不易除去的杂质)转化为易于化学处理的物质。
2.原料的预处理措施
原料预处理
1.常用仪器使用
原料预处理
3.浸出率(浸取率)
实际浸取量与理论浸取量的比值(固体溶解后,离子在溶液中含量的多少)。
4.提高浸出率的方法
适当升温(加热)、搅拌、粉碎(研磨)、增大反应物(酸、碱)的浓度等
反应条件的控制
通过控制一定的反应条件,来达到提高物质转化率或更彻底除去杂质的目的。
反应条件最常见的是溶液的pH、反应的温度、反应物的配料比等。
1.控制溶液的酸碱性(pH)的目的
(1)增强物质的氧化性(增强MnO4-、NO3-的氧化性)。
(2)通过控制溶液的pH可以除去某些金属离子。
①如:要除去溶液中含有的Fe3+、Al3+,可调节溶液的pH使之转变为Fe(OH)3、Al(OH)3沉淀。[若有Fe2+,需先用氧化剂(H2O2等)把Fe2+氧化为Fe3+]
②调节pH所需的物质一般应满足两点:能与H+反应,使溶液pH增大;不引入新杂质。例如:若要除去Cu2+溶液中混有的Fe3+,可加入CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3等物质来调节溶液的pH。
反应条件的控制
2.控制反应的温度
(1)控制反应温度的目的
(2)控制反应物温度的方法:水浴、油浴、冰水浴、沙浴等。
反应条件的控制
3.调节反应物的浓度(配料比)
(1)通过控制反应物的浓度,控制反应的类型,有利于目标反应的进行。
(2)根据需要选择适宜浓度,控制一定的反应速率,使平衡向利于目标产物生成的方向进行。
(3)反应物过量,能保证反应的完全发生或提高其他物质的转化率,但会给后续操作带来除杂问题。
4.加入氧化剂、还原剂
完成溶液中离子的转化,需要根据题目信息(溶液中离子的氧化性、还原性)判断加入试剂的作用。
如加入H2O2或NaClO等,把Fe2+转化为Fe3+。
陌生方程式的书写
在工艺流程题中常出现过渡金属元素的转化,所以有关的氧化还原反应方程式、离子方程式的书写成为必出的考查点,有时也会涉及非氧化还原反应、电极反应式的书写。
陌生方程式的书写
1.氧化还原反应方程式、离子方程式的书写
(1)了解常见氧化剂、还原剂,当在题目中出现时能联想到其氧化性、还原性
①常见氧化剂:Na2O2、Fe3+、NO2、HNO3(浓)、HNO3(稀)、O2、O3、H2O2、H2SO4(浓)、Cl2、Br2、HClO、NaClO、Ca(ClO)2、KMnO4(H+)、KClO3等。
②常见还原剂:Fe2+、SO2、H2SO3、Na2SO3、NaHSO3、SO32-、H2S、Na2S、NaHS、S2-、HI、NaI、I-等。
③注意H2O2既有氧化性,也有还原性。绝大多数情境下作氧化剂,但遇到强氧化剂时也可能作还原剂。
④注意题目中给出的提示信息、暗示信息。如要制备某金属较高价态化合物,意味着其低价离子有还原性。
陌生方程式的书写
(2)通过练习掌握氧化还原反应方程式的书写流程
陌生方程式的书写
(3)缺项化学方程式的配平
配平化学方程式时,有时要用H+、OH-、H2O来使化学方程式两边电荷及原子守恒,总的原则是酸性溶液中不能出现OH-,碱性溶液中不能出现H+,具体方法如下:
陌生方程式的书写
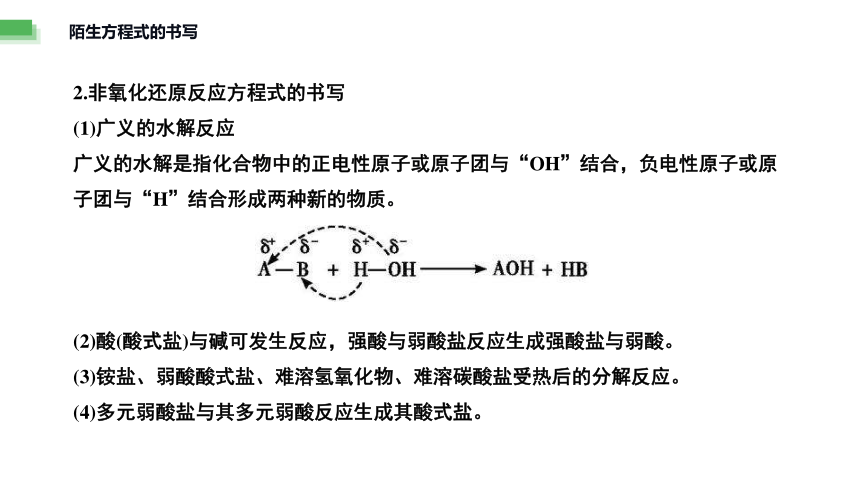
2.非氧化还原反应方程式的书写
(1)广义的水解反应
广义的水解是指化合物中的正电性原子或原子团与“OH”结合,负电性原子或原子团与“H”结合形成两种新的物质。
(2)酸(酸式盐)与碱可发生反应,强酸与弱酸盐反应生成强酸盐与弱酸。
(3)铵盐、弱酸酸式盐、难溶氢氧化物、难溶碳酸盐受热后的分解反应。
(4)多元弱酸盐与其多元弱酸反应生成其酸式盐。
陌生方程式的书写
3.电极反应式的书写
(1)原电池的电极反应都是自发氧化还原反应的半反应,其书写思路为:
①负极反应先考虑还原剂失电子后的合理产物(碳元素酸性条件下生成CO2、碱性条件下以C存在),然后考虑产物与电解质是否反应。
②正极反应则先考虑氧化剂得电子后的合理产物,然后考虑产物与电解质是否反应。
(2)电解池中的阳极有最强的氧化能力,阴极有最强的还原能力,所以可以发生平常不能发生的一些氧化还原反应,同时考虑得失电子后的产物与电解液可能发生的反应。
(3)由于离子在电极上的放电顺序除了与离子氧化还原性有关外,还与离子浓度等因素有关,所以有些电极反应需要结合题目的信息完成。
物质的分离与提纯
1.化工流程中常用分离操作
物质的分离与提纯
1.化工流程中常用分离操作
物质的分离与提纯
2.分离提纯中操作的答题规范
(1)结晶操作
从溶液中得到带结晶水的晶体的操作是:蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(2)沉淀、过滤
①沉淀剂过量的判断
把反应后的混合物静置一段时间,吸取少量上层清液,置于一洁净的试管中,再滴加少量的沉淀剂,若没有沉淀生成,则证明沉淀剂已过量。
②沉淀洗涤操作
向过滤得到的沉淀上慢慢加入适量蒸馏水至刚好浸没沉淀,然后静置,让其自然流下,重复以上操作2~3次,直至洗涤干净。为了减少沉淀的溶解,可用冰水或有机溶剂洗涤。
③检验沉淀洗涤干净
取少量最后一次洗涤液,置于一洁净的试管中,再滴加少量的检验试剂,若没有特征现象出现,则证明沉淀已洗涤干净。
物质的分离与提纯
3.沉淀洗涤时洗涤剂的选择
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
谢谢观看
同课章节目录
