题型十二 物质结构与性质综合——高考化学二轮复习题型归纳与解题技巧(共37张PPT)
文档属性
| 名称 | 题型十二 物质结构与性质综合——高考化学二轮复习题型归纳与解题技巧(共37张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-24 19:49:45 | ||
图片预览






文档简介
(共37张PPT)
2025届高考化学二轮复习题型归纳与解题技巧
题型十二 物质结构与性质综合
电子排布式、电离能和电负性
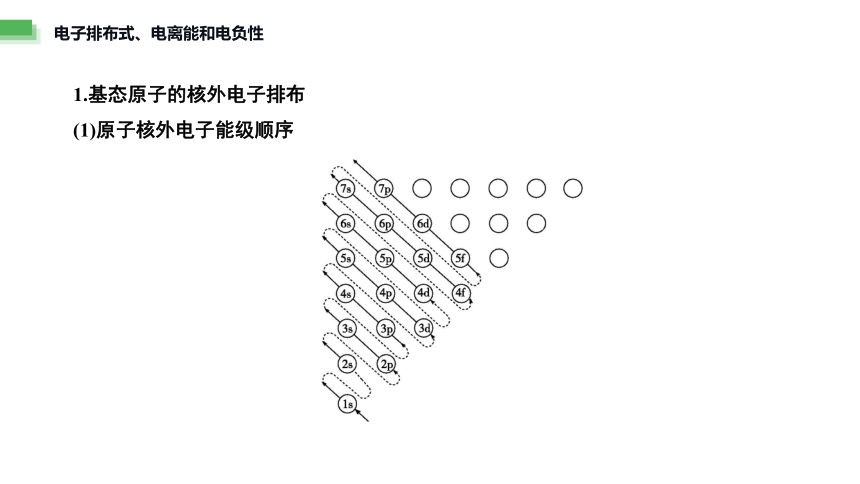
1.基态原子的核外电子排布
(1)原子核外电子能级顺序
电子排布式、电离能和电负性
(2)核外电子排布规律
电子排布式、电离能和电负性
(3)核外电子排布的四种表示方法
注意:①3d能级的半满、全满更稳定。Cr、Cu的电子排布式分别为1s22s22p63s23p63d54s1、1s22s22p63s23p63d104s1,而非1s22s22p63s23p63d44s2、1s22s22p63s23p63d94s2。
②虽然电子填充是按照4s、3d的顺序,但书写电子排布式时仍按照3d、4s的顺序书写。
电子排布式、电离能和电负性
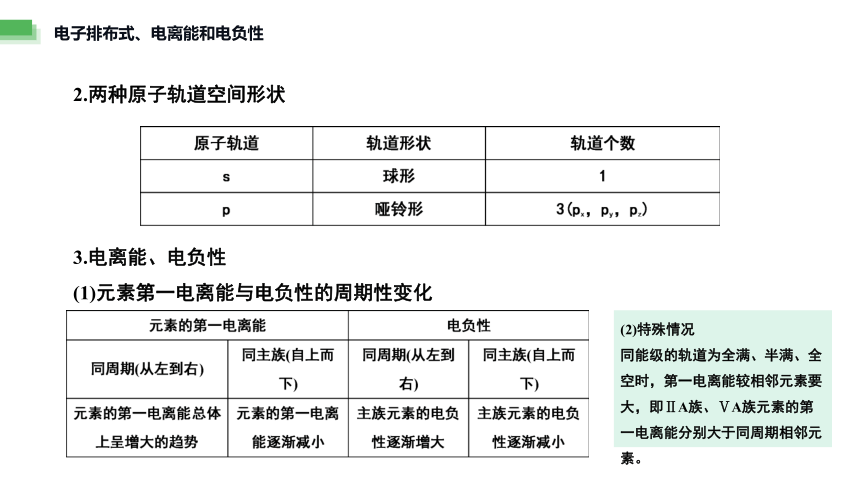
2.两种原子轨道空间形状
3.电离能、电负性
(1)元素第一电离能与电负性的周期性变化
(2)特殊情况
同能级的轨道为全满、半满、全空时,第一电离能较相邻元素要大,即ⅡA族、ⅤA族元素的第一电离能分别大于同周期相邻元素。
电子排布式、电离能和电负性
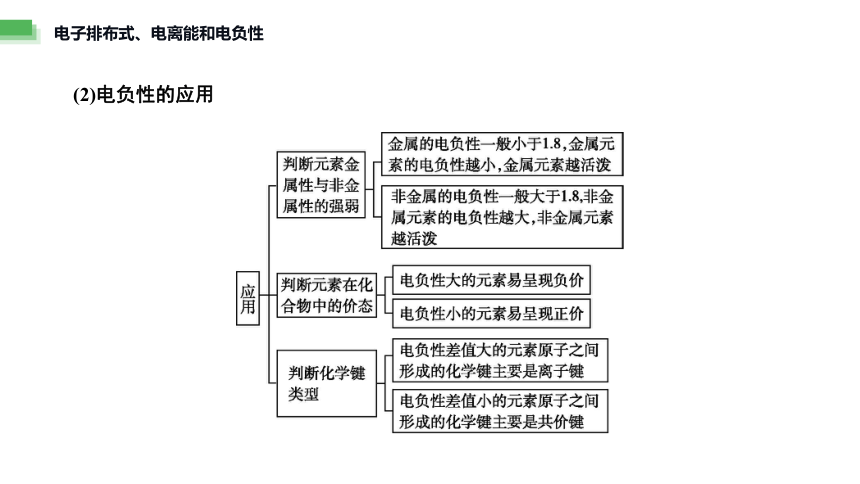
4.电离能、电负性的应用
(1)电离能的应用
电子排布式、电离能和电负性
(2)电负性的应用
共价键类型、杂化轨道类型和空间结构
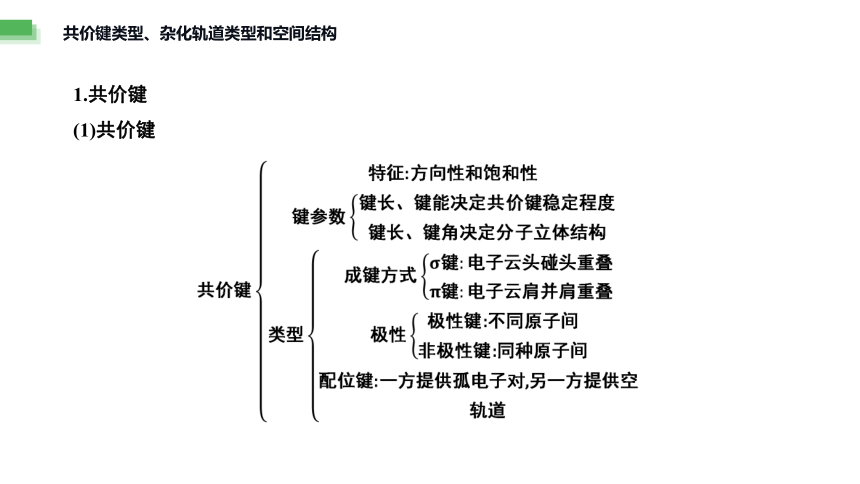
1.共价键
(1)共价键
共价键类型、杂化轨道类型和空间结构
(2)σ键和π键判定
②从成键轨道种类判断:s轨道、杂化轨道参与形成的共价键全部为σ键;p-p轨道可以形成σ键,也可以形成π键(优先形成σ键,从第二个共价键开始只能形成π键)。
(3)配位键
①配位键是一种特殊的共价键(一方提供空轨道,另一方提供孤电子对)。
②配位键的表示:常用“→”来表示配位键,箭头指向接受孤电子对的原子,如NH4+可表示为 。
注意:N中,虽然有一个氮氢键的形成过程与其他 3个氮氢键的形成过程不同,但是一旦形成之后,4个共价键就完全相同。
共价键类型、杂化轨道类型和空间结构
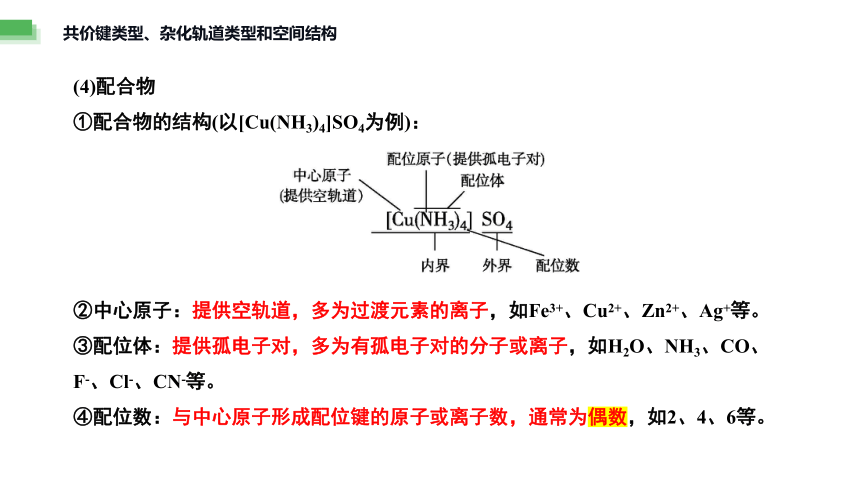
(4)配合物
①配合物的结构(以[Cu(NH3)4]SO4为例):
②中心原子:提供空轨道,多为过渡元素的离子,如Fe3+、Cu2+、Zn2+、Ag+等。
③配位体:提供孤电子对,多为有孤电子对的分子或离子,如H2O、NH3、CO、F-、Cl-、CN-等。
④配位数:与中心原子形成配位键的原子或离子数,通常为偶数,如2、4、6等。
共价键类型、杂化轨道类型和空间结构
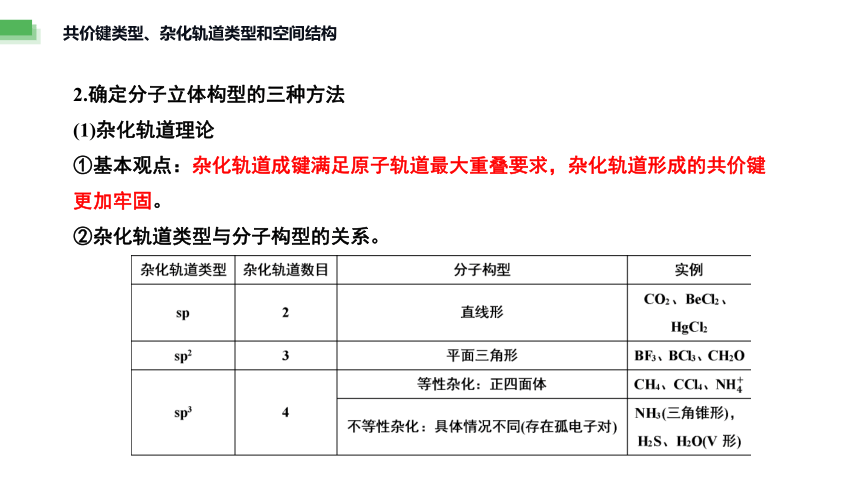
2.确定分子立体构型的三种方法
(1)杂化轨道理论
①基本观点:杂化轨道成键满足原子轨道最大重叠要求,杂化轨道形成的共价键更加牢固。
②杂化轨道类型与分子构型的关系。
共价键类型、杂化轨道类型和空间结构
(2)价层电子对互斥理论
①基本观点:分子中的价电子对(包括成键电子对和孤电子对)由于相互排斥作用,尽可能在空间上彼此远离。
②价电子对数的计算
价电子对数=成键电子对+中心原子的孤电子对数
说明:a.m为与中心原子成键的配位原子个数。
b.阳离子要减去电荷数,阴离子要加上电荷数。
c.氧原子作配位原子时,不提供电子。
共价键类型、杂化轨道类型和空间结构
③价层电子对空间构型与分子的立体构型
价层电子对空间构型是价层电子对(包括成键电子对、孤电子对)的立体构型,分子的立体构型指的是成键电子对空间构型。
中心原子无孤电子对,两者构型一致;
中心原子有孤电子对,两者构型不同。
共价键类型、杂化轨道类型和空间结构
④价层电子对互斥理论在判断分子构型中的应用
共价键类型、杂化轨道类型和空间结构
(3)等电子体及应用
①概念:原子总数相同、价电子总数相同的分子具有相似的化学键特征、空间构型。
②确定等电子体的思路:价电子数相同的元素代换(CO2、CS2;SO2、O3);价电子数相近元素组成分子与离子(CO32-、NO3-、SO3;CO、N2)。
③常见的等电子体
共价键类型、杂化轨道类型和空间结构
3.化学键的极性与分子极性的关系
(1)化学键极性取决于成键原子是否相同(同种原子是非极性键,不同种原子是极性键)。
(2)分子的极性取决于共价键的极性和分子的立体构型。
共价键类型、杂化轨道类型和空间结构
4.共价键、氢键、范德华力对物质性质的影响
结构决定性质——原因解释类简答题
三、结构决定性质——原因解释类简答题
1.价层电子对互斥对分子键角的影响
(1)价层电子对(成键电子对、孤电子对)之间相互排斥,尽可能地在空间远离。
(2)价层电子对之间斥力大小顺序:孤电子对—孤电子对 孤电子对—成键电子对>成键电子对—成键电子对。
(3)排斥力大小对键角的影响
2.分子结构对物质性质的影响
(1)对溶解度的影响
“相似相溶”规律:
非极性分子组成的溶质一般能溶于非极性分子组成的溶剂,极性分子组成的溶质一般能溶于极性分子组成的溶剂。
如果溶质分子与溶剂分子间能形成氢键,则溶剂和溶质之间的氢键作用力越大,溶解性越好。
(2)对无机含氧酸分子酸性的影响
①无机含氧酸可写成(HO)mROn。
②如果成酸元素R相同,则n值越大(非羟基氧原子越多),酸性越强,如:HClO结构决定性质——原因解释类简答题
3.范德华力、氢键对物质性质的影响
(1)范德华力存在于分子晶体中,对物质的熔点、沸点、溶解度都有影响。
①范德华力越大,分子晶体熔点、沸点越高;溶质分子与溶剂分子间的范德华力越大,则溶质分子的溶解度越大。
②对于组成和结构相似的物质,相对分子质量越大,范德华力越大。
(2)氢键分为分子内氢键和分子间氢键,影响物质性质的主要是分子间氢键。
①氢键具有方向性和饱和性,形成分子内氢键后,就减少了分子间氢键的形成。
②分子间氢键使物质熔、沸点升高,溶解度增大。
结构决定性质——原因解释类简答题
4.晶体熔、沸点高低的比较
(1)不同类型晶体的熔、沸点比较
原子晶体>离子晶体>分子晶体。
(2)同类型晶体的熔、沸点比较
①原子晶体
元素非金属性越强,形成共价键越短,键越牢固,晶体的熔、沸点越高。
如熔点:金刚石>碳化硅>硅。
②离子晶体
阴、阳离子的电荷数越多,离子半径越小,则离子间离子键越强,其晶体的熔、沸点就越高,
如熔点:MgO>NaCl>CsCl。
结构决定性质——原因解释类简答题
③分子晶体
a.组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。
如熔点:SnH4>GeH4>SiH4>CH4。
b.分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常地高。
如熔点:H2O>H2Te>H2Se>H2S;
易形成分子间氢键的物质熔、沸点高于形成分子内氢键的。
如沸点:对羟基苯甲醛>邻羟基苯甲醛。
c.组成和结构不相似的分子晶体(相对分子质量接近),分子的极性越大,其熔、沸点越高。
如熔点:CO>N2,CH3OH>CH3CH3。
④金属晶体
金属离子半径越小,离子电荷数越多,金属键越强,金属熔、沸点就越高。
如熔、沸点:Al>Mg>Na。
结构决定性质——原因解释类简答题
晶体结构分析及简单计算
1.几种常见的晶胞结构
晶体结构分析及简单计算
1.几种常见的晶胞结构
晶体结构分析及简单计算
2.晶胞的表示
(1)晶胞参数
晶胞的形状和大小可以用6个参数来表示,包括晶胞的3组棱长a、b、c和 3组棱相互间的夹角α、β、γ。如立方晶胞中,晶胞参数a=b=c,α=β=γ=90°。
(2)原子坐标参数,表示晶胞内部各原子的相对位置。
晶体结构分析及简单计算
3.晶胞的计算
(1)①“均摊法”原理
②非长方体(非正方体)晶胞中粒子对晶胞的贡献视具体情况而定。如石墨晶胞每一层内碳原子排成六边形,其顶点(1个碳原子)对六边形的贡献为。在如图所示的正三棱柱形晶胞(注:6个正三棱柱拼合成六棱柱)中:
晶体结构分析及简单计算
(2)立方体晶胞中微粒间的距离关系
(3)晶胞中M、ρ之间的关系
(其中M是物质的摩尔质量;n是晶胞拥有的微粒数;V是晶胞体积)
(4)晶胞中原子空间利用率
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
谢谢观看
2025届高考化学二轮复习题型归纳与解题技巧
题型十二 物质结构与性质综合
电子排布式、电离能和电负性
1.基态原子的核外电子排布
(1)原子核外电子能级顺序
电子排布式、电离能和电负性
(2)核外电子排布规律
电子排布式、电离能和电负性
(3)核外电子排布的四种表示方法
注意:①3d能级的半满、全满更稳定。Cr、Cu的电子排布式分别为1s22s22p63s23p63d54s1、1s22s22p63s23p63d104s1,而非1s22s22p63s23p63d44s2、1s22s22p63s23p63d94s2。
②虽然电子填充是按照4s、3d的顺序,但书写电子排布式时仍按照3d、4s的顺序书写。
电子排布式、电离能和电负性
2.两种原子轨道空间形状
3.电离能、电负性
(1)元素第一电离能与电负性的周期性变化
(2)特殊情况
同能级的轨道为全满、半满、全空时,第一电离能较相邻元素要大,即ⅡA族、ⅤA族元素的第一电离能分别大于同周期相邻元素。
电子排布式、电离能和电负性
4.电离能、电负性的应用
(1)电离能的应用
电子排布式、电离能和电负性
(2)电负性的应用
共价键类型、杂化轨道类型和空间结构
1.共价键
(1)共价键
共价键类型、杂化轨道类型和空间结构
(2)σ键和π键判定
②从成键轨道种类判断:s轨道、杂化轨道参与形成的共价键全部为σ键;p-p轨道可以形成σ键,也可以形成π键(优先形成σ键,从第二个共价键开始只能形成π键)。
(3)配位键
①配位键是一种特殊的共价键(一方提供空轨道,另一方提供孤电子对)。
②配位键的表示:常用“→”来表示配位键,箭头指向接受孤电子对的原子,如NH4+可表示为 。
注意:N中,虽然有一个氮氢键的形成过程与其他 3个氮氢键的形成过程不同,但是一旦形成之后,4个共价键就完全相同。
共价键类型、杂化轨道类型和空间结构
(4)配合物
①配合物的结构(以[Cu(NH3)4]SO4为例):
②中心原子:提供空轨道,多为过渡元素的离子,如Fe3+、Cu2+、Zn2+、Ag+等。
③配位体:提供孤电子对,多为有孤电子对的分子或离子,如H2O、NH3、CO、F-、Cl-、CN-等。
④配位数:与中心原子形成配位键的原子或离子数,通常为偶数,如2、4、6等。
共价键类型、杂化轨道类型和空间结构
2.确定分子立体构型的三种方法
(1)杂化轨道理论
①基本观点:杂化轨道成键满足原子轨道最大重叠要求,杂化轨道形成的共价键更加牢固。
②杂化轨道类型与分子构型的关系。
共价键类型、杂化轨道类型和空间结构
(2)价层电子对互斥理论
①基本观点:分子中的价电子对(包括成键电子对和孤电子对)由于相互排斥作用,尽可能在空间上彼此远离。
②价电子对数的计算
价电子对数=成键电子对+中心原子的孤电子对数
说明:a.m为与中心原子成键的配位原子个数。
b.阳离子要减去电荷数,阴离子要加上电荷数。
c.氧原子作配位原子时,不提供电子。
共价键类型、杂化轨道类型和空间结构
③价层电子对空间构型与分子的立体构型
价层电子对空间构型是价层电子对(包括成键电子对、孤电子对)的立体构型,分子的立体构型指的是成键电子对空间构型。
中心原子无孤电子对,两者构型一致;
中心原子有孤电子对,两者构型不同。
共价键类型、杂化轨道类型和空间结构
④价层电子对互斥理论在判断分子构型中的应用
共价键类型、杂化轨道类型和空间结构
(3)等电子体及应用
①概念:原子总数相同、价电子总数相同的分子具有相似的化学键特征、空间构型。
②确定等电子体的思路:价电子数相同的元素代换(CO2、CS2;SO2、O3);价电子数相近元素组成分子与离子(CO32-、NO3-、SO3;CO、N2)。
③常见的等电子体
共价键类型、杂化轨道类型和空间结构
3.化学键的极性与分子极性的关系
(1)化学键极性取决于成键原子是否相同(同种原子是非极性键,不同种原子是极性键)。
(2)分子的极性取决于共价键的极性和分子的立体构型。
共价键类型、杂化轨道类型和空间结构
4.共价键、氢键、范德华力对物质性质的影响
结构决定性质——原因解释类简答题
三、结构决定性质——原因解释类简答题
1.价层电子对互斥对分子键角的影响
(1)价层电子对(成键电子对、孤电子对)之间相互排斥,尽可能地在空间远离。
(2)价层电子对之间斥力大小顺序:孤电子对—孤电子对 孤电子对—成键电子对>成键电子对—成键电子对。
(3)排斥力大小对键角的影响
2.分子结构对物质性质的影响
(1)对溶解度的影响
“相似相溶”规律:
非极性分子组成的溶质一般能溶于非极性分子组成的溶剂,极性分子组成的溶质一般能溶于极性分子组成的溶剂。
如果溶质分子与溶剂分子间能形成氢键,则溶剂和溶质之间的氢键作用力越大,溶解性越好。
(2)对无机含氧酸分子酸性的影响
①无机含氧酸可写成(HO)mROn。
②如果成酸元素R相同,则n值越大(非羟基氧原子越多),酸性越强,如:HClO
3.范德华力、氢键对物质性质的影响
(1)范德华力存在于分子晶体中,对物质的熔点、沸点、溶解度都有影响。
①范德华力越大,分子晶体熔点、沸点越高;溶质分子与溶剂分子间的范德华力越大,则溶质分子的溶解度越大。
②对于组成和结构相似的物质,相对分子质量越大,范德华力越大。
(2)氢键分为分子内氢键和分子间氢键,影响物质性质的主要是分子间氢键。
①氢键具有方向性和饱和性,形成分子内氢键后,就减少了分子间氢键的形成。
②分子间氢键使物质熔、沸点升高,溶解度增大。
结构决定性质——原因解释类简答题
4.晶体熔、沸点高低的比较
(1)不同类型晶体的熔、沸点比较
原子晶体>离子晶体>分子晶体。
(2)同类型晶体的熔、沸点比较
①原子晶体
元素非金属性越强,形成共价键越短,键越牢固,晶体的熔、沸点越高。
如熔点:金刚石>碳化硅>硅。
②离子晶体
阴、阳离子的电荷数越多,离子半径越小,则离子间离子键越强,其晶体的熔、沸点就越高,
如熔点:MgO>NaCl>CsCl。
结构决定性质——原因解释类简答题
③分子晶体
a.组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。
如熔点:SnH4>GeH4>SiH4>CH4。
b.分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常地高。
如熔点:H2O>H2Te>H2Se>H2S;
易形成分子间氢键的物质熔、沸点高于形成分子内氢键的。
如沸点:对羟基苯甲醛>邻羟基苯甲醛。
c.组成和结构不相似的分子晶体(相对分子质量接近),分子的极性越大,其熔、沸点越高。
如熔点:CO>N2,CH3OH>CH3CH3。
④金属晶体
金属离子半径越小,离子电荷数越多,金属键越强,金属熔、沸点就越高。
如熔、沸点:Al>Mg>Na。
结构决定性质——原因解释类简答题
晶体结构分析及简单计算
1.几种常见的晶胞结构
晶体结构分析及简单计算
1.几种常见的晶胞结构
晶体结构分析及简单计算
2.晶胞的表示
(1)晶胞参数
晶胞的形状和大小可以用6个参数来表示,包括晶胞的3组棱长a、b、c和 3组棱相互间的夹角α、β、γ。如立方晶胞中,晶胞参数a=b=c,α=β=γ=90°。
(2)原子坐标参数,表示晶胞内部各原子的相对位置。
晶体结构分析及简单计算
3.晶胞的计算
(1)①“均摊法”原理
②非长方体(非正方体)晶胞中粒子对晶胞的贡献视具体情况而定。如石墨晶胞每一层内碳原子排成六边形,其顶点(1个碳原子)对六边形的贡献为。在如图所示的正三棱柱形晶胞(注:6个正三棱柱拼合成六棱柱)中:
晶体结构分析及简单计算
(2)立方体晶胞中微粒间的距离关系
(3)晶胞中M、ρ之间的关系
(其中M是物质的摩尔质量;n是晶胞拥有的微粒数;V是晶胞体积)
(4)晶胞中原子空间利用率
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
谢谢观看
同课章节目录
