题型十一 化学反应原理综合——高考化学二轮复习题型归纳与解题技巧(共32张PPT)
文档属性
| 名称 | 题型十一 化学反应原理综合——高考化学二轮复习题型归纳与解题技巧(共32张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 739.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-24 19:52:12 | ||
图片预览











文档简介
(共32张PPT)
2025届高考化学二轮复习题型归纳与解题技巧
题型十一 化学反应原理综合
反应热的比较与计算
1.反应热的比较
(1)分清是ΔH还是热量的比较。热量无正负,只比较数值;ΔH有正负,比较大小注意带符号比较。
(2)直接比较法
①吸热反应的ΔH肯定比放热反应的大(前者大于0,后者小于0)。
②等量的可燃物完全燃烧所放出的热量比不完全燃烧所放出的热量多。
③产物相同时,同种气态物质燃烧放出的热量比等量的固态物质燃烧放出的热量多。
如:A(s)+B(g)===C(g) ΔH1,A(g)+B(g)===C(g)
ΔH2,则ΔH1>ΔH2。
反应物相同时,生成同种液态物质放出的热量比生成等量的气态物质放出的热量多。
如:A(g)+B(g)===C(g) ΔH1,A(g)+B(g)===C(l)
ΔH2,则ΔH1>ΔH2。
反应热的比较与计算
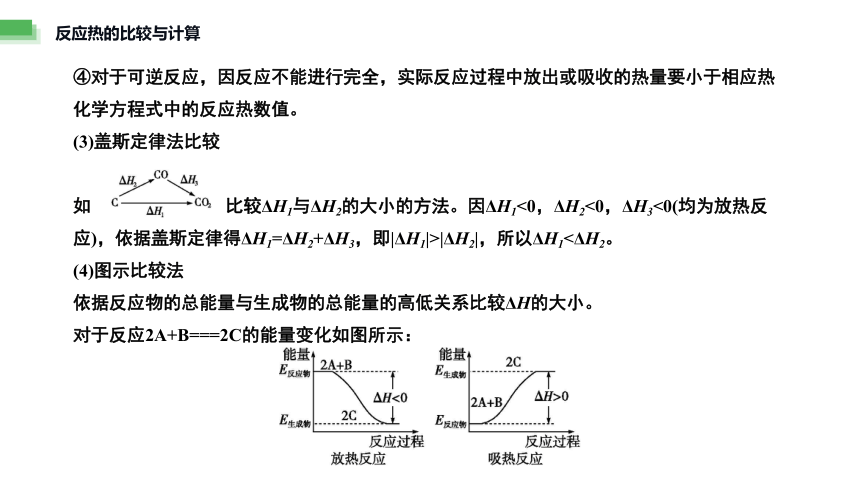
④对于可逆反应,因反应不能进行完全,实际反应过程中放出或吸收的热量要小于相应热化学方程式中的反应热数值。
(3)盖斯定律法比较
如 比较ΔH1与ΔH2的大小的方法。因ΔH1<0,ΔH2<0,ΔH3<0(均为放热反应),依据盖斯定律得ΔH1=ΔH2+ΔH3,即|ΔH1|>|ΔH2|,所以ΔH1<ΔH2。
(4)图示比较法
依据反应物的总能量与生成物的总能量的高低关系比较ΔH的大小。
对于反应2A+B===2C的能量变化如图所示:
反应热的比较与计算
2.反应热的三种计算方式
(1)利用键能计算:ΔH=∑E(反应物)-∑E(生成物),即ΔH等于反应物的键能总和与生成物的键能总和之差。
(2)由ΔH含义计算:ΔH=H(生成物)-H(反应物),这类计算通常会通过图像的方式给出计算所需的数据。
反应热的比较与计算
(3)盖斯定律的应用:
盖斯定律既可以计算出目标反应的ΔH,也可以得出目标反应的热化学方程式。
①调方向:
根据目标方程式反应物、生成物的位置,调整已知方程式的反应方向。满足目标方程式各物质的位置要求,注意方程式方向改变,ΔH符号随之改变,但数值不变。
②调化学计量数:
把目标方程式中不存在的物质的化学计量数调整为相等,ΔH随之进行调整,与化学计量数成比例。
③相加:
把调整好的方程式相加就得到目标方程式,必要时可约简化学计量数,同时也得到相应方程式的反应热ΔH。
化学平衡状态及移动方向的判断
1.化学平衡状态的判定
(1)直接判定:v正=v逆(实质)
①一定是用同一物质表达的正反应速率与逆反应速率相等(即该物质的生成速率与消耗速率相等)。
②对于用不同物质表达的速率,可通过化学方程式中的化学计量数转化为同一物质,但必须是不同方向的速率。
(2)间接判定
关键是看欲判定的条件因素是否与可逆化学反应具备相关性,也就是当化学反应向某一方向进行时,该因素是否随之发生变化:
①若条件随反应进行发生变化,说明两者具备相关性,当该条件不变时,建立平衡。
②若条件不随反应进行发生变化,说明两者不具备相关性,条件不变时,不一定建立平衡。
2.化学平衡移动的判断
(1)判断转化率的变化时,不要把平衡正向移动与反应物转化率提高等同起来,要视具体情况而定。
(2)压强影响的实质是浓度的影响,所以只有当这些“改变”造成浓度改变时,平衡才有可能移动。
(3)化学平衡移动的目的是“减弱”外界条件的改变,而不是“抵消”外界条件的改变。也就是说,新平衡建立后该物理量介于改变前后的值之间。
①反应物A的浓度由1 mol·L-1增大为2 mol·L-1,平衡右移,平衡后A的浓度:1 mol·L-1②将体系温度从50 ℃升高到80 ℃,则化学平衡向吸热反应方向移动,达到新平衡状态时,体系温度:50 ℃③对反应N2(g)+3H2(g) 2NH3(g)加压(压缩容器体积),从30 MPa加压到60 MPa,化学平衡向气体分子数减小的方向移动,达到新平衡时,体系压强:30 MPa化学平衡状态及移动方向的判断
(4)在分析化学平衡移动前后,体系颜色、压强、浓度等的变化时,我们可以把整个过程分为两个阶段:
第一阶段只考虑物理过程(如减小容器体积),然后确定颜色、压强、浓度等的变化;
第二阶段再考虑平衡的移动,在上面判断的基础上考虑相关因素的变化。结合上面(3)的结论确定相关条件的变化。
(5)虚拟过程法判断平衡移动:在判断平衡移动时,如果不好直接得出结论,可用构造虚拟过程的方法,比如在一定温度下,2 mol SO2和1 mol O2在容器甲中建立的平衡体系中,再加入2 mol SO2和1 mol O2的混合气体,可假定在另一个相同体积的容器乙中先建立平衡,此时这两个平衡体系完全一致,然后把乙中气体压入容器甲,甲中各物质的量增倍,则平衡右移。
化学平衡状态及移动方向的判断
3.等效平衡
(1)等效平衡的概念
在一定条件(恒温、恒容或恒温、恒压)下,同一可逆反应体系,不管是从正反应开始,还是从逆反应开始,在达到化学平衡状态时,任何相同组分的百分含量(体积分数、物质的量分数等)均相同,这样的化学平衡互称等效平衡。
①相同的外界条件:通常可以是恒温、恒容或恒温、恒压。
②平衡状态只与始态有关,而与途径无关(无论反应从正反应方向开始,还是从逆反应方向开始,或是从中间状态开始;不管投料是一次还是分成几次;反应容器经过扩大—缩小或缩小—扩大的过程),只要起始浓度相当,就达到相同的平衡状态。
化学平衡状态及移动方向的判断
(2)等效平衡的判定
①恒温、恒容条件
a.对于反应前后气体分子数改变的可逆反应,对于几种不同的起始状态,如果通过方程式的化学计量数转换为反应同一侧(“一边倒”换算),与原平衡完全相同,则两平衡等效。
b.对于反应前后气体分子数不变的可逆反应,通过方程式的化学计量数转换为反应同一侧,只要各物质的物质的量之比与原平衡相同,则两平衡等效。
②恒温、恒压条件
不管反应前后气体分子数是否改变,只要通过方程式的化学计量数转换为反应同一侧的状态,各物质的物质的量之比与原平衡相同,则达平衡后与原平衡等效。
化学平衡状态及移动方向的判断
1.化学反应速率的计算与比较
对于化学反应mA(g)+nB(g)===cC(g)+dD(g)
(1)速率计算公式: 。
(2)同一反应用不同的物质表示反应速率时,数值可能不同,但意义相同。不同物质表示的反应速率,存在如下关系:v(A)∶v(B)∶v(C)∶v(D)=m∶n∶c∶d。
(3)化学反应速率的大小比较(注意把速率的单位换算成相同单位)。
①通过反应条件比较大小,高温、高压、增大浓度、使用催化剂时化学反应速率都要加快。
②用不同物质表达的反应速率要通过方程式转化为同一物质再作比较。
③对于有催化剂存在的多步反应,活化能小的反应的反应速率快于活化能大的反应的反应速率。
速率、转化率及平衡常数的计算
2.转化率、平衡常数的计算
(1)转化率 。
(2)化学平衡常数:对于反应mA(g)+nB(g) pC(g)+qD(g),
①固体或纯液体的浓度是常数,平衡常数表达式中不能出现固体或纯液体。
②化学平衡常数只与温度有关,与反应物或生成物的浓度无关。
③平衡常数表达式与方程式的书写形式有关。对于同一个反应,当方程式的化学计量数不同时,对应有不同的平衡常数(数值、单位均不同);当方程式逆写时,平衡常数与原平衡常数互为倒数。
速率、转化率及平衡常数的计算
(3)压强平衡常数Kp
①Kp仅适用于气相发生的反应。
②在气相的化学平衡体系中,用各气体物质的分压替代浓度计算得到的平衡常数就是压强平衡常数。
③对于可逆反应:mA(g)+nB(g) pC(g)+qD(g), 。
④各组分分压=总压×各组分物质的量分数。
3.基元反应与化学反应速率常数
(1)基元反应
①基元反应是指在反应中,反应物微粒(分子、离子、自由基等)一步直接转化为产物的反应。
②绝大多数的反应不是基元反应,需要经历若干个基元反应才能完成。
速率、转化率及平衡常数的计算
(2)化学反应速率常数
①含义:对于基元反应,其化学反应速率与反应物浓度的数值的化学计量数次方的乘积成正比。
例如:对于基元反应mA(g)+nB(g) pC(g)+qD(g),
正反应速率为v正=k正×cm(A)×cn(B),逆反应速率为v逆=k逆×cp(C)×cq(D),其中k正、k逆分别为正、逆反应的速率常数。
②化学反应速率常数在数值上等于各反应物浓度为1 mol·L-1时的反应速率数值。
(3)速率平衡常数k正、k逆与化学平衡常数K的关系
对于前面的基元反应mA(g)+nB(g) pC(g)+qD(g),当反应建立平衡后,有v正=v逆,
即k正×cm(A)×cn(B)=k逆×cp(C)×cq(D) ,也就是说,对于基元
反应而言,存在 。
速率、转化率及平衡常数的计算
4.熟练运用“三段式”法进行平衡的相关计算
对于反应mA(g)+nB(g) pC(g)+qD(g),若A、B起始物质的量浓度分别为a mol·L-1、b mol·L-1,达到平衡后消耗A的物质的量浓度为mx mol·L-1。
速率、转化率及平衡常数的计算
5.化学平衡常数的应用
(1)判断反应进行的方向
通过与浓度商的大小比较,判断反应进行的方向。对于可逆反应
mA(g)+nB(g) pC(g)+qD(g),在一定温度下的任意时刻,浓度商(Qc)的表达式为
若Qcv(逆),反应向正反应方向进行。
若Qc=K,v(正)=v(逆),反应处于平衡状态。
若Qc>K,v(正)(2)判断反应的热效应
升高温度,K增大,则正反应为吸热反应;K减小,则正反应为放热反应。
速率、转化率及平衡常数的计算
6.催化剂的催化原理与活化能
(1)催化剂的催化原理主要是改变反应的路径,生成多种中间产物,催化反应往往由多步基元反应组成,其中活化能最大的基元反应,反应速率最慢,决定整个反应的反应速率。
(2)催化剂的主要作用是提供一个活性位点,与反应物分子结合生成中间吸附产物。
整个催化历程总体上可分为吸附—反应—脱附三个阶段,每个阶段可能包含多步反应。
首先,反应物分子被吸附在催化剂表面,催化剂与反应物分子反应生成中间产物,然后,这些中间产物继续反应或脱离催化剂表面生成最终产物。
(3)反应物分子在催化剂表面的吸附—反应—脱附过程的反应活化能远小于反应物分子直接反应的活化能,使得反应更容易进行,反应速率大大加快。
(4)由于在整个化学反应中催化剂经历了反应又生成的变化,所以催化剂在整个反应前后化学组成没有发生变化,但是催化剂的物理状态会发生变化(块状、颗粒变为粉末)。
速率、转化率及平衡常数的计算
1.化学速率、平衡图像的解答方法
(1)图像信息的获取
速率、平衡图像题的综合分析
①看轴:弄清纵、横坐标的物理含义。
②看面:分析多条曲线的差异(不同温度、不同压强)与相互关系。
③看线:弄清线的走向、变化趋势及线的陡与平所代表的化学意义;把线的变化趋势解读为可逆化学反应的特点(ΔH、反应前后气体的变化)。
④看点:弄清曲线上点的含义,特别是一些特殊点,如与坐标轴的交点、曲线的交点、折点、最高点与最低点等;尤其这些特殊点的数值是相关计算的依据。
(2)图像信息的应用
①在准确解读图像信息的基础上,对试题信息进行加工处理
速率、平衡图像题的综合分析
②找准切入口,用好图像信息
a.从曲线的变化趋势着手
通过温度、压强对可逆反应平衡的影响特点,确定化学反应的ΔH以及反应前后分子数的变化。
b.从点入手
尤其是给出坐标数值的点(包括坐标轴上的起点),这些都是进行平衡相关计算(转化率、平衡常数、反应速率等)的数据信息来源。
c.分清直线(水平段居多)、曲线变化(上升、下降、平缓、转折等)代表的化学含义,同时对走势有转折变化的曲线,要分段分析,找出各段曲线的变化趋势及其含义,每一段可能发生了不同的反应。
速率、平衡图像题的综合分析
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
谢谢观看
2025届高考化学二轮复习题型归纳与解题技巧
题型十一 化学反应原理综合
反应热的比较与计算
1.反应热的比较
(1)分清是ΔH还是热量的比较。热量无正负,只比较数值;ΔH有正负,比较大小注意带符号比较。
(2)直接比较法
①吸热反应的ΔH肯定比放热反应的大(前者大于0,后者小于0)。
②等量的可燃物完全燃烧所放出的热量比不完全燃烧所放出的热量多。
③产物相同时,同种气态物质燃烧放出的热量比等量的固态物质燃烧放出的热量多。
如:A(s)+B(g)===C(g) ΔH1,A(g)+B(g)===C(g)
ΔH2,则ΔH1>ΔH2。
反应物相同时,生成同种液态物质放出的热量比生成等量的气态物质放出的热量多。
如:A(g)+B(g)===C(g) ΔH1,A(g)+B(g)===C(l)
ΔH2,则ΔH1>ΔH2。
反应热的比较与计算
④对于可逆反应,因反应不能进行完全,实际反应过程中放出或吸收的热量要小于相应热化学方程式中的反应热数值。
(3)盖斯定律法比较
如 比较ΔH1与ΔH2的大小的方法。因ΔH1<0,ΔH2<0,ΔH3<0(均为放热反应),依据盖斯定律得ΔH1=ΔH2+ΔH3,即|ΔH1|>|ΔH2|,所以ΔH1<ΔH2。
(4)图示比较法
依据反应物的总能量与生成物的总能量的高低关系比较ΔH的大小。
对于反应2A+B===2C的能量变化如图所示:
反应热的比较与计算
2.反应热的三种计算方式
(1)利用键能计算:ΔH=∑E(反应物)-∑E(生成物),即ΔH等于反应物的键能总和与生成物的键能总和之差。
(2)由ΔH含义计算:ΔH=H(生成物)-H(反应物),这类计算通常会通过图像的方式给出计算所需的数据。
反应热的比较与计算
(3)盖斯定律的应用:
盖斯定律既可以计算出目标反应的ΔH,也可以得出目标反应的热化学方程式。
①调方向:
根据目标方程式反应物、生成物的位置,调整已知方程式的反应方向。满足目标方程式各物质的位置要求,注意方程式方向改变,ΔH符号随之改变,但数值不变。
②调化学计量数:
把目标方程式中不存在的物质的化学计量数调整为相等,ΔH随之进行调整,与化学计量数成比例。
③相加:
把调整好的方程式相加就得到目标方程式,必要时可约简化学计量数,同时也得到相应方程式的反应热ΔH。
化学平衡状态及移动方向的判断
1.化学平衡状态的判定
(1)直接判定:v正=v逆(实质)
①一定是用同一物质表达的正反应速率与逆反应速率相等(即该物质的生成速率与消耗速率相等)。
②对于用不同物质表达的速率,可通过化学方程式中的化学计量数转化为同一物质,但必须是不同方向的速率。
(2)间接判定
关键是看欲判定的条件因素是否与可逆化学反应具备相关性,也就是当化学反应向某一方向进行时,该因素是否随之发生变化:
①若条件随反应进行发生变化,说明两者具备相关性,当该条件不变时,建立平衡。
②若条件不随反应进行发生变化,说明两者不具备相关性,条件不变时,不一定建立平衡。
2.化学平衡移动的判断
(1)判断转化率的变化时,不要把平衡正向移动与反应物转化率提高等同起来,要视具体情况而定。
(2)压强影响的实质是浓度的影响,所以只有当这些“改变”造成浓度改变时,平衡才有可能移动。
(3)化学平衡移动的目的是“减弱”外界条件的改变,而不是“抵消”外界条件的改变。也就是说,新平衡建立后该物理量介于改变前后的值之间。
①反应物A的浓度由1 mol·L-1增大为2 mol·L-1,平衡右移,平衡后A的浓度:1 mol·L-1
(4)在分析化学平衡移动前后,体系颜色、压强、浓度等的变化时,我们可以把整个过程分为两个阶段:
第一阶段只考虑物理过程(如减小容器体积),然后确定颜色、压强、浓度等的变化;
第二阶段再考虑平衡的移动,在上面判断的基础上考虑相关因素的变化。结合上面(3)的结论确定相关条件的变化。
(5)虚拟过程法判断平衡移动:在判断平衡移动时,如果不好直接得出结论,可用构造虚拟过程的方法,比如在一定温度下,2 mol SO2和1 mol O2在容器甲中建立的平衡体系中,再加入2 mol SO2和1 mol O2的混合气体,可假定在另一个相同体积的容器乙中先建立平衡,此时这两个平衡体系完全一致,然后把乙中气体压入容器甲,甲中各物质的量增倍,则平衡右移。
化学平衡状态及移动方向的判断
3.等效平衡
(1)等效平衡的概念
在一定条件(恒温、恒容或恒温、恒压)下,同一可逆反应体系,不管是从正反应开始,还是从逆反应开始,在达到化学平衡状态时,任何相同组分的百分含量(体积分数、物质的量分数等)均相同,这样的化学平衡互称等效平衡。
①相同的外界条件:通常可以是恒温、恒容或恒温、恒压。
②平衡状态只与始态有关,而与途径无关(无论反应从正反应方向开始,还是从逆反应方向开始,或是从中间状态开始;不管投料是一次还是分成几次;反应容器经过扩大—缩小或缩小—扩大的过程),只要起始浓度相当,就达到相同的平衡状态。
化学平衡状态及移动方向的判断
(2)等效平衡的判定
①恒温、恒容条件
a.对于反应前后气体分子数改变的可逆反应,对于几种不同的起始状态,如果通过方程式的化学计量数转换为反应同一侧(“一边倒”换算),与原平衡完全相同,则两平衡等效。
b.对于反应前后气体分子数不变的可逆反应,通过方程式的化学计量数转换为反应同一侧,只要各物质的物质的量之比与原平衡相同,则两平衡等效。
②恒温、恒压条件
不管反应前后气体分子数是否改变,只要通过方程式的化学计量数转换为反应同一侧的状态,各物质的物质的量之比与原平衡相同,则达平衡后与原平衡等效。
化学平衡状态及移动方向的判断
1.化学反应速率的计算与比较
对于化学反应mA(g)+nB(g)===cC(g)+dD(g)
(1)速率计算公式: 。
(2)同一反应用不同的物质表示反应速率时,数值可能不同,但意义相同。不同物质表示的反应速率,存在如下关系:v(A)∶v(B)∶v(C)∶v(D)=m∶n∶c∶d。
(3)化学反应速率的大小比较(注意把速率的单位换算成相同单位)。
①通过反应条件比较大小,高温、高压、增大浓度、使用催化剂时化学反应速率都要加快。
②用不同物质表达的反应速率要通过方程式转化为同一物质再作比较。
③对于有催化剂存在的多步反应,活化能小的反应的反应速率快于活化能大的反应的反应速率。
速率、转化率及平衡常数的计算
2.转化率、平衡常数的计算
(1)转化率 。
(2)化学平衡常数:对于反应mA(g)+nB(g) pC(g)+qD(g),
①固体或纯液体的浓度是常数,平衡常数表达式中不能出现固体或纯液体。
②化学平衡常数只与温度有关,与反应物或生成物的浓度无关。
③平衡常数表达式与方程式的书写形式有关。对于同一个反应,当方程式的化学计量数不同时,对应有不同的平衡常数(数值、单位均不同);当方程式逆写时,平衡常数与原平衡常数互为倒数。
速率、转化率及平衡常数的计算
(3)压强平衡常数Kp
①Kp仅适用于气相发生的反应。
②在气相的化学平衡体系中,用各气体物质的分压替代浓度计算得到的平衡常数就是压强平衡常数。
③对于可逆反应:mA(g)+nB(g) pC(g)+qD(g), 。
④各组分分压=总压×各组分物质的量分数。
3.基元反应与化学反应速率常数
(1)基元反应
①基元反应是指在反应中,反应物微粒(分子、离子、自由基等)一步直接转化为产物的反应。
②绝大多数的反应不是基元反应,需要经历若干个基元反应才能完成。
速率、转化率及平衡常数的计算
(2)化学反应速率常数
①含义:对于基元反应,其化学反应速率与反应物浓度的数值的化学计量数次方的乘积成正比。
例如:对于基元反应mA(g)+nB(g) pC(g)+qD(g),
正反应速率为v正=k正×cm(A)×cn(B),逆反应速率为v逆=k逆×cp(C)×cq(D),其中k正、k逆分别为正、逆反应的速率常数。
②化学反应速率常数在数值上等于各反应物浓度为1 mol·L-1时的反应速率数值。
(3)速率平衡常数k正、k逆与化学平衡常数K的关系
对于前面的基元反应mA(g)+nB(g) pC(g)+qD(g),当反应建立平衡后,有v正=v逆,
即k正×cm(A)×cn(B)=k逆×cp(C)×cq(D) ,也就是说,对于基元
反应而言,存在 。
速率、转化率及平衡常数的计算
4.熟练运用“三段式”法进行平衡的相关计算
对于反应mA(g)+nB(g) pC(g)+qD(g),若A、B起始物质的量浓度分别为a mol·L-1、b mol·L-1,达到平衡后消耗A的物质的量浓度为mx mol·L-1。
速率、转化率及平衡常数的计算
5.化学平衡常数的应用
(1)判断反应进行的方向
通过与浓度商的大小比较,判断反应进行的方向。对于可逆反应
mA(g)+nB(g) pC(g)+qD(g),在一定温度下的任意时刻,浓度商(Qc)的表达式为
若Qc
若Qc=K,v(正)=v(逆),反应处于平衡状态。
若Qc>K,v(正)
升高温度,K增大,则正反应为吸热反应;K减小,则正反应为放热反应。
速率、转化率及平衡常数的计算
6.催化剂的催化原理与活化能
(1)催化剂的催化原理主要是改变反应的路径,生成多种中间产物,催化反应往往由多步基元反应组成,其中活化能最大的基元反应,反应速率最慢,决定整个反应的反应速率。
(2)催化剂的主要作用是提供一个活性位点,与反应物分子结合生成中间吸附产物。
整个催化历程总体上可分为吸附—反应—脱附三个阶段,每个阶段可能包含多步反应。
首先,反应物分子被吸附在催化剂表面,催化剂与反应物分子反应生成中间产物,然后,这些中间产物继续反应或脱离催化剂表面生成最终产物。
(3)反应物分子在催化剂表面的吸附—反应—脱附过程的反应活化能远小于反应物分子直接反应的活化能,使得反应更容易进行,反应速率大大加快。
(4)由于在整个化学反应中催化剂经历了反应又生成的变化,所以催化剂在整个反应前后化学组成没有发生变化,但是催化剂的物理状态会发生变化(块状、颗粒变为粉末)。
速率、转化率及平衡常数的计算
1.化学速率、平衡图像的解答方法
(1)图像信息的获取
速率、平衡图像题的综合分析
①看轴:弄清纵、横坐标的物理含义。
②看面:分析多条曲线的差异(不同温度、不同压强)与相互关系。
③看线:弄清线的走向、变化趋势及线的陡与平所代表的化学意义;把线的变化趋势解读为可逆化学反应的特点(ΔH、反应前后气体的变化)。
④看点:弄清曲线上点的含义,特别是一些特殊点,如与坐标轴的交点、曲线的交点、折点、最高点与最低点等;尤其这些特殊点的数值是相关计算的依据。
(2)图像信息的应用
①在准确解读图像信息的基础上,对试题信息进行加工处理
速率、平衡图像题的综合分析
②找准切入口,用好图像信息
a.从曲线的变化趋势着手
通过温度、压强对可逆反应平衡的影响特点,确定化学反应的ΔH以及反应前后分子数的变化。
b.从点入手
尤其是给出坐标数值的点(包括坐标轴上的起点),这些都是进行平衡相关计算(转化率、平衡常数、反应速率等)的数据信息来源。
c.分清直线(水平段居多)、曲线变化(上升、下降、平缓、转折等)代表的化学含义,同时对走势有转折变化的曲线,要分段分析,找出各段曲线的变化趋势及其含义,每一段可能发生了不同的反应。
速率、平衡图像题的综合分析
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
谢谢观看
同课章节目录
