题型九 化学实验综合——高考化学二轮复习题型归纳与解题技巧(共42张PPT)
文档属性
| 名称 | 题型九 化学实验综合——高考化学二轮复习题型归纳与解题技巧(共42张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-24 19:59:14 | ||
图片预览



文档简介
(共42张PPT)
2025届高考化学二轮复习题型归纳与解题技巧
题型九 化学实验综合
仪器名称、选择、连接及操作顺序问题
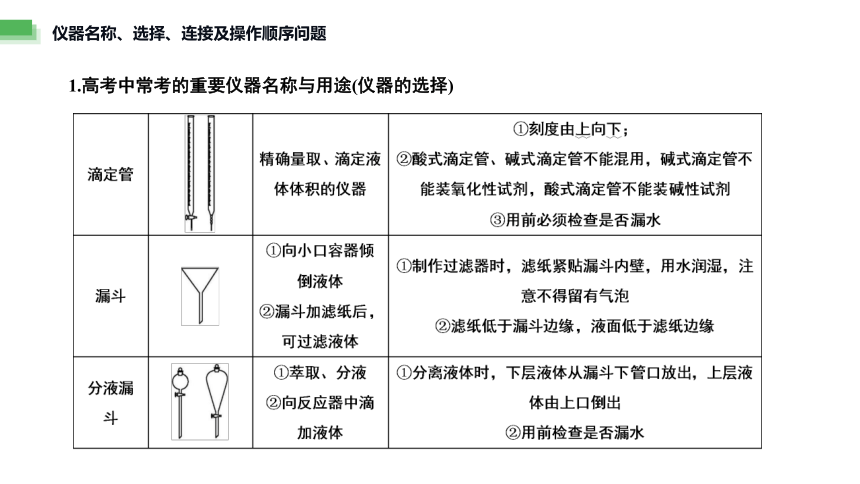
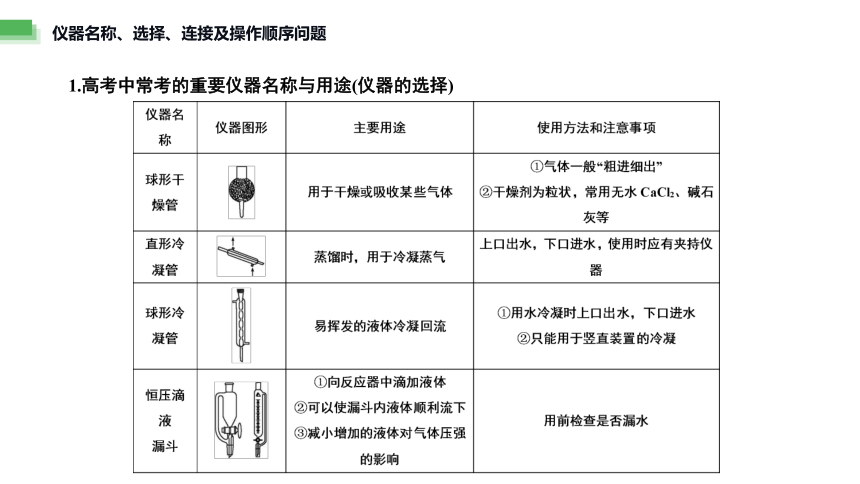
1.高考中常考的重要仪器名称与用途(仪器的选择)
仪器名称、选择、连接及操作顺序问题
1.高考中常考的重要仪器名称与用途(仪器的选择)
仪器名称、选择、连接及操作顺序问题
1.高考中常考的重要仪器名称与用途(仪器的选择)
仪器名称、选择、连接及操作顺序问题
1.高考中常考的重要仪器名称与用途(仪器的选择)
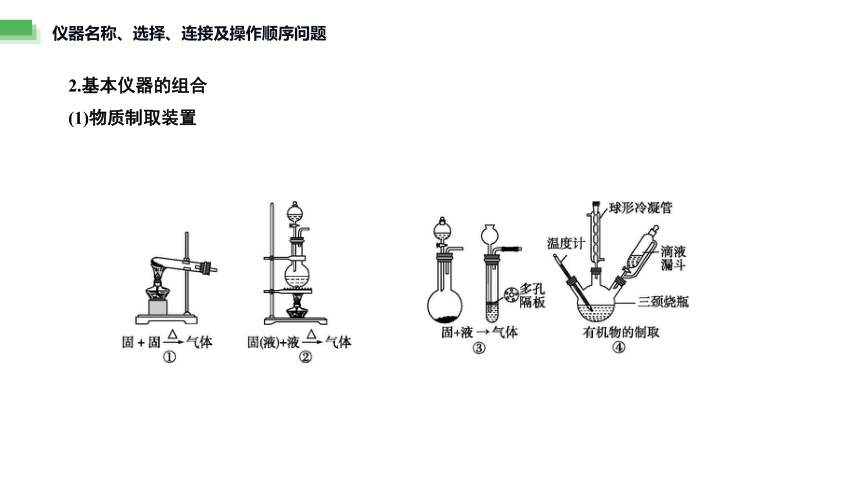
仪器名称、选择、连接及操作顺序问题
2.基本仪器的组合
(1)物质制取装置
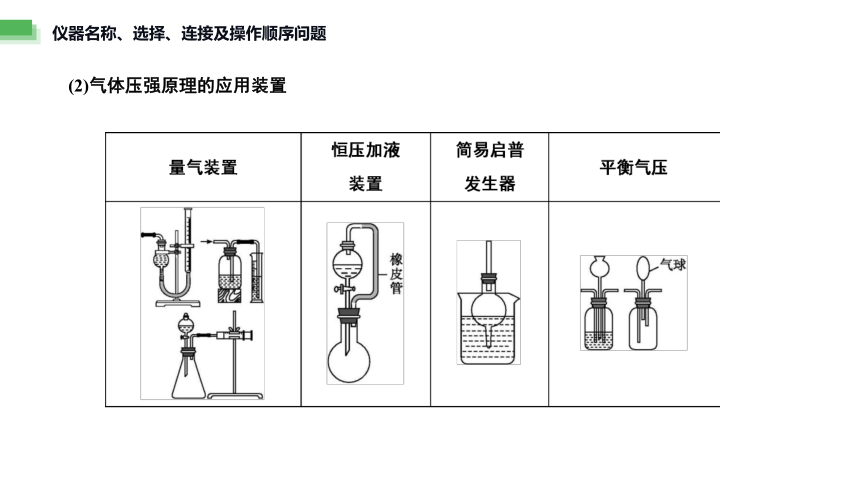
仪器名称、选择、连接及操作顺序问题
(2)气体压强原理的应用装置
仪器名称、选择、连接及操作顺序问题
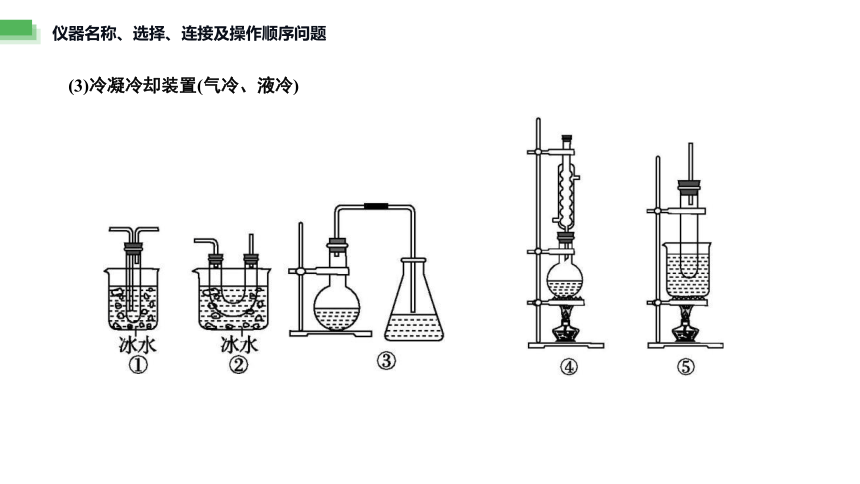
(3)冷凝冷却装置(气冷、液冷)
仪器名称、选择、连接及操作顺序问题
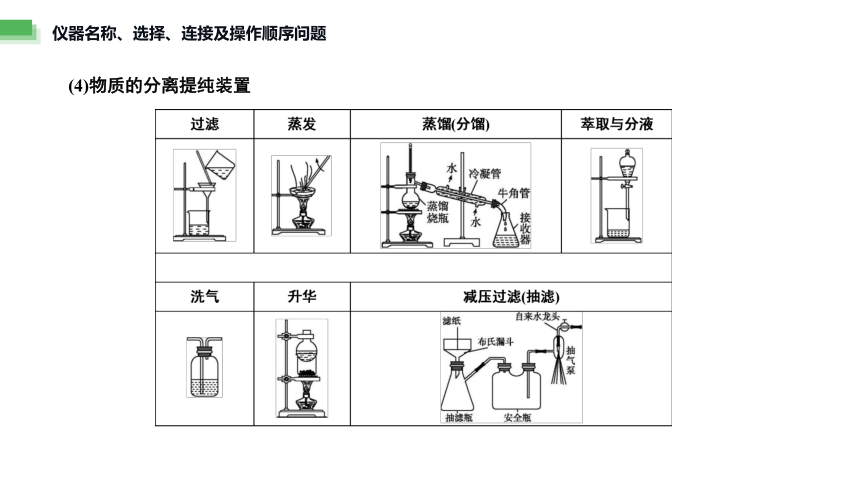
(4)物质的分离提纯装置
仪器名称、选择、连接及操作顺序问题
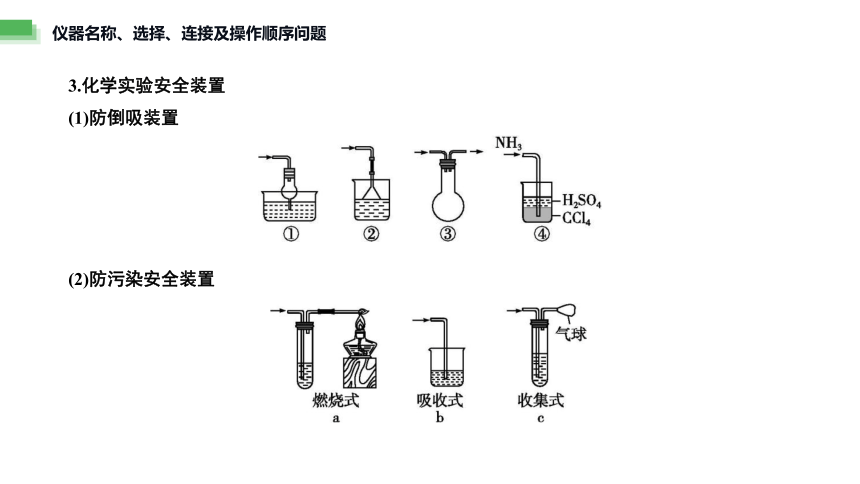
3.化学实验安全装置
(1)防倒吸装置
(2)防污染安全装置
仪器名称、选择、连接及操作顺序问题
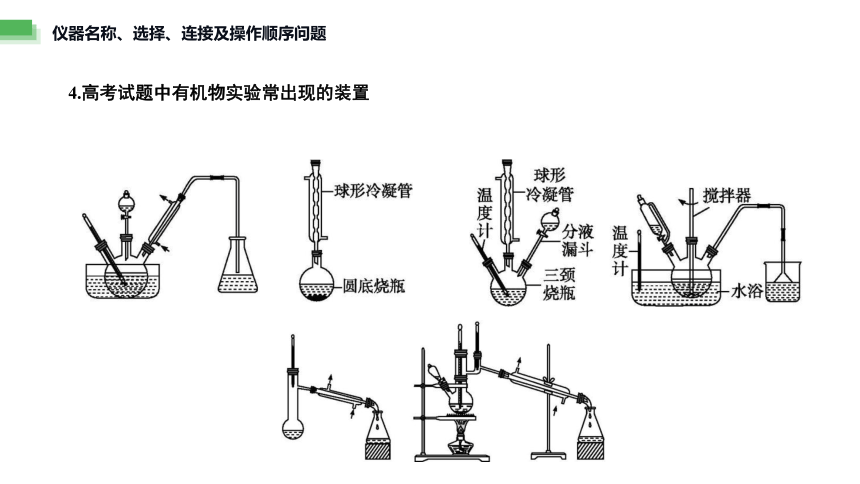
4.高考试题中有机物实验常出现的装置
仪器名称、选择、连接及操作顺序问题
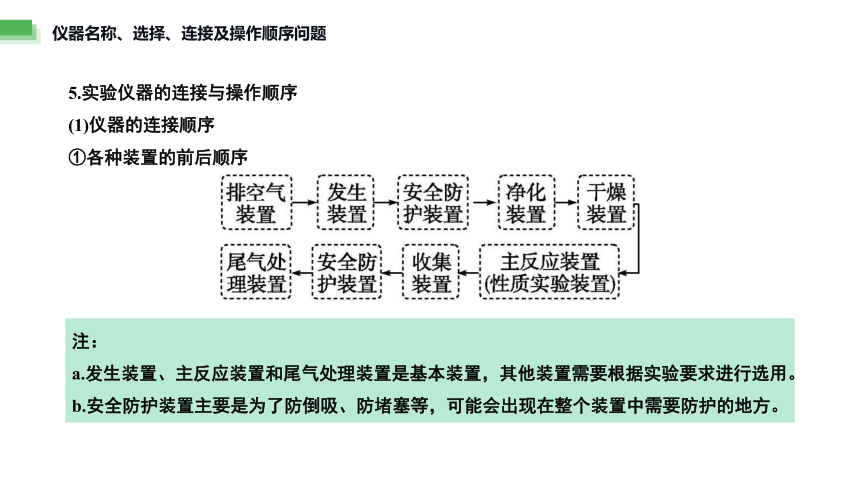
5.实验仪器的连接与操作顺序
(1)仪器的连接顺序
①各种装置的前后顺序
注:
a.发生装置、主反应装置和尾气处理装置是基本装置,其他装置需要根据实验要求进行选用。
b.安全防护装置主要是为了防倒吸、防堵塞等,可能会出现在整个装置中需要防护的地方。
仪器名称、选择、连接及操作顺序问题
②常见仪器的连接顺序
洗气瓶要长进短出;量气装置则要短进长出;干燥管要粗进细出;冷凝管要低进高出。
(2)实验操作顺序
①操作顺序
与气体有关的实验操作顺序:装置选择与连接→气密性检查→装入固体药品→加液体药品→按程序实验→拆卸仪器。
②加热操作的顺序
a.当空气成分(主要是O2)影响实验时,需要在实验开始前通入惰性气体驱除装置内的空气。
b.实验开始先点燃发生装置酒精灯,排净空气后再点燃反应装置酒精灯。
c.实验结束时,应先熄灭反应装置酒精灯,继续通原料气至试管冷却,再熄灭发生装置酒精灯。
实验现象、原因、目的以及实验评价的规范描述
1.实验简答题的特点
(1)类型:
实验现象的描述、出现问题的原因、仪器的作用、操作的目的以及实验的评价(优点、缺陷)等。
(2)答题常见问题:
回答原理错误、回答格式不合理、回答语言不规范、没能用化学语言来回答等。
2.实验现象的规范描述
(1)现象描述的原则:实验现象的描述要做到全面、准确,要从视觉、听觉、嗅觉、触觉多角度考虑。
①视觉:看到的(颜色变化、沉淀生成、气泡冒出、液面的变化、生成烟雾、发出某色光等);
②听觉:听到的(声音);
③嗅觉:闻到的(气体的气味);
④触觉:摸到的(温度变化等)。
实验现象、原因、目的以及实验评价的规范描述
(2)实验现象的描述模板
实验现象、原因、目的以及实验评价的规范描述
(3)滴定终点的判断
①有色→有色或有色→无色:
当滴入最后半滴……溶液,溶液由……色变成……色,且半分钟内不恢复……色。
②无色→有色:
当滴入最后半滴……溶液,溶液由无色变成……色,且半分钟内不褪色。
实验现象、原因、目的以及实验评价的规范描述
3.原因、目的等的规范描述
(1)分析考虑的角度
①明确实验的目的与原理,这样才能对出现的各种现象从化学反应原理角度给出解释。
②了解选择某种仪器或进行某种操作在整个实验中的作用,进而明确缺少该仪器或操作对实验的影响。
③在回答仪器或操作的作用、原因或目的时,需要从缺少仪器(操作)可能带来的后果入手分析。
(2)回答的文字模板
①正面描述:由于……,所以会出现……(现象);为了……而……
②说出后果:如果……就会……(出现的结果)。
实验现象、原因、目的以及实验评价的规范描述
4.实验评价的规范描述
(1)实验评价的角度
①从实验的可行性方面对实验方案做出评价:实验原理是否正确、可行;实验操作是否安全、合理;实验步骤是否简单、方便;实验效果是否明显等。
②从绿色化学视角对实验方案做出评价:反应原料是否易得、安全、无毒;原料利用率以及生成物质的产率是否较高;实验过程中是否造成环境污染。
③从实验安全性方面对实验方案做出评价:防倒吸;防爆炸;防氧化;防吸水(易水解的物质);防挥发(采用冷凝回流装置)。
④实验操作顺序、试剂加入顺序、实验方法使用顺序等。
(2)实验评价的规范
①从优点角度作答:采取……(操作或使用……装置),可以防止……(上述四个角度出现的问题)。
②从造成后果角度作答:如果不采取……(操作或使用……装置)会造成……(上述四个方面的后果)。
实验现象、原因、目的以及实验评价的规范描述
5.常见简答题的思考角度
(1)常见实验操作的描述
实验现象、原因、目的以及实验评价的规范描述
5.常见简答题的思考角度
(1)常见实验操作的描述
实验现象、原因、目的以及实验评价的规范描述
(2)装置或试剂作用
实验现象、原因、目的以及实验评价的规范描述
(3)操作或试剂的目的或原因
实验现象、原因、目的以及实验评价的规范描述
(3)操作或试剂的目的或原因
物质组成计算及含量的测定问题
1.定量实验数据的测定方法
(1)沉淀法:先将欲测定离子转化为沉淀,然后称量沉淀(经洗涤、干燥)的质量,再通过原子守恒计算。
(2)测定气体法
①测定气体的体积:把欲测定元素转化为气体,通过排液量气装置测定气体体积,转化为标准状况下体积并进行计算。
②测定气体的质量:利用气体的性质选择恰当的吸收剂,计算吸收剂吸收前后的质量差,即为气体质量。
(3)滴定法:通过酸碱中和滴定、沉淀滴定和氧化还原滴定等获得相应数据后再进行相关计算。
①连续滴定法:第一步滴定反应生成的产物继续参加第二步的滴定。根据第二步滴定的消耗量,可计算出第一步滴定的反应物的量,这一类常用关系式法得出各物质间的关系。
②返滴定法:第一步用过量的滴定剂,第二步再用另一物质返滴过量的物质。根据第一步加入的量减去第二步过量的量,得出第一步所求物质的物质的量。
物质组成计算及含量的测定问题
2.定量实验数据测定的注意点
欲测定元素要完全转化为沉淀或气体
①生成沉淀时,沉淀剂要过量,称量沉淀前要洗涤沉淀上附着的离子。
②由于气体体积受到温度、压强的影响,所以量气时应保持装置处于室温状态,读数时要注意消除“压强差”,保持液面相平,还要注意视线与液面最低处相平。
③测定气体质量时,最后需要通入惰性气体,把生成的气体全部驱入吸收剂以确保被完全吸收。
物质组成计算及含量的测定问题
物质组成计算及含量的测定问题
4.定量实验的计算方法
物质组成计算及含量的测定问题
5.滴定法的原理与类型
(1)滴定分析法的原理
①滴定分析是利用化学反应(中和反应、氧化还原反应、沉淀反应、配位反应)发生时,反应物都是按一定比例进行反应的。
②当我们已知一种反应物的物质的量后,可以利用其反应比例确定另一种反应物的物质的量。
③用已知准确浓度的试剂(称为标准溶液)滴加到一定体积的被测物质的溶液中,当化学反应恰好完全时为止,根据所用试剂的浓度和体积可以求得被测溶液的浓度。
④指示剂与滴定终点
指示剂:指示化学反应恰好完全时能改变溶液颜色的一种辅助试剂(有颜色的反应试剂也可以直接做指示剂)。
滴定终点:当两反应物恰好反应完全,没有任何外部特征时,此时需要借助于指示剂变色来确定停止滴定的点,即把这个指示剂变色点称为滴定终点。
物质组成计算及含量的测定问题
(2)滴定分析法的类型
中学学习过程中遇到最多的是酸碱中和滴定法和氧化还原滴定法,而沉淀滴定法、配位滴定法也会在高考试题中出现。
酸碱中和滴定法在一轮复习中已经重点学习过,这里着重介绍其他三种滴定方法。
①氧化还原滴定法
a.原理:以氧化剂或还原剂为滴定试剂,直接滴定一些具有还原性或氧化性的物质。
b.试剂:常见用于滴定的氧化剂有KMnO4、K2Cr2O7、I2等;常见用于滴定的还原剂有亚铁盐、草酸、Na2S2O3等。
c.指示剂:氧化还原滴定的指示剂有三类,氧化还原指示剂、专用指示剂(在碘量法滴定中,可溶性淀粉溶液遇碘变蓝)和自身指示剂(高锰酸钾标准溶液滴定草酸时,滴定终点为溶液由无色变为浅紫红色)。
物质组成计算及含量的测定问题
d.常见滴定反应:
(ⅰ)酸性KMnO4溶液滴定H2C2O4溶液:
原理:2MnO4-+6H++5H2C2O4====10CO2↑+2Mn2++8H2O。
指示剂:酸性KMnO4溶液本身呈紫色,不用另外选择指示剂,当滴入最后半滴酸性KMnO4溶液后,溶液由无色变为浅紫红色,且半分钟内不褪色,说明到达滴定终点。
(ⅱ)Na2S2O3溶液滴定碘液
原理:2Na2S2O3+I2====Na2S4O6+2NaI。
指示剂:用淀粉溶液作指示剂,当滴入最后半滴Na2S2O3溶液后,溶液的蓝色褪去,且半分钟内不恢复原色,说明到达滴定终点。
物质组成计算及含量的测定问题
②沉淀滴定法
a.概念:沉淀滴定是利用沉淀反应进行滴定。应用最多的是银量法,即利用Ag+与卤素离子的反应来测定Cl-、Br-、I-浓度。
b.原理:沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂与被滴定物反应的生成物的溶解度要比滴定剂与指示剂反应的生成物的溶解度小,否则不能用这种指示剂。如用AgNO3溶液测定溶液中Cl-的含量时,常以Cr为指示剂,这是因为AgCl比Ag2CrO4更难溶的缘故,首先生成AgCl白色沉淀,当Cl-基本沉淀完全
[c(Cl-)≤1.0×10-5 mol·L-1],生成砖红色的沉淀Ag2CrO4,此时标志到达滴定终点。[Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12]。
物质组成计算及含量的测定问题
③配位滴定法。
a.原理:
以配位反应(形成配合物)为反应原理的滴定分析方法,主要用于金属离子含量的测定。
b.配位剂:
应用最广泛的是乙二胺四乙酸(简称EDTA),一般情况下,EDTA与金属离子都能以1∶1形成配合物。
c.指示剂:
配位滴定有专用的配位滴定指示剂,其原理为该指示剂可与金属离子形成配合物而具有一定的颜色。滴定时,金属离子与滴定剂配位而置换出指示剂,发生特定的颜色变化来标志滴定终点。
如EDTA滴定Mg2+时,用铬黑T作指示剂,利用其在滴定终点时由蓝色变为红色来指示滴定终点。
物质组成计算及含量的测定问题
(3)滴定方法
①直接滴定:利用两种物质按比例直接反应,是最常用的滴定方法。
②间接滴定:当被测物质不能直接与标准液作用,却能和另一种可与标准液作用的物质反应时,可用间接滴定。
例如,Ca2+不能直接与高锰酸钾标准液作用,但可与C2O42-反应定量生成CaC2O4,此时可以加入定量且足够的C2O42-溶液,然后用高锰酸钾标准液滴定过量的C2O42-,从而间接测定Ca2+的含量。
③返滴定:加入一定量且过量的标准液与被测物反应,过量部分再用另一种标准液滴定。例如固体CaCO3的测定,可先加入一定量的过量盐酸标准液,加热试样完全溶解,冷却以后,再用氢氧化钠标准液返滴定剩余盐酸。
物质组成计算及含量的测定问题
6.热重分析
(1)原理:许多物质受热时会发生脱水、分解、氧化等变化而出现质量变化,据此而描绘出物质质量随温度变化的曲线——热重曲线。并进一步来研究物质的热变化过程。
(2)解题方法
①假设验证:根据物质的组成,预估物质在加热时可能发生的变化,然后利用其质量变化进行验证。
②原子守恒:金属元素不变,确定其他元素的质量,通过元素原子物质的量之比确定物质化学式。
(3)热重曲线的分析
①某温度下曲线的突变意味着该温度下发生了分解反应。
②开始阶段结晶水合物会逐步失去结晶水(根据质量变化确定),后续阶段根据化合物的稳定性确定发生的化学反应。
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
谢谢观看
2025届高考化学二轮复习题型归纳与解题技巧
题型九 化学实验综合
仪器名称、选择、连接及操作顺序问题
1.高考中常考的重要仪器名称与用途(仪器的选择)
仪器名称、选择、连接及操作顺序问题
1.高考中常考的重要仪器名称与用途(仪器的选择)
仪器名称、选择、连接及操作顺序问题
1.高考中常考的重要仪器名称与用途(仪器的选择)
仪器名称、选择、连接及操作顺序问题
1.高考中常考的重要仪器名称与用途(仪器的选择)
仪器名称、选择、连接及操作顺序问题
2.基本仪器的组合
(1)物质制取装置
仪器名称、选择、连接及操作顺序问题
(2)气体压强原理的应用装置
仪器名称、选择、连接及操作顺序问题
(3)冷凝冷却装置(气冷、液冷)
仪器名称、选择、连接及操作顺序问题
(4)物质的分离提纯装置
仪器名称、选择、连接及操作顺序问题
3.化学实验安全装置
(1)防倒吸装置
(2)防污染安全装置
仪器名称、选择、连接及操作顺序问题
4.高考试题中有机物实验常出现的装置
仪器名称、选择、连接及操作顺序问题
5.实验仪器的连接与操作顺序
(1)仪器的连接顺序
①各种装置的前后顺序
注:
a.发生装置、主反应装置和尾气处理装置是基本装置,其他装置需要根据实验要求进行选用。
b.安全防护装置主要是为了防倒吸、防堵塞等,可能会出现在整个装置中需要防护的地方。
仪器名称、选择、连接及操作顺序问题
②常见仪器的连接顺序
洗气瓶要长进短出;量气装置则要短进长出;干燥管要粗进细出;冷凝管要低进高出。
(2)实验操作顺序
①操作顺序
与气体有关的实验操作顺序:装置选择与连接→气密性检查→装入固体药品→加液体药品→按程序实验→拆卸仪器。
②加热操作的顺序
a.当空气成分(主要是O2)影响实验时,需要在实验开始前通入惰性气体驱除装置内的空气。
b.实验开始先点燃发生装置酒精灯,排净空气后再点燃反应装置酒精灯。
c.实验结束时,应先熄灭反应装置酒精灯,继续通原料气至试管冷却,再熄灭发生装置酒精灯。
实验现象、原因、目的以及实验评价的规范描述
1.实验简答题的特点
(1)类型:
实验现象的描述、出现问题的原因、仪器的作用、操作的目的以及实验的评价(优点、缺陷)等。
(2)答题常见问题:
回答原理错误、回答格式不合理、回答语言不规范、没能用化学语言来回答等。
2.实验现象的规范描述
(1)现象描述的原则:实验现象的描述要做到全面、准确,要从视觉、听觉、嗅觉、触觉多角度考虑。
①视觉:看到的(颜色变化、沉淀生成、气泡冒出、液面的变化、生成烟雾、发出某色光等);
②听觉:听到的(声音);
③嗅觉:闻到的(气体的气味);
④触觉:摸到的(温度变化等)。
实验现象、原因、目的以及实验评价的规范描述
(2)实验现象的描述模板
实验现象、原因、目的以及实验评价的规范描述
(3)滴定终点的判断
①有色→有色或有色→无色:
当滴入最后半滴……溶液,溶液由……色变成……色,且半分钟内不恢复……色。
②无色→有色:
当滴入最后半滴……溶液,溶液由无色变成……色,且半分钟内不褪色。
实验现象、原因、目的以及实验评价的规范描述
3.原因、目的等的规范描述
(1)分析考虑的角度
①明确实验的目的与原理,这样才能对出现的各种现象从化学反应原理角度给出解释。
②了解选择某种仪器或进行某种操作在整个实验中的作用,进而明确缺少该仪器或操作对实验的影响。
③在回答仪器或操作的作用、原因或目的时,需要从缺少仪器(操作)可能带来的后果入手分析。
(2)回答的文字模板
①正面描述:由于……,所以会出现……(现象);为了……而……
②说出后果:如果……就会……(出现的结果)。
实验现象、原因、目的以及实验评价的规范描述
4.实验评价的规范描述
(1)实验评价的角度
①从实验的可行性方面对实验方案做出评价:实验原理是否正确、可行;实验操作是否安全、合理;实验步骤是否简单、方便;实验效果是否明显等。
②从绿色化学视角对实验方案做出评价:反应原料是否易得、安全、无毒;原料利用率以及生成物质的产率是否较高;实验过程中是否造成环境污染。
③从实验安全性方面对实验方案做出评价:防倒吸;防爆炸;防氧化;防吸水(易水解的物质);防挥发(采用冷凝回流装置)。
④实验操作顺序、试剂加入顺序、实验方法使用顺序等。
(2)实验评价的规范
①从优点角度作答:采取……(操作或使用……装置),可以防止……(上述四个角度出现的问题)。
②从造成后果角度作答:如果不采取……(操作或使用……装置)会造成……(上述四个方面的后果)。
实验现象、原因、目的以及实验评价的规范描述
5.常见简答题的思考角度
(1)常见实验操作的描述
实验现象、原因、目的以及实验评价的规范描述
5.常见简答题的思考角度
(1)常见实验操作的描述
实验现象、原因、目的以及实验评价的规范描述
(2)装置或试剂作用
实验现象、原因、目的以及实验评价的规范描述
(3)操作或试剂的目的或原因
实验现象、原因、目的以及实验评价的规范描述
(3)操作或试剂的目的或原因
物质组成计算及含量的测定问题
1.定量实验数据的测定方法
(1)沉淀法:先将欲测定离子转化为沉淀,然后称量沉淀(经洗涤、干燥)的质量,再通过原子守恒计算。
(2)测定气体法
①测定气体的体积:把欲测定元素转化为气体,通过排液量气装置测定气体体积,转化为标准状况下体积并进行计算。
②测定气体的质量:利用气体的性质选择恰当的吸收剂,计算吸收剂吸收前后的质量差,即为气体质量。
(3)滴定法:通过酸碱中和滴定、沉淀滴定和氧化还原滴定等获得相应数据后再进行相关计算。
①连续滴定法:第一步滴定反应生成的产物继续参加第二步的滴定。根据第二步滴定的消耗量,可计算出第一步滴定的反应物的量,这一类常用关系式法得出各物质间的关系。
②返滴定法:第一步用过量的滴定剂,第二步再用另一物质返滴过量的物质。根据第一步加入的量减去第二步过量的量,得出第一步所求物质的物质的量。
物质组成计算及含量的测定问题
2.定量实验数据测定的注意点
欲测定元素要完全转化为沉淀或气体
①生成沉淀时,沉淀剂要过量,称量沉淀前要洗涤沉淀上附着的离子。
②由于气体体积受到温度、压强的影响,所以量气时应保持装置处于室温状态,读数时要注意消除“压强差”,保持液面相平,还要注意视线与液面最低处相平。
③测定气体质量时,最后需要通入惰性气体,把生成的气体全部驱入吸收剂以确保被完全吸收。
物质组成计算及含量的测定问题
物质组成计算及含量的测定问题
4.定量实验的计算方法
物质组成计算及含量的测定问题
5.滴定法的原理与类型
(1)滴定分析法的原理
①滴定分析是利用化学反应(中和反应、氧化还原反应、沉淀反应、配位反应)发生时,反应物都是按一定比例进行反应的。
②当我们已知一种反应物的物质的量后,可以利用其反应比例确定另一种反应物的物质的量。
③用已知准确浓度的试剂(称为标准溶液)滴加到一定体积的被测物质的溶液中,当化学反应恰好完全时为止,根据所用试剂的浓度和体积可以求得被测溶液的浓度。
④指示剂与滴定终点
指示剂:指示化学反应恰好完全时能改变溶液颜色的一种辅助试剂(有颜色的反应试剂也可以直接做指示剂)。
滴定终点:当两反应物恰好反应完全,没有任何外部特征时,此时需要借助于指示剂变色来确定停止滴定的点,即把这个指示剂变色点称为滴定终点。
物质组成计算及含量的测定问题
(2)滴定分析法的类型
中学学习过程中遇到最多的是酸碱中和滴定法和氧化还原滴定法,而沉淀滴定法、配位滴定法也会在高考试题中出现。
酸碱中和滴定法在一轮复习中已经重点学习过,这里着重介绍其他三种滴定方法。
①氧化还原滴定法
a.原理:以氧化剂或还原剂为滴定试剂,直接滴定一些具有还原性或氧化性的物质。
b.试剂:常见用于滴定的氧化剂有KMnO4、K2Cr2O7、I2等;常见用于滴定的还原剂有亚铁盐、草酸、Na2S2O3等。
c.指示剂:氧化还原滴定的指示剂有三类,氧化还原指示剂、专用指示剂(在碘量法滴定中,可溶性淀粉溶液遇碘变蓝)和自身指示剂(高锰酸钾标准溶液滴定草酸时,滴定终点为溶液由无色变为浅紫红色)。
物质组成计算及含量的测定问题
d.常见滴定反应:
(ⅰ)酸性KMnO4溶液滴定H2C2O4溶液:
原理:2MnO4-+6H++5H2C2O4====10CO2↑+2Mn2++8H2O。
指示剂:酸性KMnO4溶液本身呈紫色,不用另外选择指示剂,当滴入最后半滴酸性KMnO4溶液后,溶液由无色变为浅紫红色,且半分钟内不褪色,说明到达滴定终点。
(ⅱ)Na2S2O3溶液滴定碘液
原理:2Na2S2O3+I2====Na2S4O6+2NaI。
指示剂:用淀粉溶液作指示剂,当滴入最后半滴Na2S2O3溶液后,溶液的蓝色褪去,且半分钟内不恢复原色,说明到达滴定终点。
物质组成计算及含量的测定问题
②沉淀滴定法
a.概念:沉淀滴定是利用沉淀反应进行滴定。应用最多的是银量法,即利用Ag+与卤素离子的反应来测定Cl-、Br-、I-浓度。
b.原理:沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂与被滴定物反应的生成物的溶解度要比滴定剂与指示剂反应的生成物的溶解度小,否则不能用这种指示剂。如用AgNO3溶液测定溶液中Cl-的含量时,常以Cr为指示剂,这是因为AgCl比Ag2CrO4更难溶的缘故,首先生成AgCl白色沉淀,当Cl-基本沉淀完全
[c(Cl-)≤1.0×10-5 mol·L-1],生成砖红色的沉淀Ag2CrO4,此时标志到达滴定终点。[Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12]。
物质组成计算及含量的测定问题
③配位滴定法。
a.原理:
以配位反应(形成配合物)为反应原理的滴定分析方法,主要用于金属离子含量的测定。
b.配位剂:
应用最广泛的是乙二胺四乙酸(简称EDTA),一般情况下,EDTA与金属离子都能以1∶1形成配合物。
c.指示剂:
配位滴定有专用的配位滴定指示剂,其原理为该指示剂可与金属离子形成配合物而具有一定的颜色。滴定时,金属离子与滴定剂配位而置换出指示剂,发生特定的颜色变化来标志滴定终点。
如EDTA滴定Mg2+时,用铬黑T作指示剂,利用其在滴定终点时由蓝色变为红色来指示滴定终点。
物质组成计算及含量的测定问题
(3)滴定方法
①直接滴定:利用两种物质按比例直接反应,是最常用的滴定方法。
②间接滴定:当被测物质不能直接与标准液作用,却能和另一种可与标准液作用的物质反应时,可用间接滴定。
例如,Ca2+不能直接与高锰酸钾标准液作用,但可与C2O42-反应定量生成CaC2O4,此时可以加入定量且足够的C2O42-溶液,然后用高锰酸钾标准液滴定过量的C2O42-,从而间接测定Ca2+的含量。
③返滴定:加入一定量且过量的标准液与被测物反应,过量部分再用另一种标准液滴定。例如固体CaCO3的测定,可先加入一定量的过量盐酸标准液,加热试样完全溶解,冷却以后,再用氢氧化钠标准液返滴定剩余盐酸。
物质组成计算及含量的测定问题
6.热重分析
(1)原理:许多物质受热时会发生脱水、分解、氧化等变化而出现质量变化,据此而描绘出物质质量随温度变化的曲线——热重曲线。并进一步来研究物质的热变化过程。
(2)解题方法
①假设验证:根据物质的组成,预估物质在加热时可能发生的变化,然后利用其质量变化进行验证。
②原子守恒:金属元素不变,确定其他元素的质量,通过元素原子物质的量之比确定物质化学式。
(3)热重曲线的分析
①某温度下曲线的突变意味着该温度下发生了分解反应。
②开始阶段结晶水合物会逐步失去结晶水(根据质量变化确定),后续阶段根据化合物的稳定性确定发生的化学反应。
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
谢谢观看
同课章节目录
