浙江省温州十校联合体2024-2025学年第一学期期中联考高二年级化学学科试题(PDF版,含答案)
文档属性
| 名称 | 浙江省温州十校联合体2024-2025学年第一学期期中联考高二年级化学学科试题(PDF版,含答案) |  | |
| 格式 | |||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-24 22:38:23 | ||
图片预览



文档简介
2024学年第一学期温州十校联合体期中联考
高二年级化学学科试题
考生须知:
1.本卷共7 页满分100分,考试时间 90分钟。
2.答题前,在答题卷指定区域填写班级、姓名、考场号、座位号及准考证号并填涂相
应数字。
3.所有答案必须写在答题纸上,写在试卷上无效。
4.考试结束后,只需上交答题纸。
5.本卷可能需要的相对原子质量:H-1; C-12; 0-16; Na-23; S-32
选择题部分
一、选择题(本大题共16小题,每小题3分,共48分。每个小题列出的四个备选项
中只有一个是符合题目要求的,不选、多选、错选均不得分)
1.下列物质属于强电解质且溶于水后呈酸性的是
A.醋酸 B. SiO C. CH CO0Na D. KHSO
2.在水溶液中,下列电离方程式正确的是
A. CH COOH=CH CO -+H+ B. NH ·H O=—NH *+OH-
C. NaHCO =Na*+HCO D. H CO =2H++CO3
3.下列表示正确的是
A.绿矾的化学式为 Fe (SO );7H O B.CO 的电子式为: :c: :
C.CI的离子结构示意简图1728 8 D.甲烷的空间填充模型为
4.黑火药爆炸的反应方程式2KNO +3C+S=K S+N t+3CO t,则下列有关说法正确的是
A.该反应的还原剂是C和S B.若反应中转移了6mol电子,则生成气体89.6L
C.反应的氧化产物与还原产物物质的量比为3:2 D.该反应△S<0
5.25℃时,下列各组离子在指定溶液中能大量共存的是
A. 含较多Fe的溶液中:Na*、So -、HCO3
B. pH=12的溶液中:K、NO 、C10
C.含0.1mol/LAl°的溶液中:Na'、S2、C1
D. 由水电离出的c(H)=1×10-13mol/L的溶液中:K、NH 、HCO
6. 25℃时,下列不能说明HA是弱电解质的是
高二化学试卷第1页
A. 0.1mol/LH A溶液pH=3
B. 0.1mol/LNaHA 溶液pH=9
C.用H A溶液做导电试验,灯泡很暗
D. 等浓度的盐酸和 HA溶液与足量Zn粉反应产生H 的初始速率:盐酸>H A
7.下列离子方程式正确的是
A.用NaHCO 饱和溶液除去CO 中的HC1: CO 2-+H= HCO
B. H S气体通入硫酸铜溶液:H S +Cu2 =CuS1+2H
C. NaHCO溶液中通入少量Cl :2HCO +Cl =2CO +CI+CIO+H O
D.用FeCl 溶液刻蚀覆铜板制作印刷电路板:Fe +Cu = Fe2+ Cu
8.下列事实不能用勒夏特列原理解释的是
A.为了提高H 平衡转化率,合成氨采用高压、温度500℃
B. 实验室用排饱和食盐水的方法收集氯气
C.配制 FeCl 溶液时,将FeCl 固体溶解在稀盐酸中
D. 工业生产硫酸时,使用过量氧气来提高二氧化硫的转化率
9.下列有关说法正确的是
A. 聚合+tch-CHn的单体是CH CH CH
B.cH=C-CH 的官能团名称叫醛基
C.棉花、羊毛、天然橡胶、塑料等属于天然有机高分子材料
D. 植物油与氢气加成可以制造人造奶油
10. N为阿伏伽德罗常数的值,下列说法正确的是
A. 常温下,含0.01molFeCl 的浓溶液滴入足量沸水中形成的胶体 Fe(OH) 胶团粒子数为0.01N
B. pH=2的盐酸溶液中氢离子数目为0.01NA
C. 常温下,0.64g 二氧化硫通入足量水中,所得溶液中H SO 分子数为0.01NA
D. 0.01mol 熔融的NaHSO 中,阳离子数为0.01N
11.根据下图所示的过程中的能量变化情况,判断下列说法不正确的是
HH-键断裂
436kJ·mor' + +
能量 @@键断裂 @ @
243kJ·molr
能量 键形成 键形成
H@@431kJ.mor1
431kJ·moli1能量 能量
A. Cl (g)转化为氯原子是一个吸热过程
B. 1mol H (g)和1mol Cl (g)的总能量比2mol HC1(g)的总能量高
C. 1个HC1(g)分子中的化学键断裂时需要吸收431kJ能量
D. 1mol H (g)和1mol Cl (g)反应生成2mol HC1(g)的反应热△H=-183 kJ·mol1
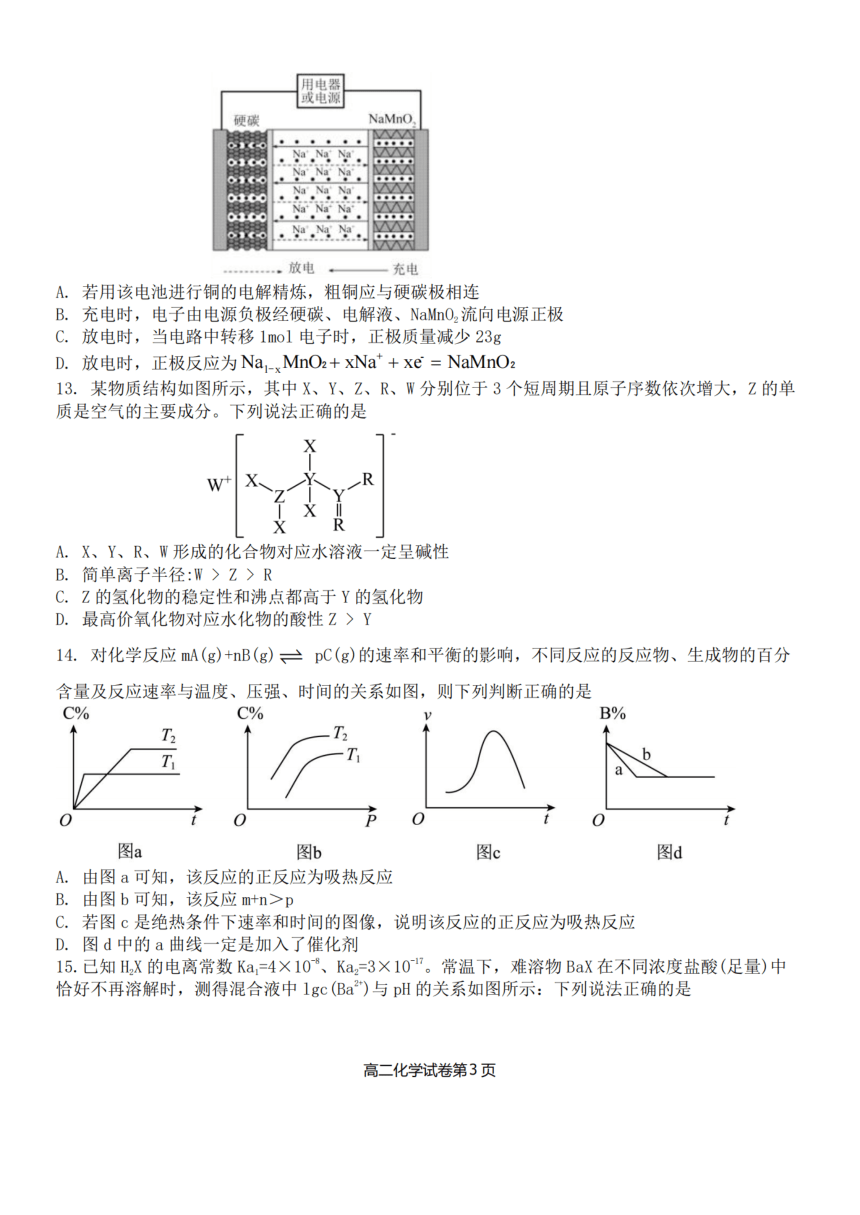
12.近年来钠离子电池备受关注。利用钠离子在电极间“脱嵌”实现充放电的原理如图所示,电池
工作时总反应为Na,C+Na _MnO C+NaMnO ,下列说法正确的是
高二化学试卷第2页
用电器
或电源
硬碳 NaMnO
出猛
.放电 充电
A.若用该电池进行铜的电解精炼,粗铜应与硬碳极相连
B.充电时,电子由电源负极经硬碳、电解液、NaMnO 流向电源正极
C. 放电时,当电路中转移1mol电子时,正极质量减少23g
D. 放电时,正极反应为Na_MnO +xNa++xe= NaMnO
13.某物质结构如图所示,其中X、Y、Z、R、W分别位于3个短周期且原子序数依次增大,Z的单
质是空气的主要成分。下列说法正确的是
A. X、Y、R、W形成的化合物对应水溶液一定呈碱性
B. 简单离子半径:W>Z>R
C. Z的氢化物的稳定性和沸点都高于Y的氢化物
D. 最高价氧化物对应水化物的酸性Z>Y
14. 对化学反应 mA(g)+nB(g)一 pC(g)的速率和平衡的影响,不同反应的反应物、生成物的百分
含量及反应速率与温度、压强、时间的关系如图,则下列判断正确的是
C% C% v
T T
T T a b
0 t 0 P 0 t 0 i
图a 图b 图c 图d
A. 由图a可知,该反应的正反应为吸热反应
B. 由图b可知,该反应 m+n>p
C.若图c是绝热条件下速率和时间的图像,说明该反应的正反应为吸热反应
D.图d中的 a曲线一定是加入了催化剂
15.已知H X的电离常数 Ka=4×10-、Ka =3×10-。常温下,难溶物 BaX在不同浓度盐酸(足量)中
恰好不再溶解时,测得混合液中1gc(Ba2)与pH的关系如图所示:下列说法正确的是
高二化学试卷第3页
A. 直线上任一点均满足: c(H) + 2c(Ba ) = c(OH)+c(CI-)+c (HX)+2c (X )
B. M点 : c(HX)>c(C1-)>c(H)
C. N点 : c(HX)约为 2×10°mol/L
D. Ksp(BaX)约为 1.2×10
16. 下列实验探究方案能达到探究目的的是
实验 实验探究方案 探究目的
向2mL5%H O 溶液中分别滴加5滴等浓度的FeCl 和 比较 KMnO,和FeCl,对 H.0 分解的
A
KMnO,溶液, 观察气体的生成速度 催化效果
在KSCN与 FeCl 的混合液中再加入 KC1固体, 观察到溶
B 增大生成物浓度,平衡逆向移动
液颜色变化
向滴有酚酞的NaCO,溶液中,加入少量BaCl 固体,观
c 验证 Na.CO,溶液中存在水解平衡
察溶液颜色变化
用pH试纸测量相同浓度NaC10溶液与CH.COONa的 pH,
D 比较次氯酸和醋酸酸性强弱
比较两溶液的pH大小
A. A B. B c. C D. D
非选择题部分
二、 非选择题(本题共5大题,共 52分)
17. (10分 ) 相比传统燃料电池,熔融盐 (碳酸钾) 甲烷燃料电池具有更高的能量转化效率,可
以将甲烷直接转化为电能,并输出纯净的CO 和水。 回答下列问题:
(1) K,CO 水溶液呈碱性的原因 (用离子方程式表示) o
(2) 1g甲烷常温下燃烧产生55.6KJ热量,写出甲烷与0 生成液态水的热化学方程式 。
(3) 以碳酸钾熔融盐为电解质,写出甲烷燃料电池负极反应方程式 。
(4) 甲烷与氯气在光照下能发生取代反应,写出一取代反应方程式 。
(5) 2C0 (g) = 2C(s)+0 (g)的△H>0,以反应自由能 △G分析反应不能进行的原因 。
18.(10分 ) 已知X是一种酸式盐,常用作化肥,其由如下转化,图中每一个方格表示有关的一
种反应物或者生成物,其中常温下A、 C是气体,回答下列问题:
高二化学试卷第4页
+木炭、加热
+HCI A +Na O ① D
加热 +BX B F G
+NaOH
C +D、催化剂加热 E +Cu②
(1)写出物质化学式:B_ ,G 。
(2)写出 C、D催化反应生成E的方程式 。
(3)写出实验室制取 A的离子反应方程式 。
(4)设计实验检验X中的阳离子(写出步骤、现象、结论) 。
19.(10分)室温下,H S水溶液中各含硫微粒物质的量分数δ随pH变化关系如下图[例如
8(S)-(s)+c(Hs)+-1.。已知:K,(FeS)=6.3×101 , K[Fe(OH) ]=4.9×101 。
1.0
0.5
7.0 13.0
0.0
4 6 8 10 12 14
pH
(1)在0.1mol·L1的Na S 溶液中,下列粒子浓度关系式正确的是_ _;
A.c(S2-)+c(HS”)+c(H S)=0.1mol·L1 B. c(Na')>c(S2-)>c(HS")>c(OH")>c(H)
C. c(Na)+c(H)=c(OH )+c(HS")+c(S2) D. c(Na)=2c(S2-)+2c(HS)
(2)溶解度比较:FeS Fe(OH)。(填“>”“=”“<”)。
(3)从图中数据计算 Ka (H S)=_ 。
(4)0.1mol/L的H S 溶液的 pH值约等于
(5)25℃时,将 a mol·L1的氨水与0.01 mol·L1的。盐酸等体积混合,若混合后溶液的 pH=7,用含的代数式表示 NH ·H 0的电离常数K=
20.(10分)为测定一碳酸钠样品的纯度,实验室准确称取一定量的Na CO 粉末1.060g,配制成
100mL 溶液,取25.00mL用0.20mol/L 盐酸标准溶液滴定,根据滴定结果计算碳酸钠的纯度。
(1)配制100mLNa CO 溶液,需要用到的玻璃仪器有烧杯、玻璃棒、滴管和
(2)有关滴定终点指示剂的 pH变色范围:酚酞8.2-10,石蕊5-8,甲基橙3.1-4.4;为提高滴
定的准确度,选择最适宜的指示剂是_ ,指示滴定终点的现象是____。
(3)滴定的可能存在的步骤如下,选取合适的操作步骤并顺序 →a→_ 。
a.用移液管取 25.00mL待测液加入锥形瓶中,滴入2-3滴指示剂
b.取碱式滴定管用蒸馏水清洗
c.用标准溶液润洗滴定管 2-3次
d.取酸式滴定管用蒸馏水清洗
e.注入标准液读数
高二化学试卷第5页
f.用待测液润洗锥形瓶
g.滴定至终点
h.重复2-3次
i.取下滴定管准确读数
(4)有关配制溶液与滴定测定结果的下列说法正确的是_
A.若在配制过程中仰视刻度定容,则导致碳酸钠纯度测定结果偏高。
B.若滴定管尖管部分滴定前存在气泡,滴定后消失,则滴定结果偏低。
C.注入标准液读数时,读数可以不是零刻度。
D.滴定前读数仰视,滴定后读数俯视,将导致滴定结果偏高。
(5)重复滴定三次的实验数据如下表所示。计算碳酸钠的纯度为 。
实验次数 HC1溶液的体积/mL 待测碳酸钠溶液的体积/mL
1 24.32 25.00
2 24.98 25.00
3 24.28 25.00
21.(12分)丙烯是重要的有机化工原料,丙烷制丙烯是化工研究的热点。由丙烷(C Hg)制丙烯
(C H )的两种方法如下:
反应I(直接脱氢):C H (g)—C H (g)+H (g) △H
反应Ⅱ(氧化脱氢):2C H (g)+ 0 (g)—2C H (g)+2H O(g) △H = -236kJ/mol
(1)已知:2H (g)+0 (g)= 2H O(g) △H=-484kJ/mol,则△H为_ kJ/mol。
(2)一定温度下,向恒容密闭容器中充入1molC Hg,开始压强为pkPa,仅发生反应I(直接脱氢)。
①下列情况能说明该反应达到平衡状态的是_ (填字母,下同)
A.容器内压强保持不变
B.气体密度保持不变
C.C H 与H 的物质的量之比保持不变
D.反应速率v正(C H)=v(C H )
②欲提高丙烯的平衡产率同时加快反应速率,应采取的措施是 。
A.减小压强 B.升高温度 C.及时分离出 H D.加催化剂
③反应过程中,C H 的气体体积分数与反应时间的关系如图1所示。此温度下该反应的平衡常数
Kp= kPa(用含p的代数式表示,Kp是用反应体系中气体物质的分压表示的平衡常数,平衡
分压=总压×体积分数)。
100
C H 体积分数/% 7550 m20 n
0 2 反应时间/min
图1
(3)①一定条件下,恒压密闭容器中仅发生反应Ⅱ(氧化脱氢)。C Hg与0 起始物质的量比分别为
1:1平衡时C Hg的体积分数随温度的变化关系如图2所示。在图中画出 n(O2)=1::2的曲线。
②相比反应I(直接脱氢),反应Ⅱ(氧化脱氢)的优点可能有 (任写一点)。
高二化学试卷第6页
5品
CsH.体积分数%2520151s0
oL
T/K
图2
(4)某工厂对尾气处理后的Na,SO 溶液进行电解,可循环再生 NaOH。,同时得到某种副产物,其原理如图所示。则b极的电极反应方程式为
A Na SO 溶液
a(O ▲ O)b
B Na C
稀NaOH溶液- SO 稀硫酸
阳离子交换膜 阴离子交换膜
高二化学试卷第7页
高二年级化学学科答案
一、选择题(本大题共16小题,每小题3分,共48分。每个小题列出的四个备选项中
只有一个是符合题目要求的,不选、多选、错选均不得分)
题号 1 2 3 4 5 6 7 8
答案 D B C C B C B A
题号 9 10 11 12 13 14 15 16
答案 D D C D D B A C
一、非选择题(本题共5大题,共52分)
17.(每空2分,共10分)
(1)CO22+ H O—HCO +0H
(2)CH (g)+20 (g)= CO (g)+2H O(1)△H=-889.6 KJ/mol
(3)CH + 4CO 2- 8e = 5CO +2H O
(4)CH + Cl 光照→CH Cl + HC1
(5)反应的△H>0,△S<0,故反应自由能△G>0,反应不能自发进行。
18.(每空2分,共10分)
(1)H O HNO
(2) 4NH +502化删4NO+6H O
(3)CaCO +2H+ = Ca2++ CO ↑+ H O
(4)取少量X于试管中,加入足量的浓 NaOH 溶液,加热,试管口置湿润的红色石蕊试纸,
试纸变蓝,则X中含 NH +。
高二化学试卷第1 页
19.(每空2分,共10分)
109
(1)A (2)<(3)10-13(4)4 (5)a-0.01
20.(除标出小分外,其余每空2分,共10分)
(1)100mL容量瓶(1分,没有规格不给分)
(2)甲基橙(1分) 当滴入最后半滴盐酸溶液,锥形瓶内溶液由黄色变橙色,且30
秒不变色
(3) d.c.e.(1分) g.i.h(1分)
(4) C
(5)97.2 0.972
21.(除标出小分外,其余每空2分,共12分)
(1)+124(1分)
(2)① AD ② B ③ 4p/3
1:2 1:1
(3)① CH.体积分数% 5三以2015 (送分)105
0
T/K
图2
②减少能耗(产物易于分离、催化剂表面不易积碳)(1分)
(4) H SO -2e~+H O=SO4-+4H+(若写 SO32-或者HSO3其他正确给1分)
高二化学试卷第 2 页
高二年级化学学科试题
考生须知:
1.本卷共7 页满分100分,考试时间 90分钟。
2.答题前,在答题卷指定区域填写班级、姓名、考场号、座位号及准考证号并填涂相
应数字。
3.所有答案必须写在答题纸上,写在试卷上无效。
4.考试结束后,只需上交答题纸。
5.本卷可能需要的相对原子质量:H-1; C-12; 0-16; Na-23; S-32
选择题部分
一、选择题(本大题共16小题,每小题3分,共48分。每个小题列出的四个备选项
中只有一个是符合题目要求的,不选、多选、错选均不得分)
1.下列物质属于强电解质且溶于水后呈酸性的是
A.醋酸 B. SiO C. CH CO0Na D. KHSO
2.在水溶液中,下列电离方程式正确的是
A. CH COOH=CH CO -+H+ B. NH ·H O=—NH *+OH-
C. NaHCO =Na*+HCO D. H CO =2H++CO3
3.下列表示正确的是
A.绿矾的化学式为 Fe (SO );7H O B.CO 的电子式为: :c: :
C.CI的离子结构示意简图1728 8 D.甲烷的空间填充模型为
4.黑火药爆炸的反应方程式2KNO +3C+S=K S+N t+3CO t,则下列有关说法正确的是
A.该反应的还原剂是C和S B.若反应中转移了6mol电子,则生成气体89.6L
C.反应的氧化产物与还原产物物质的量比为3:2 D.该反应△S<0
5.25℃时,下列各组离子在指定溶液中能大量共存的是
A. 含较多Fe的溶液中:Na*、So -、HCO3
B. pH=12的溶液中:K、NO 、C10
C.含0.1mol/LAl°的溶液中:Na'、S2、C1
D. 由水电离出的c(H)=1×10-13mol/L的溶液中:K、NH 、HCO
6. 25℃时,下列不能说明HA是弱电解质的是
高二化学试卷第1页
A. 0.1mol/LH A溶液pH=3
B. 0.1mol/LNaHA 溶液pH=9
C.用H A溶液做导电试验,灯泡很暗
D. 等浓度的盐酸和 HA溶液与足量Zn粉反应产生H 的初始速率:盐酸>H A
7.下列离子方程式正确的是
A.用NaHCO 饱和溶液除去CO 中的HC1: CO 2-+H= HCO
B. H S气体通入硫酸铜溶液:H S +Cu2 =CuS1+2H
C. NaHCO溶液中通入少量Cl :2HCO +Cl =2CO +CI+CIO+H O
D.用FeCl 溶液刻蚀覆铜板制作印刷电路板:Fe +Cu = Fe2+ Cu
8.下列事实不能用勒夏特列原理解释的是
A.为了提高H 平衡转化率,合成氨采用高压、温度500℃
B. 实验室用排饱和食盐水的方法收集氯气
C.配制 FeCl 溶液时,将FeCl 固体溶解在稀盐酸中
D. 工业生产硫酸时,使用过量氧气来提高二氧化硫的转化率
9.下列有关说法正确的是
A. 聚合+tch-CHn的单体是CH CH CH
B.cH=C-CH 的官能团名称叫醛基
C.棉花、羊毛、天然橡胶、塑料等属于天然有机高分子材料
D. 植物油与氢气加成可以制造人造奶油
10. N为阿伏伽德罗常数的值,下列说法正确的是
A. 常温下,含0.01molFeCl 的浓溶液滴入足量沸水中形成的胶体 Fe(OH) 胶团粒子数为0.01N
B. pH=2的盐酸溶液中氢离子数目为0.01NA
C. 常温下,0.64g 二氧化硫通入足量水中,所得溶液中H SO 分子数为0.01NA
D. 0.01mol 熔融的NaHSO 中,阳离子数为0.01N
11.根据下图所示的过程中的能量变化情况,判断下列说法不正确的是
HH-键断裂
436kJ·mor' + +
能量 @@键断裂 @ @
243kJ·molr
能量 键形成 键形成
H@@431kJ.mor1
431kJ·moli1能量 能量
A. Cl (g)转化为氯原子是一个吸热过程
B. 1mol H (g)和1mol Cl (g)的总能量比2mol HC1(g)的总能量高
C. 1个HC1(g)分子中的化学键断裂时需要吸收431kJ能量
D. 1mol H (g)和1mol Cl (g)反应生成2mol HC1(g)的反应热△H=-183 kJ·mol1
12.近年来钠离子电池备受关注。利用钠离子在电极间“脱嵌”实现充放电的原理如图所示,电池
工作时总反应为Na,C+Na _MnO C+NaMnO ,下列说法正确的是
高二化学试卷第2页
用电器
或电源
硬碳 NaMnO
出猛
.放电 充电
A.若用该电池进行铜的电解精炼,粗铜应与硬碳极相连
B.充电时,电子由电源负极经硬碳、电解液、NaMnO 流向电源正极
C. 放电时,当电路中转移1mol电子时,正极质量减少23g
D. 放电时,正极反应为Na_MnO +xNa++xe= NaMnO
13.某物质结构如图所示,其中X、Y、Z、R、W分别位于3个短周期且原子序数依次增大,Z的单
质是空气的主要成分。下列说法正确的是
A. X、Y、R、W形成的化合物对应水溶液一定呈碱性
B. 简单离子半径:W>Z>R
C. Z的氢化物的稳定性和沸点都高于Y的氢化物
D. 最高价氧化物对应水化物的酸性Z>Y
14. 对化学反应 mA(g)+nB(g)一 pC(g)的速率和平衡的影响,不同反应的反应物、生成物的百分
含量及反应速率与温度、压强、时间的关系如图,则下列判断正确的是
C% C% v
T T
T T a b
0 t 0 P 0 t 0 i
图a 图b 图c 图d
A. 由图a可知,该反应的正反应为吸热反应
B. 由图b可知,该反应 m+n>p
C.若图c是绝热条件下速率和时间的图像,说明该反应的正反应为吸热反应
D.图d中的 a曲线一定是加入了催化剂
15.已知H X的电离常数 Ka=4×10-、Ka =3×10-。常温下,难溶物 BaX在不同浓度盐酸(足量)中
恰好不再溶解时,测得混合液中1gc(Ba2)与pH的关系如图所示:下列说法正确的是
高二化学试卷第3页
A. 直线上任一点均满足: c(H) + 2c(Ba ) = c(OH)+c(CI-)+c (HX)+2c (X )
B. M点 : c(HX)>c(C1-)>c(H)
C. N点 : c(HX)约为 2×10°mol/L
D. Ksp(BaX)约为 1.2×10
16. 下列实验探究方案能达到探究目的的是
实验 实验探究方案 探究目的
向2mL5%H O 溶液中分别滴加5滴等浓度的FeCl 和 比较 KMnO,和FeCl,对 H.0 分解的
A
KMnO,溶液, 观察气体的生成速度 催化效果
在KSCN与 FeCl 的混合液中再加入 KC1固体, 观察到溶
B 增大生成物浓度,平衡逆向移动
液颜色变化
向滴有酚酞的NaCO,溶液中,加入少量BaCl 固体,观
c 验证 Na.CO,溶液中存在水解平衡
察溶液颜色变化
用pH试纸测量相同浓度NaC10溶液与CH.COONa的 pH,
D 比较次氯酸和醋酸酸性强弱
比较两溶液的pH大小
A. A B. B c. C D. D
非选择题部分
二、 非选择题(本题共5大题,共 52分)
17. (10分 ) 相比传统燃料电池,熔融盐 (碳酸钾) 甲烷燃料电池具有更高的能量转化效率,可
以将甲烷直接转化为电能,并输出纯净的CO 和水。 回答下列问题:
(1) K,CO 水溶液呈碱性的原因 (用离子方程式表示) o
(2) 1g甲烷常温下燃烧产生55.6KJ热量,写出甲烷与0 生成液态水的热化学方程式 。
(3) 以碳酸钾熔融盐为电解质,写出甲烷燃料电池负极反应方程式 。
(4) 甲烷与氯气在光照下能发生取代反应,写出一取代反应方程式 。
(5) 2C0 (g) = 2C(s)+0 (g)的△H>0,以反应自由能 △G分析反应不能进行的原因 。
18.(10分 ) 已知X是一种酸式盐,常用作化肥,其由如下转化,图中每一个方格表示有关的一
种反应物或者生成物,其中常温下A、 C是气体,回答下列问题:
高二化学试卷第4页
+木炭、加热
+HCI A +Na O ① D
加热 +BX B F G
+NaOH
C +D、催化剂加热 E +Cu②
(1)写出物质化学式:B_ ,G 。
(2)写出 C、D催化反应生成E的方程式 。
(3)写出实验室制取 A的离子反应方程式 。
(4)设计实验检验X中的阳离子(写出步骤、现象、结论) 。
19.(10分)室温下,H S水溶液中各含硫微粒物质的量分数δ随pH变化关系如下图[例如
8(S)-(s)+c(Hs)+-1.。已知:K,(FeS)=6.3×101 , K[Fe(OH) ]=4.9×101 。
1.0
0.5
7.0 13.0
0.0
4 6 8 10 12 14
pH
(1)在0.1mol·L1的Na S 溶液中,下列粒子浓度关系式正确的是_ _;
A.c(S2-)+c(HS”)+c(H S)=0.1mol·L1 B. c(Na')>c(S2-)>c(HS")>c(OH")>c(H)
C. c(Na)+c(H)=c(OH )+c(HS")+c(S2) D. c(Na)=2c(S2-)+2c(HS)
(2)溶解度比较:FeS Fe(OH)。(填“>”“=”“<”)。
(3)从图中数据计算 Ka (H S)=_ 。
(4)0.1mol/L的H S 溶液的 pH值约等于
(5)25℃时,将 a mol·L1的氨水与0.01 mol·L1的。盐酸等体积混合,若混合后溶液的 pH=7,用含的代数式表示 NH ·H 0的电离常数K=
20.(10分)为测定一碳酸钠样品的纯度,实验室准确称取一定量的Na CO 粉末1.060g,配制成
100mL 溶液,取25.00mL用0.20mol/L 盐酸标准溶液滴定,根据滴定结果计算碳酸钠的纯度。
(1)配制100mLNa CO 溶液,需要用到的玻璃仪器有烧杯、玻璃棒、滴管和
(2)有关滴定终点指示剂的 pH变色范围:酚酞8.2-10,石蕊5-8,甲基橙3.1-4.4;为提高滴
定的准确度,选择最适宜的指示剂是_ ,指示滴定终点的现象是____。
(3)滴定的可能存在的步骤如下,选取合适的操作步骤并顺序 →a→_ 。
a.用移液管取 25.00mL待测液加入锥形瓶中,滴入2-3滴指示剂
b.取碱式滴定管用蒸馏水清洗
c.用标准溶液润洗滴定管 2-3次
d.取酸式滴定管用蒸馏水清洗
e.注入标准液读数
高二化学试卷第5页
f.用待测液润洗锥形瓶
g.滴定至终点
h.重复2-3次
i.取下滴定管准确读数
(4)有关配制溶液与滴定测定结果的下列说法正确的是_
A.若在配制过程中仰视刻度定容,则导致碳酸钠纯度测定结果偏高。
B.若滴定管尖管部分滴定前存在气泡,滴定后消失,则滴定结果偏低。
C.注入标准液读数时,读数可以不是零刻度。
D.滴定前读数仰视,滴定后读数俯视,将导致滴定结果偏高。
(5)重复滴定三次的实验数据如下表所示。计算碳酸钠的纯度为 。
实验次数 HC1溶液的体积/mL 待测碳酸钠溶液的体积/mL
1 24.32 25.00
2 24.98 25.00
3 24.28 25.00
21.(12分)丙烯是重要的有机化工原料,丙烷制丙烯是化工研究的热点。由丙烷(C Hg)制丙烯
(C H )的两种方法如下:
反应I(直接脱氢):C H (g)—C H (g)+H (g) △H
反应Ⅱ(氧化脱氢):2C H (g)+ 0 (g)—2C H (g)+2H O(g) △H = -236kJ/mol
(1)已知:2H (g)+0 (g)= 2H O(g) △H=-484kJ/mol,则△H为_ kJ/mol。
(2)一定温度下,向恒容密闭容器中充入1molC Hg,开始压强为pkPa,仅发生反应I(直接脱氢)。
①下列情况能说明该反应达到平衡状态的是_ (填字母,下同)
A.容器内压强保持不变
B.气体密度保持不变
C.C H 与H 的物质的量之比保持不变
D.反应速率v正(C H)=v(C H )
②欲提高丙烯的平衡产率同时加快反应速率,应采取的措施是 。
A.减小压强 B.升高温度 C.及时分离出 H D.加催化剂
③反应过程中,C H 的气体体积分数与反应时间的关系如图1所示。此温度下该反应的平衡常数
Kp= kPa(用含p的代数式表示,Kp是用反应体系中气体物质的分压表示的平衡常数,平衡
分压=总压×体积分数)。
100
C H 体积分数/% 7550 m20 n
0 2 反应时间/min
图1
(3)①一定条件下,恒压密闭容器中仅发生反应Ⅱ(氧化脱氢)。C Hg与0 起始物质的量比分别为
1:1平衡时C Hg的体积分数随温度的变化关系如图2所示。在图中画出 n(O2)=1::2的曲线。
②相比反应I(直接脱氢),反应Ⅱ(氧化脱氢)的优点可能有 (任写一点)。
高二化学试卷第6页
5品
CsH.体积分数%2520151s0
oL
T/K
图2
(4)某工厂对尾气处理后的Na,SO 溶液进行电解,可循环再生 NaOH。,同时得到某种副产物,其原理如图所示。则b极的电极反应方程式为
A Na SO 溶液
a(O ▲ O)b
B Na C
稀NaOH溶液- SO 稀硫酸
阳离子交换膜 阴离子交换膜
高二化学试卷第7页
高二年级化学学科答案
一、选择题(本大题共16小题,每小题3分,共48分。每个小题列出的四个备选项中
只有一个是符合题目要求的,不选、多选、错选均不得分)
题号 1 2 3 4 5 6 7 8
答案 D B C C B C B A
题号 9 10 11 12 13 14 15 16
答案 D D C D D B A C
一、非选择题(本题共5大题,共52分)
17.(每空2分,共10分)
(1)CO22+ H O—HCO +0H
(2)CH (g)+20 (g)= CO (g)+2H O(1)△H=-889.6 KJ/mol
(3)CH + 4CO 2- 8e = 5CO +2H O
(4)CH + Cl 光照→CH Cl + HC1
(5)反应的△H>0,△S<0,故反应自由能△G>0,反应不能自发进行。
18.(每空2分,共10分)
(1)H O HNO
(2) 4NH +502化删4NO+6H O
(3)CaCO +2H+ = Ca2++ CO ↑+ H O
(4)取少量X于试管中,加入足量的浓 NaOH 溶液,加热,试管口置湿润的红色石蕊试纸,
试纸变蓝,则X中含 NH +。
高二化学试卷第1 页
19.(每空2分,共10分)
109
(1)A (2)<(3)10-13(4)4 (5)a-0.01
20.(除标出小分外,其余每空2分,共10分)
(1)100mL容量瓶(1分,没有规格不给分)
(2)甲基橙(1分) 当滴入最后半滴盐酸溶液,锥形瓶内溶液由黄色变橙色,且30
秒不变色
(3) d.c.e.(1分) g.i.h(1分)
(4) C
(5)97.2 0.972
21.(除标出小分外,其余每空2分,共12分)
(1)+124(1分)
(2)① AD ② B ③ 4p/3
1:2 1:1
(3)① CH.体积分数% 5三以2015 (送分)105
0
T/K
图2
②减少能耗(产物易于分离、催化剂表面不易积碳)(1分)
(4) H SO -2e~+H O=SO4-+4H+(若写 SO32-或者HSO3其他正确给1分)
高二化学试卷第 2 页
同课章节目录
