第四章 化学反应与电能 达标训练题(含答案) 2024-2025学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 第四章 化学反应与电能 达标训练题(含答案) 2024-2025学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 588.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-25 17:41:13 | ||
图片预览



文档简介
第四章 化学反应与电能 达标训练题2024-2025学年高二上学期化学人教版(2019)选择性必修1
一、选择题。(18题)
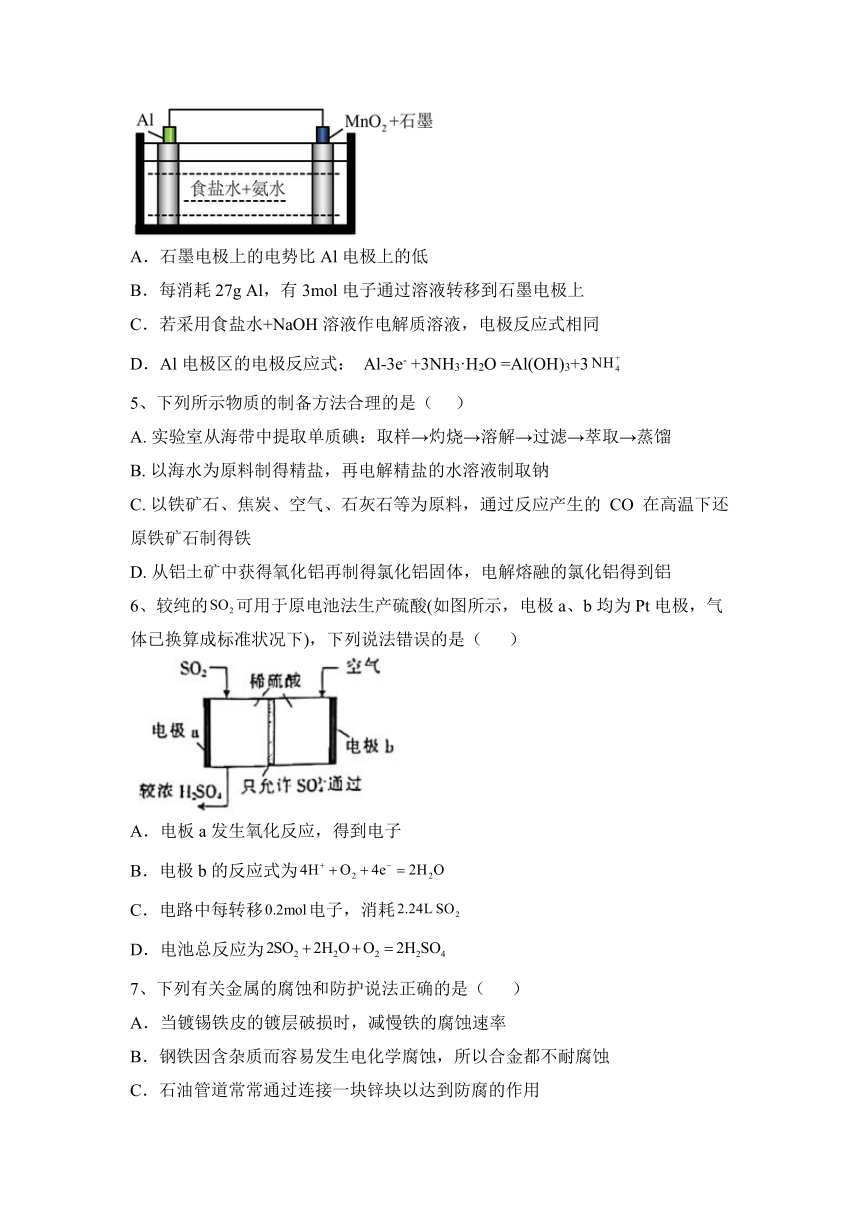
1、二氧化硫空气质子交换膜燃料电池可以利用大气所含的SO2快速启动,下图为其装置示意图。以下说法正确的是( )
A.质子流动方向Y→X B.负极区有硫酸生成
C.正极反应物为SO2 D.离子导体为O2-
2、下列各变化中属于原电池反应的( )
A.在空气中金属铝表面迅速氧化形成保护层
B.锌与稀硫酸反应时,用锌粉代替锌块可使反应加快
C.红热的铁丝与冷水接触,表面形成蓝黑色保护层
D.镀锌铁表面有划损时,仍然能阻止铁被氧化
3、利用活性铁可以很好地消除酸性水体中NO3﹣造成的污染,除去原理如图所示。下列说法中正确的是( )
A.铁电极的电极反应式:3Fe﹣8e﹣+4H2O═Fe3O4+8H+
B.NO3﹣在负极上发生还原反应
C.除NO3﹣的过程中水体pH减小
D.当电路中有4mol电子转移时,溶液中会有1mol NH4+生成
4、一种具有高能量比的新型干电池示意图如图所示,石墨电极区发生的电极反应为MnO2+e-+H2O=MnO(OH)+OH-。该装置工作时,下列叙述正确的是( )
A.石墨电极上的电势比Al电极上的低
B.每消耗27g Al,有3mol电子通过溶液转移到石墨电极上
C.若采用食盐水+NaOH溶液作电解质溶液,电极反应式相同
D.Al电极区的电极反应式: Al-3e- +3NH3·H2O =Al(OH)3+3
5、下列所示物质的制备方法合理的是( )
A. 实验室从海带中提取单质碘:取样→灼烧→溶解→过滤→萃取→蒸馏
B. 以海水为原料制得精盐,再电解精盐的水溶液制取钠
C. 以铁矿石、焦炭、空气、石灰石等为原料,通过反应产生的 CO 在高温下还原铁矿石制得铁
D. 从铝土矿中获得氧化铝再制得氯化铝固体,电解熔融的氯化铝得到铝
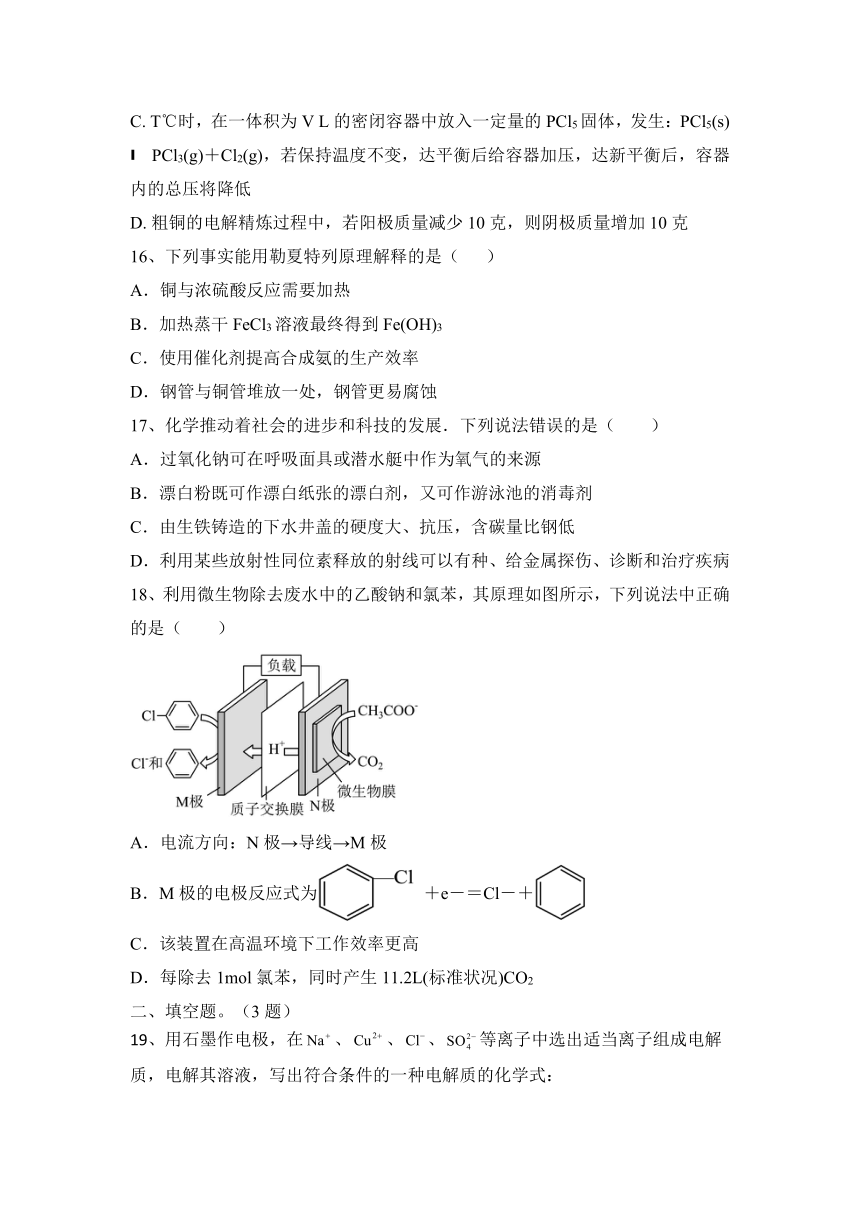
6、较纯的可用于原电池法生产硫酸(如图所示,电极a、b均为Pt电极,气体已换算成标准状况下),下列说法错误的是( )
A.电板a发生氧化反应,得到电子
B.电极b的反应式为
C.电路中每转移电子,消耗
D.电池总反应为
7、下列有关金属的腐蚀和防护说法正确的是( )
A.当镀锡铁皮的镀层破损时,减慢铁的腐蚀速率
B.钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀
C.石油管道常常通过连接一块锌块以达到防腐的作用
D.将青铜器放在银质托盘上可以避免铜绿的生成
8、最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为H2O和CO2,同时产生电能,其原理示意如图。下列有关该电池的说法正确的是( )
A.氧化银电极上的反应为Ag2O+2e-=2Ag+O2-
B.石墨电极上的反应为C6H12O6+6H2O+24e-=6CO2↑+24H+
C.转移4mol电子,氧化银电极产生22.4L CO2气体(标准状况)
D.30g C6H12O6参与反应,有4mol H+经质子交换膜进入正极区
9、下列化学用语的表示正确的是( )
A.乙烯的结构简式:CH2CH2
B.乙醇的分子式:C2H5OH
C.聚丙烯的结构简式:
D.乙烯的球棍模型:
10、根据原电池原理,结合装置图,下列说法正确的是( )
A.若X为铁,Y为硫酸铜溶液,则X为正极
B.若X为铁,Y为硫酸铜溶液,溶液中的Cu2+移向电极X极
C.若X为银,Y为硝酸银溶液,则X为正极
D.若X为铁,Y为浓硝酸,则铜为正极
11、下列实验现象叙述正确的是( )
A. 滴入硝酸酸化的BaCl2 溶液,产生白色沉淀,溶液中一定存在SO42-
B. 硫粉在纯氧中燃烧:产生明亮的蓝紫色火焰,放热,生成有刺激性气味的气体
C. 铁粉加入稀硫酸,银白色固体表面有气泡产生,固体减少,放热,溶液由无色变浅绿色
D. 水通电:两极均有气体生成,正极多,负极少,体积比约为1:2
12、下列说法正确的是( )
A.氨氮废水(含NH及NH3)可用化学氧化法或电化学氧化法处理
B.明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒
C.牺牲阳极的阴极保护法、外加电流的阳极保护法都可以用来保护金属
D.工业上均用电解熔融金属氯化物的方法来冶炼金属Na、Mg、Al
13、旅游景点售卖的仿银饰品大多是白铜(铜镍合金)。下列说法正确的是( )
A.硬度比铜的大 B.熔点比铜的高
C.容易被腐蚀 D.通过外观颜色即可区分它和白银
14、一种新型Na-Zn双离子二次电池放电时的工作原理如图所示。该二次电池放电时,下列有关说法正确的是( )
A.M极发生还原反应
B.电子由M极通过NaOH溶液移向N极
C.通过阳离子交换膜向M极移动
D.N极电极反应式为Na0.6-xMnO2+xNa++xe-=Na0.6MnO2
15、下列有关说法正确的是( )
A. H3PO2与足量的NaOH反应生成NaH2PO2 , 则NaH2PO2属于酸式盐
B. SOCl2与六水合三氯化铝混合并加热可得到无水的三氯化铝
C. T℃时,在一体积为V L的密闭容器中放入一定量的PCl5固体,发生:PCl5(s) PCl3(g)+Cl2(g),若保持温度不变,达平衡后给容器加压,达新平衡后,容器内的总压将降低
D. 粗铜的电解精炼过程中,若阳极质量减少10克,则阴极质量增加10克
16、下列事实能用勒夏特列原理解释的是( )
A.铜与浓硫酸反应需要加热
B.加热蒸干FeCl3溶液最终得到Fe(OH)3
C.使用催化剂提高合成氨的生产效率
D.钢管与铜管堆放一处,钢管更易腐蚀
17、化学推动着社会的进步和科技的发展.下列说法错误的是( )
A.过氧化钠可在呼吸面具或潜水艇中作为氧气的来源
B.漂白粉既可作漂白纸张的漂白剂,又可作游泳池的消毒剂
C.由生铁铸造的下水井盖的硬度大、抗压,含碳量比钢低
D.利用某些放射性同位素释放的射线可以有种、给金属探伤、诊断和治疗疾病
18、利用微生物除去废水中的乙酸钠和氯苯,其原理如图所示,下列说法中正确的是( )
A.电流方向:N极→导线→M极
B.M极的电极反应式为 +e-=Cl-+
C.该装置在高温环境下工作效率更高
D.每除去1mol氯苯,同时产生11.2L(标准状况)CO2
二、填空题。(3题)
19、用石墨作电极,在、、、等离子中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式:
(1)当阴极放出,阳极放出时,电解质是__________________。
(2)当阴极析出金属,阳极放出时,电解质是_________________。
(3)当阴极放出,阳极放出时,电解质是_________________。
(4)通过电子的物质的量与阴极析出的金属的物质的量、阳极放出的气体的物质的量之比为4︰2︰1时,电解质是_________________。
20、金属腐蚀现象在生产生活中普遍存在,依据下列2种腐蚀现象回答下列问题:
(1).图1,被腐蚀的金属为 , 其腐蚀类型属于 (填字母)。图2,金属腐蚀类型属于 (填字母)。
A.化学腐蚀 B.电化学腐蚀 C.析氢腐蚀 D.吸氧腐蚀
(2)图1中Cu的作用是 , 结合电极反应、电子移动、离子移动等,分析金属被腐蚀的原理 。
(3)图2中铁的生锈过程:Fe→Fe(OH)2→Fe(OH)3→Fe2O3·nH2O,将Fe转变为Fe(OH)2的反应补充完整:正极反应为 ,负极反应为 , 总反应为 。
(4)下列防止铁制品生锈的措施合理的是__________ 。
A.在铁闸门表面涂油漆
B.在地下铁管道上安装若干镁合金
C.将铁罐与浓硫酸等强氧化剂接触,使之发生钝化
21、NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品,工业上常用铝土矿(主要成分为Al2O3)来生产铵明矾NH4Al(SO4)2 12H2O,其工艺流程图如下:
(1)流程图中X为_________(填化学式),Y为______(填名称)溶液,NH3的电子式________ ;
(2)流程中电解池阳极的电极反应式为______ ;
(3)反应II的离子方程式为____________________ , 反应Ⅵ的化学方程式为_________________ ;
(4)对铵明矾NH4Al(SO4)2·12H2O高温分解的气体产物的预测不合理的是______;
A.NH3、N2、SO2、H2O B.NH3、SO3、H2O
C.NH3、SO2、H2O D.NH3、N2、SO3、SO2、H2O
三、综合解答题。
22、回答下列问题:
(1)1780年,意大利解剖学家伽伐尼在用银质手术刀触碰放在铁盘上的青蛙时,无意间发现青蛙腿部肌肉抽搐了一下,仿佛受到电流的刺激。伽伐尼认为出现这种现象的原因是动物体内存在“生物电”。结合所学知识,判断下列材质的手术刀触碰铁盘上的青蛙腿不会产生抽搐的有__________(填字母)。
a.铝 b.玻璃 c.银 d.铁
(2)1799年,伏打仔细研究了伽伐尼的发现,将含食盐水的湿抹布夹在银和锌的圆形板中间,堆积成圆柱状,制造出世界上最早的电池——伏打电池。将洁净的金属片A、B、D、E分别放置在浸有盐溶液的滤纸上面并压紧(如图1所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数,结果如表所示:
金属 电子流动方向 电压(V)
A A→Cu +0.78
B Cu→B -0.15
C D→Cu +1.35
D E→Cu +0.30
已知:构成两电极的金属的活泼性相差越大,电压表的读数越大。请依据表中数据判断:金属__________可能是最强的还原剂;金属__________不能从硫酸铜溶液中置换出铜。
(3)1836年,英国科学家丹尼尔对伏打电池进行改进,获得了世界上第一个具有稳定电流的电池,图2是丹尼尔电池的简易装置:
该电池正极的电极反应式是__________,负极的电极反应式是__________。
(4)随着社会的发展和科技的进步,越来越多的电池被制造出来。请选择适宜的材料和试剂设计一个原电池,使它正极的电极反应式为,在下面方框内画出装置图,指出电极材料和电解质溶液,并标出原电池的正负极。
第四章 化学反应与电能 达标训练题2024-2025学年高二上学期化学人教版(2019)选择性必修1
一、选择题。(18题)
1、二氧化硫空气质子交换膜燃料电池可以利用大气所含的SO2快速启动,下图为其装置示意图。以下说法正确的是( )
A.质子流动方向Y→X B.负极区有硫酸生成
C.正极反应物为SO2 D.离子导体为O2-
【答案】B
2、下列各变化中属于原电池反应的( )
A.在空气中金属铝表面迅速氧化形成保护层
B.锌与稀硫酸反应时,用锌粉代替锌块可使反应加快
C.红热的铁丝与冷水接触,表面形成蓝黑色保护层
D.镀锌铁表面有划损时,仍然能阻止铁被氧化
【答案】D
3、利用活性铁可以很好地消除酸性水体中NO3﹣造成的污染,除去原理如图所示。下列说法中正确的是( )
A.铁电极的电极反应式:3Fe﹣8e﹣+4H2O═Fe3O4+8H+
B.NO3﹣在负极上发生还原反应
C.除NO3﹣的过程中水体pH减小
D.当电路中有4mol电子转移时,溶液中会有1mol NH4+生成
【答案】A
4、一种具有高能量比的新型干电池示意图如图所示,石墨电极区发生的电极反应为MnO2+e-+H2O=MnO(OH)+OH-。该装置工作时,下列叙述正确的是( )
A.石墨电极上的电势比Al电极上的低
B.每消耗27g Al,有3mol电子通过溶液转移到石墨电极上
C.若采用食盐水+NaOH溶液作电解质溶液,电极反应式相同
D.Al电极区的电极反应式: Al-3e- +3NH3·H2O =Al(OH)3+3
【答案】D
5、下列所示物质的制备方法合理的是( )
A. 实验室从海带中提取单质碘:取样→灼烧→溶解→过滤→萃取→蒸馏
B. 以海水为原料制得精盐,再电解精盐的水溶液制取钠
C. 以铁矿石、焦炭、空气、石灰石等为原料,通过反应产生的 CO 在高温下还原铁矿石制得铁
D. 从铝土矿中获得氧化铝再制得氯化铝固体,电解熔融的氯化铝得到铝
【答案】C
6、较纯的可用于原电池法生产硫酸(如图所示,电极a、b均为Pt电极,气体已换算成标准状况下),下列说法错误的是( )
A.电板a发生氧化反应,得到电子
B.电极b的反应式为
C.电路中每转移电子,消耗
D.电池总反应为
【答案】A
7、下列有关金属的腐蚀和防护说法正确的是( )
A.当镀锡铁皮的镀层破损时,减慢铁的腐蚀速率
B.钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀
C.石油管道常常通过连接一块锌块以达到防腐的作用
D.将青铜器放在银质托盘上可以避免铜绿的生成
【答案】C
8、最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为H2O和CO2,同时产生电能,其原理示意如图。下列有关该电池的说法正确的是( )
A.氧化银电极上的反应为Ag2O+2e-=2Ag+O2-
B.石墨电极上的反应为C6H12O6+6H2O+24e-=6CO2↑+24H+
C.转移4mol电子,氧化银电极产生22.4L CO2气体(标准状况)
D.30g C6H12O6参与反应,有4mol H+经质子交换膜进入正极区
【答案】D
9、下列化学用语的表示正确的是( )
A.乙烯的结构简式:CH2CH2
B.乙醇的分子式:C2H5OH
C.聚丙烯的结构简式:
D.乙烯的球棍模型:
【答案】D
10、根据原电池原理,结合装置图,下列说法正确的是( )
A.若X为铁,Y为硫酸铜溶液,则X为正极
B.若X为铁,Y为硫酸铜溶液,溶液中的Cu2+移向电极X极
C.若X为银,Y为硝酸银溶液,则X为正极
D.若X为铁,Y为浓硝酸,则铜为正极
【答案】C
11、下列实验现象叙述正确的是( )
A. 滴入硝酸酸化的BaCl2 溶液,产生白色沉淀,溶液中一定存在SO42-
B. 硫粉在纯氧中燃烧:产生明亮的蓝紫色火焰,放热,生成有刺激性气味的气体
C. 铁粉加入稀硫酸,银白色固体表面有气泡产生,固体减少,放热,溶液由无色变浅绿色
D. 水通电:两极均有气体生成,正极多,负极少,体积比约为1:2
【答案】B
12、下列说法正确的是( )
A.氨氮废水(含NH及NH3)可用化学氧化法或电化学氧化法处理
B.明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒
C.牺牲阳极的阴极保护法、外加电流的阳极保护法都可以用来保护金属
D.工业上均用电解熔融金属氯化物的方法来冶炼金属Na、Mg、Al
【答案】A
13、旅游景点售卖的仿银饰品大多是白铜(铜镍合金)。下列说法正确的是( )
A.硬度比铜的大 B.熔点比铜的高
C.容易被腐蚀 D.通过外观颜色即可区分它和白银
【答案】A
14、一种新型Na-Zn双离子二次电池放电时的工作原理如图所示。该二次电池放电时,下列有关说法正确的是( )
A.M极发生还原反应
B.电子由M极通过NaOH溶液移向N极
C.通过阳离子交换膜向M极移动
D.N极电极反应式为Na0.6-xMnO2+xNa++xe-=Na0.6MnO2
【答案】D
15、下列有关说法正确的是( )
A. H3PO2与足量的NaOH反应生成NaH2PO2 , 则NaH2PO2属于酸式盐
B. SOCl2与六水合三氯化铝混合并加热可得到无水的三氯化铝
C. T℃时,在一体积为V L的密闭容器中放入一定量的PCl5固体,发生:PCl5(s) PCl3(g)+Cl2(g),若保持温度不变,达平衡后给容器加压,达新平衡后,容器内的总压将降低
D. 粗铜的电解精炼过程中,若阳极质量减少10克,则阴极质量增加10克
【答案】B
16、下列事实能用勒夏特列原理解释的是( )
A.铜与浓硫酸反应需要加热
B.加热蒸干FeCl3溶液最终得到Fe(OH)3
C.使用催化剂提高合成氨的生产效率
D.钢管与铜管堆放一处,钢管更易腐蚀
【答案】B
17、化学推动着社会的进步和科技的发展.下列说法错误的是( )
A.过氧化钠可在呼吸面具或潜水艇中作为氧气的来源
B.漂白粉既可作漂白纸张的漂白剂,又可作游泳池的消毒剂
C.由生铁铸造的下水井盖的硬度大、抗压,含碳量比钢低
D.利用某些放射性同位素释放的射线可以有种、给金属探伤、诊断和治疗疾病
【答案】C
18、利用微生物除去废水中的乙酸钠和氯苯,其原理如图所示,下列说法中正确的是( )
A.电流方向:N极→导线→M极
B.M极的电极反应式为 +e-=Cl-+
C.该装置在高温环境下工作效率更高
D.每除去1mol氯苯,同时产生11.2L(标准状况)CO2
【答案】D
二、填空题。(3题)
19、用石墨作电极,在、、、等离子中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式:
(1)当阴极放出,阳极放出时,电解质是__________________。
(2)当阴极析出金属,阳极放出时,电解质是_________________。
(3)当阴极放出,阳极放出时,电解质是_________________。
(4)通过电子的物质的量与阴极析出的金属的物质的量、阳极放出的气体的物质的量之比为4︰2︰1时,电解质是_________________。
【答案】(1) (2) (3)NaCl (4)
20、金属腐蚀现象在生产生活中普遍存在,依据下列2种腐蚀现象回答下列问题:
(1).图1,被腐蚀的金属为 , 其腐蚀类型属于 (填字母)。图2,金属腐蚀类型属于 (填字母)。
A.化学腐蚀 B.电化学腐蚀 C.析氢腐蚀 D.吸氧腐蚀
(2)图1中Cu的作用是 , 结合电极反应、电子移动、离子移动等,分析金属被腐蚀的原理 。
(3)图2中铁的生锈过程:Fe→Fe(OH)2→Fe(OH)3→Fe2O3·nH2O,将Fe转变为Fe(OH)2的反应补充完整:正极反应为 ,负极反应为 , 总反应为 。
(4)下列防止铁制品生锈的措施合理的是__________ 。
A.在铁闸门表面涂油漆
B.在地下铁管道上安装若干镁合金
C.将铁罐与浓硫酸等强氧化剂接触,使之发生钝化
【答案】(1)铁或Fe;BC;BD
(2)做正极材料,导电;铜做正极,氢离子在内电路移向正极,得到电子,生成氢气;铁做负极,在外电路失去电子,电子从负极移向正极,金属铁被腐蚀成亚铁离子。
(3)O2+4e-+2H2O=4OH- ;2Fe-4e-=2Fe2+;2Fe+O2+2H2O=2Fe(OH)2
(4)A,B,C
21、NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品,工业上常用铝土矿(主要成分为Al2O3)来生产铵明矾NH4Al(SO4)2 12H2O,其工艺流程图如下:
(1)流程图中X为_________(填化学式),Y为______(填名称)溶液,NH3的电子式________ ;
(2)流程中电解池阳极的电极反应式为______ ;
(3)反应II的离子方程式为____________________ , 反应Ⅵ的化学方程式为_________________ ;
(4)对铵明矾NH4Al(SO4)2·12H2O高温分解的气体产物的预测不合理的是______;
A.NH3、N2、SO2、H2O B.NH3、SO3、H2O
C.NH3、SO2、H2O D.NH3、N2、SO3、SO2、H2O
【答案】(1)NaOH 硫酸 (2)2SO42--2e-=S2O82-
(3)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(NH4)2S2O8+2H2O=2NH4HSO4+H2O2 (4)C
三、综合解答题。
22、回答下列问题:
(1)1780年,意大利解剖学家伽伐尼在用银质手术刀触碰放在铁盘上的青蛙时,无意间发现青蛙腿部肌肉抽搐了一下,仿佛受到电流的刺激。伽伐尼认为出现这种现象的原因是动物体内存在“生物电”。结合所学知识,判断下列材质的手术刀触碰铁盘上的青蛙腿不会产生抽搐的有__________(填字母)。
a.铝 b.玻璃 c.银 d.铁
(2)1799年,伏打仔细研究了伽伐尼的发现,将含食盐水的湿抹布夹在银和锌的圆形板中间,堆积成圆柱状,制造出世界上最早的电池——伏打电池。将洁净的金属片A、B、D、E分别放置在浸有盐溶液的滤纸上面并压紧(如图1所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数,结果如表所示:
金属 电子流动方向 电压(V)
A A→Cu +0.78
B Cu→B -0.15
C D→Cu +1.35
D E→Cu +0.30
已知:构成两电极的金属的活泼性相差越大,电压表的读数越大。请依据表中数据判断:金属__________可能是最强的还原剂;金属__________不能从硫酸铜溶液中置换出铜。
(3)1836年,英国科学家丹尼尔对伏打电池进行改进,获得了世界上第一个具有稳定电流的电池,图2是丹尼尔电池的简易装置:
该电池正极的电极反应式是__________,负极的电极反应式是__________。
(4)随着社会的发展和科技的进步,越来越多的电池被制造出来。请选择适宜的材料和试剂设计一个原电池,使它正极的电极反应式为,在下面方框内画出装置图,指出电极材料和电解质溶液,并标出原电池的正负极。
【答案】(1)b、d (2)D;B (3);
(4)如图所示:
(合理即可)
一、选择题。(18题)
1、二氧化硫空气质子交换膜燃料电池可以利用大气所含的SO2快速启动,下图为其装置示意图。以下说法正确的是( )
A.质子流动方向Y→X B.负极区有硫酸生成
C.正极反应物为SO2 D.离子导体为O2-
2、下列各变化中属于原电池反应的( )
A.在空气中金属铝表面迅速氧化形成保护层
B.锌与稀硫酸反应时,用锌粉代替锌块可使反应加快
C.红热的铁丝与冷水接触,表面形成蓝黑色保护层
D.镀锌铁表面有划损时,仍然能阻止铁被氧化
3、利用活性铁可以很好地消除酸性水体中NO3﹣造成的污染,除去原理如图所示。下列说法中正确的是( )
A.铁电极的电极反应式:3Fe﹣8e﹣+4H2O═Fe3O4+8H+
B.NO3﹣在负极上发生还原反应
C.除NO3﹣的过程中水体pH减小
D.当电路中有4mol电子转移时,溶液中会有1mol NH4+生成
4、一种具有高能量比的新型干电池示意图如图所示,石墨电极区发生的电极反应为MnO2+e-+H2O=MnO(OH)+OH-。该装置工作时,下列叙述正确的是( )
A.石墨电极上的电势比Al电极上的低
B.每消耗27g Al,有3mol电子通过溶液转移到石墨电极上
C.若采用食盐水+NaOH溶液作电解质溶液,电极反应式相同
D.Al电极区的电极反应式: Al-3e- +3NH3·H2O =Al(OH)3+3
5、下列所示物质的制备方法合理的是( )
A. 实验室从海带中提取单质碘:取样→灼烧→溶解→过滤→萃取→蒸馏
B. 以海水为原料制得精盐,再电解精盐的水溶液制取钠
C. 以铁矿石、焦炭、空气、石灰石等为原料,通过反应产生的 CO 在高温下还原铁矿石制得铁
D. 从铝土矿中获得氧化铝再制得氯化铝固体,电解熔融的氯化铝得到铝
6、较纯的可用于原电池法生产硫酸(如图所示,电极a、b均为Pt电极,气体已换算成标准状况下),下列说法错误的是( )
A.电板a发生氧化反应,得到电子
B.电极b的反应式为
C.电路中每转移电子,消耗
D.电池总反应为
7、下列有关金属的腐蚀和防护说法正确的是( )
A.当镀锡铁皮的镀层破损时,减慢铁的腐蚀速率
B.钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀
C.石油管道常常通过连接一块锌块以达到防腐的作用
D.将青铜器放在银质托盘上可以避免铜绿的生成
8、最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为H2O和CO2,同时产生电能,其原理示意如图。下列有关该电池的说法正确的是( )
A.氧化银电极上的反应为Ag2O+2e-=2Ag+O2-
B.石墨电极上的反应为C6H12O6+6H2O+24e-=6CO2↑+24H+
C.转移4mol电子,氧化银电极产生22.4L CO2气体(标准状况)
D.30g C6H12O6参与反应,有4mol H+经质子交换膜进入正极区
9、下列化学用语的表示正确的是( )
A.乙烯的结构简式:CH2CH2
B.乙醇的分子式:C2H5OH
C.聚丙烯的结构简式:
D.乙烯的球棍模型:
10、根据原电池原理,结合装置图,下列说法正确的是( )
A.若X为铁,Y为硫酸铜溶液,则X为正极
B.若X为铁,Y为硫酸铜溶液,溶液中的Cu2+移向电极X极
C.若X为银,Y为硝酸银溶液,则X为正极
D.若X为铁,Y为浓硝酸,则铜为正极
11、下列实验现象叙述正确的是( )
A. 滴入硝酸酸化的BaCl2 溶液,产生白色沉淀,溶液中一定存在SO42-
B. 硫粉在纯氧中燃烧:产生明亮的蓝紫色火焰,放热,生成有刺激性气味的气体
C. 铁粉加入稀硫酸,银白色固体表面有气泡产生,固体减少,放热,溶液由无色变浅绿色
D. 水通电:两极均有气体生成,正极多,负极少,体积比约为1:2
12、下列说法正确的是( )
A.氨氮废水(含NH及NH3)可用化学氧化法或电化学氧化法处理
B.明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒
C.牺牲阳极的阴极保护法、外加电流的阳极保护法都可以用来保护金属
D.工业上均用电解熔融金属氯化物的方法来冶炼金属Na、Mg、Al
13、旅游景点售卖的仿银饰品大多是白铜(铜镍合金)。下列说法正确的是( )
A.硬度比铜的大 B.熔点比铜的高
C.容易被腐蚀 D.通过外观颜色即可区分它和白银
14、一种新型Na-Zn双离子二次电池放电时的工作原理如图所示。该二次电池放电时,下列有关说法正确的是( )
A.M极发生还原反应
B.电子由M极通过NaOH溶液移向N极
C.通过阳离子交换膜向M极移动
D.N极电极反应式为Na0.6-xMnO2+xNa++xe-=Na0.6MnO2
15、下列有关说法正确的是( )
A. H3PO2与足量的NaOH反应生成NaH2PO2 , 则NaH2PO2属于酸式盐
B. SOCl2与六水合三氯化铝混合并加热可得到无水的三氯化铝
C. T℃时,在一体积为V L的密闭容器中放入一定量的PCl5固体,发生:PCl5(s) PCl3(g)+Cl2(g),若保持温度不变,达平衡后给容器加压,达新平衡后,容器内的总压将降低
D. 粗铜的电解精炼过程中,若阳极质量减少10克,则阴极质量增加10克
16、下列事实能用勒夏特列原理解释的是( )
A.铜与浓硫酸反应需要加热
B.加热蒸干FeCl3溶液最终得到Fe(OH)3
C.使用催化剂提高合成氨的生产效率
D.钢管与铜管堆放一处,钢管更易腐蚀
17、化学推动着社会的进步和科技的发展.下列说法错误的是( )
A.过氧化钠可在呼吸面具或潜水艇中作为氧气的来源
B.漂白粉既可作漂白纸张的漂白剂,又可作游泳池的消毒剂
C.由生铁铸造的下水井盖的硬度大、抗压,含碳量比钢低
D.利用某些放射性同位素释放的射线可以有种、给金属探伤、诊断和治疗疾病
18、利用微生物除去废水中的乙酸钠和氯苯,其原理如图所示,下列说法中正确的是( )
A.电流方向:N极→导线→M极
B.M极的电极反应式为 +e-=Cl-+
C.该装置在高温环境下工作效率更高
D.每除去1mol氯苯,同时产生11.2L(标准状况)CO2
二、填空题。(3题)
19、用石墨作电极,在、、、等离子中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式:
(1)当阴极放出,阳极放出时,电解质是__________________。
(2)当阴极析出金属,阳极放出时,电解质是_________________。
(3)当阴极放出,阳极放出时,电解质是_________________。
(4)通过电子的物质的量与阴极析出的金属的物质的量、阳极放出的气体的物质的量之比为4︰2︰1时,电解质是_________________。
20、金属腐蚀现象在生产生活中普遍存在,依据下列2种腐蚀现象回答下列问题:
(1).图1,被腐蚀的金属为 , 其腐蚀类型属于 (填字母)。图2,金属腐蚀类型属于 (填字母)。
A.化学腐蚀 B.电化学腐蚀 C.析氢腐蚀 D.吸氧腐蚀
(2)图1中Cu的作用是 , 结合电极反应、电子移动、离子移动等,分析金属被腐蚀的原理 。
(3)图2中铁的生锈过程:Fe→Fe(OH)2→Fe(OH)3→Fe2O3·nH2O,将Fe转变为Fe(OH)2的反应补充完整:正极反应为 ,负极反应为 , 总反应为 。
(4)下列防止铁制品生锈的措施合理的是__________ 。
A.在铁闸门表面涂油漆
B.在地下铁管道上安装若干镁合金
C.将铁罐与浓硫酸等强氧化剂接触,使之发生钝化
21、NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品,工业上常用铝土矿(主要成分为Al2O3)来生产铵明矾NH4Al(SO4)2 12H2O,其工艺流程图如下:
(1)流程图中X为_________(填化学式),Y为______(填名称)溶液,NH3的电子式________ ;
(2)流程中电解池阳极的电极反应式为______ ;
(3)反应II的离子方程式为____________________ , 反应Ⅵ的化学方程式为_________________ ;
(4)对铵明矾NH4Al(SO4)2·12H2O高温分解的气体产物的预测不合理的是______;
A.NH3、N2、SO2、H2O B.NH3、SO3、H2O
C.NH3、SO2、H2O D.NH3、N2、SO3、SO2、H2O
三、综合解答题。
22、回答下列问题:
(1)1780年,意大利解剖学家伽伐尼在用银质手术刀触碰放在铁盘上的青蛙时,无意间发现青蛙腿部肌肉抽搐了一下,仿佛受到电流的刺激。伽伐尼认为出现这种现象的原因是动物体内存在“生物电”。结合所学知识,判断下列材质的手术刀触碰铁盘上的青蛙腿不会产生抽搐的有__________(填字母)。
a.铝 b.玻璃 c.银 d.铁
(2)1799年,伏打仔细研究了伽伐尼的发现,将含食盐水的湿抹布夹在银和锌的圆形板中间,堆积成圆柱状,制造出世界上最早的电池——伏打电池。将洁净的金属片A、B、D、E分别放置在浸有盐溶液的滤纸上面并压紧(如图1所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数,结果如表所示:
金属 电子流动方向 电压(V)
A A→Cu +0.78
B Cu→B -0.15
C D→Cu +1.35
D E→Cu +0.30
已知:构成两电极的金属的活泼性相差越大,电压表的读数越大。请依据表中数据判断:金属__________可能是最强的还原剂;金属__________不能从硫酸铜溶液中置换出铜。
(3)1836年,英国科学家丹尼尔对伏打电池进行改进,获得了世界上第一个具有稳定电流的电池,图2是丹尼尔电池的简易装置:
该电池正极的电极反应式是__________,负极的电极反应式是__________。
(4)随着社会的发展和科技的进步,越来越多的电池被制造出来。请选择适宜的材料和试剂设计一个原电池,使它正极的电极反应式为,在下面方框内画出装置图,指出电极材料和电解质溶液,并标出原电池的正负极。
第四章 化学反应与电能 达标训练题2024-2025学年高二上学期化学人教版(2019)选择性必修1
一、选择题。(18题)
1、二氧化硫空气质子交换膜燃料电池可以利用大气所含的SO2快速启动,下图为其装置示意图。以下说法正确的是( )
A.质子流动方向Y→X B.负极区有硫酸生成
C.正极反应物为SO2 D.离子导体为O2-
【答案】B
2、下列各变化中属于原电池反应的( )
A.在空气中金属铝表面迅速氧化形成保护层
B.锌与稀硫酸反应时,用锌粉代替锌块可使反应加快
C.红热的铁丝与冷水接触,表面形成蓝黑色保护层
D.镀锌铁表面有划损时,仍然能阻止铁被氧化
【答案】D
3、利用活性铁可以很好地消除酸性水体中NO3﹣造成的污染,除去原理如图所示。下列说法中正确的是( )
A.铁电极的电极反应式:3Fe﹣8e﹣+4H2O═Fe3O4+8H+
B.NO3﹣在负极上发生还原反应
C.除NO3﹣的过程中水体pH减小
D.当电路中有4mol电子转移时,溶液中会有1mol NH4+生成
【答案】A
4、一种具有高能量比的新型干电池示意图如图所示,石墨电极区发生的电极反应为MnO2+e-+H2O=MnO(OH)+OH-。该装置工作时,下列叙述正确的是( )
A.石墨电极上的电势比Al电极上的低
B.每消耗27g Al,有3mol电子通过溶液转移到石墨电极上
C.若采用食盐水+NaOH溶液作电解质溶液,电极反应式相同
D.Al电极区的电极反应式: Al-3e- +3NH3·H2O =Al(OH)3+3
【答案】D
5、下列所示物质的制备方法合理的是( )
A. 实验室从海带中提取单质碘:取样→灼烧→溶解→过滤→萃取→蒸馏
B. 以海水为原料制得精盐,再电解精盐的水溶液制取钠
C. 以铁矿石、焦炭、空气、石灰石等为原料,通过反应产生的 CO 在高温下还原铁矿石制得铁
D. 从铝土矿中获得氧化铝再制得氯化铝固体,电解熔融的氯化铝得到铝
【答案】C
6、较纯的可用于原电池法生产硫酸(如图所示,电极a、b均为Pt电极,气体已换算成标准状况下),下列说法错误的是( )
A.电板a发生氧化反应,得到电子
B.电极b的反应式为
C.电路中每转移电子,消耗
D.电池总反应为
【答案】A
7、下列有关金属的腐蚀和防护说法正确的是( )
A.当镀锡铁皮的镀层破损时,减慢铁的腐蚀速率
B.钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀
C.石油管道常常通过连接一块锌块以达到防腐的作用
D.将青铜器放在银质托盘上可以避免铜绿的生成
【答案】C
8、最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为H2O和CO2,同时产生电能,其原理示意如图。下列有关该电池的说法正确的是( )
A.氧化银电极上的反应为Ag2O+2e-=2Ag+O2-
B.石墨电极上的反应为C6H12O6+6H2O+24e-=6CO2↑+24H+
C.转移4mol电子,氧化银电极产生22.4L CO2气体(标准状况)
D.30g C6H12O6参与反应,有4mol H+经质子交换膜进入正极区
【答案】D
9、下列化学用语的表示正确的是( )
A.乙烯的结构简式:CH2CH2
B.乙醇的分子式:C2H5OH
C.聚丙烯的结构简式:
D.乙烯的球棍模型:
【答案】D
10、根据原电池原理,结合装置图,下列说法正确的是( )
A.若X为铁,Y为硫酸铜溶液,则X为正极
B.若X为铁,Y为硫酸铜溶液,溶液中的Cu2+移向电极X极
C.若X为银,Y为硝酸银溶液,则X为正极
D.若X为铁,Y为浓硝酸,则铜为正极
【答案】C
11、下列实验现象叙述正确的是( )
A. 滴入硝酸酸化的BaCl2 溶液,产生白色沉淀,溶液中一定存在SO42-
B. 硫粉在纯氧中燃烧:产生明亮的蓝紫色火焰,放热,生成有刺激性气味的气体
C. 铁粉加入稀硫酸,银白色固体表面有气泡产生,固体减少,放热,溶液由无色变浅绿色
D. 水通电:两极均有气体生成,正极多,负极少,体积比约为1:2
【答案】B
12、下列说法正确的是( )
A.氨氮废水(含NH及NH3)可用化学氧化法或电化学氧化法处理
B.明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒
C.牺牲阳极的阴极保护法、外加电流的阳极保护法都可以用来保护金属
D.工业上均用电解熔融金属氯化物的方法来冶炼金属Na、Mg、Al
【答案】A
13、旅游景点售卖的仿银饰品大多是白铜(铜镍合金)。下列说法正确的是( )
A.硬度比铜的大 B.熔点比铜的高
C.容易被腐蚀 D.通过外观颜色即可区分它和白银
【答案】A
14、一种新型Na-Zn双离子二次电池放电时的工作原理如图所示。该二次电池放电时,下列有关说法正确的是( )
A.M极发生还原反应
B.电子由M极通过NaOH溶液移向N极
C.通过阳离子交换膜向M极移动
D.N极电极反应式为Na0.6-xMnO2+xNa++xe-=Na0.6MnO2
【答案】D
15、下列有关说法正确的是( )
A. H3PO2与足量的NaOH反应生成NaH2PO2 , 则NaH2PO2属于酸式盐
B. SOCl2与六水合三氯化铝混合并加热可得到无水的三氯化铝
C. T℃时,在一体积为V L的密闭容器中放入一定量的PCl5固体,发生:PCl5(s) PCl3(g)+Cl2(g),若保持温度不变,达平衡后给容器加压,达新平衡后,容器内的总压将降低
D. 粗铜的电解精炼过程中,若阳极质量减少10克,则阴极质量增加10克
【答案】B
16、下列事实能用勒夏特列原理解释的是( )
A.铜与浓硫酸反应需要加热
B.加热蒸干FeCl3溶液最终得到Fe(OH)3
C.使用催化剂提高合成氨的生产效率
D.钢管与铜管堆放一处,钢管更易腐蚀
【答案】B
17、化学推动着社会的进步和科技的发展.下列说法错误的是( )
A.过氧化钠可在呼吸面具或潜水艇中作为氧气的来源
B.漂白粉既可作漂白纸张的漂白剂,又可作游泳池的消毒剂
C.由生铁铸造的下水井盖的硬度大、抗压,含碳量比钢低
D.利用某些放射性同位素释放的射线可以有种、给金属探伤、诊断和治疗疾病
【答案】C
18、利用微生物除去废水中的乙酸钠和氯苯,其原理如图所示,下列说法中正确的是( )
A.电流方向:N极→导线→M极
B.M极的电极反应式为 +e-=Cl-+
C.该装置在高温环境下工作效率更高
D.每除去1mol氯苯,同时产生11.2L(标准状况)CO2
【答案】D
二、填空题。(3题)
19、用石墨作电极,在、、、等离子中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式:
(1)当阴极放出,阳极放出时,电解质是__________________。
(2)当阴极析出金属,阳极放出时,电解质是_________________。
(3)当阴极放出,阳极放出时,电解质是_________________。
(4)通过电子的物质的量与阴极析出的金属的物质的量、阳极放出的气体的物质的量之比为4︰2︰1时,电解质是_________________。
【答案】(1) (2) (3)NaCl (4)
20、金属腐蚀现象在生产生活中普遍存在,依据下列2种腐蚀现象回答下列问题:
(1).图1,被腐蚀的金属为 , 其腐蚀类型属于 (填字母)。图2,金属腐蚀类型属于 (填字母)。
A.化学腐蚀 B.电化学腐蚀 C.析氢腐蚀 D.吸氧腐蚀
(2)图1中Cu的作用是 , 结合电极反应、电子移动、离子移动等,分析金属被腐蚀的原理 。
(3)图2中铁的生锈过程:Fe→Fe(OH)2→Fe(OH)3→Fe2O3·nH2O,将Fe转变为Fe(OH)2的反应补充完整:正极反应为 ,负极反应为 , 总反应为 。
(4)下列防止铁制品生锈的措施合理的是__________ 。
A.在铁闸门表面涂油漆
B.在地下铁管道上安装若干镁合金
C.将铁罐与浓硫酸等强氧化剂接触,使之发生钝化
【答案】(1)铁或Fe;BC;BD
(2)做正极材料,导电;铜做正极,氢离子在内电路移向正极,得到电子,生成氢气;铁做负极,在外电路失去电子,电子从负极移向正极,金属铁被腐蚀成亚铁离子。
(3)O2+4e-+2H2O=4OH- ;2Fe-4e-=2Fe2+;2Fe+O2+2H2O=2Fe(OH)2
(4)A,B,C
21、NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品,工业上常用铝土矿(主要成分为Al2O3)来生产铵明矾NH4Al(SO4)2 12H2O,其工艺流程图如下:
(1)流程图中X为_________(填化学式),Y为______(填名称)溶液,NH3的电子式________ ;
(2)流程中电解池阳极的电极反应式为______ ;
(3)反应II的离子方程式为____________________ , 反应Ⅵ的化学方程式为_________________ ;
(4)对铵明矾NH4Al(SO4)2·12H2O高温分解的气体产物的预测不合理的是______;
A.NH3、N2、SO2、H2O B.NH3、SO3、H2O
C.NH3、SO2、H2O D.NH3、N2、SO3、SO2、H2O
【答案】(1)NaOH 硫酸 (2)2SO42--2e-=S2O82-
(3)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(NH4)2S2O8+2H2O=2NH4HSO4+H2O2 (4)C
三、综合解答题。
22、回答下列问题:
(1)1780年,意大利解剖学家伽伐尼在用银质手术刀触碰放在铁盘上的青蛙时,无意间发现青蛙腿部肌肉抽搐了一下,仿佛受到电流的刺激。伽伐尼认为出现这种现象的原因是动物体内存在“生物电”。结合所学知识,判断下列材质的手术刀触碰铁盘上的青蛙腿不会产生抽搐的有__________(填字母)。
a.铝 b.玻璃 c.银 d.铁
(2)1799年,伏打仔细研究了伽伐尼的发现,将含食盐水的湿抹布夹在银和锌的圆形板中间,堆积成圆柱状,制造出世界上最早的电池——伏打电池。将洁净的金属片A、B、D、E分别放置在浸有盐溶液的滤纸上面并压紧(如图1所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数,结果如表所示:
金属 电子流动方向 电压(V)
A A→Cu +0.78
B Cu→B -0.15
C D→Cu +1.35
D E→Cu +0.30
已知:构成两电极的金属的活泼性相差越大,电压表的读数越大。请依据表中数据判断:金属__________可能是最强的还原剂;金属__________不能从硫酸铜溶液中置换出铜。
(3)1836年,英国科学家丹尼尔对伏打电池进行改进,获得了世界上第一个具有稳定电流的电池,图2是丹尼尔电池的简易装置:
该电池正极的电极反应式是__________,负极的电极反应式是__________。
(4)随着社会的发展和科技的进步,越来越多的电池被制造出来。请选择适宜的材料和试剂设计一个原电池,使它正极的电极反应式为,在下面方框内画出装置图,指出电极材料和电解质溶液,并标出原电池的正负极。
【答案】(1)b、d (2)D;B (3);
(4)如图所示:
(合理即可)
