黑龙江省牡丹江市海林市2024-2025学年高三上学期第二次月考(期中)化学试卷(含答案)
文档属性
| 名称 | 黑龙江省牡丹江市海林市2024-2025学年高三上学期第二次月考(期中)化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 554.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-25 14:59:40 | ||
图片预览


文档简介
海林市2024-2025学年度第二学期
高三年级化学学科第二次月考
班级: 姓名:
1..改善环境质量,推动绿色发展。下列做法中,不利于环境保护的是 ( )
A.使用可降解塑料,减少白色污染
B.利用风力发电,减少煤的燃烧
C.乘坐公共交通,绿色低碳出行
D.垃圾随意丢弃,直接排放污水
2.水溶液呈酸性的盐是 ( )
A.NH4Cl B.BaCl2 C.H2SO4 D.Ca(OH)2
3.下列表示对应化学反应的离子方程式正确的是 ( )
A.MnO2与浓盐酸反应制Cl2:MnO2+4HClMn2++2Cl-+Cl2↑+2H2O
B.明矾溶于水产生Al(OH)3胶体:Al3++3H2OAl(OH)3↓+3H+
C.Na2O2溶于水产生O2:Na2O2+H2O2Na++2OH-+O2↑
D.Ca(HCO3)2溶液与少量NaOH溶液反应:HC+Ca2++OH-CaCO3↓+H2O
4.高铜酸钠(NaCuO2)是黑色难溶于水的固体,具有强氧化性,在中性或碱性环境下稳定。一种制备高铜酸钠的原理为2Cu+3NaClO+2NaOH2NaCuO2+3NaCl+H2O。下列说法错误的是 ( )
A.NaCuO2中铜的化合价为+3价
B.1 mol ClO-参加反应转移2 mol电子
C.反应中氧化产物和还原产物的物质的量之比为2∶3
D.氧化性:NaClO5.设NA为阿伏伽德罗常数的值,下列说法正确的是 ( )
A.在含4 mol Si—O的二氧化硅晶体中,氧原子的数目为4NA
B.1 L 1 mol·L-1 Na2SO4溶液中含有的氧原子数目为4NA
C.含4.6 g钠元素的Na2O2和Na2O的混合物中含有阴离子总数为0.3NA
D.由O与O组成的4.0 g物质中含中子数为2NA
6.实验需要950 mL 0.1 mol·L-1 NaCl溶液,下列有关配制过程操作正确的是 ( )
选项 实验 具体操作
A 选用仪器 选用950 mL容量瓶,检查是否漏液,并用蒸馏水洗净,可不烘干
B 称取溶质 用托盘天平精确称取5.85 g NaCl,右盘放砝码,左盘加NaCl
C 洗涤 用少量蒸馏水洗涤溶解NaCl的烧杯内壁,并将洗涤液注入容量瓶
D 定容 定容时眼睛平视刻度,用烧杯加蒸馏水至溶液凹液面与刻度线相切
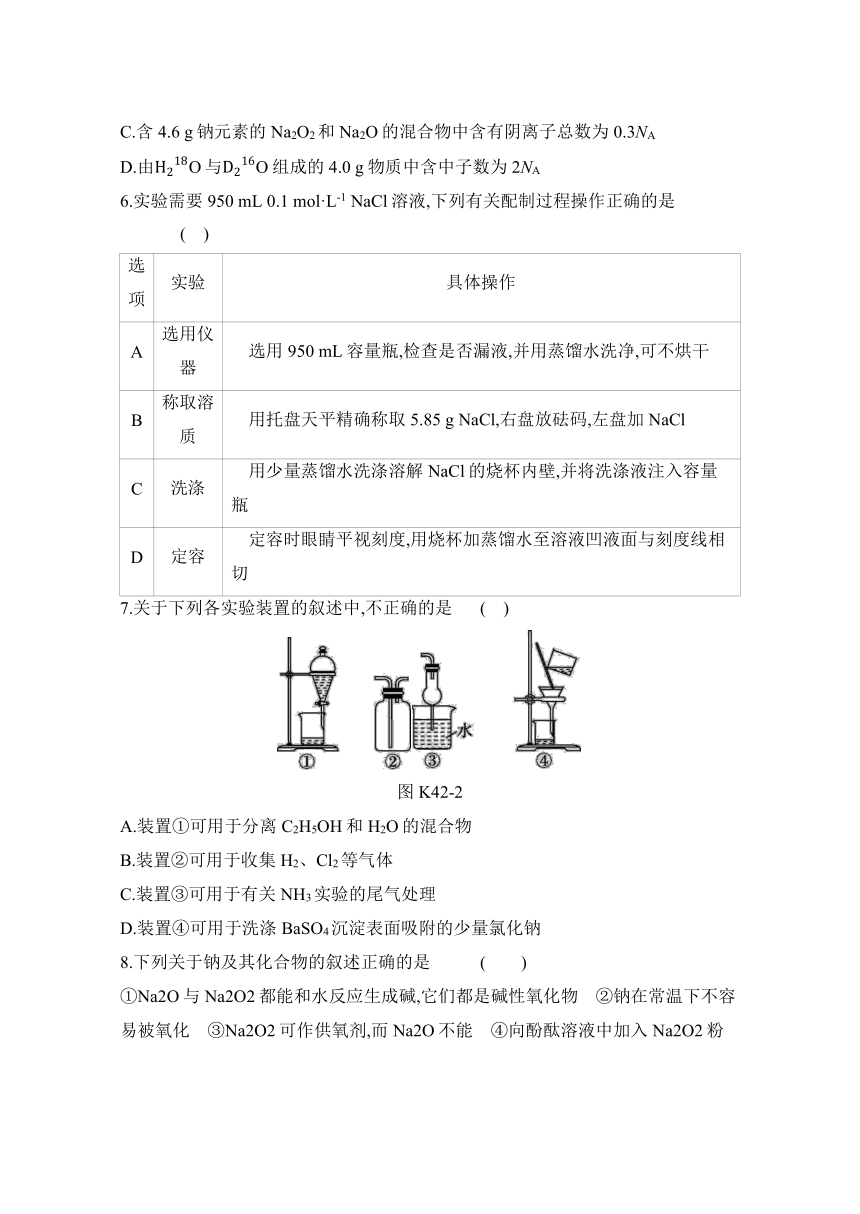
7.关于下列各实验装置的叙述中,不正确的是 ( )
图K42-2
A.装置①可用于分离C2H5OH和H2O的混合物
B.装置②可用于收集H2、Cl2等气体
C.装置③可用于有关NH3实验的尾气处理
D.装置④可用于洗涤BaSO4沉淀表面吸附的少量氯化钠
8.下列关于钠及其化合物的叙述正确的是 ( )
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物 ②钠在常温下不容易被氧化 ③Na2O2可作供氧剂,而Na2O不能 ④向酚酞溶液中加入Na2O2粉末,溶液先变红后褪色,并有气泡生成 ⑤钠与浓NH4Cl溶液反应,放出的气体中含有H2和NH3
A.①③⑤ B.②③④ C.④⑤ D.③④⑤
9.如图所示是某元素的“价—类”二维图,其中b是淡黄色固体,d是日常生活中常用的调味剂。下列说法中正确的是 ( )
A.实验室可用a检验乙醇中是否含有水
B.b与水反应,消耗1 mol b时,转移电子数为2NA(设NA为阿伏伽德罗常数的值)
C.实验室制备气体时,常用c溶液作尾气吸收剂,吸收Cl2、SO2等气体
D.工业上,采用电解饱和d溶液的方法冶炼单质a
10.如图为铁元素的“价—类”二维图,其中的箭头表示部分物质间的转化关系,下列说法正确的是 ( )
A.Fe(OH)2在空气中加热会分解成FeO
B.Fe(OH)2溶解于足量硝酸可生成Fe(NO3)2
C.维生素C能将Fe3+转化为Fe2+,该过程中维生素C作氧化剂
D.由图可预测:高铁酸盐(FeO_4^2 )具有强氧化性,消杀水中细菌时可生成Fe(OH)3胶体,进而可吸附水中的悬浮物
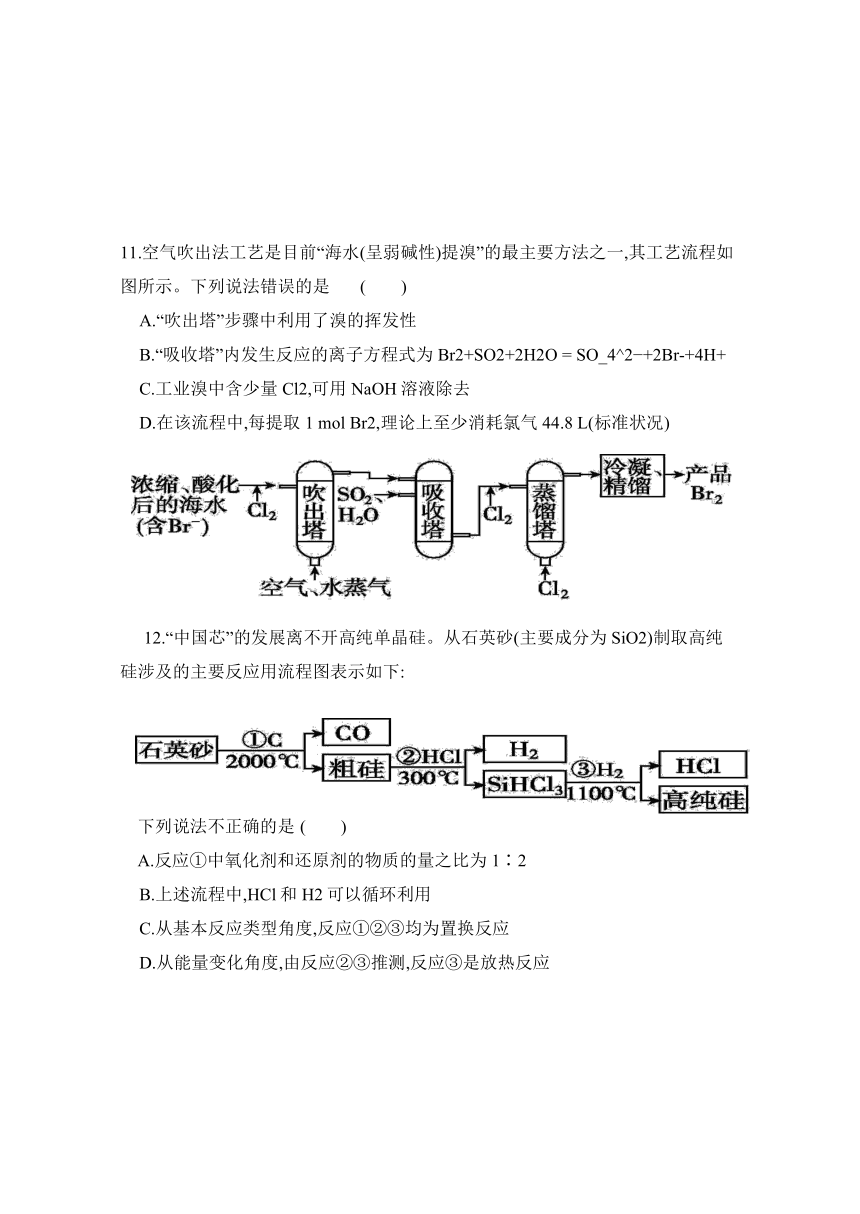
11.空气吹出法工艺是目前“海水(呈弱碱性)提溴”的最主要方法之一,其工艺流程如图所示。下列说法错误的是 ( )
A.“吹出塔”步骤中利用了溴的挥发性
B.“吸收塔”内发生反应的离子方程式为Br2+SO2+2H2O = SO_4^2 +2Br-+4H+
C.工业溴中含少量Cl2,可用NaOH溶液除去
D.在该流程中,每提取1 mol Br2,理论上至少消耗氯气44.8 L(标准状况)
12.“中国芯”的发展离不开高纯单晶硅。从石英砂(主要成分为SiO2)制取高纯硅涉及的主要反应用流程图表示如下:
下列说法不正确的是 ( )
A.反应①中氧化剂和还原剂的物质的量之比为1∶2
B.上述流程中,HCl和H2可以循环利用
C.从基本反应类型角度,反应①②③均为置换反应
D.从能量变化角度,由反应②③推测,反应③是放热反应
13.当汽车遭受一定碰撞力量以后,安全气囊中的物质会发生剧烈的反应:NaN3+KNO3 = K2O+Na2O+N2↑(未配平),生成大量气体。下列说法正确的是 ( )
A.半径大小:r(Na+)χ(O)
C.第一电离能大小:I1(Na)>I1(O) D.碱性强弱:KOH14.元素有多种化合价,可形成Cl-、ClO-、ClO_2 、ClO_3 、ClO_4 等离子。下列说法错误的是 ( )
A.基态Cl-核外电子的空间运动状态有9种
B.键角:ClO_2C.ClO-的中心原子是Cl,价层电子对数为4
D.ClO_3 的空间结构为三角锥形
15.铁是红细胞中血红蛋白的重要组成成分,缺铁时红细胞合成的血红蛋白量会减少,会使红细胞体积变小,携氧能力下降,形成缺铁性贫血,血红蛋白分子的结构如图所示。下列有关说法不正确的是 ( )
A.该结构中,氧元素的第一电离能最大
B.基态Fe2+的价层电子排布为3d6
C.咪唑环上所有原子均在同一平面上
D.O2通过配位键与Fe2+相连
二、填空题(每小题2分,共55分,19题(3)1分)
16.是重要的化工原料,由软锰矿(主要成分为,还含有少量和等杂质)和硫化锰(MnS)制备精的一种工艺流程如图:
已知相关金属离子[]形成氢氧化物沉淀的pH如下。
开始沉淀时 1.5 3.4 5.8 6.3
完全沉淀时 2.8 4.7 7.8 8.3
(1)“滤渣1”中含有未反应完全的矿粉、S和_____。
(2)“纯化”时加的作用是_______,假定溶液中,则加入氨水调节溶液pH的范围为_______。
(3)“沉锰”时生成,工业上不直接用溶液来沉锰的原因为_______。
(4)“热分解”后所得物质中还有少量MnO,需进一步进行氧化,“氧化”时生成的气体2为氯气,写出该过程中发生反应的化学方程式_______。
(5)操作x为_______。
(6)工业上还可用电解“纯化液”来制取,其阳极电极反应式为_______。电解后的废水中还含有少量,常用石灰乳进行一级沉降得到沉淀,过滤后再向滤液中加入适量进行二级沉降。已知,欲使溶液中,则应保持溶液中_______。
17.活性氧化锌能对太阳光线和其他大气物质形成防护,常用于敏感皮肤的面霜和化妆品。工业上用菱锌矿(主要成分为,还含有Ni、Cd、Fe、Cu等元素及少量不溶于成的杂质)制备,工艺流程图所示:
(1)为了提高“溶浸”效果,可采取的措施有________________________。(任写两条)
(2)“除铁”时,先加入溶液发生的离子方程式为________________,如果用代替,恰好完全反应时,理论上消耗________。
(3)常温下,“调”时,的浓度降到了,此时的溶度积常数的数值为________。
(4)“沉锌”时,在近中性条件下加入,可得碱式碳酸锌固体,同时产生大量的气体。该反应的离子方程式为________________________________________。
(5)用锌与铜制得的高纯铜锌合金滤料被广泛应用于各种水处理设备。一种铜锌合金的晶胞结构如图,已知:晶胞参数为。
①基态Zn原子价电子排布式为________________。
②与Cu原子等距离且最近的Cu原子有________个。
③该铜锌合金晶体密度为________(设为阿伏加德罗常数的值)。
18.硫代硫酸盐是一类具有应用前景的浸金试剂。硫代硫酸根可看作是中的一个O原子被S原子取代的产物。
(1)基态S原子价层电子排布式是__________。
(2)比较S原子和O原子的第一电离能大小,从原子结构的角度说明理由:_______。
(3)的空间结构是__________。
(4)同位素示踪实验可证实中两个S原子的化学环境不同,实验过程为。过程ⅱ中,断裂的只有硫硫键,若过程ⅰ所用试剂是和,过程ⅱ含硫产物是__________。
(5)的晶胞形状为长方体,边长分别为、,结构如图所示。
晶胞中的个数为__________。已知的摩尔质量是,阿伏加德罗常数为,该晶体的密度为__________。
(6)浸金时,作为配体可提供孤电子对与形成。分别判断中的中心S原子和端基S原子能否做配位原子并说明理由:_______。
19.a、b、c、d、e、f是原子序数依次增大的非0族元素,位于元素周期表的前四周期。a的一种核素无中子,b的s能级电子数与p能级的电子数之比为4:3,c与e同主族,未成对电子数为2,d在同周期元素中的原子半径最大,f在同周期元素中的未成对电子数最多。请回答下列问题:
(1)上述元素中,位于元素周期表p区的元素有______(填元素符号),其中基态c原子中电子占据的最高能级的原子轨道形状是______。
(2)基态e原子的核外电子排布式为_______,其核外有_______种不同空间运动状态的电子。
(3)b、c、d、e的简单离子半径由大到小的顺序为_______(用离子符号表示),b、c、e元素中,第一电离能最大的元素为______,原因为________。
(4)基态f原子的未成对电子数与成对电子数之比为,下列属于f原子激发态电子排布式的有_______(填标号)。
A. B. C. D.
参考答案
1-5 DADDD 6-10CADCD
11-15DDACA
16、1)
(2)将氧化为(或作氧化剂);
(3)碳酸钠溶液碱性强,会生成
(4)
(5)过滤、洗涤、干燥
(6);
17、答案::(1)搅拌、适当升高温度、适当增加、将矿石粉碎等
(2);1:3
(3)
(4)
(5)①;②8;③
18、答案:(1)
(2),氧原子半径小,原子核对最外层电子的吸引力大,不易失去一个电子
(3)四面体形
(4)和
(5)4;
(6)中的中心原子S的价层电子对数为4,无孤电子对,不能作配位原子;端基S原子含有孤电子对,能作配位原子
19.答案:(1)N、O、S;哑铃形
(2)或;9
(3);N;N原子2p轨道半充满、比相邻的O原子更稳定,更难失去电子;O、S同主族,S原子半径大于O原子,更易失去电子
(4)1:3;CD
高三年级化学学科第二次月考
班级: 姓名:
1..改善环境质量,推动绿色发展。下列做法中,不利于环境保护的是 ( )
A.使用可降解塑料,减少白色污染
B.利用风力发电,减少煤的燃烧
C.乘坐公共交通,绿色低碳出行
D.垃圾随意丢弃,直接排放污水
2.水溶液呈酸性的盐是 ( )
A.NH4Cl B.BaCl2 C.H2SO4 D.Ca(OH)2
3.下列表示对应化学反应的离子方程式正确的是 ( )
A.MnO2与浓盐酸反应制Cl2:MnO2+4HClMn2++2Cl-+Cl2↑+2H2O
B.明矾溶于水产生Al(OH)3胶体:Al3++3H2OAl(OH)3↓+3H+
C.Na2O2溶于水产生O2:Na2O2+H2O2Na++2OH-+O2↑
D.Ca(HCO3)2溶液与少量NaOH溶液反应:HC+Ca2++OH-CaCO3↓+H2O
4.高铜酸钠(NaCuO2)是黑色难溶于水的固体,具有强氧化性,在中性或碱性环境下稳定。一种制备高铜酸钠的原理为2Cu+3NaClO+2NaOH2NaCuO2+3NaCl+H2O。下列说法错误的是 ( )
A.NaCuO2中铜的化合价为+3价
B.1 mol ClO-参加反应转移2 mol电子
C.反应中氧化产物和还原产物的物质的量之比为2∶3
D.氧化性:NaClO
A.在含4 mol Si—O的二氧化硅晶体中,氧原子的数目为4NA
B.1 L 1 mol·L-1 Na2SO4溶液中含有的氧原子数目为4NA
C.含4.6 g钠元素的Na2O2和Na2O的混合物中含有阴离子总数为0.3NA
D.由O与O组成的4.0 g物质中含中子数为2NA
6.实验需要950 mL 0.1 mol·L-1 NaCl溶液,下列有关配制过程操作正确的是 ( )
选项 实验 具体操作
A 选用仪器 选用950 mL容量瓶,检查是否漏液,并用蒸馏水洗净,可不烘干
B 称取溶质 用托盘天平精确称取5.85 g NaCl,右盘放砝码,左盘加NaCl
C 洗涤 用少量蒸馏水洗涤溶解NaCl的烧杯内壁,并将洗涤液注入容量瓶
D 定容 定容时眼睛平视刻度,用烧杯加蒸馏水至溶液凹液面与刻度线相切
7.关于下列各实验装置的叙述中,不正确的是 ( )
图K42-2
A.装置①可用于分离C2H5OH和H2O的混合物
B.装置②可用于收集H2、Cl2等气体
C.装置③可用于有关NH3实验的尾气处理
D.装置④可用于洗涤BaSO4沉淀表面吸附的少量氯化钠
8.下列关于钠及其化合物的叙述正确的是 ( )
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物 ②钠在常温下不容易被氧化 ③Na2O2可作供氧剂,而Na2O不能 ④向酚酞溶液中加入Na2O2粉末,溶液先变红后褪色,并有气泡生成 ⑤钠与浓NH4Cl溶液反应,放出的气体中含有H2和NH3
A.①③⑤ B.②③④ C.④⑤ D.③④⑤
9.如图所示是某元素的“价—类”二维图,其中b是淡黄色固体,d是日常生活中常用的调味剂。下列说法中正确的是 ( )
A.实验室可用a检验乙醇中是否含有水
B.b与水反应,消耗1 mol b时,转移电子数为2NA(设NA为阿伏伽德罗常数的值)
C.实验室制备气体时,常用c溶液作尾气吸收剂,吸收Cl2、SO2等气体
D.工业上,采用电解饱和d溶液的方法冶炼单质a
10.如图为铁元素的“价—类”二维图,其中的箭头表示部分物质间的转化关系,下列说法正确的是 ( )
A.Fe(OH)2在空气中加热会分解成FeO
B.Fe(OH)2溶解于足量硝酸可生成Fe(NO3)2
C.维生素C能将Fe3+转化为Fe2+,该过程中维生素C作氧化剂
D.由图可预测:高铁酸盐(FeO_4^2 )具有强氧化性,消杀水中细菌时可生成Fe(OH)3胶体,进而可吸附水中的悬浮物
11.空气吹出法工艺是目前“海水(呈弱碱性)提溴”的最主要方法之一,其工艺流程如图所示。下列说法错误的是 ( )
A.“吹出塔”步骤中利用了溴的挥发性
B.“吸收塔”内发生反应的离子方程式为Br2+SO2+2H2O = SO_4^2 +2Br-+4H+
C.工业溴中含少量Cl2,可用NaOH溶液除去
D.在该流程中,每提取1 mol Br2,理论上至少消耗氯气44.8 L(标准状况)
12.“中国芯”的发展离不开高纯单晶硅。从石英砂(主要成分为SiO2)制取高纯硅涉及的主要反应用流程图表示如下:
下列说法不正确的是 ( )
A.反应①中氧化剂和还原剂的物质的量之比为1∶2
B.上述流程中,HCl和H2可以循环利用
C.从基本反应类型角度,反应①②③均为置换反应
D.从能量变化角度,由反应②③推测,反应③是放热反应
13.当汽车遭受一定碰撞力量以后,安全气囊中的物质会发生剧烈的反应:NaN3+KNO3 = K2O+Na2O+N2↑(未配平),生成大量气体。下列说法正确的是 ( )
A.半径大小:r(Na+)
C.第一电离能大小:I1(Na)>I1(O) D.碱性强弱:KOH
A.基态Cl-核外电子的空间运动状态有9种
B.键角:ClO_2
D.ClO_3 的空间结构为三角锥形
15.铁是红细胞中血红蛋白的重要组成成分,缺铁时红细胞合成的血红蛋白量会减少,会使红细胞体积变小,携氧能力下降,形成缺铁性贫血,血红蛋白分子的结构如图所示。下列有关说法不正确的是 ( )
A.该结构中,氧元素的第一电离能最大
B.基态Fe2+的价层电子排布为3d6
C.咪唑环上所有原子均在同一平面上
D.O2通过配位键与Fe2+相连
二、填空题(每小题2分,共55分,19题(3)1分)
16.是重要的化工原料,由软锰矿(主要成分为,还含有少量和等杂质)和硫化锰(MnS)制备精的一种工艺流程如图:
已知相关金属离子[]形成氢氧化物沉淀的pH如下。
开始沉淀时 1.5 3.4 5.8 6.3
完全沉淀时 2.8 4.7 7.8 8.3
(1)“滤渣1”中含有未反应完全的矿粉、S和_____。
(2)“纯化”时加的作用是_______,假定溶液中,则加入氨水调节溶液pH的范围为_______。
(3)“沉锰”时生成,工业上不直接用溶液来沉锰的原因为_______。
(4)“热分解”后所得物质中还有少量MnO,需进一步进行氧化,“氧化”时生成的气体2为氯气,写出该过程中发生反应的化学方程式_______。
(5)操作x为_______。
(6)工业上还可用电解“纯化液”来制取,其阳极电极反应式为_______。电解后的废水中还含有少量,常用石灰乳进行一级沉降得到沉淀,过滤后再向滤液中加入适量进行二级沉降。已知,欲使溶液中,则应保持溶液中_______。
17.活性氧化锌能对太阳光线和其他大气物质形成防护,常用于敏感皮肤的面霜和化妆品。工业上用菱锌矿(主要成分为,还含有Ni、Cd、Fe、Cu等元素及少量不溶于成的杂质)制备,工艺流程图所示:
(1)为了提高“溶浸”效果,可采取的措施有________________________。(任写两条)
(2)“除铁”时,先加入溶液发生的离子方程式为________________,如果用代替,恰好完全反应时,理论上消耗________。
(3)常温下,“调”时,的浓度降到了,此时的溶度积常数的数值为________。
(4)“沉锌”时,在近中性条件下加入,可得碱式碳酸锌固体,同时产生大量的气体。该反应的离子方程式为________________________________________。
(5)用锌与铜制得的高纯铜锌合金滤料被广泛应用于各种水处理设备。一种铜锌合金的晶胞结构如图,已知:晶胞参数为。
①基态Zn原子价电子排布式为________________。
②与Cu原子等距离且最近的Cu原子有________个。
③该铜锌合金晶体密度为________(设为阿伏加德罗常数的值)。
18.硫代硫酸盐是一类具有应用前景的浸金试剂。硫代硫酸根可看作是中的一个O原子被S原子取代的产物。
(1)基态S原子价层电子排布式是__________。
(2)比较S原子和O原子的第一电离能大小,从原子结构的角度说明理由:_______。
(3)的空间结构是__________。
(4)同位素示踪实验可证实中两个S原子的化学环境不同,实验过程为。过程ⅱ中,断裂的只有硫硫键,若过程ⅰ所用试剂是和,过程ⅱ含硫产物是__________。
(5)的晶胞形状为长方体,边长分别为、,结构如图所示。
晶胞中的个数为__________。已知的摩尔质量是,阿伏加德罗常数为,该晶体的密度为__________。
(6)浸金时,作为配体可提供孤电子对与形成。分别判断中的中心S原子和端基S原子能否做配位原子并说明理由:_______。
19.a、b、c、d、e、f是原子序数依次增大的非0族元素,位于元素周期表的前四周期。a的一种核素无中子,b的s能级电子数与p能级的电子数之比为4:3,c与e同主族,未成对电子数为2,d在同周期元素中的原子半径最大,f在同周期元素中的未成对电子数最多。请回答下列问题:
(1)上述元素中,位于元素周期表p区的元素有______(填元素符号),其中基态c原子中电子占据的最高能级的原子轨道形状是______。
(2)基态e原子的核外电子排布式为_______,其核外有_______种不同空间运动状态的电子。
(3)b、c、d、e的简单离子半径由大到小的顺序为_______(用离子符号表示),b、c、e元素中,第一电离能最大的元素为______,原因为________。
(4)基态f原子的未成对电子数与成对电子数之比为,下列属于f原子激发态电子排布式的有_______(填标号)。
A. B. C. D.
参考答案
1-5 DADDD 6-10CADCD
11-15DDACA
16、1)
(2)将氧化为(或作氧化剂);
(3)碳酸钠溶液碱性强,会生成
(4)
(5)过滤、洗涤、干燥
(6);
17、答案::(1)搅拌、适当升高温度、适当增加、将矿石粉碎等
(2);1:3
(3)
(4)
(5)①;②8;③
18、答案:(1)
(2),氧原子半径小,原子核对最外层电子的吸引力大,不易失去一个电子
(3)四面体形
(4)和
(5)4;
(6)中的中心原子S的价层电子对数为4,无孤电子对,不能作配位原子;端基S原子含有孤电子对,能作配位原子
19.答案:(1)N、O、S;哑铃形
(2)或;9
(3);N;N原子2p轨道半充满、比相邻的O原子更稳定,更难失去电子;O、S同主族,S原子半径大于O原子,更易失去电子
(4)1:3;CD
同课章节目录
