1.1.1 反应热 焓变 (共18张PPT)
文档属性
| 名称 | 1.1.1 反应热 焓变 (共18张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 811.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-26 15:18:30 | ||
图片预览






文档简介
(共18张PPT)
第一节 反应热
课时1 反应热 焓变
第一章 化学反应的热效应
目
录
Contents
关键能力
举题说法
关键能力
一、能力打底 概念辨析
判断下列说法的正误(正确的画“√”,错误的画“×”)。
(1) 所有化学反应都伴随着能量的变化。( )
(2) 需要加热才能发生的反应一定是吸热反应。( )
(3) 当反应放热时ΔH>0,反应吸热时ΔH<0。( )
(4) 断裂化学键放出能量,形成化学键吸收能量。( )
(5) 反应是吸热还是放热必须看反应物和生成物所具有总能量的相对大小。( )
(6) 断开反应物中旧化学键吸收的能量大于形成生成物中新化学键释放的能量,该反应的ΔH>0。( )
(7) 放出能量越多的反应,通常生成物越不稳定。( )
√
×
×
×
√
√
×
[解析] (2) 反应开始需加热的反应可能是吸热反应,也可能是放热反应,错误。(3) 当反应放热时ΔH<0,反应吸热时ΔH>0,错误。(4) 断裂化学键吸收能量,生成化学键放出能量,错误。(7) 化学反应放出的能量越多,生成物能量越低,物质的能量越低越稳定。
二、吸热反应和放热反应
1. 放热反应:大多数________反应、________反应、金属与__________的反应、所有的燃烧反应、铝热反应、物质的缓慢氧化等。
2. 吸热反应:大多数________反应、盐的水解反应、反应条件需不断持续加热的反应、Ba(OH)2·8H2O与NH4Cl反应、C与H2O(g)反应、C与CO2反应等。
三、反应热与焓变
1. 反应热:在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
化合
中和
酸或水
分解
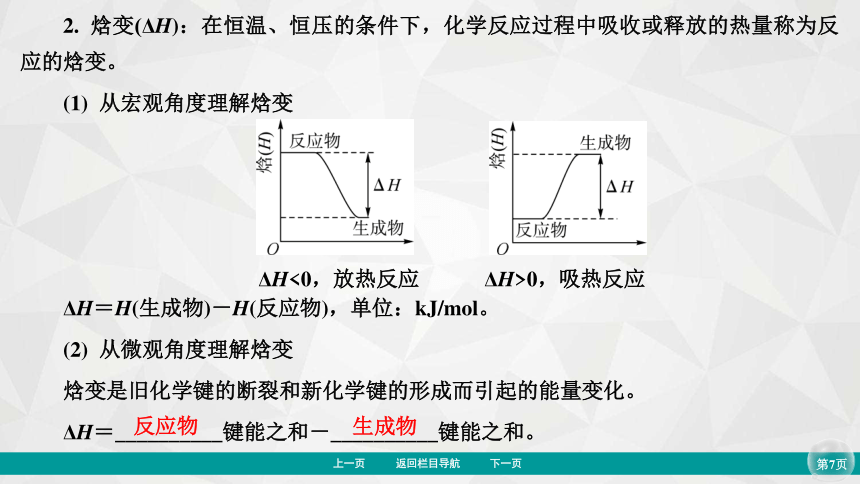
2. 焓变(ΔH):在恒温、恒压的条件下,化学反应过程中吸收或释放的热量称为反应的焓变。
(1) 从宏观角度理解焓变
ΔH=H(生成物)-H(反应物),单位:kJ/mol。
(2) 从微观角度理解焓变
焓变是旧化学键的断裂和新化学键的形成而引起的能量变化。
ΔH=__________键能之和-__________键能之和。
反应物
生成物
四、中和反应反应热的测定
1. 测定装置:
2. 实验步骤:
3. 注意事项:
(1) 在25 ℃和101 kPa下,强酸稀溶液和强碱稀溶液发生中和反应生成1 mol H2O(l) 时,均放出57.3 kJ的热量。
(2) 若是弱酸(或弱碱)发生中和反应,生成1 mol H2O(l)时所放出的热量会比 57.3 kJ少,原因是弱酸(或弱碱)分子电离成离子时需要吸收热量。
(3) 若是浓硫酸与强碱反应,生成1 mol H2O(l)时所放出的热量会比57.3 kJ多,原因是浓硫酸稀释放热。
举题说法
1
类型1 放热反应与吸热反应的判断
下列物质间的反应,其能量变化符合右图的是( )
A
A.合成氨反应
B.碳与水蒸气高温制水煤气
C.Ba(OH)2·8H2O晶体和NH4Cl晶体混合
D.碳酸钙的分解
[解析] 该图示为放热反应能量图,合成氨是放热反应;制水煤气是吸热反应;Ba(OH)2·8H2O晶体和NH4Cl晶体混合是吸热反应;碳酸钙分解是吸热反应。
2
类型2 反应热与能量图
关于图示,下列说法中正确的是( )
C
A.断开非极性键和生成极性键的能量相同
B.反应Ⅱ比反应Ⅲ生成的 O-H 键更牢固
3
类型3 反应热与化学键
(1) (2024·苏州中学)用CO2生产燃料甲醇的反应原理为CO2(g)+3H2(g)=== CH3OH(g)+H2O(g),已知某些化学键的键能数据如下表所示。则该反应的ΔH为( )
C
化学键 C—H H—H C—O C===O H—O
键能/(kJ/mol) 413.4 436.0 351.0 745.0 462.8
A.-46.2 kJ/mol B.+46.2 kJ/mol
C.-181.6 kJ/mol D.+181.6 kJ/mol
(2)(2024·扬州期中)已知共价键的键能与热化学方程式信息如下表:
共价键 H—H H—O
键能/(kJ/mol) 436 463
热化学方程式 2H2(g)+O2(g)===2H2O(g) ΔH=-482 kJ/mol 则2O(g)===O2(g)的ΔH为( )
A.428 kJ/mol B.-428 kJ/mol
C.498 kJ/mol D.-498 kJ/mol
D
[解析] (1) ΔH=反应物键能总和-生成物键能总和=(2×745.0+3×436.0-3×413.4-351.0-462.8-2×462.8)kJ/mol=-181.6 kJ/mol。(2) ΔH=反应物的键能总和-生成物的键能总和=2E(H—H)+E(O=O)-4E(H—O),-482 kJ/mol=2× 436 kJ/mol+E(O===O)-4×463 kJ/mol,解得O===O的键能为498 kJ/mol,2个氧原子结合生成氧气的过程需要释放能量,因此2O(g)===O2(g)的ΔH=-498 kJ/mol。
4
类型4 中和反应反应热的测定
某研究小组将V1 mL 0.50 mol/L稀硫酸和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验装置和实验结果如下页图所示(实验中始终保持 V1+V2=50)。回答下列问题:
(1) 如图所示实验装置中有一个明显的错误:__________________。
(2) 为了减少实验误差,实验过程中将NaOH溶液________(填“一次”或“分多次”)倒入盛有稀硫酸的小烧杯中。溶液混合后,准确读取混合溶液的____________,记为终止温度。
(3) 研究小组做该实验时环境温度________(填“高于”“低于”或“等于”) 22 ℃,判断的依据是________________________________________________________________ ____________________________________________________________________。
(4) V1∶V2=________时,酸与碱恰好完全中和,此反应所用NaOH溶液的浓度应为__________mol/L。
缺少玻璃搅拌器
一次
最高温度
低于
从图像起点可知,5 mL硫酸溶液和45 mL NaOH溶液反应放热后的温度已经是22 ℃,则溶液混合前的实验环境温度一定低于22 ℃
3∶2
1.5
[解析] (4) 当温度最高时,酸与碱恰好完全中和,由图知28 ℃时酸碱恰好完全反应,此时消耗硫酸溶液的体积为30 mL,消耗NaOH溶液的体积为50 mL-30 mL= 20 mL,V1∶V2=3∶2。2n(H2SO4)=n(NaOH),2×0.5 mol/L×30 mL=c(NaOH)× 20 mL,c(NaOH)=1.5 mol/L。
第一节 反应热
课时1 反应热 焓变
第一章 化学反应的热效应
目
录
Contents
关键能力
举题说法
关键能力
一、能力打底 概念辨析
判断下列说法的正误(正确的画“√”,错误的画“×”)。
(1) 所有化学反应都伴随着能量的变化。( )
(2) 需要加热才能发生的反应一定是吸热反应。( )
(3) 当反应放热时ΔH>0,反应吸热时ΔH<0。( )
(4) 断裂化学键放出能量,形成化学键吸收能量。( )
(5) 反应是吸热还是放热必须看反应物和生成物所具有总能量的相对大小。( )
(6) 断开反应物中旧化学键吸收的能量大于形成生成物中新化学键释放的能量,该反应的ΔH>0。( )
(7) 放出能量越多的反应,通常生成物越不稳定。( )
√
×
×
×
√
√
×
[解析] (2) 反应开始需加热的反应可能是吸热反应,也可能是放热反应,错误。(3) 当反应放热时ΔH<0,反应吸热时ΔH>0,错误。(4) 断裂化学键吸收能量,生成化学键放出能量,错误。(7) 化学反应放出的能量越多,生成物能量越低,物质的能量越低越稳定。
二、吸热反应和放热反应
1. 放热反应:大多数________反应、________反应、金属与__________的反应、所有的燃烧反应、铝热反应、物质的缓慢氧化等。
2. 吸热反应:大多数________反应、盐的水解反应、反应条件需不断持续加热的反应、Ba(OH)2·8H2O与NH4Cl反应、C与H2O(g)反应、C与CO2反应等。
三、反应热与焓变
1. 反应热:在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
化合
中和
酸或水
分解
2. 焓变(ΔH):在恒温、恒压的条件下,化学反应过程中吸收或释放的热量称为反应的焓变。
(1) 从宏观角度理解焓变
ΔH=H(生成物)-H(反应物),单位:kJ/mol。
(2) 从微观角度理解焓变
焓变是旧化学键的断裂和新化学键的形成而引起的能量变化。
ΔH=__________键能之和-__________键能之和。
反应物
生成物
四、中和反应反应热的测定
1. 测定装置:
2. 实验步骤:
3. 注意事项:
(1) 在25 ℃和101 kPa下,强酸稀溶液和强碱稀溶液发生中和反应生成1 mol H2O(l) 时,均放出57.3 kJ的热量。
(2) 若是弱酸(或弱碱)发生中和反应,生成1 mol H2O(l)时所放出的热量会比 57.3 kJ少,原因是弱酸(或弱碱)分子电离成离子时需要吸收热量。
(3) 若是浓硫酸与强碱反应,生成1 mol H2O(l)时所放出的热量会比57.3 kJ多,原因是浓硫酸稀释放热。
举题说法
1
类型1 放热反应与吸热反应的判断
下列物质间的反应,其能量变化符合右图的是( )
A
A.合成氨反应
B.碳与水蒸气高温制水煤气
C.Ba(OH)2·8H2O晶体和NH4Cl晶体混合
D.碳酸钙的分解
[解析] 该图示为放热反应能量图,合成氨是放热反应;制水煤气是吸热反应;Ba(OH)2·8H2O晶体和NH4Cl晶体混合是吸热反应;碳酸钙分解是吸热反应。
2
类型2 反应热与能量图
关于图示,下列说法中正确的是( )
C
A.断开非极性键和生成极性键的能量相同
B.反应Ⅱ比反应Ⅲ生成的 O-H 键更牢固
3
类型3 反应热与化学键
(1) (2024·苏州中学)用CO2生产燃料甲醇的反应原理为CO2(g)+3H2(g)=== CH3OH(g)+H2O(g),已知某些化学键的键能数据如下表所示。则该反应的ΔH为( )
C
化学键 C—H H—H C—O C===O H—O
键能/(kJ/mol) 413.4 436.0 351.0 745.0 462.8
A.-46.2 kJ/mol B.+46.2 kJ/mol
C.-181.6 kJ/mol D.+181.6 kJ/mol
(2)(2024·扬州期中)已知共价键的键能与热化学方程式信息如下表:
共价键 H—H H—O
键能/(kJ/mol) 436 463
热化学方程式 2H2(g)+O2(g)===2H2O(g) ΔH=-482 kJ/mol 则2O(g)===O2(g)的ΔH为( )
A.428 kJ/mol B.-428 kJ/mol
C.498 kJ/mol D.-498 kJ/mol
D
[解析] (1) ΔH=反应物键能总和-生成物键能总和=(2×745.0+3×436.0-3×413.4-351.0-462.8-2×462.8)kJ/mol=-181.6 kJ/mol。(2) ΔH=反应物的键能总和-生成物的键能总和=2E(H—H)+E(O=O)-4E(H—O),-482 kJ/mol=2× 436 kJ/mol+E(O===O)-4×463 kJ/mol,解得O===O的键能为498 kJ/mol,2个氧原子结合生成氧气的过程需要释放能量,因此2O(g)===O2(g)的ΔH=-498 kJ/mol。
4
类型4 中和反应反应热的测定
某研究小组将V1 mL 0.50 mol/L稀硫酸和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验装置和实验结果如下页图所示(实验中始终保持 V1+V2=50)。回答下列问题:
(1) 如图所示实验装置中有一个明显的错误:__________________。
(2) 为了减少实验误差,实验过程中将NaOH溶液________(填“一次”或“分多次”)倒入盛有稀硫酸的小烧杯中。溶液混合后,准确读取混合溶液的____________,记为终止温度。
(3) 研究小组做该实验时环境温度________(填“高于”“低于”或“等于”) 22 ℃,判断的依据是________________________________________________________________ ____________________________________________________________________。
(4) V1∶V2=________时,酸与碱恰好完全中和,此反应所用NaOH溶液的浓度应为__________mol/L。
缺少玻璃搅拌器
一次
最高温度
低于
从图像起点可知,5 mL硫酸溶液和45 mL NaOH溶液反应放热后的温度已经是22 ℃,则溶液混合前的实验环境温度一定低于22 ℃
3∶2
1.5
[解析] (4) 当温度最高时,酸与碱恰好完全中和,由图知28 ℃时酸碱恰好完全反应,此时消耗硫酸溶液的体积为30 mL,消耗NaOH溶液的体积为50 mL-30 mL= 20 mL,V1∶V2=3∶2。2n(H2SO4)=n(NaOH),2×0.5 mol/L×30 mL=c(NaOH)× 20 mL,c(NaOH)=1.5 mol/L。
