2.1.3 活化能 (共16张PPT)
文档属性
| 名称 | 2.1.3 活化能 (共16张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-26 15:52:10 | ||
图片预览






文档简介
(共16张PPT)
高中化学
人教版 选择性必修1
第一节 化学反应速率
课时7 活化能
第二章 化学反应速率与化学平衡
目
录
Contents
关键能力
举题说法
关键能力
一、能力打底 概念辨析
判断下列说法的正误(正确的画“√”,错误的画“×”)。
(1)能够发生化学反应的碰撞叫有效碰撞。( )
(2)活化能越大,反应速率越大。( )
(3)增大浓度可使活化分子百分数增多,化学反应速率增大。( )
(4)增大压强可使单位体积的活化分子数增加,化学反应速率增大。( )
(5)催化剂可降低反应的活化能和焓变,化学反应速率增大。( )
(6)升高温度,活化分子数和活化分子百分数均增加,化学反应速率增大。( )
√
×
×
√
×
√
二、基元反应
一步直接转化为产物
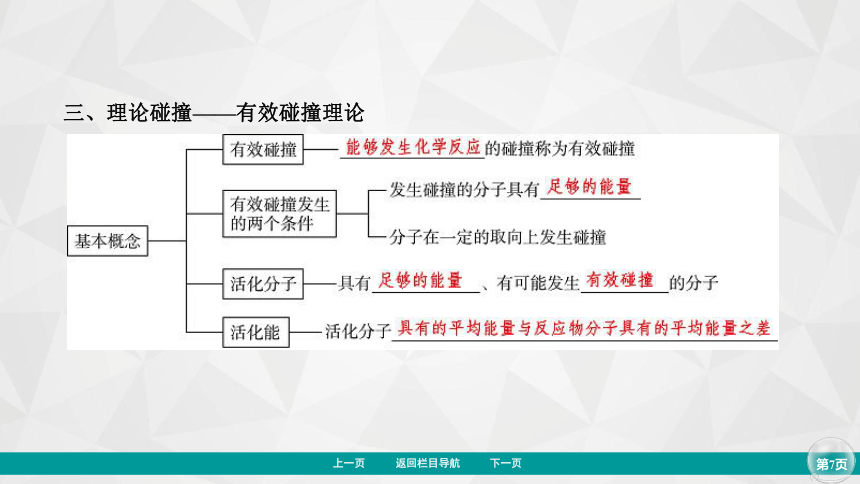
三、理论碰撞——有效碰撞理论
1. 活化分子、活化能、有效碰撞
(1)活化分子:具有足够的能量、能够发生有效碰撞的分子。
(2)活化能:如图
有催化剂参与的反应,活化能较______,反应速率较______。但是催化剂不改变反应的________。图中,E为__________________,E+ΔH为__________________。催化反应①对应的活化能是________,催化反应②对应的逆反应的活化能是____________。决定O3分解反应速率的是催化反应_____(填“①”或“②”)。
(3)有效碰撞:活化分子之间能够发生化学反应的碰撞。
小
大
焓变
正反应的活化能
逆反应的活化能
E1
E2+ΔH
②
2. 活化分子、有效碰撞与反应速率的关系
举题说法
1
下列说法正确的是( )
A.增大压强,活化分子百分数增加,化学反应速率一定增大
B. 升高温度,单位体积内分子总数不变,但活化分子数增加了
C. 分子间所有的碰撞都为有效碰撞
D. 加入反应物,活化分子百分数增加,化学反应速率增大
[解析] 压强对反应速率的影响只能适用于气体体系,且增大压强,活化分子百分数不变,A错误;升高温度,活化分子百分数增加,化学反应速率一定增大,B正确;活化分子间所发生的碰撞,只有能发生化学反应的碰撞才是有效碰撞,C错误;加入反应物,活化分子百分数不变,但是单位体积内活化分子数增加,化学反应速率增大,且改变固体的质量反应速率不变,D错误。
B
2
(2024·泰州中学)在气体反应中,能使反应物活化分子百分数增大的方法是( )
①增大反应物的浓度 ②增大压强 ③升高温度 ④移去生成物 ⑤加入催化剂
A.①③④ B. ③⑤
C. ②③⑤ D. ①②⑤
[解析] 增大反应物的浓度,单位体积内活化分子数增加,但活化分子百分数不变,①错误;增大压强相当于增大反应物浓度,活化分子百分数不变,②错误;升高温度,单位体积内分子数目不变,活化分子百分数增大,③正确;移去生成物,生成物的浓度减小,活化分子数减小,④错误;加入催化剂,降低反应的活化能,活化分子数目增加,则活化分子百分数增大,⑤正确。故选B。
B
3
对于反应2N2O5(g)―→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第二步 NO2+NO3―→NO+NO2+O2 慢反应
第三步 NO+NO3―→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是( )
A.v(第一步的逆反应)B. 反应的中间产物只有NO3
C. 第二步中NO2与NO3的碰撞仅部分有效
D. 第三步反应的活化能较高
C
[解析] 第一步反应快速平衡,说明正、逆反应的反应速率很大,极短时间内即可达到平衡,A错误;由题给三步反应可知,反应的中间产物有NO3和NO,B错误;第二步反应慢,说明有效碰撞次数少,C正确;反应快,说明反应的活化能较低,D错误。
高中化学
人教版 选择性必修1
第一节 化学反应速率
课时7 活化能
第二章 化学反应速率与化学平衡
目
录
Contents
关键能力
举题说法
关键能力
一、能力打底 概念辨析
判断下列说法的正误(正确的画“√”,错误的画“×”)。
(1)能够发生化学反应的碰撞叫有效碰撞。( )
(2)活化能越大,反应速率越大。( )
(3)增大浓度可使活化分子百分数增多,化学反应速率增大。( )
(4)增大压强可使单位体积的活化分子数增加,化学反应速率增大。( )
(5)催化剂可降低反应的活化能和焓变,化学反应速率增大。( )
(6)升高温度,活化分子数和活化分子百分数均增加,化学反应速率增大。( )
√
×
×
√
×
√
二、基元反应
一步直接转化为产物
三、理论碰撞——有效碰撞理论
1. 活化分子、活化能、有效碰撞
(1)活化分子:具有足够的能量、能够发生有效碰撞的分子。
(2)活化能:如图
有催化剂参与的反应,活化能较______,反应速率较______。但是催化剂不改变反应的________。图中,E为__________________,E+ΔH为__________________。催化反应①对应的活化能是________,催化反应②对应的逆反应的活化能是____________。决定O3分解反应速率的是催化反应_____(填“①”或“②”)。
(3)有效碰撞:活化分子之间能够发生化学反应的碰撞。
小
大
焓变
正反应的活化能
逆反应的活化能
E1
E2+ΔH
②
2. 活化分子、有效碰撞与反应速率的关系
举题说法
1
下列说法正确的是( )
A.增大压强,活化分子百分数增加,化学反应速率一定增大
B. 升高温度,单位体积内分子总数不变,但活化分子数增加了
C. 分子间所有的碰撞都为有效碰撞
D. 加入反应物,活化分子百分数增加,化学反应速率增大
[解析] 压强对反应速率的影响只能适用于气体体系,且增大压强,活化分子百分数不变,A错误;升高温度,活化分子百分数增加,化学反应速率一定增大,B正确;活化分子间所发生的碰撞,只有能发生化学反应的碰撞才是有效碰撞,C错误;加入反应物,活化分子百分数不变,但是单位体积内活化分子数增加,化学反应速率增大,且改变固体的质量反应速率不变,D错误。
B
2
(2024·泰州中学)在气体反应中,能使反应物活化分子百分数增大的方法是( )
①增大反应物的浓度 ②增大压强 ③升高温度 ④移去生成物 ⑤加入催化剂
A.①③④ B. ③⑤
C. ②③⑤ D. ①②⑤
[解析] 增大反应物的浓度,单位体积内活化分子数增加,但活化分子百分数不变,①错误;增大压强相当于增大反应物浓度,活化分子百分数不变,②错误;升高温度,单位体积内分子数目不变,活化分子百分数增大,③正确;移去生成物,生成物的浓度减小,活化分子数减小,④错误;加入催化剂,降低反应的活化能,活化分子数目增加,则活化分子百分数增大,⑤正确。故选B。
B
3
对于反应2N2O5(g)―→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第二步 NO2+NO3―→NO+NO2+O2 慢反应
第三步 NO+NO3―→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是( )
A.v(第一步的逆反应)
C. 第二步中NO2与NO3的碰撞仅部分有效
D. 第三步反应的活化能较高
C
[解析] 第一步反应快速平衡,说明正、逆反应的反应速率很大,极短时间内即可达到平衡,A错误;由题给三步反应可知,反应的中间产物有NO3和NO,B错误;第二步反应慢,说明有效碰撞次数少,C正确;反应快,说明反应的活化能较低,D错误。
