6.3 金属矿物与金属冶炼课件(共33张PPT内嵌视频)--科粤版(2024)九年级化学下册
文档属性
| 名称 | 6.3 金属矿物与金属冶炼课件(共33张PPT内嵌视频)--科粤版(2024)九年级化学下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 25.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-27 21:35:25 | ||
图片预览









文档简介
(共33张PPT)
第六单元 金属和金属材料
金属矿物与金属冶炼 第3课时
(科粤版)九年级
下
01
教学目标
内容总览
02
新知导入
03
探究新知
04
课堂练习
05
课堂总结
06
板书设计
教学目标
知道元素有两种存在形态,认识几种金属矿物。
01
02
了解钢铁是怎样炼成的,了解生铁和钢的区别和主要性能。
03
认识还原反应及物质的还原性。
新知导入
金属是从何而来的呢?
探究新知
单质
稳定性
化合物
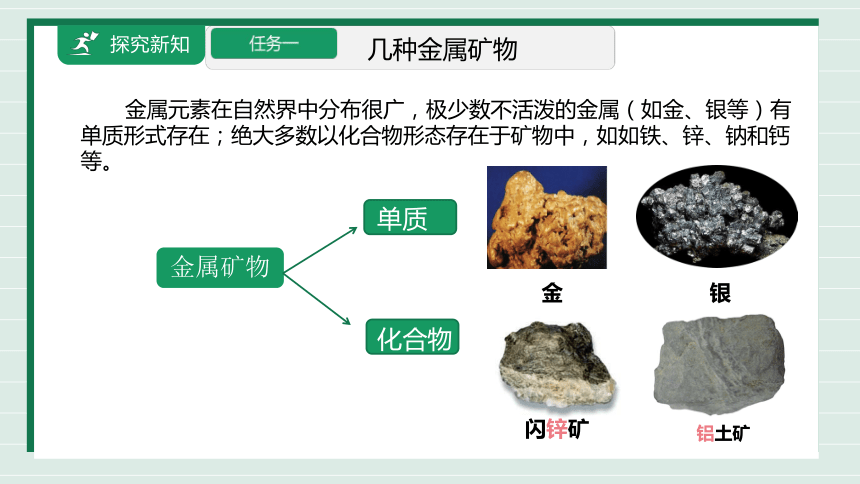
金属矿物
金属元素在自然界中分布很广,极少数不活泼的金属(如金、银等)有单质形式存在;绝大多数以化合物形态存在于矿物中,如如铁、锌、钠和钙等。
几种金属矿物
金 银
闪锌矿
铝土矿
探究新知
地壳中,铝和铁的含量最多。
探究新知
黄铁矿(FeS2 )
磁铁矿(Fe3O4)
菱铁矿(FeCO3 )
赤铁矿(Fe2O3)
含有矿物的岩石称为矿石。铁矿石等都是常见的矿石。
探究新知
黄铜矿 CuFeS2
辉铜矿 Cu2S
赤铜矿 (Cu2O)
孔雀石Cu(OH)2CO3
铜
矿
石
金属的冶炼实质就是把金属从矿石中还原出来的过程。
探究新知
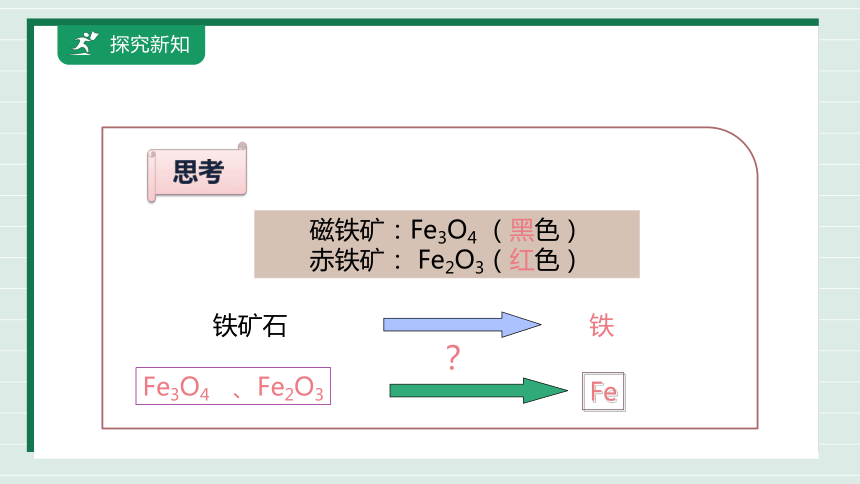
思考
磁铁矿:Fe3O4 (黑色)
赤铁矿: Fe2O3(红色)
铁矿石
铁
Fe
Fe3O4 、Fe2O3
?
探究新知
钢铁的冶炼
任务二
实验探究
利用如图装置,进行氧化铁与一氧化碳反应生成铁的实验。
探究新知
探究新知
现象:红棕色的Fe2O3变黑,同时产生使石灰
水变浑浊的气体。
基本原理:
氧化反应:得到氧的反应
还原反应:失去氧的反应
Fe2O3+3CO == 2Fe+3CO2
高温
探究新知
炼铁的基本原理:
用还原剂一氧化碳在高温条件下将氧化铁中的铁还原出来
还原反应:含氧化合物失去氧的反应
还原剂:能夺取含氧化合物里的氧,
使它发生还原反应的物质具有还原性
方程式:_________________
Fe2O3+3CO=2Fe+3CO2
高温
探究新知
具有还原性的物质: CO
练习:请写出H2和C还原Fe2O3的化学方程式
高温
3H2+Fe2O3 = 2Fe+3H2O
3C+2Fe2O3 = 4Fe+3CO2
高温
探究新知
H2和C还原CuO实验装置图比较
探究新知
探究新知
H2、C、CO化学性质的比较
性 质 物质 可燃性 还原性
C C + O2 CO2 2C + O2 2CO
C + 2CuO 2Cu+CO2
CO 2CO + O2 2CO2
CO + CuO Cu + CO2
H2 2H2 + O2 2H2O H2 + CuO Cu + H2O
点燃
点燃
点燃
点燃
高温
探究新知
铁的冶炼
1.炼铁
焦炭
过量空气
CO2
焦炭
CO
高温
高温
Fe
赤铁矿
高温
反应过程:
设备:高炉
原料:铁矿石(赤铁矿)、焦炭、石灰石、空气
探究新知
涉及反应化学方程式:
C + CO2 == 2CO
高温
C + O2 == CO2
点燃
3CO + Fe2O3 == 2Fe + 3CO2
高温
产品:生铁(含碳量2~4.3%)、钢(含碳量0.03~2%),二者都是合金。
探究新知
2.炼钢:
生铁
氧气
钢
高温
(含碳量2-4.3%)
(含碳量0.03-2%)
合金
探究新知
生铁和钢的区别
类别 含碳量% 含杂质 机械性能 机械加工
生铁 2~4.3 多 硬而脆 可铸不可锻
钢 0.03~2 少 硬而韧、有弹性 可铸可锻
探究新知
中国古代冶炼图
探究新知
冶炼金属的常用方法
1.活泼金属(如K Na Mg AI) :电解法
2.一般金属(如Zn Fe Sn Pb Cu) :热还原法
3.较稳定金属(如Hg Ag) :直接加热法
4.稳定金属(如Pt Au) :可通过金沙淘洗获得
Fe2O3+3CO=2Fe+3CO2
高温
△
2HgO === 2Hg + O2↑
探究新知
金属活动性顺序:
K Ca Na Mg Al ‖Zn Fe Sn Pb (H)Cu‖Hg Ag‖Pt Au
电解法
热还原法
直接加热法
探究新知
例题
探究新知
黑色
浑浊
通一氧化碳
加热
一氧化碳与空气混合加热引起爆炸
撤掉酒精灯
通一氧化碳至玻璃管冷却
氧气进入将铁再次氧化
点燃
收集
探究新知
铁矿石
焦炭
CO2
2CO
3
2Fe+3CO2
提供热量
产生还原剂CO
探究新知
例题
例:1000吨含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁多少吨?
解析:带入化学方程式计算的数据应是纯净物的质量。根据赤铁矿石的质量可以算出氧化铁的质量,从而求出铁的质量。即可解出含铁96%生铁的质量:1000 t×80% × 70% ÷96%=583.3 t
探究新知
1.某炼钢厂日产含杂质5%的生铁3000t,试计算:
⑴该3000 t生铁中含纯铁多少吨?
⑵该炼钢厂每天需含Fe2O3质量分数为85%的赤铁矿石多少吨?
(计算结果保留整数)
练习
解:⑴生铁中含纯铁:3000t×(1-5%)=2850t.
Fe2O3 + 3CO=== 2Fe + 3CO2
112
X· 85% 2850t
高温
160
X· 85%
=
112
2850t
⑵设需含Fe2O3质量分数为85%的赤铁矿石的质量为x。
X≈4790t
答:⑴该3000 t生铁中含纯铁2850t。
⑵该炼钢厂每天需含Fe2O3质量分数为85%的赤铁矿石为4790t。
课堂总结
小结
1.有少数很不活泼的金属如金、银、铂,有以单质形态存在的矿物,绝大多数金属都是以化合物形态存在于矿物之中。
2.还原反应,还原性。
3.炼铁、炼钢。
4.冶炼金属的常用方法。
板书设计
金属矿物与金属冶炼
几种金属矿物
铁的冶炼
含杂质物质的化学方程式的计算
一氧化碳还原氧化铁
高炉炼铁
(还原反应)
32
https://www.21cnjy.com/help/help_extract.php
让备课更有效
www.21cnjy.com
Thanks!
第六单元 金属和金属材料
金属矿物与金属冶炼 第3课时
(科粤版)九年级
下
01
教学目标
内容总览
02
新知导入
03
探究新知
04
课堂练习
05
课堂总结
06
板书设计
教学目标
知道元素有两种存在形态,认识几种金属矿物。
01
02
了解钢铁是怎样炼成的,了解生铁和钢的区别和主要性能。
03
认识还原反应及物质的还原性。
新知导入
金属是从何而来的呢?
探究新知
单质
稳定性
化合物
金属矿物
金属元素在自然界中分布很广,极少数不活泼的金属(如金、银等)有单质形式存在;绝大多数以化合物形态存在于矿物中,如如铁、锌、钠和钙等。
几种金属矿物
金 银
闪锌矿
铝土矿
探究新知
地壳中,铝和铁的含量最多。
探究新知
黄铁矿(FeS2 )
磁铁矿(Fe3O4)
菱铁矿(FeCO3 )
赤铁矿(Fe2O3)
含有矿物的岩石称为矿石。铁矿石等都是常见的矿石。
探究新知
黄铜矿 CuFeS2
辉铜矿 Cu2S
赤铜矿 (Cu2O)
孔雀石Cu(OH)2CO3
铜
矿
石
金属的冶炼实质就是把金属从矿石中还原出来的过程。
探究新知
思考
磁铁矿:Fe3O4 (黑色)
赤铁矿: Fe2O3(红色)
铁矿石
铁
Fe
Fe3O4 、Fe2O3
?
探究新知
钢铁的冶炼
任务二
实验探究
利用如图装置,进行氧化铁与一氧化碳反应生成铁的实验。
探究新知
探究新知
现象:红棕色的Fe2O3变黑,同时产生使石灰
水变浑浊的气体。
基本原理:
氧化反应:得到氧的反应
还原反应:失去氧的反应
Fe2O3+3CO == 2Fe+3CO2
高温
探究新知
炼铁的基本原理:
用还原剂一氧化碳在高温条件下将氧化铁中的铁还原出来
还原反应:含氧化合物失去氧的反应
还原剂:能夺取含氧化合物里的氧,
使它发生还原反应的物质具有还原性
方程式:_________________
Fe2O3+3CO=2Fe+3CO2
高温
探究新知
具有还原性的物质: CO
练习:请写出H2和C还原Fe2O3的化学方程式
高温
3H2+Fe2O3 = 2Fe+3H2O
3C+2Fe2O3 = 4Fe+3CO2
高温
探究新知
H2和C还原CuO实验装置图比较
探究新知
探究新知
H2、C、CO化学性质的比较
性 质 物质 可燃性 还原性
C C + O2 CO2 2C + O2 2CO
C + 2CuO 2Cu+CO2
CO 2CO + O2 2CO2
CO + CuO Cu + CO2
H2 2H2 + O2 2H2O H2 + CuO Cu + H2O
点燃
点燃
点燃
点燃
高温
探究新知
铁的冶炼
1.炼铁
焦炭
过量空气
CO2
焦炭
CO
高温
高温
Fe
赤铁矿
高温
反应过程:
设备:高炉
原料:铁矿石(赤铁矿)、焦炭、石灰石、空气
探究新知
涉及反应化学方程式:
C + CO2 == 2CO
高温
C + O2 == CO2
点燃
3CO + Fe2O3 == 2Fe + 3CO2
高温
产品:生铁(含碳量2~4.3%)、钢(含碳量0.03~2%),二者都是合金。
探究新知
2.炼钢:
生铁
氧气
钢
高温
(含碳量2-4.3%)
(含碳量0.03-2%)
合金
探究新知
生铁和钢的区别
类别 含碳量% 含杂质 机械性能 机械加工
生铁 2~4.3 多 硬而脆 可铸不可锻
钢 0.03~2 少 硬而韧、有弹性 可铸可锻
探究新知
中国古代冶炼图
探究新知
冶炼金属的常用方法
1.活泼金属(如K Na Mg AI) :电解法
2.一般金属(如Zn Fe Sn Pb Cu) :热还原法
3.较稳定金属(如Hg Ag) :直接加热法
4.稳定金属(如Pt Au) :可通过金沙淘洗获得
Fe2O3+3CO=2Fe+3CO2
高温
△
2HgO === 2Hg + O2↑
探究新知
金属活动性顺序:
K Ca Na Mg Al ‖Zn Fe Sn Pb (H)Cu‖Hg Ag‖Pt Au
电解法
热还原法
直接加热法
探究新知
例题
探究新知
黑色
浑浊
通一氧化碳
加热
一氧化碳与空气混合加热引起爆炸
撤掉酒精灯
通一氧化碳至玻璃管冷却
氧气进入将铁再次氧化
点燃
收集
探究新知
铁矿石
焦炭
CO2
2CO
3
2Fe+3CO2
提供热量
产生还原剂CO
探究新知
例题
例:1000吨含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁多少吨?
解析:带入化学方程式计算的数据应是纯净物的质量。根据赤铁矿石的质量可以算出氧化铁的质量,从而求出铁的质量。即可解出含铁96%生铁的质量:1000 t×80% × 70% ÷96%=583.3 t
探究新知
1.某炼钢厂日产含杂质5%的生铁3000t,试计算:
⑴该3000 t生铁中含纯铁多少吨?
⑵该炼钢厂每天需含Fe2O3质量分数为85%的赤铁矿石多少吨?
(计算结果保留整数)
练习
解:⑴生铁中含纯铁:3000t×(1-5%)=2850t.
Fe2O3 + 3CO=== 2Fe + 3CO2
112
X· 85% 2850t
高温
160
X· 85%
=
112
2850t
⑵设需含Fe2O3质量分数为85%的赤铁矿石的质量为x。
X≈4790t
答:⑴该3000 t生铁中含纯铁2850t。
⑵该炼钢厂每天需含Fe2O3质量分数为85%的赤铁矿石为4790t。
课堂总结
小结
1.有少数很不活泼的金属如金、银、铂,有以单质形态存在的矿物,绝大多数金属都是以化合物形态存在于矿物之中。
2.还原反应,还原性。
3.炼铁、炼钢。
4.冶炼金属的常用方法。
板书设计
金属矿物与金属冶炼
几种金属矿物
铁的冶炼
含杂质物质的化学方程式的计算
一氧化碳还原氧化铁
高炉炼铁
(还原反应)
32
https://www.21cnjy.com/help/help_extract.php
让备课更有效
www.21cnjy.com
Thanks!
