第三节 碳达峰与碳中和 同步课件 -九年级化学上册同步精品课堂(鲁教版2024)
文档属性
| 名称 | 第三节 碳达峰与碳中和 同步课件 -九年级化学上册同步精品课堂(鲁教版2024) |  | |
| 格式 | pptx | ||
| 文件大小 | 37.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-27 22:13:52 | ||
图片预览










文档简介
(共35张PPT)
感受化学魅力
探寻化学之美
控制燃烧
第六单元
第三节
碳达峰与碳中和
目
录
CONTENTS
1
认识自然界中的碳循环及CO2含量变化对环境的影响,认识保护自然平衡、人与自然和谐相处的重要性
2
了解二氧化碳的物理性质,掌握二氧化碳的实验室制取及其化学性质
感受化学魅力
探寻化学之美
重点:二氧化碳的制取及化学性质
难点:二氧化碳的化学性质及可持续发展理念
3
认识实现“双碳”目标的途径,树立可持续发展的理念
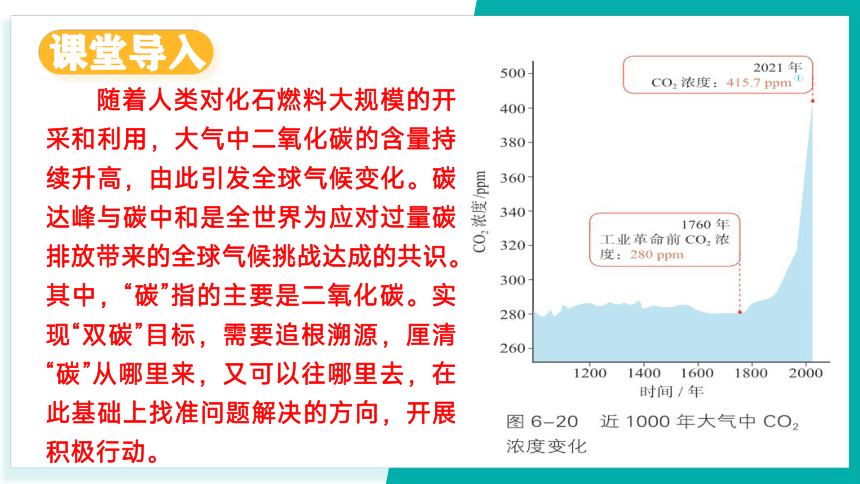
随着人类对化石燃料大规模的开采和利用,大气中二氧化碳的含量持续升高,由此引发全球气候变化。碳达峰与碳中和是全世界为应对过量碳排放带来的全球气候挑战达成的共识。其中,“碳”指的主要是二氧化碳。实现“双碳”目标,需要追根溯源,厘清“碳”从哪里来,又可以往哪里去,在此基础上找准问题解决的方向,开展积极行动。
课堂导入
了解自然界中的碳循环
一、
碳循环是自然界中物质和能量循环的重要组成部分
探究新知
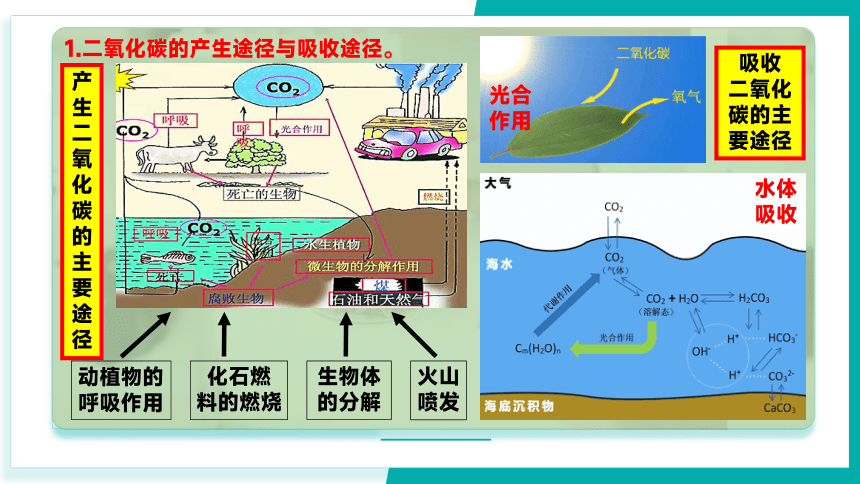
观察下图(图中数字表示通过不
同途径产生或消耗碳量的相对
值),思考并讨论:
1.二氧化碳的产生途径有哪些
二氧化碳的吸收途径又有哪些
2.二氧化碳的循环对自然界和人
类社会有什么重要意义
3.从碳循环的角度分析,造成大
气中二氧化碳含量增加的主要原
因是什么
观察思考6-4
自然界中的碳循环
产生
二氧化碳的主要途径
动植物的
呼吸作用
化石燃
料的燃烧
生物体
的分解
火山
喷发
吸收
二氧化碳的主要途径
光合
作用
水体
吸收
1.二氧化碳的产生途径与吸收途径。
2.二氧化碳的循环对自然界和人类社会具有极其重要的意义。
(1)维持生态平衡
二氧化碳是植物进行光合作用的重要原料,通过光合
作用,植物能够将二氧化碳转化为碳水化合物并释放氧气,为动物提供生存所需的氧气。同时,动物的呼吸作用又会产生二氧化碳,这样
形成了一个生态循环系统,保持了大气中二氧化碳的平衡;
(2)温室效应
二氧化碳是一种重要的温室气体,其浓度的变化会对全球气候产生显著影响。过多的二氧化碳排放会导致全球气温上升,引发温室效应,进而导致冰川融化、海平面上升、洪水等自然灾害,对生态环境和人类社会造成严重影响。
要维持二氧化碳含量的相对稳定,保护生态环境和人类社会的可持续发展。
3.二氧化碳含量增加的主要原因
(1)人类活动导致的化石燃料燃烧
随着工业化进程的加快,人类大量使用化石燃
料(如煤、石油和天然气),这些燃料在燃烧过程中产生大量的二氧化碳。这是大气中二氧化碳浓度增加的主要来源之一;
(2)森林砍伐和土地利用变化
人类活动导致大量森林被砍伐,森林的减少使
光合作用减弱,而光合作用是自然界中吸收二氧化碳的主要途径。城市扩张和土地开发也减少了植被覆盖,进一步降低了二氧化碳的吸收能力。
二、
二氧化碳是空气中的成分之一,是含碳的主要气体
心有质量思过往
行有方向期未来
认识二氧化碳
二氧化碳的物理性质及干冰的用途
1.无色、无味的气体
2.密度比空气大
3.能溶于水
4.在一定压强和低温条件下,能变成白色块状或片状固体固体,俗称“干冰”
人工降雨
食物储运
干冰清洗
舞台烟雾
活动探究6-4
二氧化碳溶于水
如图所示,向一个集满二氧化碳气体的矿泉水瓶中加入约1/3体积的水,立即拧紧瓶盖,振荡,观察现象。
步骤 现象 解释
与结论
1
矿泉水瓶变瘪
二氧化碳能溶于水,瓶内气体减少,气压变小,矿泉水瓶变瘪
二氧化碳能溶于水。通常情况下,1体积的水大约可以溶解1体积的二氧化碳,增大压强会溶解得更多。
取一支试管,从矿泉水瓶中倒入适量的二氧化碳水溶液。然后向试管中滴加几滴紫色石蕊试液,振荡,观察现象。将试管加热,观察现象。
二氧化碳的化学性质
二氧化碳与水反应
步骤 现象
解释与结论
2
紫色石蕊试液变为红色,加热后又变为紫色
二氧化碳和水水反应,生成了碳酸,碳酸使紫色石蕊试液变红色
碳酸不稳定,易分解生成水和二氧化碳,石蕊试液右边为紫色
CO2+H2O=H2CO3
H2CO3=CO2↑+H2O
二氧化碳还能与氢氧化钙[Ca(OH)2]的水溶液(俗称石灰水)反应
二氧化碳与石灰水反应
现象
解释与结论
澄清石灰石变浑浊
二氧化碳能与氢氧化钙反应生成碳酸钙沉淀,使溶液变浑浊
CO2+Ca(OH)2=CaCO3↓+H2O
在实验室中常用澄清石灰水检验二氧化碳的存在。
活动探究6-5
实验室制取二氧化碳的实验装置
氧气的学习,我们已经知道了实验室制取气体的一般思路和方法。请你依据上述反应原理,设计实验室制取二氧化碳的实验装置,分析每部分实验装置的作用,了解实验中应注意的事项。
将你设计的装置与右图所示的装置进行对比,小组交流讨论各装置的优缺点。
实验药品:
大理石(主要成分是碳酸钙)与稀盐酸
反应原理:
CaCO3+2HCl=CaCl2+H2O+CO2↑
验满方法:
将燃着的木条放在集气瓶口,木条熄灭,说明已满
二氧化碳的用途
1.二氧化碳既不燃烧、一般也不支持燃烧且本身无毒,可用于灭火、作科学实验和工业生产的保护气
3.工业原料:用来制纯碱、尿素、汽水饮料等
2.农业生产的气体肥料
二、
二氧化碳的吸收量与排放量大致相等,处于“收支平衡”,地球生态才能健康、稳定地运行
心有质量思过往
行有方向期未来
实现“双碳目标”
的路径
修复大气中二氧化碳含量的平衡必定要“降碳”——促使全球、国家、城市、企业等主体的碳排放由升转降。在此过程中,碳排放的最高点即碳峰值被
称为碳达峰;达峰
之后,人为碳排放
与通过植树造林、
碳捕集与封存技术
等人为碳吸收达到
平衡,即为碳中和。
碳达峰与碳中和
2020年9月,我国在联合国大会上承诺:中国将提高国家自主贡献力度,采取更加有力的政策和措施,二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现碳中和。这一承诺体现了我国的责任担当,也是我国实现绿色可持续发展的内在要求。
活动探究6-6
实现“双碳” 目标的思路
碳中和最核心的科学问题是物质转化和能量转换。我们把碳循环过程中向大气中释放二氧化碳的现象简称“碳排放”,把大气中相对于“收支平衡”的碳循环而言,二氧化碳过量的现象简称“碳超标”。结合所学,你认为实现“双碳”目标的基本思路是什么 请尝试完成以下任务:
1.找出从源头上减少“碳排放”的可行性路径。
2.研究制定解决“碳超标”问题的方案。
实现“双碳”目标,一方面要从源头上减少化石燃料的利用,控制二氧化碳的产生,从而减少二氧化碳的排放,比如开发能替代化石燃料的绿色能源等。另一方面,对于不得不排放的二氧化碳就要加大力度促进二氧化碳的吸收和转化。比如通过植树造林提高植物的光合作用,通过人工方法对二氧化碳进行捕集、利用与封存(包括海洋
封存、陆地封存、矿石碳化、地质利
用、化工利用、生物利用等)。总之,
依据二氧化碳的性质可以寻求降低大
气中二氧化碳含量的方法,重塑碳循
环的健康模式。
课堂达标
1.电视综艺节目中,舞台上那些白色雾状物是( )
A.干冰使得周围空气中的水蒸气遇冷凝结而成的小水滴
B.干冰升华产生的白色雾状二氧化碳
C.干冰吸收四周空气中的热后所产生的二氧化碳气体
D.干冰吸热后变成的水蒸气
A
课堂达标
2.科技改变生活。一系列新技术、新应用在北京冬奥会使用。例如国家速滑馆使用的“冰丝带”制冰技术(二氧化碳跨临界制冷系统).下列关于二氧化碳的说法错误的是( )
A.二氧化碳可用于制碳酸类饮料
B.干冰(固体二氧化碳)可用于人工降雨
C.常温下二氧化碳是一种有刺激性气味的有毒气体
D.大气中二氧化碳的消耗途径主要是植物的光合作用
C
3.用如图所示装置可以探究二氧化碳的制取和性质。下列关于该实验的叙述正确的是( )
A.浸有紫色石蕊溶液的棉花无明显现象
B.粗铜丝能控制反应的发生和停止
C.产生的二氧化碳可用排水法收集
D.能验证二氧化碳的密度比空气的大
B
课堂达标
课堂达标
4.下图是实验室制取并收集CO2气体的实验操作,其中不正确的是( )
A. 检查气密性 B. 装药品
C. 产生气体 D. 收集气体
D
5.实验室制取CO2的实验中,下列说法正确的是( )
A.可选用稀硫酸与块状石灰石反应制取CO2
B.制取CO2前需要检查装置的气密性
C.收集CO2既可用排水法又可用向上排空气法
D.可用紫色石蕊溶液检验生成的CO2
B
课堂达标
课堂达标
6.我国承诺2030年前实现“碳达峰”,2060年前实现“碳中和”,体现大国担当。
(1)“碳达峰”是指CO2排放量达到最高值。下列有利于控制二氧化碳排放的是 。
A.少使用一次性餐具 B.使用清洁能源
C.使用脱硫煤 D.推广电动汽车
(2)“碳中和”是指在规定时期内实现排放多少CO2就做多少抵消措施来达到平衡,实现CO2“净零”排放。自然界中吸收二氧化碳的主要途径是通过植物的 作用;“液态阳光技术”能将二氧化碳在催化剂的作用下与氢气反应,转化为一种液体燃料甲醇(CH3OH)和水,该反应的化学方程式为 。
ABD
光合
CO2+3H2 催化剂CH3OH+H2O
课堂达标
7.按如图所示装置探究二氧化碳的性质。
(1)如图A所示,点燃两只短蜡烛,分别
放在白铁皮架的两个阶梯上,把白铁皮
架放在烧杯里,沿烧杯壁倾倒二氧化碳。
观察到的现象是 。这个实验可以得出的结论是:① ;② 。
(2)如图B所示,将一只充满二氧化碳的试管倒立在盛有澄清石灰水的烧杯中,可以观察到的现象是 ; 。发生反应的化学方程 。
(3)如图C所示,打开瓶塞,迅速将烧杯中滴有紫色石蕊试液的少许蒸馏水倒入瓶中,立即拧紧瓶塞,振荡,出现的现象是 ;发生反应的化学方程式为 。
下层阶梯上的蜡烛火焰先熄灭,上层的后熄灭
二氧化碳的密度比空气的大
二氧化碳既不燃烧,也不支持燃烧
澄清石灰水进入试管中且不断上升
澄清石灰水逐渐变浑浊
Ca(OH)2+CO2=CaCO ↓+2H2O
紫色石蕊试液变红(或软塑料瓶变瘪)
H2O + CO2 = H2CO3
课堂达标
8.根据如图装置回答问题。
(1)写出标号仪器的名称:①______;②______。
(2)用高锰酸钾制取并收集较纯净的氧气,应选用
的装置是______(填字母)。
(3)实验室制取二氧化碳,反应的化学方程式为 ,发生装置可选用 A 或 C,装置 C 的优点是 ;若用装置 G 收集二氧化碳,气体应从______(填“a”或“b”)端通入。
(4)某同学在学习氮肥时,查阅资料:
① 氨气密度小于空气,极易溶于水,其水溶液称为氨水;
② 氨水在浓度大或受热时易分解放出氨气。
实验室用生石灰和浓氨水能快速制取氨气的原因是 ;制得的氨气______(填“能”或“不能”)用装置 D 收集。
分液漏斗
水槽
BF
2HCl+CaCO =CaCl +H O+CO ↑
可以控制反应的发生和停止
a
生石灰与水混合发生化合反应且放热,因溶剂水被消耗而导致浓氨水的浓度变大,因放热而导致温度升高,从而容易分解放出氨气
不能
知识总结
1.自然界中二氧化碳的循环
2.认识二氧化碳
(1)二氧化碳物理性质及干冰的用途
(2)二氧化碳的化学性质
①能与水反应,
②二氧化碳能使澄清的石灰水变浑浊(二氧化碳的检验)
(3)实验室制取
①药品:石灰石或大理石(主要成分CaCO3)与稀盐酸(HCl)
②原理: CaCO3+2HCl=CaCl2+H2O+CO2↑
3.实现“双碳目标”的路径
碳达峰、碳中和;减少二氧化碳的排放、促进二氧化碳的吸收和转化
CO2+H2O=H2CO3
CO2+Ca(OH)2=CaCO3↓+H2O
谢谢您的观看
THANKS
感受化学魅力
探寻化学之美
感受化学魅力
探寻化学之美
控制燃烧
第六单元
第三节
碳达峰与碳中和
目
录
CONTENTS
1
认识自然界中的碳循环及CO2含量变化对环境的影响,认识保护自然平衡、人与自然和谐相处的重要性
2
了解二氧化碳的物理性质,掌握二氧化碳的实验室制取及其化学性质
感受化学魅力
探寻化学之美
重点:二氧化碳的制取及化学性质
难点:二氧化碳的化学性质及可持续发展理念
3
认识实现“双碳”目标的途径,树立可持续发展的理念
随着人类对化石燃料大规模的开采和利用,大气中二氧化碳的含量持续升高,由此引发全球气候变化。碳达峰与碳中和是全世界为应对过量碳排放带来的全球气候挑战达成的共识。其中,“碳”指的主要是二氧化碳。实现“双碳”目标,需要追根溯源,厘清“碳”从哪里来,又可以往哪里去,在此基础上找准问题解决的方向,开展积极行动。
课堂导入
了解自然界中的碳循环
一、
碳循环是自然界中物质和能量循环的重要组成部分
探究新知
观察下图(图中数字表示通过不
同途径产生或消耗碳量的相对
值),思考并讨论:
1.二氧化碳的产生途径有哪些
二氧化碳的吸收途径又有哪些
2.二氧化碳的循环对自然界和人
类社会有什么重要意义
3.从碳循环的角度分析,造成大
气中二氧化碳含量增加的主要原
因是什么
观察思考6-4
自然界中的碳循环
产生
二氧化碳的主要途径
动植物的
呼吸作用
化石燃
料的燃烧
生物体
的分解
火山
喷发
吸收
二氧化碳的主要途径
光合
作用
水体
吸收
1.二氧化碳的产生途径与吸收途径。
2.二氧化碳的循环对自然界和人类社会具有极其重要的意义。
(1)维持生态平衡
二氧化碳是植物进行光合作用的重要原料,通过光合
作用,植物能够将二氧化碳转化为碳水化合物并释放氧气,为动物提供生存所需的氧气。同时,动物的呼吸作用又会产生二氧化碳,这样
形成了一个生态循环系统,保持了大气中二氧化碳的平衡;
(2)温室效应
二氧化碳是一种重要的温室气体,其浓度的变化会对全球气候产生显著影响。过多的二氧化碳排放会导致全球气温上升,引发温室效应,进而导致冰川融化、海平面上升、洪水等自然灾害,对生态环境和人类社会造成严重影响。
要维持二氧化碳含量的相对稳定,保护生态环境和人类社会的可持续发展。
3.二氧化碳含量增加的主要原因
(1)人类活动导致的化石燃料燃烧
随着工业化进程的加快,人类大量使用化石燃
料(如煤、石油和天然气),这些燃料在燃烧过程中产生大量的二氧化碳。这是大气中二氧化碳浓度增加的主要来源之一;
(2)森林砍伐和土地利用变化
人类活动导致大量森林被砍伐,森林的减少使
光合作用减弱,而光合作用是自然界中吸收二氧化碳的主要途径。城市扩张和土地开发也减少了植被覆盖,进一步降低了二氧化碳的吸收能力。
二、
二氧化碳是空气中的成分之一,是含碳的主要气体
心有质量思过往
行有方向期未来
认识二氧化碳
二氧化碳的物理性质及干冰的用途
1.无色、无味的气体
2.密度比空气大
3.能溶于水
4.在一定压强和低温条件下,能变成白色块状或片状固体固体,俗称“干冰”
人工降雨
食物储运
干冰清洗
舞台烟雾
活动探究6-4
二氧化碳溶于水
如图所示,向一个集满二氧化碳气体的矿泉水瓶中加入约1/3体积的水,立即拧紧瓶盖,振荡,观察现象。
步骤 现象 解释
与结论
1
矿泉水瓶变瘪
二氧化碳能溶于水,瓶内气体减少,气压变小,矿泉水瓶变瘪
二氧化碳能溶于水。通常情况下,1体积的水大约可以溶解1体积的二氧化碳,增大压强会溶解得更多。
取一支试管,从矿泉水瓶中倒入适量的二氧化碳水溶液。然后向试管中滴加几滴紫色石蕊试液,振荡,观察现象。将试管加热,观察现象。
二氧化碳的化学性质
二氧化碳与水反应
步骤 现象
解释与结论
2
紫色石蕊试液变为红色,加热后又变为紫色
二氧化碳和水水反应,生成了碳酸,碳酸使紫色石蕊试液变红色
碳酸不稳定,易分解生成水和二氧化碳,石蕊试液右边为紫色
CO2+H2O=H2CO3
H2CO3=CO2↑+H2O
二氧化碳还能与氢氧化钙[Ca(OH)2]的水溶液(俗称石灰水)反应
二氧化碳与石灰水反应
现象
解释与结论
澄清石灰石变浑浊
二氧化碳能与氢氧化钙反应生成碳酸钙沉淀,使溶液变浑浊
CO2+Ca(OH)2=CaCO3↓+H2O
在实验室中常用澄清石灰水检验二氧化碳的存在。
活动探究6-5
实验室制取二氧化碳的实验装置
氧气的学习,我们已经知道了实验室制取气体的一般思路和方法。请你依据上述反应原理,设计实验室制取二氧化碳的实验装置,分析每部分实验装置的作用,了解实验中应注意的事项。
将你设计的装置与右图所示的装置进行对比,小组交流讨论各装置的优缺点。
实验药品:
大理石(主要成分是碳酸钙)与稀盐酸
反应原理:
CaCO3+2HCl=CaCl2+H2O+CO2↑
验满方法:
将燃着的木条放在集气瓶口,木条熄灭,说明已满
二氧化碳的用途
1.二氧化碳既不燃烧、一般也不支持燃烧且本身无毒,可用于灭火、作科学实验和工业生产的保护气
3.工业原料:用来制纯碱、尿素、汽水饮料等
2.农业生产的气体肥料
二、
二氧化碳的吸收量与排放量大致相等,处于“收支平衡”,地球生态才能健康、稳定地运行
心有质量思过往
行有方向期未来
实现“双碳目标”
的路径
修复大气中二氧化碳含量的平衡必定要“降碳”——促使全球、国家、城市、企业等主体的碳排放由升转降。在此过程中,碳排放的最高点即碳峰值被
称为碳达峰;达峰
之后,人为碳排放
与通过植树造林、
碳捕集与封存技术
等人为碳吸收达到
平衡,即为碳中和。
碳达峰与碳中和
2020年9月,我国在联合国大会上承诺:中国将提高国家自主贡献力度,采取更加有力的政策和措施,二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现碳中和。这一承诺体现了我国的责任担当,也是我国实现绿色可持续发展的内在要求。
活动探究6-6
实现“双碳” 目标的思路
碳中和最核心的科学问题是物质转化和能量转换。我们把碳循环过程中向大气中释放二氧化碳的现象简称“碳排放”,把大气中相对于“收支平衡”的碳循环而言,二氧化碳过量的现象简称“碳超标”。结合所学,你认为实现“双碳”目标的基本思路是什么 请尝试完成以下任务:
1.找出从源头上减少“碳排放”的可行性路径。
2.研究制定解决“碳超标”问题的方案。
实现“双碳”目标,一方面要从源头上减少化石燃料的利用,控制二氧化碳的产生,从而减少二氧化碳的排放,比如开发能替代化石燃料的绿色能源等。另一方面,对于不得不排放的二氧化碳就要加大力度促进二氧化碳的吸收和转化。比如通过植树造林提高植物的光合作用,通过人工方法对二氧化碳进行捕集、利用与封存(包括海洋
封存、陆地封存、矿石碳化、地质利
用、化工利用、生物利用等)。总之,
依据二氧化碳的性质可以寻求降低大
气中二氧化碳含量的方法,重塑碳循
环的健康模式。
课堂达标
1.电视综艺节目中,舞台上那些白色雾状物是( )
A.干冰使得周围空气中的水蒸气遇冷凝结而成的小水滴
B.干冰升华产生的白色雾状二氧化碳
C.干冰吸收四周空气中的热后所产生的二氧化碳气体
D.干冰吸热后变成的水蒸气
A
课堂达标
2.科技改变生活。一系列新技术、新应用在北京冬奥会使用。例如国家速滑馆使用的“冰丝带”制冰技术(二氧化碳跨临界制冷系统).下列关于二氧化碳的说法错误的是( )
A.二氧化碳可用于制碳酸类饮料
B.干冰(固体二氧化碳)可用于人工降雨
C.常温下二氧化碳是一种有刺激性气味的有毒气体
D.大气中二氧化碳的消耗途径主要是植物的光合作用
C
3.用如图所示装置可以探究二氧化碳的制取和性质。下列关于该实验的叙述正确的是( )
A.浸有紫色石蕊溶液的棉花无明显现象
B.粗铜丝能控制反应的发生和停止
C.产生的二氧化碳可用排水法收集
D.能验证二氧化碳的密度比空气的大
B
课堂达标
课堂达标
4.下图是实验室制取并收集CO2气体的实验操作,其中不正确的是( )
A. 检查气密性 B. 装药品
C. 产生气体 D. 收集气体
D
5.实验室制取CO2的实验中,下列说法正确的是( )
A.可选用稀硫酸与块状石灰石反应制取CO2
B.制取CO2前需要检查装置的气密性
C.收集CO2既可用排水法又可用向上排空气法
D.可用紫色石蕊溶液检验生成的CO2
B
课堂达标
课堂达标
6.我国承诺2030年前实现“碳达峰”,2060年前实现“碳中和”,体现大国担当。
(1)“碳达峰”是指CO2排放量达到最高值。下列有利于控制二氧化碳排放的是 。
A.少使用一次性餐具 B.使用清洁能源
C.使用脱硫煤 D.推广电动汽车
(2)“碳中和”是指在规定时期内实现排放多少CO2就做多少抵消措施来达到平衡,实现CO2“净零”排放。自然界中吸收二氧化碳的主要途径是通过植物的 作用;“液态阳光技术”能将二氧化碳在催化剂的作用下与氢气反应,转化为一种液体燃料甲醇(CH3OH)和水,该反应的化学方程式为 。
ABD
光合
CO2+3H2 催化剂CH3OH+H2O
课堂达标
7.按如图所示装置探究二氧化碳的性质。
(1)如图A所示,点燃两只短蜡烛,分别
放在白铁皮架的两个阶梯上,把白铁皮
架放在烧杯里,沿烧杯壁倾倒二氧化碳。
观察到的现象是 。这个实验可以得出的结论是:① ;② 。
(2)如图B所示,将一只充满二氧化碳的试管倒立在盛有澄清石灰水的烧杯中,可以观察到的现象是 ; 。发生反应的化学方程 。
(3)如图C所示,打开瓶塞,迅速将烧杯中滴有紫色石蕊试液的少许蒸馏水倒入瓶中,立即拧紧瓶塞,振荡,出现的现象是 ;发生反应的化学方程式为 。
下层阶梯上的蜡烛火焰先熄灭,上层的后熄灭
二氧化碳的密度比空气的大
二氧化碳既不燃烧,也不支持燃烧
澄清石灰水进入试管中且不断上升
澄清石灰水逐渐变浑浊
Ca(OH)2+CO2=CaCO ↓+2H2O
紫色石蕊试液变红(或软塑料瓶变瘪)
H2O + CO2 = H2CO3
课堂达标
8.根据如图装置回答问题。
(1)写出标号仪器的名称:①______;②______。
(2)用高锰酸钾制取并收集较纯净的氧气,应选用
的装置是______(填字母)。
(3)实验室制取二氧化碳,反应的化学方程式为 ,发生装置可选用 A 或 C,装置 C 的优点是 ;若用装置 G 收集二氧化碳,气体应从______(填“a”或“b”)端通入。
(4)某同学在学习氮肥时,查阅资料:
① 氨气密度小于空气,极易溶于水,其水溶液称为氨水;
② 氨水在浓度大或受热时易分解放出氨气。
实验室用生石灰和浓氨水能快速制取氨气的原因是 ;制得的氨气______(填“能”或“不能”)用装置 D 收集。
分液漏斗
水槽
BF
2HCl+CaCO =CaCl +H O+CO ↑
可以控制反应的发生和停止
a
生石灰与水混合发生化合反应且放热,因溶剂水被消耗而导致浓氨水的浓度变大,因放热而导致温度升高,从而容易分解放出氨气
不能
知识总结
1.自然界中二氧化碳的循环
2.认识二氧化碳
(1)二氧化碳物理性质及干冰的用途
(2)二氧化碳的化学性质
①能与水反应,
②二氧化碳能使澄清的石灰水变浑浊(二氧化碳的检验)
(3)实验室制取
①药品:石灰石或大理石(主要成分CaCO3)与稀盐酸(HCl)
②原理: CaCO3+2HCl=CaCl2+H2O+CO2↑
3.实现“双碳目标”的路径
碳达峰、碳中和;减少二氧化碳的排放、促进二氧化碳的吸收和转化
CO2+H2O=H2CO3
CO2+Ca(OH)2=CaCO3↓+H2O
谢谢您的观看
THANKS
感受化学魅力
探寻化学之美
同课章节目录
