3.2 课时2 新型合金和物质的量在化学方程式中计算的应用(共27张PPT)课件 2024-2025学年高一化学人教版(2019)必修一
文档属性
| 名称 | 3.2 课时2 新型合金和物质的量在化学方程式中计算的应用(共27张PPT)课件 2024-2025学年高一化学人教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 55.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-27 18:00:52 | ||
图片预览








文档简介
(共27张PPT)
新型合金和物质的量
在化学方程式中计算的应用
第三章 铁 金属材料
一、新型合金
1.钛合金
钛合金强度高、耐蚀性好、耐热性高。钛合金主要用于制作飞机发动机压气机部件,其次为火箭、导弹和高速飞机的结构件。
钛的外形很像钢铁,但远比钢铁坚硬,而重量只有同样大小的钢铁的一半。安然无恙的“躺”在各种强酸、强碱中;连比较凶猛的酸—王水,也不能腐蚀它。
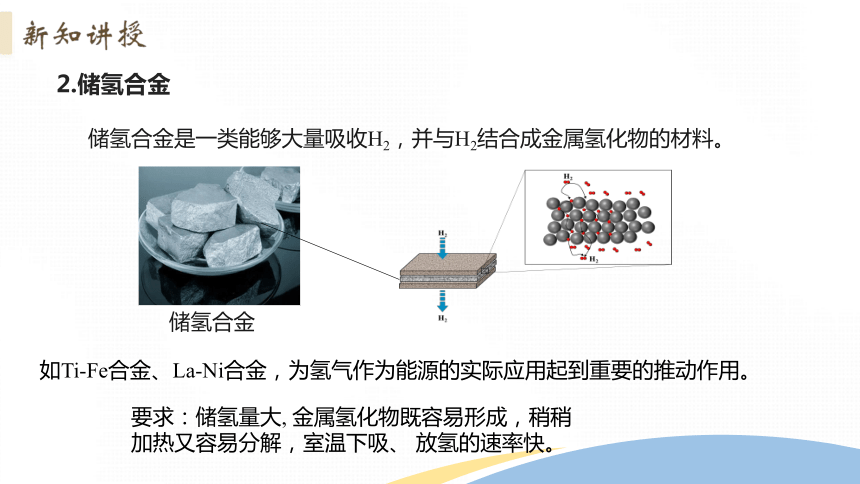
2.储氢合金
2.储氢合金
储氢合金
储氢合金是一类能够大量吸收H2,并与H2结合成金属氢化物的材料。
如Ti-Fe合金、La-Ni合金,为氢气作为能源的实际应用起到重要的推动作用。
要求:储氢量大, 金属氢化物既容易形成,稍稍加热又容易分解,室温下吸、 放氢的速率快。
3.耐热合金
合金在高温下还具有高强度和良好的抗氧化性,因而还可用于热处理工业,制造各种结构件。
喷气式飞机的发动机叶片是由镍、铁、碳和钴组成的镍钴合金制造的,能承受1 100 ℃的高温
你知道吗?
有些金属是有“记忆的”
4.形状记忆合金
记忆合金是—种原子排列很有规则、体积变为小于0.5%的马氏体相变合金。这种合金在外力作用下会产生变形,当把外力去掉,在一定的温度条件下,能恢复原来的形状。由于它具有百万次以上的恢复功能,因此叫作“记忆合金”。
4.形状记忆合金
人造卫星的天线
发射人造卫星之前,将抛物面天线折叠起来装进卫星体内,火箭升空把人造卫星送到预定轨道后,只需加温,折叠的卫星天线因具有"记忆"功能而自然展开,恢复抛物面形状。
5.用途广泛的稀土金属
~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~
在金属元素中,有一类性质相似,并在自然界共生在一起的稀土元素,他们是元素周期表中原子序数从57~71(从镧至镥,称为镧系元素)的15种元素以及钪和钇,共17种元素。稀土元素在科技、生产中有广泛的用途,被誉为新材料的宝库。
稀土金属既可单独使用,也可用于生产合金。在合金中加入适量稀土金属,能大大改善合金的性能。因而,稀土元素又被称为“冶金工业的维生素”。例如,在钢中加入稀土元素,可以增加钢的塑性、韧性、耐磨性、耐热性、耐腐蚀性和抗氧化性等。
因此,稀土金属广泛应用在冶金、石油化工、材料工业(电子材料、荧光材料、发光材料、永磁材料、超导材料、染色材料、纳米材料、引火合金和催化剂等)、医药及农业等领域。
我国是稀土资源大国。到目前为止,我国的稀土储量、稀土产量、稀土用量和稀土出口量均居世界第一位。我国化学家徐光宪院士与其研究团队在稀土元素的分离及应用中做出了重要贡献。
随着稀土资源的不断开采,如何合理利用和保护我国的稀土资源,实现可持续发展战略,已经引起政府和社会各界的关注。
科学·技术·社会
二、物质的量在化学方程式中计算的应用
质量 m
(g)
微粒数
N 个
÷M
物质的量
n(mol)
×M
× NA
÷ NA
气体体积V
×22.4L·mol-1
6.02×1023
摩尔质量
溶液体积
×物质的量浓度(c)
÷物质的量浓度
÷22.4L·mol-1
标准状况下
结论:物质的量是联系各物理量的纽带,可以简便的进行各量之间的转换。
2Na + 2H2O === 2NaOH + H2↑
化学计量数之比
2
2
2
:
:
:
1
扩大NA倍
2NA
2NA
2NA
:
:
NA
:
物质的量(n)之比
2 mol
2 mol
2 mol
:
:
1 mol
:
化学方程式中的化学计量数与几个物理量的关系
H2 + Cl2 === 2HCl
化学计量数之比
1
1
2
:
:
物质的量(n)之比
1
1
2
:
:
同温同压下
1 mol×
1 mol×
2 mol×Vm
:
Vm
Vm
:
体积之比
1体积
1体积
2体积
:
:
化学方程式中的化学计量数与几个物理量的关系
结论:
(1)化学方程式中各物质的化学计量数之比等于各物质的分子数之比,
等于各物质的物质的量之比,即v1:v2:v3=N1:N2:N3=n1:n2:n3
(2)对于有气体参加的反应,在同温同压下各气体的化学计量数之比等
于各气体的体积之比,即v1:v2:v3=V1:V2:V3
化学方程式中的化学计量数与几个物理量的关系
物质的量应用于化学方程式计算类题的解题步骤
写
写出相关的化学方程式;
标
在化学方程式中有关物质的化学式下面标出已知量和未知量
列
列出比列式
解
根据比例式求解
答
简明的写出答案
设
设所求物质的物质的量或质量、体积(标准状况)等
审
审清题目条件和题目要求
物质的量应用于化学方程式计算时的注意事项
(1)化学方程式中各物质的化学计量数之比等于各物质的物质的量之比,而非质量之比。
(2)计算时,各种物质不一定都用物质的量表示,也可以用质量表示,气态物质还可以用体积(标准状况)表示。但要注意物质的量与其他各物理量之间的换算关系,只要做到计量单位“上下一致,左右相当”即可。
有关物质的量的计算中的“三个规范”
(1)书写规范:各种符号的书写要规范,大写字母与小写字母的意义各不相同。如“M”表示摩尔质量,而“m”表示质量;“N”表示微粒数,而“n”表示物质的量。
(2)符号规范:
①设未知数直接用各物理量的符号表示,且要注明物质(或粒子)的符号。如设参加反应HCl溶液的体积为V[HCl(aq)]。
②各物理量及单位、物质的名称、公式等尽量用符号表示。如已知NaOH溶液的体积和物质的量浓度,求NaOH的质量时就写成:m(NaOH)=c(NaOH)·V[NaOH(aq)]·M(NaOH)。
(3)单位规范:把已知量代入计算式中计算时都要带单位且单位要统一。
(1)关系式法
当已知物和未知物之间是靠多个反应来联系时,只需直接确定已知量和未
知量之间的比例关系,即“关系式”。如把CO还原Fe2O3生成的CO2通入澄
清石灰水中,求生成沉淀的量,根据化学方程式知3CO~3CO2~3CaCO3,
即CO~CaCO3。
化学计算中常用的三种方法
(2)守恒法
①质量守恒
宏观特征:反应前后元素的质量守恒。
微观守恒:反应前后各元素的原子个数守恒。
②得失电子守恒
氧化还原反应中,氧化剂得电子总数等于还原剂失电子总数。
(2)守恒法
③电荷守恒
ⅰ.电解质溶液中,阴离子所带负电荷总数等于阳离子所带正电荷总数。
ⅱ.离子方程式中,反应物所带电荷总数与生成物所带电荷总数相等且
电性相同。
(3)差量法
根据化学反应前后物质的有关物理量发生的变化,找出所谓“理论差量”,
如反应前后的质量差、物质的量差、气体体积差等。该差量的大小与反
应物的有关量成正比。差量法就是借助这种比例关系,解决一定量变的
计算题。
方程式运用的灵活性
除一般的化学方程式外,如果是离子反应,可以根据离子方程式进行
计算;如果是氧化还原反应,也可以利用电子转移关系进行有关计算。
【例1】完全中和0.10 mol NaOH,需要硫酸的物质的量是多少?
所需硫酸的质量是多少?
解:2NaOH +H2SO4 === Na2SO4 + 2H2O
2 1
0.10 mol n(H2SO4)
硫酸的质量:
n(H2SO4)= = 0.05 mol
m= nM = 0.05×98 g/mol = 4.9 g
答:略。
【例2】把6.5 g Zn放入足量盐酸中,锌完全反应。计算:
(1)6.5 g Zn的物质的量; (2)参加反应的HCl的物质的量;
(3)生成H2的体积(标准状况)。
解:(1)n(Zn)= = = 0.1 mol
Zn + 2HCl === ZnCl2 + H2↑
1 mol 2 mol 22.4 L
0.1 mol n(HCl) V(H2)
(2)n(HCl) = = 0.2 mol
(3)V(H2) = = 2.24 L
答:略。
新型合金
钛合金
储氢合金
耐热合金
形状记忆合金
物质的量在化学方程式中计算的应用
化学方程式中化学计量数与相关物理量的关系
物质的量应用于化学方程式计算的基本步骤
化学计算中的常用方法
关系式法—解答连续反应类型计算题的捷径
差量法—质量差值法、体积差值法
守恒法—质量守恒、电荷守恒、电子守恒
方程组法——两个已知量求解混合物中两种物质的未知量
B
1. 等量的铁粉分别与足量的盐酸、水蒸气在一定的条件下充分反应,则在相同的条件下,产生氢气的体积比是( )
A. 1:1 B. 3:4 C. 2:3 D. 4:3
A
2. 4 mol Fe和3 mol Cl2完全反应,生成FeCl3的物质的量为( )
A. 2 mol B. 3 mol C. 4 mol D. 1 mol
C
3. 0.3 mol Cl2和足量的金属M反应,生成0.2 mol MCln,n等于( )
A. 1 B. 2 C. 3 D. 4
C
4. 将足量铁粉放入100 ml 0.1 mol.L-1 的CuSO4溶液中,充分反应后
洗出的铜的质量为( )
A. 32 g B. 6.4 g C. 0.64 g D. 3.2 g
新型合金和物质的量
在化学方程式中计算的应用
第三章 铁 金属材料
一、新型合金
1.钛合金
钛合金强度高、耐蚀性好、耐热性高。钛合金主要用于制作飞机发动机压气机部件,其次为火箭、导弹和高速飞机的结构件。
钛的外形很像钢铁,但远比钢铁坚硬,而重量只有同样大小的钢铁的一半。安然无恙的“躺”在各种强酸、强碱中;连比较凶猛的酸—王水,也不能腐蚀它。
2.储氢合金
2.储氢合金
储氢合金
储氢合金是一类能够大量吸收H2,并与H2结合成金属氢化物的材料。
如Ti-Fe合金、La-Ni合金,为氢气作为能源的实际应用起到重要的推动作用。
要求:储氢量大, 金属氢化物既容易形成,稍稍加热又容易分解,室温下吸、 放氢的速率快。
3.耐热合金
合金在高温下还具有高强度和良好的抗氧化性,因而还可用于热处理工业,制造各种结构件。
喷气式飞机的发动机叶片是由镍、铁、碳和钴组成的镍钴合金制造的,能承受1 100 ℃的高温
你知道吗?
有些金属是有“记忆的”
4.形状记忆合金
记忆合金是—种原子排列很有规则、体积变为小于0.5%的马氏体相变合金。这种合金在外力作用下会产生变形,当把外力去掉,在一定的温度条件下,能恢复原来的形状。由于它具有百万次以上的恢复功能,因此叫作“记忆合金”。
4.形状记忆合金
人造卫星的天线
发射人造卫星之前,将抛物面天线折叠起来装进卫星体内,火箭升空把人造卫星送到预定轨道后,只需加温,折叠的卫星天线因具有"记忆"功能而自然展开,恢复抛物面形状。
5.用途广泛的稀土金属
~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~
在金属元素中,有一类性质相似,并在自然界共生在一起的稀土元素,他们是元素周期表中原子序数从57~71(从镧至镥,称为镧系元素)的15种元素以及钪和钇,共17种元素。稀土元素在科技、生产中有广泛的用途,被誉为新材料的宝库。
稀土金属既可单独使用,也可用于生产合金。在合金中加入适量稀土金属,能大大改善合金的性能。因而,稀土元素又被称为“冶金工业的维生素”。例如,在钢中加入稀土元素,可以增加钢的塑性、韧性、耐磨性、耐热性、耐腐蚀性和抗氧化性等。
因此,稀土金属广泛应用在冶金、石油化工、材料工业(电子材料、荧光材料、发光材料、永磁材料、超导材料、染色材料、纳米材料、引火合金和催化剂等)、医药及农业等领域。
我国是稀土资源大国。到目前为止,我国的稀土储量、稀土产量、稀土用量和稀土出口量均居世界第一位。我国化学家徐光宪院士与其研究团队在稀土元素的分离及应用中做出了重要贡献。
随着稀土资源的不断开采,如何合理利用和保护我国的稀土资源,实现可持续发展战略,已经引起政府和社会各界的关注。
科学·技术·社会
二、物质的量在化学方程式中计算的应用
质量 m
(g)
微粒数
N 个
÷M
物质的量
n(mol)
×M
× NA
÷ NA
气体体积V
×22.4L·mol-1
6.02×1023
摩尔质量
溶液体积
×物质的量浓度(c)
÷物质的量浓度
÷22.4L·mol-1
标准状况下
结论:物质的量是联系各物理量的纽带,可以简便的进行各量之间的转换。
2Na + 2H2O === 2NaOH + H2↑
化学计量数之比
2
2
2
:
:
:
1
扩大NA倍
2NA
2NA
2NA
:
:
NA
:
物质的量(n)之比
2 mol
2 mol
2 mol
:
:
1 mol
:
化学方程式中的化学计量数与几个物理量的关系
H2 + Cl2 === 2HCl
化学计量数之比
1
1
2
:
:
物质的量(n)之比
1
1
2
:
:
同温同压下
1 mol×
1 mol×
2 mol×Vm
:
Vm
Vm
:
体积之比
1体积
1体积
2体积
:
:
化学方程式中的化学计量数与几个物理量的关系
结论:
(1)化学方程式中各物质的化学计量数之比等于各物质的分子数之比,
等于各物质的物质的量之比,即v1:v2:v3=N1:N2:N3=n1:n2:n3
(2)对于有气体参加的反应,在同温同压下各气体的化学计量数之比等
于各气体的体积之比,即v1:v2:v3=V1:V2:V3
化学方程式中的化学计量数与几个物理量的关系
物质的量应用于化学方程式计算类题的解题步骤
写
写出相关的化学方程式;
标
在化学方程式中有关物质的化学式下面标出已知量和未知量
列
列出比列式
解
根据比例式求解
答
简明的写出答案
设
设所求物质的物质的量或质量、体积(标准状况)等
审
审清题目条件和题目要求
物质的量应用于化学方程式计算时的注意事项
(1)化学方程式中各物质的化学计量数之比等于各物质的物质的量之比,而非质量之比。
(2)计算时,各种物质不一定都用物质的量表示,也可以用质量表示,气态物质还可以用体积(标准状况)表示。但要注意物质的量与其他各物理量之间的换算关系,只要做到计量单位“上下一致,左右相当”即可。
有关物质的量的计算中的“三个规范”
(1)书写规范:各种符号的书写要规范,大写字母与小写字母的意义各不相同。如“M”表示摩尔质量,而“m”表示质量;“N”表示微粒数,而“n”表示物质的量。
(2)符号规范:
①设未知数直接用各物理量的符号表示,且要注明物质(或粒子)的符号。如设参加反应HCl溶液的体积为V[HCl(aq)]。
②各物理量及单位、物质的名称、公式等尽量用符号表示。如已知NaOH溶液的体积和物质的量浓度,求NaOH的质量时就写成:m(NaOH)=c(NaOH)·V[NaOH(aq)]·M(NaOH)。
(3)单位规范:把已知量代入计算式中计算时都要带单位且单位要统一。
(1)关系式法
当已知物和未知物之间是靠多个反应来联系时,只需直接确定已知量和未
知量之间的比例关系,即“关系式”。如把CO还原Fe2O3生成的CO2通入澄
清石灰水中,求生成沉淀的量,根据化学方程式知3CO~3CO2~3CaCO3,
即CO~CaCO3。
化学计算中常用的三种方法
(2)守恒法
①质量守恒
宏观特征:反应前后元素的质量守恒。
微观守恒:反应前后各元素的原子个数守恒。
②得失电子守恒
氧化还原反应中,氧化剂得电子总数等于还原剂失电子总数。
(2)守恒法
③电荷守恒
ⅰ.电解质溶液中,阴离子所带负电荷总数等于阳离子所带正电荷总数。
ⅱ.离子方程式中,反应物所带电荷总数与生成物所带电荷总数相等且
电性相同。
(3)差量法
根据化学反应前后物质的有关物理量发生的变化,找出所谓“理论差量”,
如反应前后的质量差、物质的量差、气体体积差等。该差量的大小与反
应物的有关量成正比。差量法就是借助这种比例关系,解决一定量变的
计算题。
方程式运用的灵活性
除一般的化学方程式外,如果是离子反应,可以根据离子方程式进行
计算;如果是氧化还原反应,也可以利用电子转移关系进行有关计算。
【例1】完全中和0.10 mol NaOH,需要硫酸的物质的量是多少?
所需硫酸的质量是多少?
解:2NaOH +H2SO4 === Na2SO4 + 2H2O
2 1
0.10 mol n(H2SO4)
硫酸的质量:
n(H2SO4)= = 0.05 mol
m= nM = 0.05×98 g/mol = 4.9 g
答:略。
【例2】把6.5 g Zn放入足量盐酸中,锌完全反应。计算:
(1)6.5 g Zn的物质的量; (2)参加反应的HCl的物质的量;
(3)生成H2的体积(标准状况)。
解:(1)n(Zn)= = = 0.1 mol
Zn + 2HCl === ZnCl2 + H2↑
1 mol 2 mol 22.4 L
0.1 mol n(HCl) V(H2)
(2)n(HCl) = = 0.2 mol
(3)V(H2) = = 2.24 L
答:略。
新型合金
钛合金
储氢合金
耐热合金
形状记忆合金
物质的量在化学方程式中计算的应用
化学方程式中化学计量数与相关物理量的关系
物质的量应用于化学方程式计算的基本步骤
化学计算中的常用方法
关系式法—解答连续反应类型计算题的捷径
差量法—质量差值法、体积差值法
守恒法—质量守恒、电荷守恒、电子守恒
方程组法——两个已知量求解混合物中两种物质的未知量
B
1. 等量的铁粉分别与足量的盐酸、水蒸气在一定的条件下充分反应,则在相同的条件下,产生氢气的体积比是( )
A. 1:1 B. 3:4 C. 2:3 D. 4:3
A
2. 4 mol Fe和3 mol Cl2完全反应,生成FeCl3的物质的量为( )
A. 2 mol B. 3 mol C. 4 mol D. 1 mol
C
3. 0.3 mol Cl2和足量的金属M反应,生成0.2 mol MCln,n等于( )
A. 1 B. 2 C. 3 D. 4
C
4. 将足量铁粉放入100 ml 0.1 mol.L-1 的CuSO4溶液中,充分反应后
洗出的铜的质量为( )
A. 32 g B. 6.4 g C. 0.64 g D. 3.2 g
