2025苏教版高中化学必修第二册强化练习题--第二单元 探究铁及其化合物的转化(含解析)
文档属性
| 名称 | 2025苏教版高中化学必修第二册强化练习题--第二单元 探究铁及其化合物的转化(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 673.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-01 18:49:27 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2025苏教版高中化学必修第二册
第二单元 探究铁及其化合物的转化
基础过关练题组一 单质铁的性质
1.(2024江苏盐城中学模拟)下列关于铁及其性质的说法,不正确的是( )
A.金属铁可以被磁铁吸引
B.铁丝可以在氧气中剧烈燃烧
C.铁有良好的导电、导热性
D.铁丝在氯气中燃烧生成FeCl2
2.(经典题)(2023河北石家庄开学考试)如图是铁与其他物质之间的性质关系(“—”表示相连物质间能发生反应,“→”表示两种物质间的转化关系,部分物质和反应条件已略去),下列有关说法正确的是( )
A.反应①的过程中,固体的质量逐渐减少
B.反应②中有银白色固体析出
C.反应③可通过细铁丝在空气中燃烧实现
D.反应④可能是2Fe+6HCl 2FeCl3+3H2↑
题组二 铁的化合物的性质
3.(2023广东深圳龙华期末)某同学探究FeCl3性质时,发现在FeCl3溶液中滴加KSCN溶液后出现红色,再向溶液中滴加柠檬水(富含维生素C)后红色褪去。下列说法不正确的是( )
A.维生素C具有还原性
B.上述过程中FeCl3发生还原反应
C.上述过程中FeCl3作氧化剂
D.1 mol Fe3+完全转化为Fe2+,共失去1 mol电子
4.下列对铁的化合物的叙述错误的是( )
铁的化合物 铁元素 化合价 部分性质
A Fe3O4 +6价 黑色晶体,具有磁性
B Fe(OH)2 +2价 白色固体,易被氧化
C Fe(OH)3 +3价 红褐色固体,加热失去水生成红棕色固体
D FeCl3 +3价 FeCl3溶液中的Fe3+能被Fe还原成Fe2+
5.(2024河南洛阳月考)铁元素是人体重要的微量元素,参与人体血红蛋白的形成,人体内的Fe大部分是+2价的Fe,Fe2+易被人体吸收,下列有关铁及其化合物的说法正确的是 ( )
A.维生素C具有氧化性,可将难吸收的Fe3+转化为Fe2+,促进人体对铁元素的吸收
B.向FeCl2溶液中加入KSCN溶液,溶液变为血红色
C.向FeCl2溶液中加入NaOH溶液,生成红褐色沉淀
D.FeCl3溶液滴在淀粉-KI试纸上,试纸变蓝
6.(经典题)(2024河北保定二模)部分含铁的纯净物中铁元素化合价与物质类别的关系如下。下列叙述错误的是( )
A.图中相邻物质中c→d在空气里最易转化
B.在隔绝空气条件下加热FeC2O4可得到b
C.在高温下a与水蒸气反应生成b和H2
D.e溶液中加入铜粉,发生氧化还原反应
题组三 Fe3+和Fe2+的检验与转化
7.(经典题)下列离子的检验方法合理的是( )
A.向某溶液中滴入KSCN溶液,溶液变为血红色,说明不含Fe2+
B.向某溶液中通入Cl2,然后加入KSCN溶液,溶液变为血红色,说明原溶液中含有Fe2+
C.向某溶液中加入NaOH溶液,得到红褐色沉淀,说明溶液中含有Fe3+
D.向某溶液中加入NaOH溶液得白色沉淀,又观察到沉淀颜色迅速变为灰绿色,最后变为红褐色,说明溶液中含有Fe2+,不含有Mg2+
8.(2024江苏宿迁月考)室温下,下列实验探究方案能达到目的的是( )
选项 探究方案 探究目的
A 将Fe(NO3)2样品溶于稀盐酸后,滴加KSCN溶液,观察溶液颜色变化 检验Fe(NO3)2是否变质
B 将FeCl3溶液滴入足量HI溶液中,加入CCl4后振荡、静置,观察CCl4层颜色变化 证明氧化性:Fe3+>I2
C 向某溶液中滴加少量氯水,再滴入几滴KSCN溶液,观察现象 检验溶液中是否含有Fe2+
D 向FeSO4溶液中滴加少量酸性KMnO4溶液,观察现象 证明Fe2+具有氧化性
9.(2023重庆南开中学期末)某课外活动小组探究某食品包装袋中还原性铁粉是否变质,分别取少量样品溶于盐酸,然后进行下列实验。下列说法正确的是( )
A.若滴加少量NaOH溶液,无红褐色沉淀产生,说明铁粉未变质
B.若滴加KSCN溶液,溶液变为血红色,说明铁粉变质
C.若先滴加氯水,再滴加KSCN溶液,溶液变为血红色,说明铁粉全部变质
D.若滴加KSCN溶液,溶液未变红,说明铁粉未变质
题组四 氢氧化亚铁的制备
10.(2024江苏天一中学月考)某同学欲利用如图装置制取能较长时间存在的Fe(OH)2,其中实验所用溶液现配现用且蒸馏水先加热煮沸。下列分析正确的是( )
A.X可以是稀硫酸或浓硫酸
B.实验开始时应先关闭止水夹a、打开止水夹b,再向烧瓶中加入X
C.反应一段时间后可在A中观察到白色沉淀
D.反应结束后若关闭b及分液漏斗活塞,则Fe(OH)2可较长时间存在
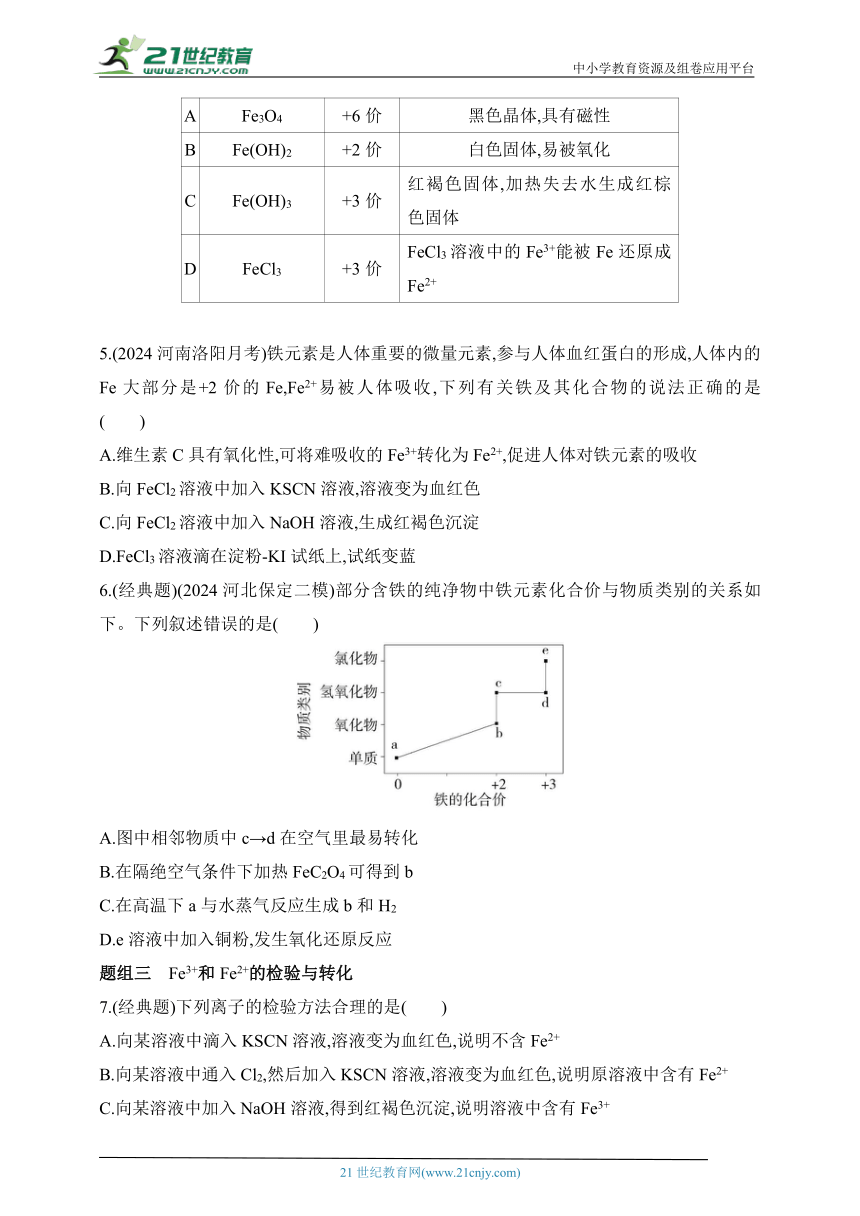
11.用下列装置做实验(所用稀硫酸和NaOH溶液均预先煮沸处理,FeSO4溶液均为新制的),能较长时间看到 Fe(OH)2白色沉淀的是( )
① ②
③ ④
A.①②③ B.①②④
C.①③④ D.②③④
能力提升练
题组一 铁及其化合物的转化
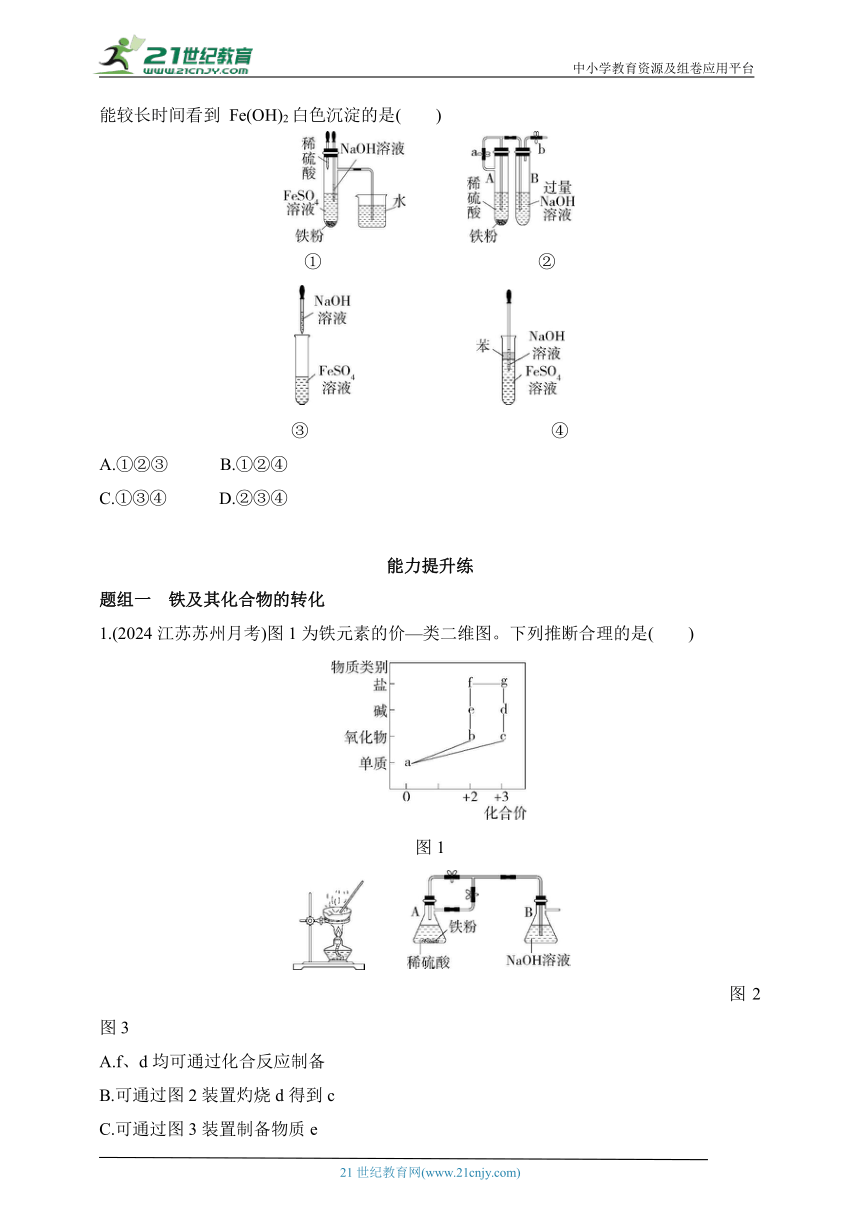
1.(2024江苏苏州月考)图1为铁元素的价—类二维图。下列推断合理的是( )
图1
图2 图3
A.f、d均可通过化合反应制备
B.可通过图2装置灼烧d得到c
C.可通过图3装置制备物质e
D.a→f→g→e的每步转化均可一步实现
2.(2024河北师大附中月考)为确定某矿石成分,进行如下操作:
下列有关说法正确的是( )
A.向溶液甲中滴加KSCN溶液,溶液变红,则原矿石样品中存在Fe(Ⅲ)
B.向溶液乙中滴加KSCN溶液,溶液变红,则原矿石样品中存在Fe(Ⅲ)
C.向溶液甲中滴加少量NaOH溶液,一定出现红褐色沉淀
D.该矿石一定为赤铁矿
3.(2024江苏淮安期中调研)高铁酸钾(K2FeO4)是一种饮用水处理剂,在水处理过程中,高铁酸钾转化为Fe(OH)3胶体,制备高铁酸钾的流程如图所示,下列叙述不正确的是( )
A.铁屑在干燥的氯气中发生反应Ⅰ时,若铁屑过量,可能生成FeCl2
B.反应Ⅱ中n(氧化剂)∶n(还原剂)=3∶2
C.该条件下,物质的溶解性:Na2FeO4>K2FeO4
D.用K2FeO4对饮用水杀菌消毒的同时,生成的Fe(OH)3胶体可吸附杂质净化水
题组二 与铁及其化合物相关的计算
4.(2024河北张家口开学联考)部分被氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.92 g,经如下处理:
下列说法正确的是( )
A.取少量滤液A,滴加KSCN溶液,溶液变红
B.V=224
C.滤渣Ⅰ的成分是Fe、Cu
D.样品中氧元素的质量是1.6 g
5.(2023河北廊坊第一中学期末)二水合草酸亚铁(FeC2O4·2H2O)是制备某种铁锂电池最常用的原料。国内某科研团队以氮气为保护气,对二水合草酸亚铁的受热分解情况进行研究,生成的气体只含CO、CO2和H2O(g),得到固体的质量与加热温度的变化曲线如图所示。下列说法正确的是( )
A.b点的固体成分为FeC2O4·H2O
B.b→c的化学方程式为FeC2O4FeCO3+CO↑
C.从a→d,生成的CO、CO2的物质的量不相等
D.加热至250 ℃以上,固体质量略有增加,可能是因为FeO与CO反应生成了Fe3C
题组三 与铁的化合物相关的综合实验
6.(2023山东莘县多校期末联考)某兴趣小组同学为研究Cu与Fe3+的反应进行如下实验(已知CuCl为白色固体,微溶于水):
序号 实验步骤 实验现象
Ⅰ 充分振荡,加入2 mL蒸馏水 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象
Ⅱ 充分振荡,加入2 mL蒸馏水 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀
Ⅲ 充分振荡,加入2 mL蒸馏水 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀
下列说法不正确的是( )
A.三个实验中消耗的铜粉的量不完全一样
B.上述实验表明能否形成白色沉淀只取决于加入Cu的量
C.实验Ⅰ、Ⅱ、Ⅲ中均发生了反应2Fe3+++2Fe2+
D.实验Ⅱ中加水后的离子反应可能是Cu2++Cu+2Cl- 2CuCl
7.(2023河北石家庄第二中学期末)铁是人体必需的微量元素,严重缺铁时需要服用补铁剂。实验小组为研究某补铁剂中铁元素的价态及其含量,设计并进行了如下实验:
[查阅资料]1.该补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。
2.KSCN中的硫元素为-2价。
3.K3[Fe(CN)6]与Fe2+反应产生蓝色沉淀。
实验一:检验该补铁剂中铁元素的价态。
(1)已知甲同学为了检验药品中Fe2+的存在,将药物碾碎、水溶后过滤。取少量所得滤液于试管中,加入K3[Fe(CN)6]溶液,未出现明显现象,其主要原因为 。
改进后进行如下操作:
1片
补铁剂接近无色
的溶液①浅红色
溶液②深红色溶液③,又迅
速变为无色溶液④
(2)试剂1是 ,试剂2是 。
(3)加入试剂2后溶液变为浅红色,说明溶液①中含有 。
(4)能证明溶液①中含有Fe2+的实验现象是 。
(5)甲同学猜测深红色溶液③迅速变为无色溶液④的原因可能是溶液中的SCN-与H2O2发生了化学反应。
a.甲同学猜测的依据是 。
b.乙同学通过实验证实了甲同学的猜测,其实验方案及现象是 。
实验二:测定该补铁剂中铁元素的含量。
m片
补铁剂接近无色
的溶液红褐色
沉淀红棕色
固体a g
(6)每片该补铁剂含铁元素的质量为 g。
(7)人体只能吸收Fe2+,医生建议在服用该补铁剂时,同时服用维生素C,理由是 。
答案与分层梯度式解析
第二单元 探究铁及其化合物的转化
基础过关练
1.D 2.B 3.D 4.A 5.D 6.C 7.C 8.B
9.B 10.D 11.B
1.D 氯气具有强氧化性,铁丝在氯气中燃烧生成FeCl3,而不是FeCl2。
2.B 由图可知,反应①为Fe+CuSO4 FeSO4+Cu,反应②为Fe+2AgNO3 Fe(NO3)2+2Ag,反应③为3Fe+2O2 Fe3O4,反应④为Fe与非氧化性酸的反应,如Fe+H2SO4 FeSO4+H2↑或Fe+2HCl FeCl2+H2↑等。反应①中,固体由Fe(相对原子质量为56)变为Cu(相对原子质量为64),固体质量增大,A错误;Ag为银白色固体,B正确;铁丝在空气中不能燃烧,C错误;Fe与HCl反应生成FeCl2和H2,D错误。
3.D 维生素C和FeCl3反应生成FeCl2,Fe元素化合价降低,FeCl3发生还原反应,FeCl3为氧化剂,则维生素C为还原剂,具有还原性,A、B、C正确;1 mol Fe3+被还原为Fe2+,得到1 mol电子,D错误。
4.A Fe3O4中铁元素有+2价、+3价两种价态,A错误。
5.D 维生素C有还原性,能把Fe3+还原成易被人体吸收的Fe2+,A错误;Fe2+与KSCN不反应,向FeCl2溶液中加入KSCN溶液,无明显现象,B错误;向FeCl2溶液中加入NaOH溶液,生成白色沉淀,迅速变为灰绿色,最终变为红褐色,C错误;Fe3+和I-发生反应生成Fe2+和I2,淀粉遇I2变蓝,D正确。
6.C 据图可知,a为Fe、b为FeO、c为Fe(OH)2、d为Fe(OH)3、e为FeCl3。Fe(OH)2具有强还原性,易与空气中O2和水反应生成Fe(OH)3,A正确;FeC2O4在隔绝空气时加热分解生成FeO、CO和CO2,B正确;Fe在高温条件下与水蒸气反应生成Fe3O4和H2,C错误;FeCl3溶液与加入的铜粉反应的化学方程式为2FeCl3+Cu2FeCl2+CuCl2,属于氧化还原反应,D正确。
7.C 向某溶液中滴入KSCN溶液,溶液变为血红色,该现象可以证明存在Fe3+,但无法确定Fe2+是否存在,A错误;原溶液可能含Fe2+而不含Fe3+,也可能含Fe3+而不含Fe2+,还可能同时含Fe2+、Fe3+,B错误;Fe(OH)3是红褐色沉淀,C正确;Fe(OH)2转化为红褐色Fe(OH)3时会掩盖其他白色沉淀,所以当含Fe2+的溶液中含有Mg2+时,也可能出现题述现象,D错误。
8.B 酸性条件下,N能把Fe2+氧化为Fe3+,即该探究方案不能检验Fe(NO3)2是否变质,A错误;将FeCl3溶液滴入足量HI溶液中,加入CCl4振荡、静置,CCl4层颜色变为紫红色,说明Fe3+把I-氧化为I2,可证明氧化性:Fe3+>I2,B正确;检验溶液中是否含有Fe2+,应先向溶液中滴入几滴KSCN溶液,若无明显现象,再滴加少量氯水,如果溶液变红,说明原溶液中含有Fe2+,C错误;向FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,可证明Fe2+具有还原性,D错误。
9.B 若滴入的NaOH较少,先与盐酸反应,即使铁变质,也不会有红褐色沉淀产生,A错误;若滴加KSCN溶液,溶液变为血红色,可知溶液中含有Fe3+,说明铁粉变质,B正确;若先滴加氯水,Cl2能将Fe2+氧化为Fe3+,则无法判断铁粉是否变质,C错误;滴加KSCN溶液,溶液未变红,说明溶液不含Fe3+,但可能是铁粉部分变质,未变质的铁粉将Fe3+还原,D错误。
名师点睛
检验Fe2+、Fe3+的注意事项
(1)只含Fe2+的溶液
待测液不变色血红色
(2)同时含有Fe2+和Fe3+的溶液
Fe2+对检验Fe3+无干扰,可以滴加KSCN溶液检验Fe3+;Fe3+对检验Fe2+有干扰,不能采用加KSCN溶液和氧化剂的方法检验Fe2+,通常向溶液中滴加适量酸性KMnO4溶液,若溶液紫红色褪去说明含有Fe2+。
10.D 利用稀硫酸和铁反应生成H2,生成的H2排出装置内的空气,验纯后关闭止水夹a;一段时间后,A中压强增大,将FeSO4溶液压入NaOH溶液中,观察到有白色沉淀生成。结合上述分析可知,X不能是浓硫酸,因为常温下铁遇浓硫酸发生钝化,A错误;实验开始时应先打开止水夹a和b,向烧瓶中加入X,使产生的H2排出装置内空气,B错误;反应一段时间后关闭止水夹a,在B中可观察到白色沉淀,C错误;反应结束关闭b及分液漏斗活塞,由于装置内无氧气,Fe(OH)2可较长时间存在,D正确。
11.B Fe与稀硫酸反应生成的氢气将装置内空气排尽,可防止生成的氢氧化亚铁被氧化,①符合题意;开始时打开止水夹a和b,Fe与稀硫酸反应生成的氢气将装置内空气排尽,然后夹紧止水夹a,利用生成的氢气使A中压强增大,将A中液体压入B中,再夹紧止水夹b,可防止生成的氢氧化亚铁被氧化,②符合题意;没有隔绝空气,生成的氢氧化亚铁易被氧化,③不符合题意;苯隔绝空气,可防止生成的氢氧化亚铁被氧化,④符合题意。
能力提升练
1.A 2.A 3.A 4.B 5.B 6.B
1.A 图1中a为Fe,b为FeO,c为Fe2O3,d为Fe(OH)3,e为Fe(OH)2,f为亚铁盐,g为铁盐。f为亚铁盐,可通过反应Fe+2Fe3+ 3Fe2+得到,d为Fe(OH)3,可通过反应4Fe(OH)2+O2+2H2O 4Fe(OH)3得到,均为化合反应,A正确;Fe(OH)3受热分解得到Fe2O3,灼烧应在坩埚中进行,B错误;图3中装置A中的导管没有插入液面以下,生成的硫酸亚铁无法进入B中,无法制备氢氧化亚铁,C错误;Fe与稀盐酸或稀硫酸反应得到亚铁盐,亚铁盐与氯气反应得到铁盐,铁盐不能一步得到Fe(OH)2,D错误。
2.A 向溶液甲中滴加KSCN溶液,溶液变红,说明溶液甲中存在Fe3+,则原矿石样品中存在Fe(Ⅲ),A正确;向溶液乙中滴加KSCN溶液,溶液变红,说明溶液乙中存在Fe3+,但由于已通入Cl2,无法证明原矿石样品中存在Fe(Ⅲ),B错误;溶解矿石样品时盐酸过量,加入少量NaOH溶液,NaOH先与盐酸反应,不一定出现红褐色沉淀,C错误;根据题给信息和反应流程无法确定矿石的成分,D错误。
3.A
Cl2具有强氧化性,无论铁屑是否过量,Fe与干燥Cl2发生反应Ⅰ时只生成FeCl3,A错误;结合反应Ⅱ的化学方程式可知,NaClO为氧化剂,FeCl3为还原剂,即二者物质的量之比为3∶2,B正确;根据Na2FeO4+2KOHK2FeO4↓+2NaOH和复分解反应发生的条件,可知题给条件下的溶解性:Na2FeO4>K2FeO4,C正确;K2FeO4具有强氧化性,可杀菌消毒,同时被还原产生的Fe3+在水中形成Fe(OH)3胶体,可吸附水中的悬浮杂质,从而达到净水的目的,D正确。
知识拓展 K2FeO4具有强氧化性,可使细菌、病毒的蛋白质变性而失去生理活性,可用于饮用水杀菌消毒;K2FeO4得电子被还原产生的Fe3+与水反应产生Fe(OH)3胶体,胶体可以吸附水中悬浮的固体小颗粒,从而达到净化饮用水的目的。
4.B
样品中Fe原子的物质的量为0.04 mol,说明参与反应的H2SO4为0.04 mol,即 0.08 mol H+参与反应,根据样品中含0.48 g O,可知O转化为水消耗的n(H+)= ×2=0.06 mol,则生成H2消耗的H+的物质的量为0.08 mol-0.06 mol= 0.02 mol,由Fe~2H+~H2可知生成0.01 mol H2,在标准状况下体积为224 mL,B正确。
5.B
1.80 gFeC2O4·2H2O的物质的量为n(FeC2O4·2H2O)==0.01 mol,a→b减少的质量为水的质量,减少的水的物质的量n(H2O)==0.02 mol,说明结晶水全部失去,则b点的固体成分为FeC2O4,A错误;由铁原子守恒,可知1.16 g固体中铁的质量为0.56 g,阴离子的质量为(1.16-0.56)g=0.6 g,损失的质量为(1.44-1.16)g= 0.28 g,则b→c的反应为FeC2O4受热分解为FeCO3和CO,B正确;b→c的反应生成的CO的物质的量为n(CO)==0.01 mol,c→d的反应生成CO2的物质的量为n(CO2)==0.01 mol,所以从a→d,生成的CO、CO2的物质的量相等,C错误;加热至250 ℃以上,固体质量略有增加,若FeO与CO反应生成Fe3C,则固体质量减小,D错误。
6.B 实验Ⅰ、Ⅱ、Ⅲ中加入Fe3+的物质的量相等,实验Ⅰ中铜粉少量,消耗的铜粉少于其他两个实验,A正确;实验Ⅱ、Ⅲ均加入过量的铜,后者未产生白色沉淀,结合实验Ⅰ可知能否形成白色沉淀由Cu的量和Cl-共同决定,B不正确;实验Ⅰ、Ⅱ、Ⅲ中溶液黄色变浅或褪去,都发生了反应2Fe3++Cu Cu2++2Fe2+,C正确;Ⅱ中加水后生成的白色沉淀应为CuCl,可能的离子反应:Cu2++Cu+2Cl- 2CuCl,D正确。
7.答案 (1)该补铁剂不溶于水
(2)稀盐酸 KSCN溶液
(3)Fe3+
(4)加入H2O2溶液后,溶液变为深红色
(5)a.KSCN中的硫元素为-2价,SCN-具有还原性,过氧化氢具有氧化性 b.取少量的无色溶液④,滴加KSCN溶液,溶液变为血红色
(6)
(7)Fe2+容易被氧化,而维生素C具有还原性,可以防止Fe2+被氧化
解析 (1)甲同学将药物碾碎、水溶后过滤,取少量滤液,向其中加入K3[Fe(CN)6]溶液未出现明显现象,主要原因为该补铁剂不溶于水。(2)Fe3+能和KSCN溶液反应使溶液变红,而Fe2+不能使KSCN溶液变红,过氧化氢具有强氧化性,能将Fe2+氧化为Fe3+,结合实验流程可知,试剂1是稀盐酸,试剂2是KSCN溶液。(3)含Fe3+的溶液遇KSCN溶液变红,加入试剂2后溶液变为浅红色,说明溶液①中含有Fe3+。(4)加入过氧化氢溶液后,溶液变为深红色,说明Fe2+被氧化,生成了更多的Fe3+,Fe2+与H2O2发生反应的离子方程式为2H++2Fe2++H2O2+2H2O。(5)a.KSCN中的硫元素为-2价,SCN-具有还原性,H2O2具有氧化性,两者可能发生反应导致SCN-被消耗,所以溶液褪色。b.由于SCN-被消耗,溶液变无色,故乙同学要证实甲同学的猜测,可以取少量的无色溶液④,滴加KSCN溶液,溶液变为血红色,证明甲同学的猜测正确。 (6)根据铁原子守恒,m片补铁剂中铁元素质量等于a g氧化铁中铁元素的质量,为 g,则每片该补铁剂含铁元素的质量为 g= g。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025苏教版高中化学必修第二册
第二单元 探究铁及其化合物的转化
基础过关练题组一 单质铁的性质
1.(2024江苏盐城中学模拟)下列关于铁及其性质的说法,不正确的是( )
A.金属铁可以被磁铁吸引
B.铁丝可以在氧气中剧烈燃烧
C.铁有良好的导电、导热性
D.铁丝在氯气中燃烧生成FeCl2
2.(经典题)(2023河北石家庄开学考试)如图是铁与其他物质之间的性质关系(“—”表示相连物质间能发生反应,“→”表示两种物质间的转化关系,部分物质和反应条件已略去),下列有关说法正确的是( )
A.反应①的过程中,固体的质量逐渐减少
B.反应②中有银白色固体析出
C.反应③可通过细铁丝在空气中燃烧实现
D.反应④可能是2Fe+6HCl 2FeCl3+3H2↑
题组二 铁的化合物的性质
3.(2023广东深圳龙华期末)某同学探究FeCl3性质时,发现在FeCl3溶液中滴加KSCN溶液后出现红色,再向溶液中滴加柠檬水(富含维生素C)后红色褪去。下列说法不正确的是( )
A.维生素C具有还原性
B.上述过程中FeCl3发生还原反应
C.上述过程中FeCl3作氧化剂
D.1 mol Fe3+完全转化为Fe2+,共失去1 mol电子
4.下列对铁的化合物的叙述错误的是( )
铁的化合物 铁元素 化合价 部分性质
A Fe3O4 +6价 黑色晶体,具有磁性
B Fe(OH)2 +2价 白色固体,易被氧化
C Fe(OH)3 +3价 红褐色固体,加热失去水生成红棕色固体
D FeCl3 +3价 FeCl3溶液中的Fe3+能被Fe还原成Fe2+
5.(2024河南洛阳月考)铁元素是人体重要的微量元素,参与人体血红蛋白的形成,人体内的Fe大部分是+2价的Fe,Fe2+易被人体吸收,下列有关铁及其化合物的说法正确的是 ( )
A.维生素C具有氧化性,可将难吸收的Fe3+转化为Fe2+,促进人体对铁元素的吸收
B.向FeCl2溶液中加入KSCN溶液,溶液变为血红色
C.向FeCl2溶液中加入NaOH溶液,生成红褐色沉淀
D.FeCl3溶液滴在淀粉-KI试纸上,试纸变蓝
6.(经典题)(2024河北保定二模)部分含铁的纯净物中铁元素化合价与物质类别的关系如下。下列叙述错误的是( )
A.图中相邻物质中c→d在空气里最易转化
B.在隔绝空气条件下加热FeC2O4可得到b
C.在高温下a与水蒸气反应生成b和H2
D.e溶液中加入铜粉,发生氧化还原反应
题组三 Fe3+和Fe2+的检验与转化
7.(经典题)下列离子的检验方法合理的是( )
A.向某溶液中滴入KSCN溶液,溶液变为血红色,说明不含Fe2+
B.向某溶液中通入Cl2,然后加入KSCN溶液,溶液变为血红色,说明原溶液中含有Fe2+
C.向某溶液中加入NaOH溶液,得到红褐色沉淀,说明溶液中含有Fe3+
D.向某溶液中加入NaOH溶液得白色沉淀,又观察到沉淀颜色迅速变为灰绿色,最后变为红褐色,说明溶液中含有Fe2+,不含有Mg2+
8.(2024江苏宿迁月考)室温下,下列实验探究方案能达到目的的是( )
选项 探究方案 探究目的
A 将Fe(NO3)2样品溶于稀盐酸后,滴加KSCN溶液,观察溶液颜色变化 检验Fe(NO3)2是否变质
B 将FeCl3溶液滴入足量HI溶液中,加入CCl4后振荡、静置,观察CCl4层颜色变化 证明氧化性:Fe3+>I2
C 向某溶液中滴加少量氯水,再滴入几滴KSCN溶液,观察现象 检验溶液中是否含有Fe2+
D 向FeSO4溶液中滴加少量酸性KMnO4溶液,观察现象 证明Fe2+具有氧化性
9.(2023重庆南开中学期末)某课外活动小组探究某食品包装袋中还原性铁粉是否变质,分别取少量样品溶于盐酸,然后进行下列实验。下列说法正确的是( )
A.若滴加少量NaOH溶液,无红褐色沉淀产生,说明铁粉未变质
B.若滴加KSCN溶液,溶液变为血红色,说明铁粉变质
C.若先滴加氯水,再滴加KSCN溶液,溶液变为血红色,说明铁粉全部变质
D.若滴加KSCN溶液,溶液未变红,说明铁粉未变质
题组四 氢氧化亚铁的制备
10.(2024江苏天一中学月考)某同学欲利用如图装置制取能较长时间存在的Fe(OH)2,其中实验所用溶液现配现用且蒸馏水先加热煮沸。下列分析正确的是( )
A.X可以是稀硫酸或浓硫酸
B.实验开始时应先关闭止水夹a、打开止水夹b,再向烧瓶中加入X
C.反应一段时间后可在A中观察到白色沉淀
D.反应结束后若关闭b及分液漏斗活塞,则Fe(OH)2可较长时间存在
11.用下列装置做实验(所用稀硫酸和NaOH溶液均预先煮沸处理,FeSO4溶液均为新制的),能较长时间看到 Fe(OH)2白色沉淀的是( )
① ②
③ ④
A.①②③ B.①②④
C.①③④ D.②③④
能力提升练
题组一 铁及其化合物的转化
1.(2024江苏苏州月考)图1为铁元素的价—类二维图。下列推断合理的是( )
图1
图2 图3
A.f、d均可通过化合反应制备
B.可通过图2装置灼烧d得到c
C.可通过图3装置制备物质e
D.a→f→g→e的每步转化均可一步实现
2.(2024河北师大附中月考)为确定某矿石成分,进行如下操作:
下列有关说法正确的是( )
A.向溶液甲中滴加KSCN溶液,溶液变红,则原矿石样品中存在Fe(Ⅲ)
B.向溶液乙中滴加KSCN溶液,溶液变红,则原矿石样品中存在Fe(Ⅲ)
C.向溶液甲中滴加少量NaOH溶液,一定出现红褐色沉淀
D.该矿石一定为赤铁矿
3.(2024江苏淮安期中调研)高铁酸钾(K2FeO4)是一种饮用水处理剂,在水处理过程中,高铁酸钾转化为Fe(OH)3胶体,制备高铁酸钾的流程如图所示,下列叙述不正确的是( )
A.铁屑在干燥的氯气中发生反应Ⅰ时,若铁屑过量,可能生成FeCl2
B.反应Ⅱ中n(氧化剂)∶n(还原剂)=3∶2
C.该条件下,物质的溶解性:Na2FeO4>K2FeO4
D.用K2FeO4对饮用水杀菌消毒的同时,生成的Fe(OH)3胶体可吸附杂质净化水
题组二 与铁及其化合物相关的计算
4.(2024河北张家口开学联考)部分被氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.92 g,经如下处理:
下列说法正确的是( )
A.取少量滤液A,滴加KSCN溶液,溶液变红
B.V=224
C.滤渣Ⅰ的成分是Fe、Cu
D.样品中氧元素的质量是1.6 g
5.(2023河北廊坊第一中学期末)二水合草酸亚铁(FeC2O4·2H2O)是制备某种铁锂电池最常用的原料。国内某科研团队以氮气为保护气,对二水合草酸亚铁的受热分解情况进行研究,生成的气体只含CO、CO2和H2O(g),得到固体的质量与加热温度的变化曲线如图所示。下列说法正确的是( )
A.b点的固体成分为FeC2O4·H2O
B.b→c的化学方程式为FeC2O4FeCO3+CO↑
C.从a→d,生成的CO、CO2的物质的量不相等
D.加热至250 ℃以上,固体质量略有增加,可能是因为FeO与CO反应生成了Fe3C
题组三 与铁的化合物相关的综合实验
6.(2023山东莘县多校期末联考)某兴趣小组同学为研究Cu与Fe3+的反应进行如下实验(已知CuCl为白色固体,微溶于水):
序号 实验步骤 实验现象
Ⅰ 充分振荡,加入2 mL蒸馏水 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象
Ⅱ 充分振荡,加入2 mL蒸馏水 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀
Ⅲ 充分振荡,加入2 mL蒸馏水 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀
下列说法不正确的是( )
A.三个实验中消耗的铜粉的量不完全一样
B.上述实验表明能否形成白色沉淀只取决于加入Cu的量
C.实验Ⅰ、Ⅱ、Ⅲ中均发生了反应2Fe3+++2Fe2+
D.实验Ⅱ中加水后的离子反应可能是Cu2++Cu+2Cl- 2CuCl
7.(2023河北石家庄第二中学期末)铁是人体必需的微量元素,严重缺铁时需要服用补铁剂。实验小组为研究某补铁剂中铁元素的价态及其含量,设计并进行了如下实验:
[查阅资料]1.该补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。
2.KSCN中的硫元素为-2价。
3.K3[Fe(CN)6]与Fe2+反应产生蓝色沉淀。
实验一:检验该补铁剂中铁元素的价态。
(1)已知甲同学为了检验药品中Fe2+的存在,将药物碾碎、水溶后过滤。取少量所得滤液于试管中,加入K3[Fe(CN)6]溶液,未出现明显现象,其主要原因为 。
改进后进行如下操作:
1片
补铁剂接近无色
的溶液①浅红色
溶液②深红色溶液③,又迅
速变为无色溶液④
(2)试剂1是 ,试剂2是 。
(3)加入试剂2后溶液变为浅红色,说明溶液①中含有 。
(4)能证明溶液①中含有Fe2+的实验现象是 。
(5)甲同学猜测深红色溶液③迅速变为无色溶液④的原因可能是溶液中的SCN-与H2O2发生了化学反应。
a.甲同学猜测的依据是 。
b.乙同学通过实验证实了甲同学的猜测,其实验方案及现象是 。
实验二:测定该补铁剂中铁元素的含量。
m片
补铁剂接近无色
的溶液红褐色
沉淀红棕色
固体a g
(6)每片该补铁剂含铁元素的质量为 g。
(7)人体只能吸收Fe2+,医生建议在服用该补铁剂时,同时服用维生素C,理由是 。
答案与分层梯度式解析
第二单元 探究铁及其化合物的转化
基础过关练
1.D 2.B 3.D 4.A 5.D 6.C 7.C 8.B
9.B 10.D 11.B
1.D 氯气具有强氧化性,铁丝在氯气中燃烧生成FeCl3,而不是FeCl2。
2.B 由图可知,反应①为Fe+CuSO4 FeSO4+Cu,反应②为Fe+2AgNO3 Fe(NO3)2+2Ag,反应③为3Fe+2O2 Fe3O4,反应④为Fe与非氧化性酸的反应,如Fe+H2SO4 FeSO4+H2↑或Fe+2HCl FeCl2+H2↑等。反应①中,固体由Fe(相对原子质量为56)变为Cu(相对原子质量为64),固体质量增大,A错误;Ag为银白色固体,B正确;铁丝在空气中不能燃烧,C错误;Fe与HCl反应生成FeCl2和H2,D错误。
3.D 维生素C和FeCl3反应生成FeCl2,Fe元素化合价降低,FeCl3发生还原反应,FeCl3为氧化剂,则维生素C为还原剂,具有还原性,A、B、C正确;1 mol Fe3+被还原为Fe2+,得到1 mol电子,D错误。
4.A Fe3O4中铁元素有+2价、+3价两种价态,A错误。
5.D 维生素C有还原性,能把Fe3+还原成易被人体吸收的Fe2+,A错误;Fe2+与KSCN不反应,向FeCl2溶液中加入KSCN溶液,无明显现象,B错误;向FeCl2溶液中加入NaOH溶液,生成白色沉淀,迅速变为灰绿色,最终变为红褐色,C错误;Fe3+和I-发生反应生成Fe2+和I2,淀粉遇I2变蓝,D正确。
6.C 据图可知,a为Fe、b为FeO、c为Fe(OH)2、d为Fe(OH)3、e为FeCl3。Fe(OH)2具有强还原性,易与空气中O2和水反应生成Fe(OH)3,A正确;FeC2O4在隔绝空气时加热分解生成FeO、CO和CO2,B正确;Fe在高温条件下与水蒸气反应生成Fe3O4和H2,C错误;FeCl3溶液与加入的铜粉反应的化学方程式为2FeCl3+Cu2FeCl2+CuCl2,属于氧化还原反应,D正确。
7.C 向某溶液中滴入KSCN溶液,溶液变为血红色,该现象可以证明存在Fe3+,但无法确定Fe2+是否存在,A错误;原溶液可能含Fe2+而不含Fe3+,也可能含Fe3+而不含Fe2+,还可能同时含Fe2+、Fe3+,B错误;Fe(OH)3是红褐色沉淀,C正确;Fe(OH)2转化为红褐色Fe(OH)3时会掩盖其他白色沉淀,所以当含Fe2+的溶液中含有Mg2+时,也可能出现题述现象,D错误。
8.B 酸性条件下,N能把Fe2+氧化为Fe3+,即该探究方案不能检验Fe(NO3)2是否变质,A错误;将FeCl3溶液滴入足量HI溶液中,加入CCl4振荡、静置,CCl4层颜色变为紫红色,说明Fe3+把I-氧化为I2,可证明氧化性:Fe3+>I2,B正确;检验溶液中是否含有Fe2+,应先向溶液中滴入几滴KSCN溶液,若无明显现象,再滴加少量氯水,如果溶液变红,说明原溶液中含有Fe2+,C错误;向FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,可证明Fe2+具有还原性,D错误。
9.B 若滴入的NaOH较少,先与盐酸反应,即使铁变质,也不会有红褐色沉淀产生,A错误;若滴加KSCN溶液,溶液变为血红色,可知溶液中含有Fe3+,说明铁粉变质,B正确;若先滴加氯水,Cl2能将Fe2+氧化为Fe3+,则无法判断铁粉是否变质,C错误;滴加KSCN溶液,溶液未变红,说明溶液不含Fe3+,但可能是铁粉部分变质,未变质的铁粉将Fe3+还原,D错误。
名师点睛
检验Fe2+、Fe3+的注意事项
(1)只含Fe2+的溶液
待测液不变色血红色
(2)同时含有Fe2+和Fe3+的溶液
Fe2+对检验Fe3+无干扰,可以滴加KSCN溶液检验Fe3+;Fe3+对检验Fe2+有干扰,不能采用加KSCN溶液和氧化剂的方法检验Fe2+,通常向溶液中滴加适量酸性KMnO4溶液,若溶液紫红色褪去说明含有Fe2+。
10.D 利用稀硫酸和铁反应生成H2,生成的H2排出装置内的空气,验纯后关闭止水夹a;一段时间后,A中压强增大,将FeSO4溶液压入NaOH溶液中,观察到有白色沉淀生成。结合上述分析可知,X不能是浓硫酸,因为常温下铁遇浓硫酸发生钝化,A错误;实验开始时应先打开止水夹a和b,向烧瓶中加入X,使产生的H2排出装置内空气,B错误;反应一段时间后关闭止水夹a,在B中可观察到白色沉淀,C错误;反应结束关闭b及分液漏斗活塞,由于装置内无氧气,Fe(OH)2可较长时间存在,D正确。
11.B Fe与稀硫酸反应生成的氢气将装置内空气排尽,可防止生成的氢氧化亚铁被氧化,①符合题意;开始时打开止水夹a和b,Fe与稀硫酸反应生成的氢气将装置内空气排尽,然后夹紧止水夹a,利用生成的氢气使A中压强增大,将A中液体压入B中,再夹紧止水夹b,可防止生成的氢氧化亚铁被氧化,②符合题意;没有隔绝空气,生成的氢氧化亚铁易被氧化,③不符合题意;苯隔绝空气,可防止生成的氢氧化亚铁被氧化,④符合题意。
能力提升练
1.A 2.A 3.A 4.B 5.B 6.B
1.A 图1中a为Fe,b为FeO,c为Fe2O3,d为Fe(OH)3,e为Fe(OH)2,f为亚铁盐,g为铁盐。f为亚铁盐,可通过反应Fe+2Fe3+ 3Fe2+得到,d为Fe(OH)3,可通过反应4Fe(OH)2+O2+2H2O 4Fe(OH)3得到,均为化合反应,A正确;Fe(OH)3受热分解得到Fe2O3,灼烧应在坩埚中进行,B错误;图3中装置A中的导管没有插入液面以下,生成的硫酸亚铁无法进入B中,无法制备氢氧化亚铁,C错误;Fe与稀盐酸或稀硫酸反应得到亚铁盐,亚铁盐与氯气反应得到铁盐,铁盐不能一步得到Fe(OH)2,D错误。
2.A 向溶液甲中滴加KSCN溶液,溶液变红,说明溶液甲中存在Fe3+,则原矿石样品中存在Fe(Ⅲ),A正确;向溶液乙中滴加KSCN溶液,溶液变红,说明溶液乙中存在Fe3+,但由于已通入Cl2,无法证明原矿石样品中存在Fe(Ⅲ),B错误;溶解矿石样品时盐酸过量,加入少量NaOH溶液,NaOH先与盐酸反应,不一定出现红褐色沉淀,C错误;根据题给信息和反应流程无法确定矿石的成分,D错误。
3.A
Cl2具有强氧化性,无论铁屑是否过量,Fe与干燥Cl2发生反应Ⅰ时只生成FeCl3,A错误;结合反应Ⅱ的化学方程式可知,NaClO为氧化剂,FeCl3为还原剂,即二者物质的量之比为3∶2,B正确;根据Na2FeO4+2KOHK2FeO4↓+2NaOH和复分解反应发生的条件,可知题给条件下的溶解性:Na2FeO4>K2FeO4,C正确;K2FeO4具有强氧化性,可杀菌消毒,同时被还原产生的Fe3+在水中形成Fe(OH)3胶体,可吸附水中的悬浮杂质,从而达到净水的目的,D正确。
知识拓展 K2FeO4具有强氧化性,可使细菌、病毒的蛋白质变性而失去生理活性,可用于饮用水杀菌消毒;K2FeO4得电子被还原产生的Fe3+与水反应产生Fe(OH)3胶体,胶体可以吸附水中悬浮的固体小颗粒,从而达到净化饮用水的目的。
4.B
样品中Fe原子的物质的量为0.04 mol,说明参与反应的H2SO4为0.04 mol,即 0.08 mol H+参与反应,根据样品中含0.48 g O,可知O转化为水消耗的n(H+)= ×2=0.06 mol,则生成H2消耗的H+的物质的量为0.08 mol-0.06 mol= 0.02 mol,由Fe~2H+~H2可知生成0.01 mol H2,在标准状况下体积为224 mL,B正确。
5.B
1.80 gFeC2O4·2H2O的物质的量为n(FeC2O4·2H2O)==0.01 mol,a→b减少的质量为水的质量,减少的水的物质的量n(H2O)==0.02 mol,说明结晶水全部失去,则b点的固体成分为FeC2O4,A错误;由铁原子守恒,可知1.16 g固体中铁的质量为0.56 g,阴离子的质量为(1.16-0.56)g=0.6 g,损失的质量为(1.44-1.16)g= 0.28 g,则b→c的反应为FeC2O4受热分解为FeCO3和CO,B正确;b→c的反应生成的CO的物质的量为n(CO)==0.01 mol,c→d的反应生成CO2的物质的量为n(CO2)==0.01 mol,所以从a→d,生成的CO、CO2的物质的量相等,C错误;加热至250 ℃以上,固体质量略有增加,若FeO与CO反应生成Fe3C,则固体质量减小,D错误。
6.B 实验Ⅰ、Ⅱ、Ⅲ中加入Fe3+的物质的量相等,实验Ⅰ中铜粉少量,消耗的铜粉少于其他两个实验,A正确;实验Ⅱ、Ⅲ均加入过量的铜,后者未产生白色沉淀,结合实验Ⅰ可知能否形成白色沉淀由Cu的量和Cl-共同决定,B不正确;实验Ⅰ、Ⅱ、Ⅲ中溶液黄色变浅或褪去,都发生了反应2Fe3++Cu Cu2++2Fe2+,C正确;Ⅱ中加水后生成的白色沉淀应为CuCl,可能的离子反应:Cu2++Cu+2Cl- 2CuCl,D正确。
7.答案 (1)该补铁剂不溶于水
(2)稀盐酸 KSCN溶液
(3)Fe3+
(4)加入H2O2溶液后,溶液变为深红色
(5)a.KSCN中的硫元素为-2价,SCN-具有还原性,过氧化氢具有氧化性 b.取少量的无色溶液④,滴加KSCN溶液,溶液变为血红色
(6)
(7)Fe2+容易被氧化,而维生素C具有还原性,可以防止Fe2+被氧化
解析 (1)甲同学将药物碾碎、水溶后过滤,取少量滤液,向其中加入K3[Fe(CN)6]溶液未出现明显现象,主要原因为该补铁剂不溶于水。(2)Fe3+能和KSCN溶液反应使溶液变红,而Fe2+不能使KSCN溶液变红,过氧化氢具有强氧化性,能将Fe2+氧化为Fe3+,结合实验流程可知,试剂1是稀盐酸,试剂2是KSCN溶液。(3)含Fe3+的溶液遇KSCN溶液变红,加入试剂2后溶液变为浅红色,说明溶液①中含有Fe3+。(4)加入过氧化氢溶液后,溶液变为深红色,说明Fe2+被氧化,生成了更多的Fe3+,Fe2+与H2O2发生反应的离子方程式为2H++2Fe2++H2O2+2H2O。(5)a.KSCN中的硫元素为-2价,SCN-具有还原性,H2O2具有氧化性,两者可能发生反应导致SCN-被消耗,所以溶液褪色。b.由于SCN-被消耗,溶液变无色,故乙同学要证实甲同学的猜测,可以取少量的无色溶液④,滴加KSCN溶液,溶液变为血红色,证明甲同学的猜测正确。 (6)根据铁原子守恒,m片补铁剂中铁元素质量等于a g氧化铁中铁元素的质量,为 g,则每片该补铁剂含铁元素的质量为 g= g。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
