4.1 课时4 原子结构与元素的性质 卤族元素(22页)课件 2024-2025学年高一化学人教版(2019)必修一
文档属性
| 名称 | 4.1 课时4 原子结构与元素的性质 卤族元素(22页)课件 2024-2025学年高一化学人教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 23.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-28 19:29:55 | ||
图片预览





文档简介
(共22张PPT)
卤族元素
第四章 物质结构 元素周期律
宏观辨识与微观探析:
认识卤族元素性质的递变规律,并能用原子结构理论初步加以解释同主族元素性质的递变规律,掌握元素性质与原子结构的关系,培养宏观辨识与微观探析的化学核心素养。
证据推理与模型认知:
通过分析卤族元素的相关性质的图表信息,尝试运用比较、归纳等方法对信息进行加工,培养分析、处理数据的能力,体会事物变化过程中量变引起质变的规律,落实证据推理与模型认知的化学核心素养。
科学探究与创新意识:
能设计实验方案,探究同主族元素性质的递变性,提升“科学探究与创新意识”的学科核心素养。
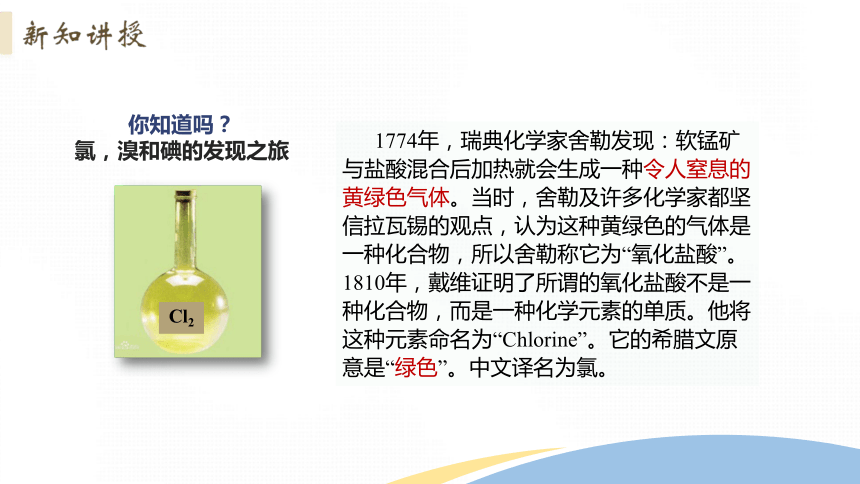
1774年,瑞典化学家舍勒发现:软锰矿与盐酸混合后加热就会生成一种令人窒息的黄绿色气体。当时,舍勒及许多化学家都坚信拉瓦锡的观点,认为这种黄绿色的气体是一种化合物,所以舍勒称它为“氧化盐酸”。1810年,戴维证明了所谓的氧化盐酸不是一种化合物,而是一种化学元素的单质。他将这种元素命名为“Chlorine”。它的希腊文原意是“绿色”。中文译名为氯。
碱金属
卤素元素
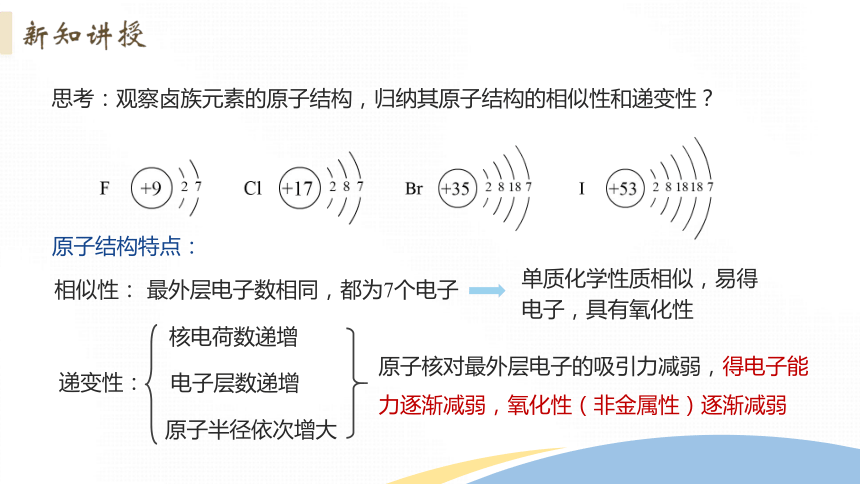
思考:观察卤族元素的原子结构,归纳其原子结构的相似性和递变性?
原子结构特点:
相似性:
最外层电子数相同,都为7个电子
递变性:
核电荷数递增
电子层数递增
原子半径依次增大
原子核对最外层电子的吸引力减弱,得电子能力逐渐减弱,氧化性(非金属性)逐渐减弱
单质化学性质相似,易得电子,具有氧化性
你知道吗?
氯,溴和碘的发现之旅
Cl2
1774年,瑞典化学家舍勒发现:软锰矿与盐酸混合后加热就会生成一种令人窒息的黄绿色气体。当时,舍勒及许多化学家都坚信拉瓦锡的观点,认为这种黄绿色的气体是一种化合物,所以舍勒称它为“氧化盐酸”。1810年,戴维证明了所谓的氧化盐酸不是一种化合物,而是一种化学元素的单质。他将这种元素命名为“Chlorine”。它的希腊文原意是“绿色”。中文译名为氯。
你知道吗?
氯,溴和碘的发现之旅
Br2
1824年,法国青年学生巴拉尔,在研究提取结晶盐后的母液时,当通入氯气时,母液变成红棕色。他断定这是和氯以及碘相似的新元素。1826年8月14日法国科学院组成委员会审查巴拉尔的报告,肯定了他的实验结果,将其命名为:葡萄牙文brōmos(恶臭),因为溴具有刺激性臭味。溴的拉丁名和元素符号Br由此而来。
你知道吗?
氯,溴和碘的发现之旅
1947年前苏联出版的一期《自然》杂志中,其中提到碘的发现说:“……在工作中的库尔图瓦放着两个玻璃瓶,一个是他制药用的,里面盛着海草灰和酒精,另一个里面盛着铁在硫酸中的溶液。库尔图瓦在吃饭,一只公猫撞倒了硫酸瓶和并列在一起的药瓶。器皿被打破了,液体混合起来,一缕蓝紫色的气体从地面上升起……”
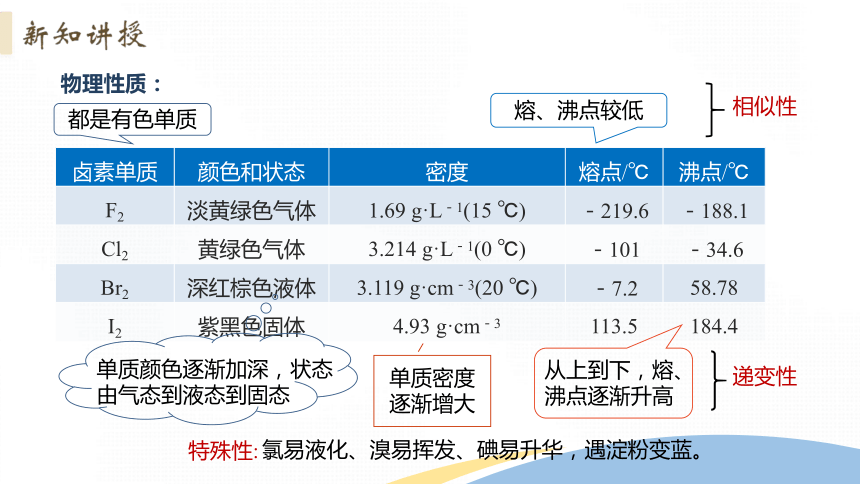
卤素单质 颜色和状态 密度 熔点/℃ 沸点/℃
F2 淡黄绿色气体 1.69 g·L-1(15 ℃) -219.6 -188.1
Cl2 黄绿色气体 3.214 g·L-1(0 ℃) -101 -34.6
Br2 深红棕色液体 3.119 g·cm-3(20 ℃) -7.2 58.78
I2 紫黑色固体 4.93 g·cm-3 113.5 184.4
物理性质:
都是有色单质
熔、沸点较低
相似性
单质密度逐渐增大
从上到下,熔、沸点逐渐升高
单质颜色逐渐加深,状态由气态到液态到固态
递变性
氯易液化、溴易挥发、碘易升华,遇淀粉变蓝。
特殊性:
1.化学性质的相似性
氯气的化学性质
(1)与金属反应
如:3Cl2+2Fe=2FeCl3
(2)与H2反应
Cl2+H2=2HCl(强光照射爆炸)
(3)与水反应
Cl2+H2O==HCl+HClO
(4)与碱反应
Cl2+ 2NaOH = NaCl + NaClO +H2O
①都能与金属反应生成金属卤化物
②都能与氢气反应生成卤化氢(HX)
③都能与水反应
④都能与碱反应
卤素单质的化学性质
(1)X2与金属单质反应
通式: X2+金属 金属卤化物
2Na +Cl2=2NaCl
2Na+Br2=2NaBr
2Na+I2=2NaI
特殊: I2与变价金属生成低价盐
Fe+I2=FeI2 2Cu+I2=2CuI
得到电子的能力逐渐减弱
(2)卤素单质与水反应
Br2+ H2O=====HBr+HBrO
2F2+2H2O=====4HF+O2 (特例)
Cl2 +H2O=====HCl+HClO
通式:X2 + H2O=====HX+HXO(X:Cl、Br、I)
I2 +H2O=====HI+HIO
反应越来越难以发生
名称 反应条件 方程式 生成氢化物的稳定性
F2
Cl2
Br2
I2
H2+F2 === 2HF
H2+Cl2 === 2HCl
H2+Br2 === 2HBr
H2+I2 2HI
光照
或点燃
HF很稳定
HBr较不稳定
HCl稳定
HI很不稳定
反应所需条件逐渐变苛刻
光照或点燃
暗处剧烈反应
高温
高温、持 续加热
气态氢化物的稳定性逐渐减弱
有何相似性和递变性?
稳定性:HF>HCl>HBr>HI; 酸性:HF结论:非金属性:F2 > Cl2>Br2>I2
(3)卤素与氢气的反应
分别向盛有4 mL KBr溶液和4 mL KI溶液的两支试管中加入1mL氯水,振荡,观察溶液的颜色变化,并与氯水的颜色进行比较。写出反应的化学方程式。
向盛有4 mL. KI溶液的试管中加入1mL溴水,振荡,观察溶液的颜色变化,并与溴水的颜色进行比较。写出反应的化学方程式。
(4)卤素间的置换反应
实验操作 实验现象 离子反应方程式 结论
振荡静置后,溶液由无色变为橙黄色
振荡静置后,溶液由无色变为褐色
振荡静置后,溶液由无色变为褐色
Cl2+ 2I- === 2Cl-+I2
Cl2+2Br- === 2Cl-+Br2
Br2+2I- === 2Br-+I2
Cl2>Br2
Cl2>I2
Br2>I2
结论:氧化性:Cl2>Br2>I2
元素非金属性强弱的探究:
元素非金属性强弱的判断:
非金属性
单质与氢气化合的难易程度(易—强)
气态氢化物的稳定性(强—强)
最高价氧化物对应水化物的酸性强弱(强—强)
非金属单质间的置换反应(以强制弱)
阴离子还原性越强,单质的氧化性(非金属性)越弱
根据元素在周期表中的位置,同主族从上到下,非金属性逐渐减弱
化学性质:
2F2 + 2H2O === 4HF + O2 (爆炸)
X2 + H2O HX+ HXO(F除外)
F2的特殊性
X2+ 2NaOH === NaX+ NaXO+H2O (F除外)
3X2+ 6NaOH === 5NaX+ NaXO3+3H2O (F除外)
卤素与水的反应
卤素与碱的反应
3X2 + 2Fe === 2FeX3
△
(X=F、Cl、Br 但≠I 除外)
△
I2 + Fe === FeI2
卤素与金属单质反应
卤素元素原子结构和化学性质的相似性和递变性
(1)相似性
卤素单质X2
1.卤素与氢气的反应:H2+X2 === 2HX
2.卤素与水的反应
3.卤素与碱的反应:
X2 + H2O === HX+ HXO
2F2 + 2H2O === 4HF + O2
X2+ 2NaOH === NaX+ NaXO+H2O (F除外)
具体表现如下:
①与H2反应越来越难,对应氢化物的稳定性逐渐减弱,还原性逐渐增强,
其水溶液的酸性逐渐增强,即:
稳定性:HF>HCl>HBr>HI; 还原性:HF酸性:HF(2)递变性
②最高价氧化物对应水化物的酸性逐渐减弱,即HClO4>HBrO4>HIO4。
1. 卤素按F、Cl、Br、I的顺序其非金属性逐渐减弱的原因是( )
A.原子核内质子数增多起主要作用
B.相对原子质量逐渐增大起主要作用
C.其单质的密度增大起主要作用
D.随着核电荷数增加电子层数增大起主要作用
D
2.下列各项中,碱金属元素随原子序数的增加,跟卤族元素变化不一致的是( )
A. 单质的熔沸点 B. 原子半径
C. 单质的密度 D. 原子的电子层数
A
卤族元素
第四章 物质结构 元素周期律
宏观辨识与微观探析:
认识卤族元素性质的递变规律,并能用原子结构理论初步加以解释同主族元素性质的递变规律,掌握元素性质与原子结构的关系,培养宏观辨识与微观探析的化学核心素养。
证据推理与模型认知:
通过分析卤族元素的相关性质的图表信息,尝试运用比较、归纳等方法对信息进行加工,培养分析、处理数据的能力,体会事物变化过程中量变引起质变的规律,落实证据推理与模型认知的化学核心素养。
科学探究与创新意识:
能设计实验方案,探究同主族元素性质的递变性,提升“科学探究与创新意识”的学科核心素养。
1774年,瑞典化学家舍勒发现:软锰矿与盐酸混合后加热就会生成一种令人窒息的黄绿色气体。当时,舍勒及许多化学家都坚信拉瓦锡的观点,认为这种黄绿色的气体是一种化合物,所以舍勒称它为“氧化盐酸”。1810年,戴维证明了所谓的氧化盐酸不是一种化合物,而是一种化学元素的单质。他将这种元素命名为“Chlorine”。它的希腊文原意是“绿色”。中文译名为氯。
碱金属
卤素元素
思考:观察卤族元素的原子结构,归纳其原子结构的相似性和递变性?
原子结构特点:
相似性:
最外层电子数相同,都为7个电子
递变性:
核电荷数递增
电子层数递增
原子半径依次增大
原子核对最外层电子的吸引力减弱,得电子能力逐渐减弱,氧化性(非金属性)逐渐减弱
单质化学性质相似,易得电子,具有氧化性
你知道吗?
氯,溴和碘的发现之旅
Cl2
1774年,瑞典化学家舍勒发现:软锰矿与盐酸混合后加热就会生成一种令人窒息的黄绿色气体。当时,舍勒及许多化学家都坚信拉瓦锡的观点,认为这种黄绿色的气体是一种化合物,所以舍勒称它为“氧化盐酸”。1810年,戴维证明了所谓的氧化盐酸不是一种化合物,而是一种化学元素的单质。他将这种元素命名为“Chlorine”。它的希腊文原意是“绿色”。中文译名为氯。
你知道吗?
氯,溴和碘的发现之旅
Br2
1824年,法国青年学生巴拉尔,在研究提取结晶盐后的母液时,当通入氯气时,母液变成红棕色。他断定这是和氯以及碘相似的新元素。1826年8月14日法国科学院组成委员会审查巴拉尔的报告,肯定了他的实验结果,将其命名为:葡萄牙文brōmos(恶臭),因为溴具有刺激性臭味。溴的拉丁名和元素符号Br由此而来。
你知道吗?
氯,溴和碘的发现之旅
1947年前苏联出版的一期《自然》杂志中,其中提到碘的发现说:“……在工作中的库尔图瓦放着两个玻璃瓶,一个是他制药用的,里面盛着海草灰和酒精,另一个里面盛着铁在硫酸中的溶液。库尔图瓦在吃饭,一只公猫撞倒了硫酸瓶和并列在一起的药瓶。器皿被打破了,液体混合起来,一缕蓝紫色的气体从地面上升起……”
卤素单质 颜色和状态 密度 熔点/℃ 沸点/℃
F2 淡黄绿色气体 1.69 g·L-1(15 ℃) -219.6 -188.1
Cl2 黄绿色气体 3.214 g·L-1(0 ℃) -101 -34.6
Br2 深红棕色液体 3.119 g·cm-3(20 ℃) -7.2 58.78
I2 紫黑色固体 4.93 g·cm-3 113.5 184.4
物理性质:
都是有色单质
熔、沸点较低
相似性
单质密度逐渐增大
从上到下,熔、沸点逐渐升高
单质颜色逐渐加深,状态由气态到液态到固态
递变性
氯易液化、溴易挥发、碘易升华,遇淀粉变蓝。
特殊性:
1.化学性质的相似性
氯气的化学性质
(1)与金属反应
如:3Cl2+2Fe=2FeCl3
(2)与H2反应
Cl2+H2=2HCl(强光照射爆炸)
(3)与水反应
Cl2+H2O==HCl+HClO
(4)与碱反应
Cl2+ 2NaOH = NaCl + NaClO +H2O
①都能与金属反应生成金属卤化物
②都能与氢气反应生成卤化氢(HX)
③都能与水反应
④都能与碱反应
卤素单质的化学性质
(1)X2与金属单质反应
通式: X2+金属 金属卤化物
2Na +Cl2=2NaCl
2Na+Br2=2NaBr
2Na+I2=2NaI
特殊: I2与变价金属生成低价盐
Fe+I2=FeI2 2Cu+I2=2CuI
得到电子的能力逐渐减弱
(2)卤素单质与水反应
Br2+ H2O=====HBr+HBrO
2F2+2H2O=====4HF+O2 (特例)
Cl2 +H2O=====HCl+HClO
通式:X2 + H2O=====HX+HXO(X:Cl、Br、I)
I2 +H2O=====HI+HIO
反应越来越难以发生
名称 反应条件 方程式 生成氢化物的稳定性
F2
Cl2
Br2
I2
H2+F2 === 2HF
H2+Cl2 === 2HCl
H2+Br2 === 2HBr
H2+I2 2HI
光照
或点燃
HF很稳定
HBr较不稳定
HCl稳定
HI很不稳定
反应所需条件逐渐变苛刻
光照或点燃
暗处剧烈反应
高温
高温、持 续加热
气态氢化物的稳定性逐渐减弱
有何相似性和递变性?
稳定性:HF>HCl>HBr>HI; 酸性:HF
(3)卤素与氢气的反应
分别向盛有4 mL KBr溶液和4 mL KI溶液的两支试管中加入1mL氯水,振荡,观察溶液的颜色变化,并与氯水的颜色进行比较。写出反应的化学方程式。
向盛有4 mL. KI溶液的试管中加入1mL溴水,振荡,观察溶液的颜色变化,并与溴水的颜色进行比较。写出反应的化学方程式。
(4)卤素间的置换反应
实验操作 实验现象 离子反应方程式 结论
振荡静置后,溶液由无色变为橙黄色
振荡静置后,溶液由无色变为褐色
振荡静置后,溶液由无色变为褐色
Cl2+ 2I- === 2Cl-+I2
Cl2+2Br- === 2Cl-+Br2
Br2+2I- === 2Br-+I2
Cl2>Br2
Cl2>I2
Br2>I2
结论:氧化性:Cl2>Br2>I2
元素非金属性强弱的探究:
元素非金属性强弱的判断:
非金属性
单质与氢气化合的难易程度(易—强)
气态氢化物的稳定性(强—强)
最高价氧化物对应水化物的酸性强弱(强—强)
非金属单质间的置换反应(以强制弱)
阴离子还原性越强,单质的氧化性(非金属性)越弱
根据元素在周期表中的位置,同主族从上到下,非金属性逐渐减弱
化学性质:
2F2 + 2H2O === 4HF + O2 (爆炸)
X2 + H2O HX+ HXO(F除外)
F2的特殊性
X2+ 2NaOH === NaX+ NaXO+H2O (F除外)
3X2+ 6NaOH === 5NaX+ NaXO3+3H2O (F除外)
卤素与水的反应
卤素与碱的反应
3X2 + 2Fe === 2FeX3
△
(X=F、Cl、Br 但≠I 除外)
△
I2 + Fe === FeI2
卤素与金属单质反应
卤素元素原子结构和化学性质的相似性和递变性
(1)相似性
卤素单质X2
1.卤素与氢气的反应:H2+X2 === 2HX
2.卤素与水的反应
3.卤素与碱的反应:
X2 + H2O === HX+ HXO
2F2 + 2H2O === 4HF + O2
X2+ 2NaOH === NaX+ NaXO+H2O (F除外)
具体表现如下:
①与H2反应越来越难,对应氢化物的稳定性逐渐减弱,还原性逐渐增强,
其水溶液的酸性逐渐增强,即:
稳定性:HF>HCl>HBr>HI; 还原性:HF
②最高价氧化物对应水化物的酸性逐渐减弱,即HClO4>HBrO4>HIO4。
1. 卤素按F、Cl、Br、I的顺序其非金属性逐渐减弱的原因是( )
A.原子核内质子数增多起主要作用
B.相对原子质量逐渐增大起主要作用
C.其单质的密度增大起主要作用
D.随着核电荷数增加电子层数增大起主要作用
D
2.下列各项中,碱金属元素随原子序数的增加,跟卤族元素变化不一致的是( )
A. 单质的熔沸点 B. 原子半径
C. 单质的密度 D. 原子的电子层数
A
