4.1 课时3 原子结构与元素的性质 碱金属(20页)课件 2024-2025学年高一化学人教版(2019)必修一
文档属性
| 名称 | 4.1 课时3 原子结构与元素的性质 碱金属(20页)课件 2024-2025学年高一化学人教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 49.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-28 19:32:41 | ||
图片预览




文档简介
(共20张PPT)
碱金属
第四章 物质结构 元素周期律
宏观辨识与微观探析:
通过观察实验现象,分析实验原理,探究认识碱金属元素性质的递变规律,能用原子结构理论初步加以解释同主族元素性质的递变规律,初步掌握元素性质与原子结构的关系,培养宏观辨识与微观探析的化学核心素养。
证据推理与模型认知:
通过碱金属元素的相关性质的图表信息,培养分析、处理数据的能力,尝试运用比较、归纳等方法对信息进行加工,落实证据推理与模型认知的化学核心素养。
科学探究与创新意识:
通过完成碱金属性质的探究实验,初步体验科学探究在化学学科的学习中的重要地位,了解科学探究的基本方法,培养初步的科学探究能力。
为什么能从锂电池联想到开发钠电池?
元素化学性质相似
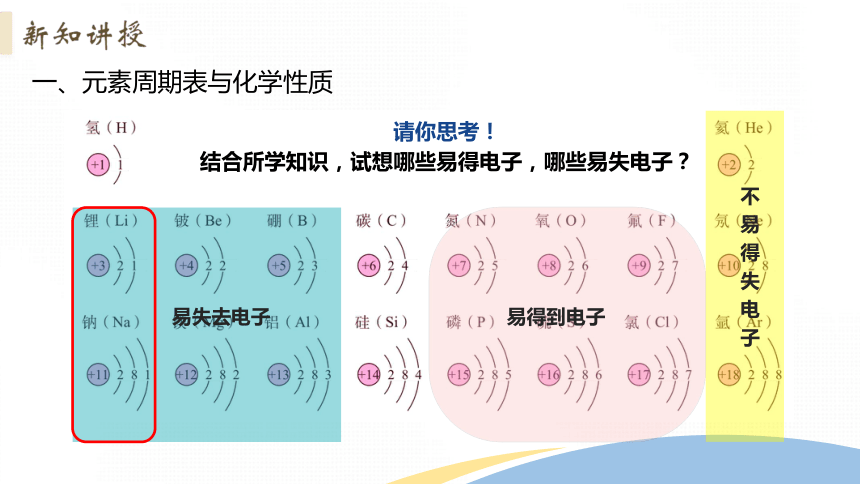
一、元素周期表与化学性质
易失去电子
易得到电子
不易得失电子
请你思考!
结合所学知识,试想哪些易得电子,哪些易失电子?
一、元素周期表与化学性质
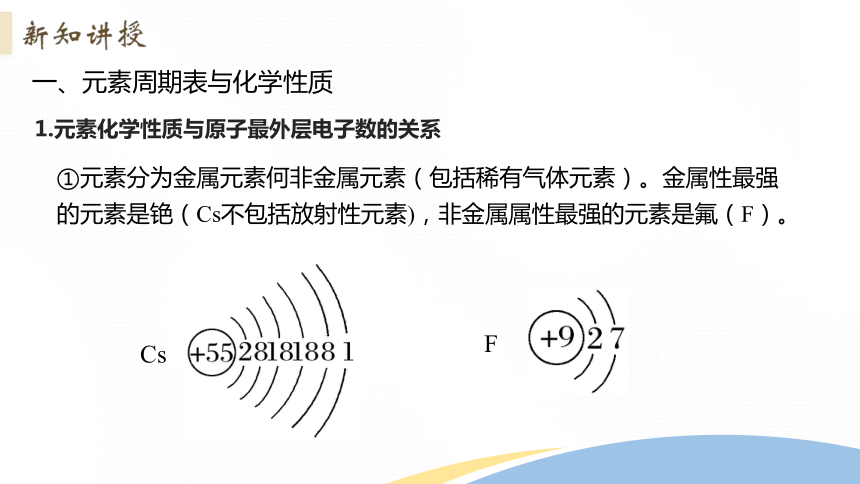
1.元素化学性质与原子最外层电子数的关系
①元素分为金属元素何非金属元素(包括稀有气体元素)。金属性最强的元素是铯(Cs不包括放射性元素),非金属属性最强的元素是氟(F)。
Cs
F
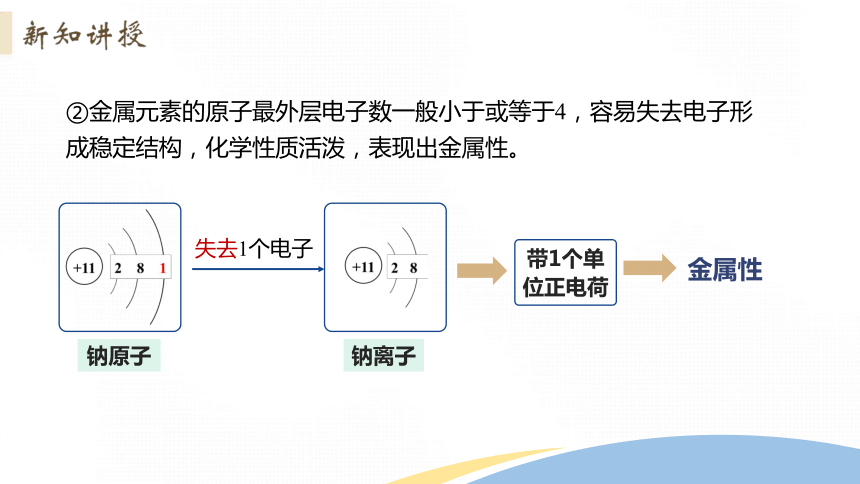
②金属元素的原子最外层电子数一般小于或等于4,容易失去电子形成稳定结构,化学性质活泼,表现出金属性。
失去1个电子
钠离子
带1个单位正电荷
钠原子
金属性
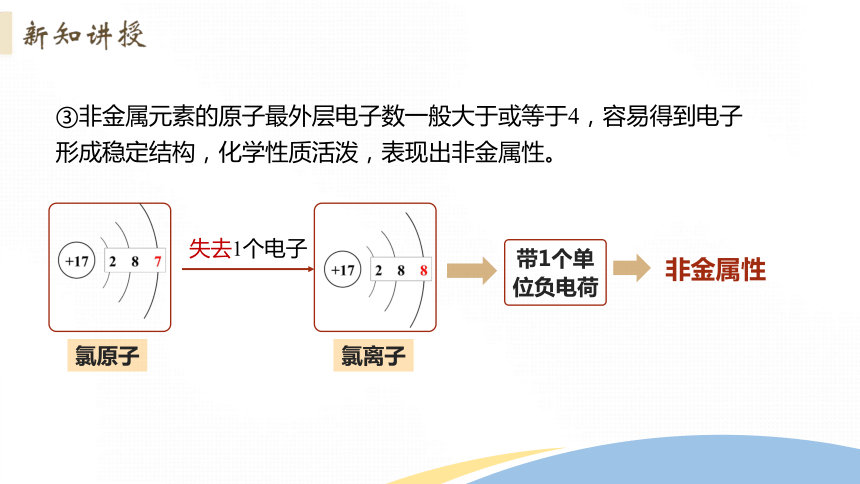
③非金属元素的原子最外层电子数一般大于或等于4,容易得到电子形成稳定结构,化学性质活泼,表现出非金属性。
失去1个电子
带1个单位负电荷
非金属性
氯原子
氯离子
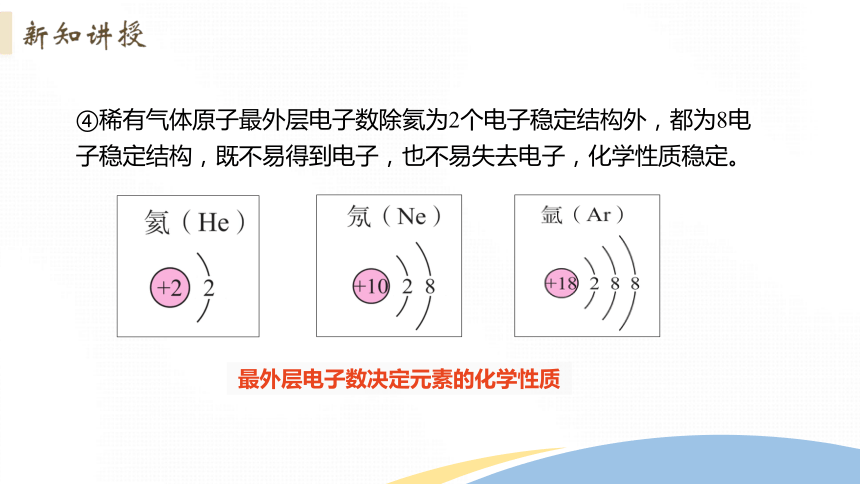
④稀有气体原子最外层电子数除氦为2个电子稳定结构外,都为8电子稳定结构,既不易得到电子,也不易失去电子,化学性质稳定。
最外层电子数决定元素的化学性质
碱金属
卤素元素
二、碱金属
元素名称 元素符号 核电荷数 原子结构示意图 最外层电子数 电子层数 原子半径
( nm)
锂 0.152
钠 0.186
钾 0.227
铷 0.248
铯 0.265
+3
2
1
+11
2
8
1
+19
2
8
8
1
+37
2
8
18
8
1
+55
2
8
18
18
8
1
Na
K
Rb
Li
Cs
3
11
19
37
55
1
1
1
1
1
2
3
4
5
6
原子半径逐渐增大
核电荷数逐渐增大
电子层数逐渐增多
有何相似性和递变性?
【实验探究1】
钾与氧气反应
将干燥的坩埚加热,同时切取一块绿豆大的钾,用镊子夹取并迅速投到热坩埚中,继续加热片刻,待钾熔化后立即撤掉酒精灯,观察现象。
钠 钾
化学性质 在空气中燃烧
反应方程式
K+O2 === KO2 (超氧化钾)
2Na+O2 === Na2O2
剧烈燃烧,产生黄色
火焰,生成淡黄色固体
剧烈燃烧(比钠剧烈),产生
紫色火焰,生成黄色固体
【实验探究2】
钾与水的反应
在烧杯中加入一些水,滴入几滴酚酞溶液。切取一块绿豆大的钾,用镊子夹取并投入水中,观察现象。
钠 钾
化学性质 与水反应
反应方程式
浮、熔、游、响、红
熔成小球,浮在水面上,四处游动,有轻微的爆鸣声,溶液变红(比钠和水反应剧烈)
2Na+2H2O === 2NaOH+H2↑
2K+2H2O === 2KOH+H2↑
碱金属的化学性质:
单质 与氧气反应 与水反应 反应程度 氢氧化物的碱性 结论
Li
Na K Rb Cs 反应越来越剧烈,产物越来越复杂
遇水燃烧,甚至爆炸
2Na+O2 === Na2O2
4Li+O2 === 2Li2O
2Na+2H2O === 2NaOH+H2↑
2K+2H2O ===2KOH+H2↑
2Li+2H2O === 2LiOH+H2↑
反应剧烈程度依次增强
氢氧化物的碱性依次增强
单质的还原性依次增强
均具有还原性
生成的氧化物越来越复杂
K+O2 === KO2
有何相似性和递变性?
碱金属元素原子结构和化学性质的相似性和递变性:
原子半径
化学性
质相似
(1) 易失去电子,表现出强还原性
(2)化合物中显+1价
最外层电子数相同
核电荷数
电子层数
相似性:
递变性:
原子核对最外层电子的吸引力
还原性
失电子能力
金属性
元素名称 Li Na K Rb Cs
原子结构示意图
与O2、H2O反应越来越剧烈、最高价氧化物对应的水化物碱性增强
金属性增强
金属性强弱可以从其单质与水(或酸)反应置换出氢的难易程度,以及它们的最高价氧化物的水化物——氢氧化物的碱性强弱来判断。
还原性、
+3
2
1
+11
2
8
1
+19
2
8
8
1
+37
2
8
18
8
1
+55
2
8
18
18
8
1
元素金属性强弱的判断依据:
金属性:
单质与水或酸反应置换出氢气的难易程度(易—强)
最高价氧化物对应水化物的碱性强弱(强—强)
金属活动顺序表
金属单质间的置换反应(以强制弱)
阳离子氧化性越强,元素的还原性越弱
根据元素在周期表中的位置,同主族从上到下,金属性逐渐增强
物理性质:
碱金属元素 颜色、状态 密度(g·cm-3) 熔点℃ 沸点℃
Li 银白色,柔软 0.534 180.5 1347
Na 银白色,柔软 0.97 97.81 882.9
K 银白色,柔软 63.65 774
Rb 银白色,柔软 1.532 38.89 688
Cs 1.879 28.40 678.4
密度:从上到下,逐渐增大(K特殊)
熔沸点:从上到下,逐渐降低
递变性
相似性
略带金色光泽
0.86
0.86
除铯外,都呈银白色,都较柔软
密度、熔点都较小
保存在石蜡油中
1.化学性质:
2.物理性质:
3.预测:
(1)相似性: ①银白色(Cs略带金色光泽)
②密度较小
③熔点较低
④导热性和导电性好
(2)递变性: ①密度:从Li到Cs,逐渐增大(K特殊)
②熔沸点:从Li到Cs,逐渐降低
位置→结构→性质
(1)相似性:① 具有还原性
② 能与O2 反应
③ 能与H2O 反应
(2)递变性: 还原性、金属性强弱: Li< Na< K< Rb< Cs
1.下列对碱金属性质的叙述不正确的是( )
A. 单质都是柔软的金属,密度都较小
B. 单质在空气中燃烧生成的都是过氧化物
C. 碱金属单质与水剧烈反应生成碱和氢气
D. 单质的熔沸点随着原子序数的增加而降低
2.碱金属元素及其单质从Li→Cs性质递变规律正确的是( )
A. 密度逐渐增大 B. 熔点逐渐升高
C. 金属性逐渐增强 D. 还原性逐渐减弱
B
C
碱金属
第四章 物质结构 元素周期律
宏观辨识与微观探析:
通过观察实验现象,分析实验原理,探究认识碱金属元素性质的递变规律,能用原子结构理论初步加以解释同主族元素性质的递变规律,初步掌握元素性质与原子结构的关系,培养宏观辨识与微观探析的化学核心素养。
证据推理与模型认知:
通过碱金属元素的相关性质的图表信息,培养分析、处理数据的能力,尝试运用比较、归纳等方法对信息进行加工,落实证据推理与模型认知的化学核心素养。
科学探究与创新意识:
通过完成碱金属性质的探究实验,初步体验科学探究在化学学科的学习中的重要地位,了解科学探究的基本方法,培养初步的科学探究能力。
为什么能从锂电池联想到开发钠电池?
元素化学性质相似
一、元素周期表与化学性质
易失去电子
易得到电子
不易得失电子
请你思考!
结合所学知识,试想哪些易得电子,哪些易失电子?
一、元素周期表与化学性质
1.元素化学性质与原子最外层电子数的关系
①元素分为金属元素何非金属元素(包括稀有气体元素)。金属性最强的元素是铯(Cs不包括放射性元素),非金属属性最强的元素是氟(F)。
Cs
F
②金属元素的原子最外层电子数一般小于或等于4,容易失去电子形成稳定结构,化学性质活泼,表现出金属性。
失去1个电子
钠离子
带1个单位正电荷
钠原子
金属性
③非金属元素的原子最外层电子数一般大于或等于4,容易得到电子形成稳定结构,化学性质活泼,表现出非金属性。
失去1个电子
带1个单位负电荷
非金属性
氯原子
氯离子
④稀有气体原子最外层电子数除氦为2个电子稳定结构外,都为8电子稳定结构,既不易得到电子,也不易失去电子,化学性质稳定。
最外层电子数决定元素的化学性质
碱金属
卤素元素
二、碱金属
元素名称 元素符号 核电荷数 原子结构示意图 最外层电子数 电子层数 原子半径
( nm)
锂 0.152
钠 0.186
钾 0.227
铷 0.248
铯 0.265
+3
2
1
+11
2
8
1
+19
2
8
8
1
+37
2
8
18
8
1
+55
2
8
18
18
8
1
Na
K
Rb
Li
Cs
3
11
19
37
55
1
1
1
1
1
2
3
4
5
6
原子半径逐渐增大
核电荷数逐渐增大
电子层数逐渐增多
有何相似性和递变性?
【实验探究1】
钾与氧气反应
将干燥的坩埚加热,同时切取一块绿豆大的钾,用镊子夹取并迅速投到热坩埚中,继续加热片刻,待钾熔化后立即撤掉酒精灯,观察现象。
钠 钾
化学性质 在空气中燃烧
反应方程式
K+O2 === KO2 (超氧化钾)
2Na+O2 === Na2O2
剧烈燃烧,产生黄色
火焰,生成淡黄色固体
剧烈燃烧(比钠剧烈),产生
紫色火焰,生成黄色固体
【实验探究2】
钾与水的反应
在烧杯中加入一些水,滴入几滴酚酞溶液。切取一块绿豆大的钾,用镊子夹取并投入水中,观察现象。
钠 钾
化学性质 与水反应
反应方程式
浮、熔、游、响、红
熔成小球,浮在水面上,四处游动,有轻微的爆鸣声,溶液变红(比钠和水反应剧烈)
2Na+2H2O === 2NaOH+H2↑
2K+2H2O === 2KOH+H2↑
碱金属的化学性质:
单质 与氧气反应 与水反应 反应程度 氢氧化物的碱性 结论
Li
Na K Rb Cs 反应越来越剧烈,产物越来越复杂
遇水燃烧,甚至爆炸
2Na+O2 === Na2O2
4Li+O2 === 2Li2O
2Na+2H2O === 2NaOH+H2↑
2K+2H2O ===2KOH+H2↑
2Li+2H2O === 2LiOH+H2↑
反应剧烈程度依次增强
氢氧化物的碱性依次增强
单质的还原性依次增强
均具有还原性
生成的氧化物越来越复杂
K+O2 === KO2
有何相似性和递变性?
碱金属元素原子结构和化学性质的相似性和递变性:
原子半径
化学性
质相似
(1) 易失去电子,表现出强还原性
(2)化合物中显+1价
最外层电子数相同
核电荷数
电子层数
相似性:
递变性:
原子核对最外层电子的吸引力
还原性
失电子能力
金属性
元素名称 Li Na K Rb Cs
原子结构示意图
与O2、H2O反应越来越剧烈、最高价氧化物对应的水化物碱性增强
金属性增强
金属性强弱可以从其单质与水(或酸)反应置换出氢的难易程度,以及它们的最高价氧化物的水化物——氢氧化物的碱性强弱来判断。
还原性、
+3
2
1
+11
2
8
1
+19
2
8
8
1
+37
2
8
18
8
1
+55
2
8
18
18
8
1
元素金属性强弱的判断依据:
金属性:
单质与水或酸反应置换出氢气的难易程度(易—强)
最高价氧化物对应水化物的碱性强弱(强—强)
金属活动顺序表
金属单质间的置换反应(以强制弱)
阳离子氧化性越强,元素的还原性越弱
根据元素在周期表中的位置,同主族从上到下,金属性逐渐增强
物理性质:
碱金属元素 颜色、状态 密度(g·cm-3) 熔点℃ 沸点℃
Li 银白色,柔软 0.534 180.5 1347
Na 银白色,柔软 0.97 97.81 882.9
K 银白色,柔软 63.65 774
Rb 银白色,柔软 1.532 38.89 688
Cs 1.879 28.40 678.4
密度:从上到下,逐渐增大(K特殊)
熔沸点:从上到下,逐渐降低
递变性
相似性
略带金色光泽
0.86
0.86
除铯外,都呈银白色,都较柔软
密度、熔点都较小
保存在石蜡油中
1.化学性质:
2.物理性质:
3.预测:
(1)相似性: ①银白色(Cs略带金色光泽)
②密度较小
③熔点较低
④导热性和导电性好
(2)递变性: ①密度:从Li到Cs,逐渐增大(K特殊)
②熔沸点:从Li到Cs,逐渐降低
位置→结构→性质
(1)相似性:① 具有还原性
② 能与O2 反应
③ 能与H2O 反应
(2)递变性: 还原性、金属性强弱: Li< Na< K< Rb< Cs
1.下列对碱金属性质的叙述不正确的是( )
A. 单质都是柔软的金属,密度都较小
B. 单质在空气中燃烧生成的都是过氧化物
C. 碱金属单质与水剧烈反应生成碱和氢气
D. 单质的熔沸点随着原子序数的增加而降低
2.碱金属元素及其单质从Li→Cs性质递变规律正确的是( )
A. 密度逐渐增大 B. 熔点逐渐升高
C. 金属性逐渐增强 D. 还原性逐渐减弱
B
C
