3.1《电离平衡》课时巩固练习(基础)2024-2025学年高二上学期化学人教版(2019)选择性必修第一(含答案)
文档属性
| 名称 | 3.1《电离平衡》课时巩固练习(基础)2024-2025学年高二上学期化学人教版(2019)选择性必修第一(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 208.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-28 20:01:02 | ||
图片预览



文档简介
3.1《电离平衡》课时巩固练习(基础)
2024-2025学年高二上学期化学人教版(2019)选择性必修第一
一、选择题:
1、在物质的分类中,下列物质属于弱电解质的是( )
A.NaOH B.CO2 C.CH3COOH D. K2CO3
2、下列关于电离平衡常数的说法中正确的是( )
A. 电离平衡常数越小,表示弱电解质电离能力越弱
B. 电离平衡常数与温度无关
C. 不同浓度的同一弱电解质,电离平衡常数不同
D. 多元弱酸各步电离常数关系为:
3、在相同温度时的醋酸溶液与醋酸溶液相比较,下列数值前者大于后者的是( )
A. B.
C. D.中和时所需
4、下列事实可证明HF是弱酸的是( )
A. 溶液可以导电
B. 溶液与碳酸钙反应,缓慢放出二氧化碳
C.完全中和溶液需要溶液
D.等体积、等pH的盐酸和HF溶液,稀释相同倍数后,盐酸溶液的pH更大
5、根据下列实验不能证明一元酸HR为弱酸的是( )
A.加热HR溶液时,溶液的pH变大
B.室温下,NaR溶液的pH大于7
C.HR溶液中加入少量NaR固体,溶解后溶液的pH变大
D.20℃时,溶液的
6、下列关于盐酸和醋酸,说法错误的是( )
A.当c(HCl)=c(CH3COOH)时,盐酸中的c(H+)更大c(HCl)=c(CH3COOH)
B.当c(H+)相等时,c(HCl)C.当c(Cl-)=c(CH3COO-)时,c(HCl)D.当c(H+)相等时,完全中和等体积的两种酸所需的NaOH用量相同
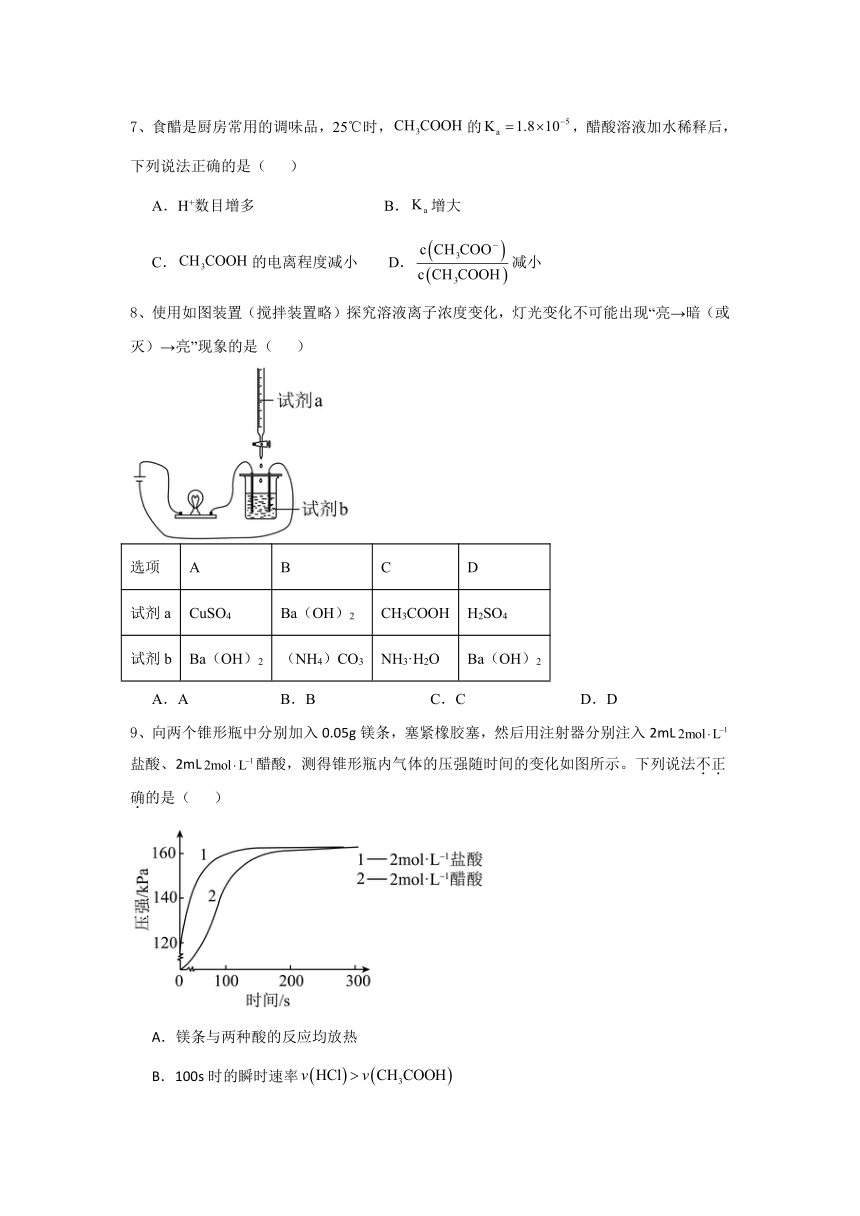
7、食醋是厨房常用的调味品,25℃时,的,醋酸溶液加水稀释后,下列说法正确的是( )
A.H+数目增多 B.增大
C.的电离程度减小 D.减小
8、使用如图装置(搅拌装置略)探究溶液离子浓度变化,灯光变化不可能出现“亮→暗(或灭)→亮”现象的是( )
选项 A B C D
试剂a CuSO4 Ba(OH)2 CH3COOH H2SO4
试剂b Ba(OH)2 (NH4)CO3 NH3·H2O Ba(OH)2
A.A B.B C.C D.D
9、向两个锥形瓶中分别加入0.05g镁条,塞紧橡胶塞,然后用注射器分别注入2mL盐酸、2mL醋酸,测得锥形瓶内气体的压强随时间的变化如图所示。下列说法不正确的是( )
A.镁条与两种酸的反应均放热
B.100s时的瞬时速率
C.醋酸的平均反应速率呈现“慢―快―慢”的趋势
D.300s内平均反应速率
10、某二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-H++A2-(25 ℃时Ka=5.0×10-3),下列有关说法中正确的是( )
A.H2A是弱酸
B.稀释0.1 mol·L-1 H2A溶液,因电离平衡向右移动而导致c(H+)增大
C.若0.1 mol·L-1 NaHA溶液中c(H+)=0.02 mol·L-1,则0.1 mol·L-1的H2A中c(H+)<0.12 mol·L-1
D.在0.1 mol·L-1的H2A溶液中,c(H+)=0.12 mol·L-1
11、下列指定化学用语正确的是( )
A.NaHCO3的电离方程式:NaHCO3=Na++H++
B.HF的电离方程式:HF=H++F-
C.NaHSO4在水溶液中的电离方程式:NaHSO4=Na++H++
D.H2S的电离方程式:H2S 2H++S2-
12、已知25℃时,关于0.1mol/L醋酸溶液,下列说法正确的是( )
A.升高温度,醋酸的电离程度增大,c(H+)增大
B.向该溶液中通入HCl气体,平衡逆向移动,c(H+)减小
C.该温度下1mol/L的醋酸溶液
D.加水稀释后,溶液中增大
13、已知电离常数:,,,,下列离子方程式书写正确的是( )
A.向溶液中滴加HCN:
B.向溶液中通入过量HF:
C.向和NaCN混合溶液中通入少量HF:
D.向NaCN溶液中通入少量:
14、在0.l mol/L的NH3 H2O溶液中存在如下电离平衡:NH3 H2O +OH-。对于该平衡,下列叙述正确的是( )
A.加入少量NaOH固体,溶液中c(OH-)减少
B.通入少量HCl气体,平衡正向移动
C.加水,反应速率增大,平衡逆向移动
D.加入少量NH4Cl固体,平衡正向移动
15、室温下,将1.0 mol·L-1盐酸滴入20 mL 1.0 mol·L-1氨水中,溶液pH随加入盐酸体积变化的曲线如图所示。下列有关说法正确的是( )
A.c()+c(NH3·H2O)=c(Cl-)时,V(盐酸)=20 mL
B.V1>20 mL,此时水的电离程度最大
C.a点,pH=14
D.c点可能存在c()>c(Cl-)>c(H+)
二、非选择题:
16、下列物质中:①Cl2、②CO2、③NH4Cl、④BaSO4、⑤CH3COONa、⑥NaHCO3⑦盐酸、⑧Ba(OH)2、⑨H2O、⑩CH3COOH
(1)属于强电解质的是_______,(填序号)
(2)弱电解质的是_______;(填序号)
(3)写出电离方程式:NaHCO3_______、CH3COOH_______。
(4)25℃,0.1mol/L的下列三种溶液①CH3COOH②HCl③H2SO4。pH由大到小的排列顺序是_______(填选项字母);
A.①>②>③ B.③>②>① C.③>①=②
(5)浓度、体积相同①CH3COOH②HCl③H2SO4这三种溶液用NaOH溶液完全中和时,消耗NaOH的物质的量的大小顺序是_______(填选项字母)。
A.①>②>③ B.③>②>① C.③>①=②
17、常温下,有c(H+)相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
(1)加适量醋酸钠晶体后,醋酸溶液中c(H+) (填“增大”、“减小”或“不变”)。
(2)加水稀释10倍后,溶液中的c(H+):醋酸 盐酸(填“>”、“=”或“<”)。
(3)使温度都升高,溶液中c(H+):醋酸 盐酸(填“>”、“=”或“<”)。
(4)将的加水稀释,有关稀释后醋酸溶液的说法中,正确的是 (填字母)。
a.电离程度增大 b.溶液中离子总数增多
c.溶液导电性增强 d.溶液中醋酸分子增多
18、次磷酸(H3PO2)是一元弱酸,常温下,电离平衡常数Ka(H3PO2)=5.9×10-2,Ka(CH3COOH)=1.8×10-5。
(1)写出次磷酸电离方程式__ 。
(2)将0.1 mol L-1的H3PO2溶液加水稀释,有关稀释后H3PO2溶液的说法中,正确的是_ _(填字母)。
a.电离程度增大 b.溶液中离子总数增多
c.溶液导电性增强 d.溶液中H3PO2分子增多
(3)将少量次磷酸溶液与CH3COONa溶液混合,写出该反应离子方程式_ _。
19、有下列物质的溶液
若四种溶液的物质的量浓度相同,其最大的是__________用序号表示,下同。
若四种溶液的相同,其物质的量浓度最大的是_____________。
将相同的上述四种溶液与反应生成等量氢气,所需时间最短的是_____________。
将溶于水制成溶液,此溶液的物质的量浓度为___________,经测定溶液中为,此温度下醋酸的电离常数__________写出计算式,不必计算最终结果。温度升高,将_______填“变大”、“不变”或“变小”。
现有室温的、、三种溶液。若三种酸相同,完全中和物质的量均相同的三份溶液时,需三种酸的体积大小关系是________________用序号表示。
参考答案
一、选择题:
1、 C 2、A 3、 A 4、 D 5、 A
6、 D 7、A 8、 C 9、B 10、C
11、C 12、A 13、C 14、B 15、A
二、非选择题:
16、【答案】(1)③④⑤⑥⑧ (2)⑨⑩
(3) (4)A (5)C
【解析】(1)根据分析可知,④⑤⑥⑧为强电解质;故答案为④⑤⑥⑧;
(2)根据分析可知,⑨⑩是弱电解质;故答案为⑨⑩;
(3)NaHCO3是盐,属于强电解质,电离方程式为,CH3COOH为弱电解质,电离方程式为;
故答案为,;
(4)0.1mol/L的①CH3COOH、②HCl、③H2SO4,CH3COOH为弱电解质,H+浓度小于0.1mol/L;HCl为强电解质,H+浓度等于0.1mol/L;H2SO4为强电解质,且分子中含有两个可电离出的H,H+浓度等于0.2mol/L;氢离子浓度越大,酸性越强,pH越小,所以有pH大小为①>②>③;
故答案选A;
(5)用NaOH溶液中和浓度、体积相同的①CH3COOH、②HCl、③H2SO4时,消耗的NaOH体积与可电离H+的浓度有关,可电离H+的浓度越大,消耗的NaOH体积越多,可电离H+的浓度为①=②<③;
故答案选C。
17、【答案】(1)减小(2)>(3)>(4)ab
【详解】(1)CH3COOH CH3COO-+H+,加适量醋酸钠晶体后,c(CH3COO-)增大,平衡左移,c(H+)减小;
(2)加水稀释10倍后,醋酸的电离平衡向右移动,n(H+)增大;HCl不存在电离平衡,HCl电离出的n(H+)不变;所以加水稀释10倍后,醋酸溶液中的c(H+)大于盐酸溶液中的c(H+);
(3)使温度都升高20℃,醋酸的电离平衡向电离方向移动,c(H+)增大,HCl已经完全电离,溶液中c(H+),醋酸>盐酸;
(4)a.醋酸是弱电解质,加水稀释醋酸溶液,促进醋酸电离,则醋酸的电离程度增大,故a符合题意;
b.加水稀释醋酸,促进醋酸电离,溶液中离子总数增多,故b符合题意;
c.加水稀释醋酸,虽然促进醋酸电离,溶液中离子个数增多,但离子浓度降低,所以导电能力减弱,故c不符合题意;
d.加水稀释醋酸,促进醋酸电离,导致醋酸分子数减少,故d不符合题意;
答案选ab。
18、【答案】(1)H3PO2H++H2PO (2)ab
(3)H3PO2+CH3COO-CH3COOH+H2PO
【解析】(1)次磷酸(H3PO2)是一元弱酸,在溶液中能够微弱的电离产生H+、H2PO,存在电离平衡,电离方程式为:H3PO2H++H2PO;
(2)a.次磷酸是弱电解质,在溶液中存在电离偏高,向溶液中加水稀释次磷酸溶液,促进次磷酸电离,则次磷酸的电离程度增大,a符合题意;
b.加水稀释次磷酸,促进次磷酸电离,使溶液中离子总数增多,b符合题意;
c.加水稀释次磷酸,虽然促进次磷酸电离,溶液中离子个数增多,但离子浓度降低,所以溶液的导电能力减弱,c不符合题意;
d.加水稀释次磷酸,促进次磷酸电离,导致次磷酸分子数减少,d不符合题意;
答案选ab;
(3)由于电离平衡常数:Ka(H3PO2)>Ka(CH3COOH),所以酸性:H3PO2>CH3COOH,将少量次磷酸溶液与CH3COONa溶液混合,发生反应产生CH3COOH和NaH2PO2,该反应的离子方程式为:H3PO2+CH3COO-CH3COOH+H2PO。
19、【答案】 ; ;变大
【解析】(1)醋酸是一元弱酸、盐酸是一元强酸、硫酸是二元强酸、硫酸氢钠相当于一元强酸,若溶液的物质的量浓度相同,的大小顺序为:,故答案为:;
醋酸是一元弱酸、盐酸是一元强酸、硫酸是二元强酸、硫酸氢钠相当于一元强酸,若溶液的相同,则其物质的量浓度大小顺序为:,故答案为:;
将相同的上述四种溶液与反应生成等量氢气,过程中氢离子浓度越大反应速率越大,需要时间最短,反应过程中弱电解质溶液中氢离子浓度大,所需时间最短的是
故答案为:;
,
;
,,醋酸电离吸热,升温促进电离,电离平衡常数增大,
故答案为: ; ;变大。
当它们相同时,溶液中氢离子浓度相同,假设提供的氢离子,需要醋酸浓度应大于;需要溶液浓度为;、需要 溶液浓度为;其中和等量的烧碱溶液,假设氢氧化钠物质的量为,需要醋酸,需要;需要,需相同的三种酸溶液的体积大小关系是。
2024-2025学年高二上学期化学人教版(2019)选择性必修第一
一、选择题:
1、在物质的分类中,下列物质属于弱电解质的是( )
A.NaOH B.CO2 C.CH3COOH D. K2CO3
2、下列关于电离平衡常数的说法中正确的是( )
A. 电离平衡常数越小,表示弱电解质电离能力越弱
B. 电离平衡常数与温度无关
C. 不同浓度的同一弱电解质,电离平衡常数不同
D. 多元弱酸各步电离常数关系为:
3、在相同温度时的醋酸溶液与醋酸溶液相比较,下列数值前者大于后者的是( )
A. B.
C. D.中和时所需
4、下列事实可证明HF是弱酸的是( )
A. 溶液可以导电
B. 溶液与碳酸钙反应,缓慢放出二氧化碳
C.完全中和溶液需要溶液
D.等体积、等pH的盐酸和HF溶液,稀释相同倍数后,盐酸溶液的pH更大
5、根据下列实验不能证明一元酸HR为弱酸的是( )
A.加热HR溶液时,溶液的pH变大
B.室温下,NaR溶液的pH大于7
C.HR溶液中加入少量NaR固体,溶解后溶液的pH变大
D.20℃时,溶液的
6、下列关于盐酸和醋酸,说法错误的是( )
A.当c(HCl)=c(CH3COOH)时,盐酸中的c(H+)更大c(HCl)=c(CH3COOH)
B.当c(H+)相等时,c(HCl)
7、食醋是厨房常用的调味品,25℃时,的,醋酸溶液加水稀释后,下列说法正确的是( )
A.H+数目增多 B.增大
C.的电离程度减小 D.减小
8、使用如图装置(搅拌装置略)探究溶液离子浓度变化,灯光变化不可能出现“亮→暗(或灭)→亮”现象的是( )
选项 A B C D
试剂a CuSO4 Ba(OH)2 CH3COOH H2SO4
试剂b Ba(OH)2 (NH4)CO3 NH3·H2O Ba(OH)2
A.A B.B C.C D.D
9、向两个锥形瓶中分别加入0.05g镁条,塞紧橡胶塞,然后用注射器分别注入2mL盐酸、2mL醋酸,测得锥形瓶内气体的压强随时间的变化如图所示。下列说法不正确的是( )
A.镁条与两种酸的反应均放热
B.100s时的瞬时速率
C.醋酸的平均反应速率呈现“慢―快―慢”的趋势
D.300s内平均反应速率
10、某二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-H++A2-(25 ℃时Ka=5.0×10-3),下列有关说法中正确的是( )
A.H2A是弱酸
B.稀释0.1 mol·L-1 H2A溶液,因电离平衡向右移动而导致c(H+)增大
C.若0.1 mol·L-1 NaHA溶液中c(H+)=0.02 mol·L-1,则0.1 mol·L-1的H2A中c(H+)<0.12 mol·L-1
D.在0.1 mol·L-1的H2A溶液中,c(H+)=0.12 mol·L-1
11、下列指定化学用语正确的是( )
A.NaHCO3的电离方程式:NaHCO3=Na++H++
B.HF的电离方程式:HF=H++F-
C.NaHSO4在水溶液中的电离方程式:NaHSO4=Na++H++
D.H2S的电离方程式:H2S 2H++S2-
12、已知25℃时,关于0.1mol/L醋酸溶液,下列说法正确的是( )
A.升高温度,醋酸的电离程度增大,c(H+)增大
B.向该溶液中通入HCl气体,平衡逆向移动,c(H+)减小
C.该温度下1mol/L的醋酸溶液
D.加水稀释后,溶液中增大
13、已知电离常数:,,,,下列离子方程式书写正确的是( )
A.向溶液中滴加HCN:
B.向溶液中通入过量HF:
C.向和NaCN混合溶液中通入少量HF:
D.向NaCN溶液中通入少量:
14、在0.l mol/L的NH3 H2O溶液中存在如下电离平衡:NH3 H2O +OH-。对于该平衡,下列叙述正确的是( )
A.加入少量NaOH固体,溶液中c(OH-)减少
B.通入少量HCl气体,平衡正向移动
C.加水,反应速率增大,平衡逆向移动
D.加入少量NH4Cl固体,平衡正向移动
15、室温下,将1.0 mol·L-1盐酸滴入20 mL 1.0 mol·L-1氨水中,溶液pH随加入盐酸体积变化的曲线如图所示。下列有关说法正确的是( )
A.c()+c(NH3·H2O)=c(Cl-)时,V(盐酸)=20 mL
B.V1>20 mL,此时水的电离程度最大
C.a点,pH=14
D.c点可能存在c()>c(Cl-)>c(H+)
二、非选择题:
16、下列物质中:①Cl2、②CO2、③NH4Cl、④BaSO4、⑤CH3COONa、⑥NaHCO3⑦盐酸、⑧Ba(OH)2、⑨H2O、⑩CH3COOH
(1)属于强电解质的是_______,(填序号)
(2)弱电解质的是_______;(填序号)
(3)写出电离方程式:NaHCO3_______、CH3COOH_______。
(4)25℃,0.1mol/L的下列三种溶液①CH3COOH②HCl③H2SO4。pH由大到小的排列顺序是_______(填选项字母);
A.①>②>③ B.③>②>① C.③>①=②
(5)浓度、体积相同①CH3COOH②HCl③H2SO4这三种溶液用NaOH溶液完全中和时,消耗NaOH的物质的量的大小顺序是_______(填选项字母)。
A.①>②>③ B.③>②>① C.③>①=②
17、常温下,有c(H+)相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
(1)加适量醋酸钠晶体后,醋酸溶液中c(H+) (填“增大”、“减小”或“不变”)。
(2)加水稀释10倍后,溶液中的c(H+):醋酸 盐酸(填“>”、“=”或“<”)。
(3)使温度都升高,溶液中c(H+):醋酸 盐酸(填“>”、“=”或“<”)。
(4)将的加水稀释,有关稀释后醋酸溶液的说法中,正确的是 (填字母)。
a.电离程度增大 b.溶液中离子总数增多
c.溶液导电性增强 d.溶液中醋酸分子增多
18、次磷酸(H3PO2)是一元弱酸,常温下,电离平衡常数Ka(H3PO2)=5.9×10-2,Ka(CH3COOH)=1.8×10-5。
(1)写出次磷酸电离方程式__ 。
(2)将0.1 mol L-1的H3PO2溶液加水稀释,有关稀释后H3PO2溶液的说法中,正确的是_ _(填字母)。
a.电离程度增大 b.溶液中离子总数增多
c.溶液导电性增强 d.溶液中H3PO2分子增多
(3)将少量次磷酸溶液与CH3COONa溶液混合,写出该反应离子方程式_ _。
19、有下列物质的溶液
若四种溶液的物质的量浓度相同,其最大的是__________用序号表示,下同。
若四种溶液的相同,其物质的量浓度最大的是_____________。
将相同的上述四种溶液与反应生成等量氢气,所需时间最短的是_____________。
将溶于水制成溶液,此溶液的物质的量浓度为___________,经测定溶液中为,此温度下醋酸的电离常数__________写出计算式,不必计算最终结果。温度升高,将_______填“变大”、“不变”或“变小”。
现有室温的、、三种溶液。若三种酸相同,完全中和物质的量均相同的三份溶液时,需三种酸的体积大小关系是________________用序号表示。
参考答案
一、选择题:
1、 C 2、A 3、 A 4、 D 5、 A
6、 D 7、A 8、 C 9、B 10、C
11、C 12、A 13、C 14、B 15、A
二、非选择题:
16、【答案】(1)③④⑤⑥⑧ (2)⑨⑩
(3) (4)A (5)C
【解析】(1)根据分析可知,④⑤⑥⑧为强电解质;故答案为④⑤⑥⑧;
(2)根据分析可知,⑨⑩是弱电解质;故答案为⑨⑩;
(3)NaHCO3是盐,属于强电解质,电离方程式为,CH3COOH为弱电解质,电离方程式为;
故答案为,;
(4)0.1mol/L的①CH3COOH、②HCl、③H2SO4,CH3COOH为弱电解质,H+浓度小于0.1mol/L;HCl为强电解质,H+浓度等于0.1mol/L;H2SO4为强电解质,且分子中含有两个可电离出的H,H+浓度等于0.2mol/L;氢离子浓度越大,酸性越强,pH越小,所以有pH大小为①>②>③;
故答案选A;
(5)用NaOH溶液中和浓度、体积相同的①CH3COOH、②HCl、③H2SO4时,消耗的NaOH体积与可电离H+的浓度有关,可电离H+的浓度越大,消耗的NaOH体积越多,可电离H+的浓度为①=②<③;
故答案选C。
17、【答案】(1)减小(2)>(3)>(4)ab
【详解】(1)CH3COOH CH3COO-+H+,加适量醋酸钠晶体后,c(CH3COO-)增大,平衡左移,c(H+)减小;
(2)加水稀释10倍后,醋酸的电离平衡向右移动,n(H+)增大;HCl不存在电离平衡,HCl电离出的n(H+)不变;所以加水稀释10倍后,醋酸溶液中的c(H+)大于盐酸溶液中的c(H+);
(3)使温度都升高20℃,醋酸的电离平衡向电离方向移动,c(H+)增大,HCl已经完全电离,溶液中c(H+),醋酸>盐酸;
(4)a.醋酸是弱电解质,加水稀释醋酸溶液,促进醋酸电离,则醋酸的电离程度增大,故a符合题意;
b.加水稀释醋酸,促进醋酸电离,溶液中离子总数增多,故b符合题意;
c.加水稀释醋酸,虽然促进醋酸电离,溶液中离子个数增多,但离子浓度降低,所以导电能力减弱,故c不符合题意;
d.加水稀释醋酸,促进醋酸电离,导致醋酸分子数减少,故d不符合题意;
答案选ab。
18、【答案】(1)H3PO2H++H2PO (2)ab
(3)H3PO2+CH3COO-CH3COOH+H2PO
【解析】(1)次磷酸(H3PO2)是一元弱酸,在溶液中能够微弱的电离产生H+、H2PO,存在电离平衡,电离方程式为:H3PO2H++H2PO;
(2)a.次磷酸是弱电解质,在溶液中存在电离偏高,向溶液中加水稀释次磷酸溶液,促进次磷酸电离,则次磷酸的电离程度增大,a符合题意;
b.加水稀释次磷酸,促进次磷酸电离,使溶液中离子总数增多,b符合题意;
c.加水稀释次磷酸,虽然促进次磷酸电离,溶液中离子个数增多,但离子浓度降低,所以溶液的导电能力减弱,c不符合题意;
d.加水稀释次磷酸,促进次磷酸电离,导致次磷酸分子数减少,d不符合题意;
答案选ab;
(3)由于电离平衡常数:Ka(H3PO2)>Ka(CH3COOH),所以酸性:H3PO2>CH3COOH,将少量次磷酸溶液与CH3COONa溶液混合,发生反应产生CH3COOH和NaH2PO2,该反应的离子方程式为:H3PO2+CH3COO-CH3COOH+H2PO。
19、【答案】 ; ;变大
【解析】(1)醋酸是一元弱酸、盐酸是一元强酸、硫酸是二元强酸、硫酸氢钠相当于一元强酸,若溶液的物质的量浓度相同,的大小顺序为:,故答案为:;
醋酸是一元弱酸、盐酸是一元强酸、硫酸是二元强酸、硫酸氢钠相当于一元强酸,若溶液的相同,则其物质的量浓度大小顺序为:,故答案为:;
将相同的上述四种溶液与反应生成等量氢气,过程中氢离子浓度越大反应速率越大,需要时间最短,反应过程中弱电解质溶液中氢离子浓度大,所需时间最短的是
故答案为:;
,
;
,,醋酸电离吸热,升温促进电离,电离平衡常数增大,
故答案为: ; ;变大。
当它们相同时,溶液中氢离子浓度相同,假设提供的氢离子,需要醋酸浓度应大于;需要溶液浓度为;、需要 溶液浓度为;其中和等量的烧碱溶液,假设氢氧化钠物质的量为,需要醋酸,需要;需要,需相同的三种酸溶液的体积大小关系是。
