2025届高考化学基础练作业课件 专题八 水溶液中的离子反应与平衡 课件(144张)
文档属性
| 名称 | 2025届高考化学基础练作业课件 专题八 水溶液中的离子反应与平衡 课件(144张) |  | |
| 格式 | pptx | ||
| 文件大小 | 26.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-03 10:26:04 | ||
图片预览









文档简介
(共144张PPT)
考点22 电离平衡
考点23 水的电离和溶液的pH
考点24 盐类的水解
考点25 沉淀溶解平衡
热考题型11 溶液中微粒浓度大小关系
热考题型12 电解质溶液图像分析
专题综合训练
【考情分析】在高考中,必考,常以图像为载体,考查弱电解质的电离平衡、盐类的水解平衡、沉淀的溶解平衡,
考查角度有微粒浓度比较、影响因素、相关计算等。也会渗透在工艺流程题中和实验题中进行考查。
考点22 电离平衡
01
经典3+2
1.[2024广东部分学校模拟]时,第一步完全电离,第二步电离平衡常数。则 时,
下列说法正确的是( )
B
A. 溶液显碱性
B.溶液中存在
C.的溶液中,
D.向溶液中滴加溶液至中性时,
【解析】第一步完全电离,则溶液中,只电离不水解,溶液显酸性,A项错误; 溶液
中存在物料守恒:,B项正确;的 溶液中,
,,C项错误;向 溶
液中滴加溶液至中性时,, ,故
,D项错误。
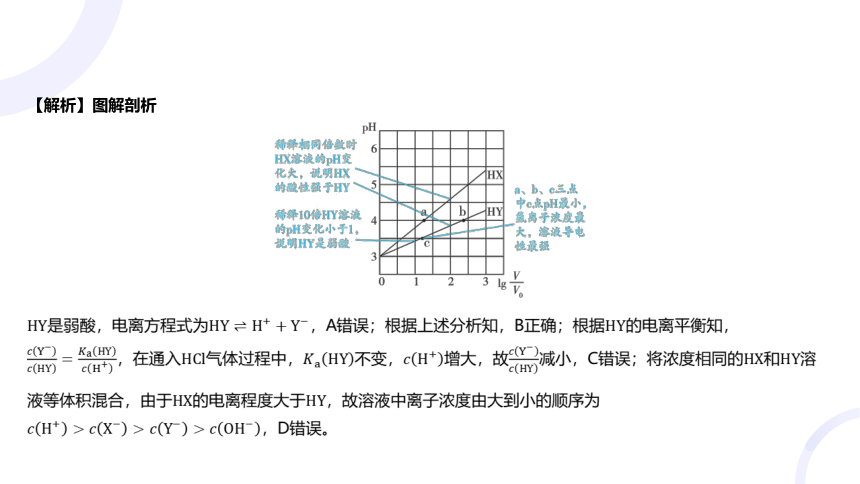
2.[2024天星原创]常温下,将相同、体积均为的和溶液分别加水稀释至体积为,溶液随 的变
化如图所示。下列说法正确的是( )
B
A.的电离方程式为
B.、、三点溶液导电性最强的是 点
C.在的溶液中通入气体, 保持不变
D.将的和溶液等体积混合,溶液中离子浓度最大的是
【解析】图解剖析
是弱酸,电离方程式为,A错误;根据上述分析知,B正确;根据 的电离平衡知,
,在通入气体过程中,不变,增大,故减小,C错误;将浓度相同的和 溶
液等体积混合,由于的电离程度大于 ,故溶液中离子浓度由大到小的顺序为
,D错误。
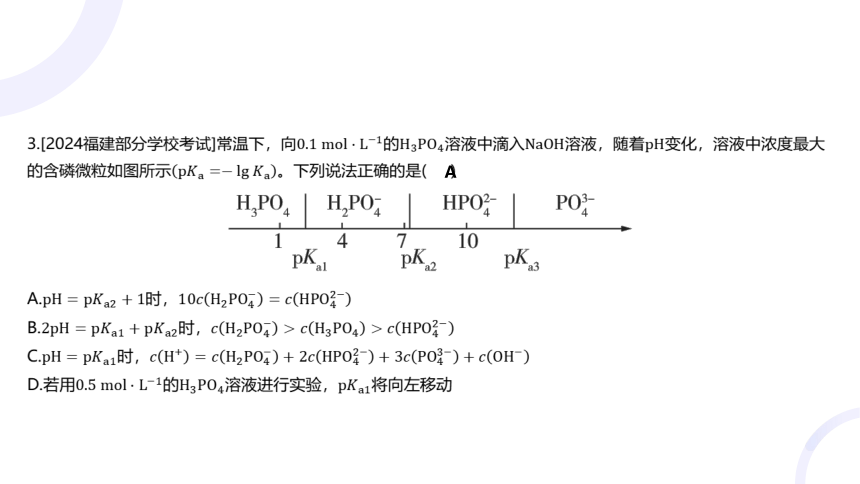
3.[2024福建部分学校考试]常温下,向的溶液中滴入溶液,随着 变化,溶液中浓度最大
的含磷微粒如图所示 。下列说法正确的是( )
A
A.时,
B.时,
C.时,
D.若用的溶液进行实验, 将向左移动
【解析】, ,则
,则 ,即
,A项正确;时,,此时溶液中主要含有 ,根据
可得,
,
则,即,B项错误; 时,根据电荷守恒可知,
,C项错误;电离平衡常数只受温度的影响,故
不移动,D项错误。
4.[2023浙江卷1月]甲酸 是重要的化工原料。工业废水中的甲酸
及其盐,通过离子交换树脂(含固体活性成分, 为烷基)因静电
作用被吸附回收,其回收率(被吸附在树脂上甲酸根的物质的量分数)
与废水初始关系如图(已知甲酸 ),下列说法不正
确的是( )
D
A.活性成分在水中存在平衡:
B.的废水中
C.废水初始,随下降,甲酸的电离被抑制,与 作用
的 数目减少
D.废水初始,离子交换树脂活性成分主要以 形态存在
【解析】活性成分中能与水电离出的形成配位键,因此在水中存在平衡: ,A
项正确;的废水中,,根据甲酸 ,得
,B项正确;废水初始,随下降, 增大,电离平衡
逆向移动,甲酸的电离被抑制,减小,与作用的 数目减少,C项正
确;废水初始时回收率小于,说明吸附在树脂上的甲酸根较少,活性成分主要以 形态存在,D项错
误。
5.[2021湖北卷]常温下,已知溶液中含磷物种的浓度之和为 ,
溶液中各含磷物种的关系如图所示。图中 表示各含磷物种的浓度负
对数,表示的浓度负对数;、、 三
点的坐标:,, 。下列说法正确的是( )
D
A.曲线①表示随 的变化
B. 的结构简式为
C.的溶液中:
D.的平衡常数
【解析】图像分析
图像中含物质只有3种,说明为二元弱酸。随着逐渐增大, 减小,根据
、,知逐渐减小, 先增大后减
小,逐渐增大,,则逐渐增大,先减小后增大, 逐渐减小,
故曲线③表示,曲线②表示,曲线①表示。根据点知,
时,,则的,根据点知, 时,
,则的 。
曲线①表示随的变化,A项错误;为二元弱酸,其结构简式为 ,B项错误;
即,由图可知,此时,,即 ,而
,故 ,C项错误;由
减去,可得 ,则平衡常数
,D项正确。
5-1.变图像[2024河北邯郸部分学校模拟]常温下,向一定浓度的 (亚磷
酸, )溶液中滴加一定浓度的溶液,溶液中 或
随溶液的 的变化关系如图所示。下列叙述正确的是( )
C
A.直线代表与 的关系
B.点对应溶液的
C.的平衡常数为
D.时,
【解析】根据亚磷酸结构可知,其属于二元弱酸,随着溶液增大,减小, 先增大后减小,
增大,则减小,增大,故直线、分别代表、与 的关系,A错
误。
6.[2022湖北卷]如图是亚砷酸和酒石酸混合体系中部分物种的
图(浓度:总为,总为 )。下列说法错误的是( )
D
A.的为
B.的酸性比 的强
C.时,的浓度比 的高
D.时,溶液中浓度最高的物种为
【解析】的,由题图知,时, ,则
,A项正确;的,由题图知, 时,
,则的,故比 的酸性强,B项
正确;时,的浓度略低于,而的浓度略高于 ,
C项正确;结合题干和上述分析知,酒石酸的酸性远强于,且溶液中总的浓度小于总 的浓度,所以当
时,溶液中浓度最高的物种不是 ,D项错误。
6-1.变形式[2024内蒙古呼和浩特监测改编]亚砷酸 可用于治
疗白血病。亚砷酸在溶液中存在多种微粒形态,各种微粒的物质的
量分数与溶液 的关系如图所示。下列说法不正确的是( )
C
A.人体血液的为 ,给药后人体所含砷元素微粒主要是
B. 可发生电离和水解,溶液显碱性
C.当溶液的 时,
D.用 表示微粒的物质的量分数, 时
【解析】据图可知当在之间时,元素的主要存在形式为 ,A项正确;由题图及砷元素的存
在形态可知,可发生电离和水解,溶液显碱性,B项正确;当溶液的时,溶液中阳离子除 外
还有加入的碱的阳离子,则根据电荷守恒有 ,C项错误;
由图可知,当溶液的时,溶液中含的微粒主要有、、,用 表示微粒的物质的量
分数,则 ,D项正确。
创新1+1
1.新角度·酸碱质子理论[2022湖北卷]根据酸碱质子理论,给出质子 的物质是酸,给出质子的能力越强,酸性越
强。已知:
下列酸性强弱顺序正确的是( )
D
A. B.
C. D.
【解析】根据“酸碱质子理论”,由第一个反应可判断酸性 ,由第二个反应可判断酸性
,故D项正确。
2.新角度·不同浓度溶液的电导率[2023北京海淀区练习]分别测定不同浓度溶液、溶液和 溶液的电
导率 数值,测定结果的数据处理如下表。
溶液
溶液 4 839 2 478 1 252
溶液 10 958 5 593 2 797
溶液 267 182 126
已知:代表 溶液的电导率数值;其他条件相同时,电导率越大,溶液导电性越好。
下列说法不正确的是( )
B
A.仅由 的数据不能说明三种电解质的强弱
B.表中数据不能说明同等条件下与 的导电能力强弱
C. 比值数据能说明 存在电离平衡
D.溶液的 数据能说明溶液越稀, 的电离程度越大
【解析】、均为强电解质,不能仅由的数据说明、 电解质的强弱,A项正确;同等条件下,氯
离子浓度相同,氯离子的导电能力相同,溶液的电导率大于溶液的电导率,说明同等条件下 的导电能力
比的导电能力强,B项错误;由表中数据可知,溶液、溶液的 比值数据约等于浓度之比,说明两者
均不存在电离平衡,而溶液的 比值数据却大于浓度之比,说明 存在电离平衡,且由
和的值知,溶液越稀, 的电离程度越大,C项正确,D项正确。
3.新角度·氨水中的平衡[2023河北石家庄质检]时,已知 的氨水中存在如下平衡:
下列说法正确的是( )
C
A.反应①和②互为可逆反应
B.该氨水中存在
C.若该氨水中,则
D.向该氨水中加入硫酸,当 时,溶液呈中性
【解析】可逆反应是指在相同条件下既可正向进行,也可逆向进行的化学反应,反应①和②的反应物和生成物不
完全相同,不互为可逆反应,A项错误;根据电荷守恒,氨水中存在 ,B项错误;反应
反应②可得,则 ,结合电
荷守恒以及,可得 ,C项正确;溶液呈中性,则
,根据电荷守恒,知 ,D项错误。
4.新图像·两种溶液中多条曲线[2024山东日照考试] 时,两种不
同浓度、 的弱
酸溶液中,[即、、 和
]随变化的关系如图所示。为 的电离常数,电离
度 。下列说法错误的是( )
C
A.曲线表示溶液中 的变化情况
B.当溶液的时,溶液中满足
C.点时
D.溶液中的电离度 (忽略水的电离)
【解析】综合分析
的电离方程式为,增大,平衡正向移动,减小, 增大,结合初始浓度
、可知,、、、 曲线代表微粒如图所示。
由上述分析可知,A项正确;在溶液中,、曲线交点处,, ,得
,由图像可知,当溶液的大于时,,B项正确;点溶液中, ,
不满足 ,C项错误;
,D项正确。
考点23 水的电离和溶液的pH
02
经典3+2
1.[2024广东佛山南海区摸底]苯甲酸 是一种弱酸,可用于制备防腐剂苯甲酸钠。下列说法正确的是( )
A
A.稀释苯甲酸钠溶液,溶液的 减小
B.苯甲酸钠溶液中:
C.常温下,的苯甲酸溶液中,水电离的为
D.用 溶液滴定苯甲酸溶液测浓度时,选用甲基橙作指示剂
【解析】苯甲酸是一种弱酸,苯甲酸钠属于强碱弱酸盐,苯甲酸钠溶液由于 的水解而呈碱性:
,稀释苯甲酸钠溶液,能促进的水解,但溶液中减小,溶液的
减小,A项正确;苯甲酸钠溶液中电荷守恒为,由于 的水解是微弱
的,,则 ,B项错误;苯甲酸溶液中苯甲酸电离
出的抑制水的电离,常温下,的苯甲酸溶液中 ,
,则水电离的溶液中的 ,C项错误;
与苯甲酸溶液恰好完全反应生成的苯甲酸钠溶液呈碱性,用 溶液滴定苯甲酸溶液测浓度时应选择碱性
范围内发生颜色变化的指示剂,不能选用甲基橙作指示剂,可选用酚酞作指示剂,D项错误。
2.[2023上海卷]将溶液分别滴入 溶液与
溶液中,其随滴入 溶液体积变化的图像如图所示。
下列说法正确的是( )
D
A.点
B.点:
C.、 点溶液混合后呈酸性
D.水的电离程度:
【解析】点为溶液,由知,溶液中,由 ,
可知,A错误;点溶液为等物质的量的和 的混合溶液,根据电荷守恒,
溶液中,根据物料守恒,溶液中 ,两式联立得
,B错误;点溶液为等物质的量的和的混合溶液,点溶液为 溶液,
两点溶液混合得到、和的混合溶液,且和的物质的量相等,由点溶液(等物质的量的和
的混合溶液)可知,的水解程度大于的电离程度,则、点溶液混合后呈碱性,C错误;和 电
离出的抑制水的电离,电离出的越多,越小,对水的电离抑制程度越大,随溶液的加入, 减少,
水的电离程度增大,恰好完全中和时(加入的溶液为),水的电离程度最大,对比各点对应的 和
溶液体积可知,水的电离程度 ,D正确。
2-1.变角度[2024福建福州质检]室温下,将 溶液滴入
和 的混合溶液,测得混合
溶液的随滴加的 的变化关系如图所示。下列说法正确的是( )
B
A.点时,
B.点时,
C.点时,
D.过程中,水的电离程度大小关系为:
【解析】
为强酸完全电离,为弱酸部分电离,且 电离出的
抑制的电离,所以点,A选项错误; 点加入
溶液,溶液总体积变为原来的两倍,则 减小为
,B选项正确;点溶液为等物质的量的和 的混合
液,存在物料守恒: ,C选项错误;
由上述分析可知,点水的电离程度小于 点,D选项错误。
3.[2024天星原创]室温下,用溶液分别滴定 种一元弱酸溶液,
滴定曲线如图所示(滴定分数,A代表弱酸,B代表 ,曲线从下往上分别代表弱酸的
、4、5、6、7、8、9、10)。下列说法不正确的是( )
B
A.物质的量浓度相等时, 越小,滴定突变越不明显,滴定误差越大
B.滴定分数时,溶液中水的电离程度:溶液 溶液
C.滴定图像中的每种一元弱酸时,均可选择酚酞作为指示剂
D.计算的弱酸溶液的 时,不能忽略水的电离
【解析】由题图可知,越大, 越小,滴定突跃范围越小,允许的误差范围越小,则滴定误差越大,A正确。
由题图可知,滴定分数时,滴定后和 的溶液均呈酸性,即酸的电离大于盐的水解,水的电
离受到抑制,其中的溶液酸性更强,对水的电离抑制程度更大,B错误。题给8种一元弱酸与 溶液恰
好完全反应时,溶液均呈碱性,均可选择酚酞作为指示剂,C正确。由题图可知, 越大,一元弱酸的酸性越弱,
滴定前溶液的 越接近7,此时水的电离不能忽略,D正确。
4.[2023天津南开中学模拟]常温下,已知醋酸的电离常数,向 溶液
中逐滴加入的溶液,溶液中水电离的随加入 溶液体积的变化关系如图所示,下列
说法正确的是(已知 )( )
B
A.、两点对应溶液的 相同
B.点对应溶液中:
C.点对应溶液中,
D.点坐标为
【解析】
5.[2024吉林部分学校模拟]为了更好地表示溶液的酸碱性,科学家提出了酸度的概念: 。常温下,用
的溶液滴定溶液,溶液的酸度随滴入的 溶液体积的变化关系如
图所示(滴定过程中温度的变化忽略不计),已知 ,下列说法错误的是( )
B
A.该过程可以用酚酞作指示剂
B.滴定过程中, 的值逐渐减小
C.常温下,的电离常数
D.当(溶液)时,溶液中存在:
【解析】
6.[2024陕西宝鸡部分学校检测]人体血液存在和 等
缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值 表示
或与的关系如图所示。已知 ,
。下列说法正确的是( )
D
A.曲线Ⅰ表示与 的变化关系
B.点 点的过程中,水的电离程度逐渐减小
C.当增大时, 逐渐减小
D.当时,
【解析】由电离平衡和可知,随增大,溶液中 增大,电离平
衡向右移动,减小,增大,即减小,增大,所以曲线Ⅰ表示与 的变
化关系,曲线Ⅱ表示与的变化关系,A项错误;点点的过程中, 逐渐增大,对水的电离
的促进作用增大,所以水的电离程度逐渐增大,B项错误;根据 和
,可得,当增大时, 的电离被促
进,逐渐增大,、不变,所以 逐渐增大,C项错误;已知
,,当时,,,则此时的
为,由图可推断,时,,说明 ,D项正确。
7.[2023江西南昌模拟]常温下,用的盐酸滴定未知浓度的一元碱 溶液。溶液中,
、的分布分数 随滴加盐酸体积的变化关系如图所示。已知:的分布分数 。下列叙述
正确的是( )
B
A. B.滴定时,可以选择甲基橙作指示剂
C.滴定过程中,水的电离程度: D.点对应溶液中,粒子浓度大小为
【解析】
向溶液中滴加盐酸,溶液的碱性逐渐减弱,碱电离产生的 对水电离的抑制作用逐渐减弱,则在恰好完全
反应前,水的电离程度逐渐增大,因此水的电离程度: ,C错误。
创新1+1
1.新图像·柱状图[2024湘豫名校联考]常温下,向
(一元弱酸)溶液中滴加氨水,溶液 与
的关系如图所示。
下列叙述正确的是( )
D
A. 变化中,水的电离程度一直增大
B.点溶液中:
C.与选择酚酞作指示剂相比,本实验选择甲基橙溶液作指示剂更合适
D.常温下,的数量级为
【解析】综合分析
由物料守恒可知,溶液与氨水恰好反应时,溶液中,溶液中为 ,
由图可知,为1.0时,溶液为7,溶液呈中性,说明与在溶液中的电离程度相同,电离常数相等,
点为等浓度的和的混合溶液,溶液呈酸性,、点为和 的混合溶液,溶液呈碱性。
为1.0时,溶液与氨水恰好反应,反应生成的在溶液中水解促进水的电离,水的电离程度最大, 点为等
浓度的和的混合溶液,、点为和的混合溶液,酸、碱均会抑制水的电离,则 变化中,
水的电离程度先增大后减小,A项错误;点为等浓度的和的混合溶液,溶液呈酸性, ,
结合电荷守恒可知,溶液中,B项错误;为1.0时, 溶液与
氨水恰好反应,溶液为7,溶液更接近酚酞溶液的变色范围 ,所以选择酚酞作指示剂误差更
小,选择酚酞作指示剂比甲基橙(变色范围)更合适,C项错误;由溶液的 为2.85
可知,的电离常数,的电离常数与的电离常数 相等,
,数量级为 ,D项正确。
2.新考法·电流滴定法判断滴定终点[2023山东菏泽模拟]电流滴定法(电压 )是根据电流情况判断滴定
终点,如图1所示(夹持仪器略),仅、同时存在时才能产生电流。可用此法来测定 溶液的浓度。滴
定过程中电流随溶液的体积的变化曲线如图2所示。已知: 。下列说法正确的
是( )
D
图1
图2
A. 为滴定终点
B. 段电流减小是因为离子浓度降低
C.应选用淀粉溶液作指示剂
D.若碘液中含有的,硫代硫酸钠溶液的浓度为
【解析】根据题给信息,仅、同时存在时才能产生电流,处电流最大,说明仍含有 ,没有达到滴定终点,A
项错误;根据,段离子浓度增大,段电流减小是因为 的浓度降低,B项错误;达
到滴定终点时, 完全反应,根据电流为0判断滴定终点,不用再加指示剂,C项错误;根据
, ,则
,D项正确。
3.新考法·电位滴定法[2024湖南名校质检]某研究小组利用电位滴定法研究盐
酸滴定亚磷酸钠溶液过程中的化学变化,得到电极电位 和溶液
随盐酸滴加的体积 变化曲线如图所示[已知:①电位滴定法的原理:在
化学计量点附近,被测离子浓度发生突跃,指示电极电位也发生了突跃,进
而确定滴定终点。②亚磷酸 是二元弱酸,其电离常数分别是
, ]。下列说法正确的是( )
D
A.点对应溶液的溶质为和,
B.第二次电极电位突跃发生的离子反应为
C.水的电离程度:
D.点对应的溶液中一定存在:
【解析】点为第一次电极电位突跃,恰好完成第一步反应,对应溶质为和, 的电离常数
,的水解常数,则 的电离程度大于水解程度,溶液的
,A项错误;发生第二次突跃是和盐酸恰好完全反应,反应是 ,B项错误;
点溶液显酸性,点溶液酸性强于点,加盐酸过程中水的电离程度逐渐减小,因此水的电离程度: ,C项错
误;点对应溶质为、、 ,根据电荷守恒有:
,根据物料守恒可得 ,所以
,D项正确。
考点24 盐类的水解
03
经典3+2
1.[2024广东惠州调研]化学让生活更美好。下列事实与盐类的水解无关的是( )
C
A.用明矾净水 B.用热的纯碱溶液清洗油污
C.用稀盐酸清除铁锈 D.配制 溶液时加入少量盐酸
【解析】明矾电离出的 水解生成氢氧化铝胶体,胶体具有吸附性,可用于净水,A项与盐类的水解有关;纯碱水
解生成 ,加热纯碱水解程度增大,溶液碱性增强,在碱性条件下油脂水解生成溶于水的盐和醇,B项与盐类
的水解有关;铁锈的主要成分为氧化铁,属于碱性氧化物,能与盐酸反应生成盐和水,C项与盐类的水解无关;
为强酸弱碱盐,水解显酸性,配制 溶液时为抑制其水解,要加入少量盐酸,D项与盐类的水解有关。
2.[2023重庆卷] 溶解度随温度变化的曲线如图所示,关于各点
对应的溶液,下列说法正确的是( )
B
A.点等于点
B.点大于点
C. 点降温过程中有2个平衡发生移动
D.点
【解析】点和点温度不同,故 不相等,A错误;升高温度促进铵根
离子的水解,且 点铵根离子的浓度更大,水解生成的氢离子浓度更大,
故点大于点,B正确; 点降温过程中有水的电离平衡、铵根离
子的水解平衡、硫酸铵的溶解平衡3个平衡发生移动,C错误; 点为硫酸铵的不饱和溶液,溶液中存在电荷守恒
,故D错误。
2-1.变物质[2024陕西部分学校考试]某小组为了探究溶液和 溶液的相关
性质,进行如下实验:
实验1:常温下,用计测得溶液的为 ,向溶液中缓慢通
入,使溶质恰好变为(忽略溶液体积变化),测得溶液的 为5.28。
实验2:取溶液,先加热,后降温,测得溶液 与温度的
关系如图所示(忽略溶液体积变化)。下列叙述正确的是( )
A
A.常温下,
B.常温下,
C.,主要原因是升高温度抑制 水解,促进水电离
D.,主要原因是降低温度使 减小
【解析】由实验1可知,亚硫酸氢钠溶液显酸性,故的电离能力大于水解能力, ,A
项正确;向碳酸氢钠溶液中通入,转化为亚硫酸氢钠溶液,说明的酸性比 的强,
,B项错误;升高温度, 的水解程度、水的电离程度均增大,C项错误;如果是因
为降低温度导致水解程度降低,则点溶液和点溶液应该相等,但实验结果表明点溶液高于 点溶液,说明
点溶液中部分被空气中的氧气氧化是导致 减小的主要因素,D项错误。
3.[2023北京东城区练习]室温下,向纯碱(可能含有 )的稀溶液
中逐滴加入盐酸,滴定曲线如图,其中、 为滴定终点。
下列分析正确的是( )
D
A.处溶液,原因是
B.由滴定数据可推知,原纯碱中不含
C.和处的溶液中,均存在
D.原纯碱稀溶液中
【解析】图像分析
、为滴定终点,则发生反应, 发生反应
。设原纯碱溶液中的物质的量为,的物质的量为 ,则
,
, 。
处溶液中的溶质为和,溶液的的主要原因是 ,A项错误;由上
述分析知,原纯碱为和的混合物,B项错误;和 处的溶液中,均存在电荷守恒
,C项错误;原纯碱稀溶液中,
, ,则
,D项正确。
4.[2022江苏卷]一种捕集烟气中的过程如图所示。室温下以
溶液吸收,若通入所引起的溶液体积变化和 挥发可忽略,溶液中含碳
物种的浓度。 电离常数分别为
、 。下列说法正确的是( )
C
A.吸收所得到的溶液中:
B.完全转化为时,溶液中:
C.溶液吸收,溶液中:
D.题图所示的“吸收”“转化”过程中,溶液的温度下降
【解析】吸收可能生成,此时由于以第一步水解为主,故溶液中 ,也可
能生成,由于的水解很微弱,故此时溶液中,还可能生成和 的混合
物,同理,溶液中亦存在,A项错误; 溶液中存在质子守恒
,B项错误;由于溶液的浓度为, ,
即,此等式为溶液的物料守恒式,故此时所得溶液为 溶液,
存在水解平衡,电离平衡,由 可知,
的水解程度大于电离程度,故 ,C项正确;“吸收”时发生的反应和“转化”时发生的反应
均为放热反应(【提醒】以生成为例,“吸收”时发生的反应为 ,“转化”时发生的
反应为 。)
,故溶液的温度升高,D项错误。
4-1.变情境[2024江苏南京六校调研]硫代硫酸钠 的制备和应用相关流程如图所示。
已知:时,的,;的, 。
下列说法正确的是( )
D
A.步骤1所得的溶液中:
B.步骤1过程中时,
C.步骤3所得的清液中:
D.步骤3的离子方程式为
【解析】
由上述分析知,步骤1所得溶液中含、 ,
故A错误;时浓度为 ,则
,
故B错误;步骤3加入了足量的 ,则所得清液中
存在 ,C错误;由步骤3发生的化学反应知,D正确。
5.[2024四川成都七中模拟]时,向 柠檬酸三钠溶液中滴加
的盐酸,用电导率仪测得滴加盐酸体积与溶液电导率的关系如图所示。已知:柠
檬酸(分子式为 ,其结构简式为 )属于三元弱酸,其电离平衡常数的
,,, 。下列说法错误的是( )
D
A.点时溶液中的数量级为
B. 点溶液显酸性
C.点溶液满足:
D.时,溶液满足:
【解析】
,
则, 时,溶液中
,则 ,D项错
误。
6.[2023江苏南京联考]溶液中各含氮(或碳)微粒的分布分数 是指某含氮
(或碳)微粒的浓度占各含氮(或碳)微粒浓度之和的分数。 时,向
的溶液中滴加适量的盐酸或 溶液,溶
液中各含氮(或碳)微粒的分布分数 与 的变化关系如图所示(不考虑
溶液中的和 分子)。下列说法正确的是( )
C
A.
B.点时,溶液中
C.点时,溶液中
D.反应的平衡常数为 ,
【解析】综合分析
由题意可知,向溶液中滴加适量的盐酸时,发生反应,溶液中 减小,
增大;向溶液中滴加适量的溶液时,发生反应 、
,溶液中和均减小,和 均增大,由此推断出曲线①、
②、③、④、⑤分别代表、、、、的分布分数与 的变化关系。
当时,,;当 时,
,;当时, ,
,则
,A错误。点时,, ,
根据电荷守恒得 ,即
,B错误。由题图可知, 点时,溶液中
,C正确。反应 平衡常数
(【技法】采用
“凑常数法”,将表达式中分子、分母同乘以某一离子的浓度,将其转化为与电离常数、水的离子积常数等相关的
表达式进行计算。), ,D错误。
创新1+1
1.新考法·共价化合物的水解 [2024湖北黄冈调研]共价化合物的水解分为亲电水解和亲核水解。发生亲电水解的条
件是中心原子具有孤电子对,能接受的 的进攻,例如:
发生亲核水解的条件是中心原子具有 和空的价层轨道,例如:
D
A.中原子电负性大, 原子难以给出孤电子对,所以较难发生亲电水解
B. 中C原子外围空间小,且没有能量较低的空轨道,所以较难发生亲核水解
C.预测的水解产物为和
D.已知的水解产物为和 ,所以水解类型为亲电水解
【解析】发生亲电水解的条件是中心原子具有孤电子对,能接受的的进攻,中原子电负性大, 原子
难以给出孤电子对,所以较难发生亲电水解,A项正确;发生亲核水解的条件是中心原子具有 和空的价层轨
道,中C原子外围空间小,且没有能量较低的空轨道,所以较难发生亲核水解,B项正确; 可发生亲核水解,
水解产物为和,C项正确;的水解产物为和 ,符合亲核水解规律,D项错误。
下列说法错误的是( )
2.新考法·模块融合(盐类水解+实验探究)[2023广东广州测试节选]醋酸钠 是一种常用的防腐剂和缓
冲剂。
(1)某小组探究外界因素对水解程度的影响。甲同学设计实验方案如下 表中溶液浓度均为
ⅰ.实验___和___(填序号),探究加水稀释对 水解程度的影响;
ⅱ.实验1和3,探究加入对 水解程度的影响;
ⅲ.实验1和4,探究温度对 水解程度的影响。
序号 温度
1 40.0 0 0
2 4.0 0 36.0
3 20.0 10.0
4 40.0 0 0
1
2
①根据甲同学的实验方案,补充数据: ___。
②实验测得,该结果不足以证明加入促进了 的水解。根据__________(填一种微粒的化学
式)的浓度增大可以说明加入能促进 的水解。
③已知水解为吸热反应,甲同学预测,但实验结果为 。实验结果与预测不一致的原因是
_________________________________________________________________________________________。
0
温度升高,水解程度增大,水的电离程度也增大,二者综合影响导致增大,减小
【解题思路】实验1和2只有 的浓度不同,其他条件均相同,根据控制单一变量法,知两实验探究的是加
水稀释对水解程度的影响。①实验1和3,探究加入对水解程度的影响,则 浓度
应保持不变,因此。②加入能促进的水解,则 的浓度增大。
(2)小组通过测定不同温度下的水解常数确定温度对 水解程度的影响。
查阅资料:,为 溶液起始浓度。
试剂与仪器:溶液、盐酸、 计。
实验:测定下的水解常数 ,完成下表中序号7的实验。
序号 实验 记录的数据
5 取溶液,用 盐酸滴定至终点 消耗盐酸体积为
6 测纯水的
7 ________________________________
在和 下重复上述实验。
数据处理:下,_ ________________________(用含、、 的计算式表示)。
实验结论:,温度升高,促进 水解。
测时相同溶液的
或
【解题思路】根据实验5,可计算得到溶液的起始浓度 ,根据实验6,可计算得到
该温度下水的离子积为,因此实验7需测定时相同溶液的,从而计算得到 溶液
中,则 。
考点25 沉淀溶解平衡
04
经典3+2
1.[2023广东佛山考试]牙齿表面存在如下平衡:
。
已知的 。下列说法错误的是( )
B
A.在牙膏中添加适量的磷酸盐,能起到保护牙齿的作用
B.口腔中的食物残渣能产生有机酸,容易导致龋齿,使 增大
C.正常口腔的 接近中性,有利于牙齿健康
D.使用含氟牙膏,当与共存时,
【解析】在牙膏中添加适量的磷酸盐,使平衡 逆向移动,生
成覆盖在牙齿表面,能起到保护牙齿的作用,A项正确; 只与温度有关,与溶液的酸碱性无关,
B项错误;正常口腔的接近中性,防止 溶解,有利于牙齿健康,C项正确;
,D项正确。
2.[2024江西部分学校考试]时,和 的沉淀溶解平衡曲线如图所示。已
知为浓度的负对数, 为阴离子浓度的负对数。下列说法不正确的是( )
B
A.曲线Ⅰ是 的沉淀溶解平衡曲线
B.加热可使溶液由点变到 点
C.点对应的溶液可能为 的过饱和溶液
D.时,的平衡常数
由上述分析可知,曲线Ⅰ为 的沉淀溶解平衡曲
线,若加热, 的沉淀溶解平衡正向移动,溶
液中和会同时增大,则和
均会减小,则加热不能使溶液由点变到 点,B错
误;点在 的沉淀溶解平衡曲线的下方,该点
,即, ,
即 ,则
,故 点对应的溶液可能为
的过饱和溶液,C正确;由反应 可知,
,D正确。
【解析】
3.[2023全国甲卷]如图为、和 在水中达沉淀溶解
平衡时的关系图 ;
可认为离子沉淀完全 。下列叙述正确的是
( )
C
A.由点可求得
B.时的溶解度为
C.浓度均为的和 可通过分步沉淀进行分离
D.、混合溶液中 时二者不会同时沉淀
【解析】点、 ,则
,A错误;时对应的 ,即
,故的溶解度为,B错误;由图可知, 时的
小于时的,则可通过调分步沉淀浓度均为的和 ,C正确;由
图可知,时此时的,由于为定值, 沉淀的过程
中溶液中浓度增大,浓度减小,故、 会同时沉淀,D错误。
3-1.变图像[2024贵州贵阳摸底]易被氧化成 。为验证该事实,某实验小组利用数字化实验设备,从贴有“
”标签的溶液中取样品,逐滴加入 溶液,得到的
溶液 曲线如图所示。关于该实验,下列说法错误的是
已知:, 。( )
C
A.使产生沉淀的范围为
B. 时,产生红褐色沉淀
C.时,溶液中
D. 时,溶液中
【解析】第一步:根据溶度积计算和沉淀的范围。当离子浓度 时认为沉淀完全,根据
、的溶度积计算可得沉淀完全时约为,沉淀完全时约为 ,若样品溶液中的
未被氧化,则开始沉淀时的 约为7。
第二步:分析图像。由题图知,当溶液在范围内时,溶液变化缓慢,说明加入的
并未完全进入溶液中,结合易被氧化成及上面计算的范围知,此时和结合生成了 沉
淀,继续滴加溶液,进入溶液中,变化明显,同理,当溶液在 范围内时
产生沉淀。
第三步:分析选项。由上述分析知,A正确、B正确;时, ,
则, ,
,C错误;时,溶液中 没有完全沉淀,故根据电荷守恒有:
,D正确。
4.[2023浙江卷6月]草酸 是二元弱酸。某小组做如下两组实验:
实验Ⅰ:往溶液中滴加 溶液。
实验Ⅱ:往溶液中滴加 溶液。
已知:的电离常数,, ,溶液混合后体积变化忽略不
计 ,下列说法正确的是( )
D
A.实验Ⅰ可选用甲基橙作指示剂,指示反应终点
B.实验Ⅰ中时,存在
C.实验Ⅱ中发生反应
D.实验Ⅱ中时,溶液中
【解析】实验Ⅰ滴定终点溶液中的溶质是 ,溶液呈碱性,故不能选用甲基橙作指示剂,A错误;实验Ⅰ中
时,溶液中溶质是等物质的量的和, ,故
以电离为主,又,故的电离程度大于 的水解程度,溶液中
,B错误;实验Ⅱ中,当滴加少量的氯化钙时 过量,则初始阶段发生反应
,该反应的平衡常数为
,平衡常
数,说明反应能够进行完全,后面随着氯化钙的加入,和 也会发生反应,C错误;由题给数据
可知,当加入时,溶液中的 浓度为
,由
知,此时溶液中浓度为 ,D正确。
5.[2024山东潍坊部分学校模拟](双选)磷酸银可用于光催化降解含有机物的污水,一段时间后,溶液变为浅的棕黑色,磷酸银催化效果降低。实验室制备少量磷酸银的工艺流程如下:
已知:
;
②常温时, 。
下列说法正确的是( )
AD
A.银氨溶液中的平衡:
B.“析银”离子方程式:
C.“离心沉淀”所得母液中有两种溶质
D.磷酸银催化失效的原因可能是光照分解生成
【解析】关键一步
制备银氨溶液过程中发生反应: ,析银过程中发生
反应: 、
。
已知 、
,由可得:
,A项正确;由上述分析知,“析银”时发生反应:
,B项错误;“离心沉淀”所得母液中有
、、等溶质,C项错误;由溶液变为浅的棕黑色推测,磷酸银光照生成 单质,因此催
化效果降低,D项正确。
6.[2022全国乙卷]废旧铅蓄电池的铅膏中主要含有、、和,还有少量、、 的盐或氧化物等,
为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
一些难溶电解质的溶度积常数如下表:
难溶电解质
一定条件下,一些金属氢氧化物沉淀时的 如下表:
金属氢氧化物
开始沉淀的 2.3 6.8 3.5 7.2
完全沉淀的 3.2 8.3 4.6 9.1
回答下列问题:
(1)在“脱硫”中 转化反应的离子方程式为__________________________________________,
用沉淀溶解平衡原理解释选择 的原因
_ ________________________________________________________________________________________。
该反应的,反应正向进行的程度很大,可以进行到底
【解题思路】的远小于的,易发生生成 的沉淀转化,且进行较为彻底。
【解题思路】的大于的,不易发生生成 的沉淀转化,即使发生,反应进行的程度也很小。
(2)在“脱硫”中,加入不能使铅膏中 完全转化,原因是(
反应
的 ,反应正向进行的程度
很小
)。
(3)在“酸浸”中,除加入醋酸,还要加入 。
能被 氧化的离子是______;
促进了金属在醋酸中转化为 ,其化学方程式为___________________________________;
也能使转化为, 的作用是__________。
作还原剂
【解题思路】具有还原性,能被氧化;能氧化,使其转化成,再与 结合生成
,依据氧化还原反应的规律,即可写出反应的化学方程式;通过与、 反应转化为
,发生氧化还原反应,化合价降低, 作还原剂。
(4)“酸浸”后溶液的约为 ,滤渣的主要成分是_________________________。
、、
【解题思路】根据题给信息,当时,、完全转化为、 ;结合(2)知,加入的
不能使完全转化,故滤渣中还含有 。
(5)“沉铅”的滤液中,金属离子有___________。
、
【解题思路】加入溶液,发生沉铅的反应为 ,故滤液中含有的金属
阳离子有以及未沉淀的 。
【解析】 信息转换
加入使转化为,便于后续的酸浸;通过酸浸,铅元素全部转化为可溶性的 ,过滤
后在滤液中加入溶液,使转化为,加热分解得到 。
创新1+1
1.新图像·电动势与标准溶液体积关系图[2024浙江名校联考]某温度下,用
硝酸银标准溶液对含和的混合溶液进行电位滴定
与的反应可以忽略,获得电动势和硝酸银标准溶液体积 的电位滴定曲线
如图所示。
已知:, 。该温度下,
, 。下列说法不正确的是( )
D
A.主要发生了反应:
B.若为弱酸,则从 ,水的电离程度不断减小
C.原混合溶液中
D.的平衡常数为
【解析】综合分析
,可知含和的混合溶液滴加硝酸银,先与硝酸银反应; 发生反应
、发生反应,发生反应 。
由上述分析可知,A项正确;若为弱酸,则从,发生反应, 浓度减小,对水电离
的促进作用减小,水的电离程度不断减小,B项正确;主要发生了反应: ,则
,原混合溶液中
,C项正确; 的平衡常数为
,D项错误。
2.新考法·模块融合(沉淀溶解平衡+实验)[2024广东部分学校模拟]某学习小组在实验室进行了有关碘化铅
的实验探究。回答下列问题:
Ⅰ.制备 悬浊液
(1)溶液和溶液反应会产生金黄色的 沉淀,形成美丽的“黄金雨”。
① 溶液在空气中久置会变质,其原因是__________________________________。
具有还原性,会被空气中的氧化
②生成 的化学方程式为________________________________。充分反应后,
经一系列操作得到纯净的固体,向其中加入蒸馏水,得到 悬浊液。
Ⅱ.探究浓度对 沉淀溶解平衡的影响
【查阅资料】ⅰ.温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;
时,饱和溶液的电导率为 。
(2)稀释对沉淀溶解平衡的影响:时,向 悬浊液
中加入一定体积的蒸馏水,通过图甲所示装置测定电导率,并得到
电导率随时间变化的曲线(图乙)。
①实验装置中仪器 的名称为____________。
酸式滴定管
②由电导率变化曲线可知,实验中通过仪器 加入蒸馏水的方式是___(填标号)。
B
A.连续逐滴加入 B.分三次快速加入 C.一次性快速加入
③图乙中,_________________段(用字母表示,任写一段)表示达到沉淀溶解平衡状态; 段溶液的电导率
逐渐增大的原因是__________________,溶液中离子浓度不断增大。
或或或
固体不断溶解
(3)对沉淀溶解平衡的影响:时,将悬浊液静置后,取上层清液(即 饱和溶液)
于烧杯中,另取蒸馏水于相同规格的烧杯中进行对比实验,再分别向其中加入
溶液。实验数据记录如表:
累计加入的溶液的体积/ 电导率/ 饱和溶液 蒸馏水
0 368 4
0.50
1.00
①上述实验过程中,增大饱和溶液中 的浓度,可观察到的实验现象是________________。
②利用蒸馏水进行对比实验时,所取蒸馏水的体积为_____ 。
③表格数据______(填“大于”“小于”或“等于”),说明增大的浓度, 沉淀溶解平衡向生成沉
淀的方向移动。
产生金黄色沉淀
200
小于
【解析】 实验分析
实验目的 制备悬浊液并探究 沉淀溶解平衡的影响因素
实验原理
实验现象及 相关分析 增大饱和溶液中的浓度,平衡 逆向移动,可观察到溶液中
产生金黄色沉淀
实验探究及 相关分析 (3)②为保证变量唯一,所取蒸馏水的体积应与所取上层清液的体积相同,即 。
#b#
③增大的浓度,沉淀溶解平衡向生成沉淀的方向移动,导致上层清液中 浓度的增加量小于
蒸馏水中 浓度的增加量,故上层清液的电导率的变化量小于蒸馏水的电导率的变化量,则
小于
【解题思路】
热考题型11 溶液中微粒浓度大小关系
1.[2022重庆卷]某小组模拟成垢-除垢过程如下。
水溶液
忽略体积变化,且步骤②中反应完全。下列说法正确的是( )
D
A.经过步骤①,溶液中
B.经过步骤②,溶液中
C.经过步骤②,溶液中
D.经过步骤③,溶液中
【解析】步骤①,和恰好完全反应,,得到 和
,根据物料守恒 知,A项错误;步骤②,发生反应
,生成,剩余和 ,
,B项错误;经过步骤②,溶液中存在物料守恒 ,C
项错误;步骤③加入冰醋酸,根据物料守恒, ,D项正确。
2.[2023江苏卷]室温下,用含少量的溶液制备的过程如图所示。已知 ,
。下列说法正确的是( )
C
A.溶液中:
B.“除镁”得到的上层清液中:
C.溶液中:
D.“沉锰”后的滤液中:
【解析】根据电荷守恒可知,溶液中存在: ,A错误;“除镁”
得到的上层清液中存在的沉淀溶解平衡,其溶度积常数 ,则
,B错误; 溶液中存在电荷守恒
,物料守恒 ,二者联
立可得,C正确;“沉锰”后的滤液中还存在、 ,故D错误。
3.[2024湖北武汉部分学校调研]常温下,向饱和氯水中以恒定速率滴加 溶液,测
得溶液的随时间的变化如图所示。溶液中氯元素的存在形式仅考虑、 、
、,该过程不考虑 的分解。下列说法错误的是( )
D
A.点:
B.点:
C.从点到点, 逐渐减小
D.从点到 点,水的电离程度逐渐增大
【解析】点为饱和氯水,根据,完全电离, 部分电离,知
,A项正确;点溶液呈中性, ,根据电荷守恒:
,知,B项正确;从点到 点,不断滴加
溶液,减小,,不变,则逐渐减小,C项正确;从点到 点,水的电
离程度先增大后减小,D项错误。
4.[2024天星原创]电导率是衡量电解质溶液导电能力大小的物理量。常温下, 的电离常数
。向浓度均为的和的混合液中滴加 溶
液,测得溶液电导率与加入 溶液体积的关系如图所示。下列说法不正确的是( )
D
A.点溶液中约为
B.、、、四点对应溶液中,水电离程度最大的是 点
C.点对应溶液中:
D.该温度下的溶液在点与 点之间
【解析】
点对应溶液中,电离使溶液呈酸性,点对应溶液中, 水解使溶液呈碱性,常温
下的溶液呈中性,则在点与 点之间,D错误。
5.[2024天星原创]常温常压下,某化学兴趣小组在实验室中先将 缓慢通入饱和食盐水中至饱和,然后向所得
溶液中缓慢通入,测得溶液中水电离的 随通入气体体积的变化曲线如图所示(实验中不考虑氨水的挥
发)。下列叙述正确的是( )
C
A.由点到点的过程中,溶液中 增大
B. 点溶液呈中性
C.点所示溶液中:
D.点所示溶液中:
【解析】
6.[2024天星原创]高铁酸钠是一种品质优良的无机絮凝剂,能高效地
除去水中的微细悬浮物。常温下,将一定量稀硫酸逐滴滴入高铁酸钠
溶液中,溶液中含铁微粒存在平衡:
; ;
。各含铁微粒的物质的量分数
,表示含铁微粒]随 变化如图。下列说法不正确
的是( )
D
A.
B.随着的增大,溶液中 的值不变
C.点对应溶液中:
D.常温下,反应的平衡常数
,温度不变,、不变,则随着的增大,溶液中 的值不
变,B正确。反应 的平衡常数
,D错误。
【解析】
7.[2023浙江杭州质检]常温下,向 溶液中缓慢加入少量溶于水的
粉末(已知难溶,忽略溶液体积变化),溶液中与 变化如图所示
[横纵坐标未按比例画,已知:, 。下列
有关说法不正确的是( )
D
A.点溶液中约为
B.、、三点中由水电离产生的最小的是 点
C.的数量级约为
D.点溶液可能存在关系:
【解析】点溶液为溶液,设溶液中为,则 ,由
,解得,A项正确;根据化学反应
可知,随着反应进行浓度逐渐增大,对水的电离的抑制作用逐渐增强,所以、、 三点中由水电离产生的
最小的是点,B项正确;根据点数据计算, ,
,,此时溶液中 ,解得
,故
,C项正确;由于部
分元素以的形式存在,依据元素守恒,则有 ,D项错误。
8.[2023辽宁卷]某废水处理过程中始终保持 饱和,即
,通过调节使和 形成硫化物而分
离,体系中与关系如图所示,为、、和
的浓度,单位为。已知 ,下列说法正确
的是( )
D
A.
B.③为与 的关系曲线
C.
D.
【解析】饱和溶液中随着的增大,不变,
逐渐增大,逐渐增大,则有和 随着
增大而减小,当相同时, ,即
,则曲线③、④分别为 与
、的关系曲线,B错误;随着 的增大,
逐渐增大,则和 逐渐减小,又
,即相同时, ,
,即曲线①、②分别为 与
、 的关系曲线。
热考题型12 电解质溶液图像分析
05
1.[2024辽宁沈阳部分学校模拟]赖氨酸,用 表示]是人体必需氨基酸,其盐酸盐
在水溶液中存在电离平衡:。向一定浓度的溶液中滴加 溶液,溶
液中、、和的分布分数随 的变化关系如图所示。下列
说法正确的是( )
D
A.
B.点对应溶液中,
C.点对应溶液中,
D.点对应溶液中,
【解析】
2.[2024海南部分学校检测改编]已知。初始温度时,向 氨水中滴加
稀硫酸,测得混合溶液的温度、随加入稀硫酸的体积 的变化关系如图所示。下列说法正确的
是( )
D
A.、、三点对应的水解平衡常数:
B.水的电离程度:
C.图中点对应溶液中
D.若,则点对应溶液中
【解析】
3.[2024湖南部分学校联考]时,用气体调节氨水的。溶液中微粒浓度的对数值 、反应
物的物质的量之比与 的变化关系如图所示。忽略通入气体后溶液体积的变化。下列说法错误的是
( )
B
A.所示溶液中:
B.所示溶液中:
C.时,溶液中
D.时,水解平衡常数的数量级为
【解析】
4.[2024江西九校联考]是一种难溶于水、但可溶于酸的盐。在常温下,向 浊液中
通入氯化氢气体,得到了如图所示的图像,图像表现了该体系中为或
与的关系。已知 ,下列说法错误的是( )
B
A.
B.点的溶液中存在
C.点的溶液中存在
D.由图像可知的数量级为
【解析】图像分析
,两边取负对数,,、 符合
的函数关系,所以代表,代表 。
由图可知,当时,代入 的表达式可得
,A项正确; 点溶液中存在电荷守恒
和物料守恒 ,二式联立可得
,点溶液中含、,是强酸弱碱盐,故溶液呈酸性, ,
则,B项错误;点处,结合电荷守恒 ,
可得,C项正确;将代入 中可得
,,所以的数量级为 ,D项正确。
5.[2023北京卷]利用平衡移动原理,分析一定温度下在不同的 体系中的可能产物。
已知:①图1中曲线表示体系中各含碳粒子的物质的量分数与 的关系。
②图2中曲线Ⅰ的离子浓度关系符合 ;曲线Ⅱ的离子浓度关系符合
[注:起始,不同下 由图1得到]。
图1
图2
下列说法不正确的是( )
C
A.由图1,,
B.由图2,初始状态、 ,无沉淀生成
C.由图2,初始状态、 ,平衡后溶液中存在
D.由图1和图2,初始状态、,发生反应:
&6&【解析】&6&
6.[2023湖南部分学校联考改编]常温下,浓度相同的一元弱酸 稀溶液和一元弱
碱稀溶液相互滴定,其溶液的与或 的变化关系如图所示。
已知和的电离常数分别为和,且和 点的纵坐标之和为14。下列说
法错误的是( )
D
A. B.和 点的纵坐标之和为14
C.水的电离程度: D.溶液中点大于 点
【解析】由题图知,随浓度比值的增大,减小,则其代表溶液滴定溶液的图像, 随浓度比值的增
大,增大,则其代表溶液滴定溶液的图像,即直线代表与的变化关系,直线代表 与
的变化关系。点时,两直线相同,则该点的, ,由题图可知,该点的
,则,故该温度下,,即 ,A正确。
时,,该温度下,,同理,已知和
点的纵坐标之和为14,即,则;点时,,即 ,
此时,同理,点对应,,B正确。 和
点的纵坐标之和为14,由上述分析可知,点溶液中等于点溶液中 ,则两点对水的电离影响程度
相等,点两直线相同,该点的,因此点水的电离程度逐渐增大,即水的电离程度: ,
C正确。根据上述分析可知,直线是向溶液中滴加溶液,直线是向溶液中滴加溶液,和
的电离平衡常数相等,点时,,此时两种溶液恰好完全反应,因此点大于点 ,D错误。
7.[2023湖北卷] 为某邻苯二酚类配体,其
,。常温下构建(Ⅲ) 溶
液体系,其中 ,
。体系中含 物种的组分
分布系数 与 的关系如图所示,分布系数
,已知, 。下列
说法正确的是( )
C
A.当 时,体系中
B.在之间,含的物种主要为
C.的平衡常数的 约为14
D.当 时,参与配位的
【解析】由图可知,即时 ,又
,根据 知,此时
,结合 知,此时
,又时, ,故A错误;
在之间时 ,其中两种离子共含
,当时, ,
根据,,即 ,由
,得,即 ,B错误;该反应的平衡常数
,由题图知,当时,,由 ,得①
式 ①,此时
,代入①式,
,则,故 ,C
正确;时,则参与配位的 的总浓度为
,D错误。
专题综合训练
06
1.[2021重庆卷]下列叙述正确的是( )
C
A.向氨水中加入醋酸使溶液呈酸性,则
B.向溶液中加入少量 固体,则水的电离程度减小
C.向溶液中滴加盐酸至,则
D.向磷酸中加水至原体积的两倍,则
【解析】溶液中存在电荷守恒,溶液呈酸性, ,则
,A项错误;向溶液中加入少量固体,由于的水解程度比 的水解程
度大(因为的碱性比弱),故水的电离程度增大,B项错误;向 溶液中滴加盐酸至
,则和按物质的量之比为发生反应,反应后得到等物质的量的和 ,
的水解是微弱的,故,C项正确;向 磷酸中加水至原体积的2倍,
,但是弱酸,在水中不能完全电离,故 ,D项错误。
2.[2024江苏淮安考试改编]常温下,可用如图所示的方法制备。已知: ,
,,, 。下列
说法正确的是( )
C
A.溶液中:
B.溶液中:
C.反应的平衡常数约为
D.当混合液中时,应控制
【解析】A项,溶液中,和均发生水解, ,
,
,
,则 的水解程度小于
的水解程度,所以溶液中,错误;B项, 溶液中存在质子守恒
,错误;C项,反应 的平衡常数
,正确;D项,
,为避免生成 沉淀,
, ,
, ,错误。
3.[2024河北石家庄部分学校考试]已知常温下水溶液中、、、、 的分布分数
随变化曲线如图1;溶液中和 的关系如图2。用
溶液滴定 溶液,下列说法错误的是( )
D
A.曲线表示
B.的水解平衡常数
C.滴定过程中溶液会变浑浊
D.滴定过程中始终存在:
【解析】图像分析
随增大,溶液中、减少,、增多, 先增多后减少,结合粒子分布分数的计算公式可确定图1中
各曲线含义。
由上述分析知,A项正确;时 ,则
,B项正确;难溶,滴定过程中会生成 沉淀,
C项正确;若滴定过程中 不沉淀,则溶液中存在电荷守恒
,物料守恒 ,两式联立得:
,但生成 沉淀,故D项错误。
4.[2023豫北名校联考]下列依据有关实验操作和实验现象(或数据)能得出相应的实验结论且实验结论符合客观事
实的是( )
选 项 实验操作 实验现象(或 数据) 实验结论
A 将盐酸与 反应得到的气体直接通入硅酸钠溶液中 产生白色胶状 的沉淀 酸性:
B 向 溶液中滴加 溶液,再加入几滴同浓度的 溶液 先产生白色沉 淀,后产生黑 色沉淀
C 常温下,将等体积的饱和溶液与饱和 溶 液混合 试管中有白色 沉淀产生 常温下, 的溶解度小于
和 的
D 常温下,用计分别测定 和 溶液的 均等于7 同温下,不同浓度的
溶液中水的电离程度相同
C
【解析】 生成的中混有挥发出来的气体,故无法判断硅酸与碳酸的酸性强弱,A项不符合题意; 与
溶液反应后有剩余,剩余的与溶液反应生成沉淀,故无法比较和 的大
小,B项不符合题意;常温下,的溶解度小于和的溶解度,故将等体积的饱和 溶液
与饱和溶液混合后,产生的 因过饱和而析出,试管中有白色沉淀产生,C项符合题意;同温下,不同
浓度的 溶液中,水的电离程度不相同,但同一溶液中的醋酸根离子和铵根离子的水解程度相同,故两
溶液均呈中性,D项不符合题意。
5.[2023辽宁锦州模拟]时,用 溶液滴定同浓
度的溶液,滴定分数、 及微粒分布分数
,表示、或 的关系如图
所示。下列说法错误的是( )
D
A.时,
B.点对应溶液中:
C.、、、四点对应溶液中水的电离程度:
D.用溶液滴定 溶液可用甲基橙作指示剂
【解析】图像分析
由题图可知,、、、四点所在曲线为溶液滴定同浓度二元弱酸 的滴定曲线,当
时,溶液中溶质为和;当时,溶液中溶质为,对应溶液的,则
溶液显酸性;当时,溶液中溶质为和;当时,溶液中溶质为 ,对应溶
液的,则 溶液显碱性。
由题图可知,时,当时,对应溶液的约为4,则 ,
A正确。由上述分析可知,点对应溶液中溶质为和,且 ,由电荷守恒可知
,又点对应溶液, ,故
,B正确。未加氢氧化钠溶液时,电离出 ,抑制水的电离,
加入氢氧化钠溶液过程中,酸逐渐被中和生成盐,对水的电离抑制程度减弱,中和生成的、 能水解,促
进水的电离,当酸碱恰好中和生成,即点附近时,对水的电离促进程度最大,故、、、 四点对应
溶液中水的电离程度:,C正确。用溶液滴定 溶液时,滴定终点时溶质为
,溶液显碱性,应选择酚酞作指示剂,D错误。
速解
“特殊点结论法”速判:由“浓度相等的点”、,可得出、 ,A
正确。酸碱中和滴定曲线中,“恰好完全反应点”对应的是正盐,生成正盐时若存在对水电离的影响,则只存在盐
类对水电离的促进作用,此时水的电离程度最大,C正确。酸滴定碱一般选用甲基橙作指示剂,而碱滴定酸一般选
用酚酞作指示剂,则用溶液滴定 溶液可用酚酞作指示剂,D错误。
6.[2024天星原创]室温下,向一定浓度的溶液中滴加溶液,溶液中酸度 随溶液
、或 的变化如图所示。下列说法错误的是( )
D
A.室温下,的
B.室温下, 溶液显酸性
C.的平衡常数的数量级为
D.时,
【解析】
7.[2023新课标卷]向饱和溶液(有足量固体)中滴加氨水,发生反应 和
。与
的关系如图所示(其中代表、、或 )。
下列说法错误的是( )
A
A.曲线Ⅰ可视为溶解度随 浓度变化曲线
B.的溶度积常数
C.反应的平衡常数的值为
D. 时,溶液中
命题分析
本题以向 饱和溶液中滴加氨水的反应为背景,呈现了一个自
变量下的多个因变量变化过程图,图像复杂,但选项考查较为简
单,只要考生能够分析出每条曲线的含义,即可快速得到正确答
案,这对考生从图中提取和加工数据的能力提出了较高要求。本
题易错选B项,需注意,曲线Ⅲ、Ⅳ的起点在纵轴“ ”上方,而
不是“ ”。
【解析】
8.[2024河北秦皇岛部分学校联考]将或 悬浊液置于分压固定的
气相中,体系中与关系如图所示,为、、、 、
的浓度,单位为。已知: 。下列说法正
确的是( )
A
A.,
B. ,平衡常数
C.表示 曲线
D.向点溶液中加入,可以达到 点溶液
【解析】图像分析
分压固定的气相中,使溶液中浓度也相应固定,因此表示,随着逐渐增大, 、
的浓度逐渐增大,且较小时的浓度大于的浓度,所以表示,表示 ;根
据判断,表示,表示 。
,时,和的浓度相等,此时, 表
示、表示,两者交于,此时、的浓度均为 ,
,A项正确;通过与的交点说明 ,则
,点处 ,
,结合得出 ,
, 的平衡
常数,B项错误;由上述分析可知表示,C项错误;点可表示 的
不饱和溶液,向点溶液中加入可以达到点饱和溶液,而不是加 ,D项错误。
9.[2022广东卷节选]食醋是烹饪美食的调味品,有效成分主要为醋酸(用表示)。 的应用与其电离平衡密切
相关。时,的 。
(1)某小组研究下 电离平衡的影响因素。
提出假设 稀释溶液或改变浓度, 电离平衡会发生移动。
设计方案并完成实验 用浓度均为的和溶液,按下表配制总体积相同的系列溶液;测定 ,记录
数据。
①根据表中信息,补充数据:_____, ______。
3.00
33.00
【解题思路】实验中,,两种溶液的浓度相等,当 时,
,为保证溶液的总体积为,则 。
②由实验Ⅰ和Ⅱ可知,稀释 溶液,电离平衡____(填“正”或“逆”)向移动;结合表中数据,给出判断理由: ___________
___________________________________________________________________________________________________
________________ 。
正
【解题思路】由实验Ⅰ、Ⅱ的数据分析,实验Ⅱ中的浓度为实验Ⅰ中的,但是没有从2.86变为, 浓度相
对变大(实际为),说明稀释时,促进了 的电离。
③由实验Ⅱ可知,增大浓度, 电离平衡逆向移动。
实验结论 假设成立。
实验Ⅱ中的
的浓度为实验Ⅰ的,稀释10倍后,假设电离平衡不移动,理论为,实际为,说明稀释 时,
促进了 的电离
(2)小组分析上表数据发现:随着的增加,的值逐渐接近的 。
查阅资料获悉:一定条件下,按配制的溶液中,的值等于的 。
对比数据发现,实验中与资料数据 存在一定差异;推测可能由物质浓度准确程度不够引起,
故先准确测定 溶液的浓度再验证。
【解题思路】与以物质的量为反应,则 ,
。与 完全反应时,生成强碱弱酸
盐,滴定终点时,溶液显碱性,所以加入溶液时,对应的滴定终点溶液的 。
(ⅰ)移取溶液,加入2滴酚酞溶液,用溶液滴定至终点,消耗体积为 ,
则该溶液的浓度为________ 。画出上述过程的滴定曲线示意图并标注滴定终点。
(ⅱ)用上述溶液和溶液,配制等物质的量的与混合溶液,测定 ,结果与资料
数据相符。
【答案】&7& .
(3)小组进一步提出:如果只有浓度均约为的和溶液,如准确测定的 小组同学设计方
案并进行实验。请完成下表中Ⅱ的内容。
Ⅰ 移取溶液,用溶液滴定至终点,消耗溶液
Ⅱ ________________________________________________,测得溶液的 为4.76
移取溶液,向其中加入溶液
【解题思路】醋酸的电离平衡:,平衡常数,当时, ,
故在Ⅱ中,向溶液中加入溶液,反应后的溶液中和浓度相等,测定溶液的 ,即
可得出 。
实验总结 得到的结果与资料数据相符,方案可行。
(4)根据 可以判断弱酸的酸性强弱。写出一种无机弱酸及其用途____________________________________。
、杀菌消毒(其他合理答案也可)
【解题思路】 为弱酸,可以用于自来水的杀菌消毒。
考点22 电离平衡
考点23 水的电离和溶液的pH
考点24 盐类的水解
考点25 沉淀溶解平衡
热考题型11 溶液中微粒浓度大小关系
热考题型12 电解质溶液图像分析
专题综合训练
【考情分析】在高考中,必考,常以图像为载体,考查弱电解质的电离平衡、盐类的水解平衡、沉淀的溶解平衡,
考查角度有微粒浓度比较、影响因素、相关计算等。也会渗透在工艺流程题中和实验题中进行考查。
考点22 电离平衡
01
经典3+2
1.[2024广东部分学校模拟]时,第一步完全电离,第二步电离平衡常数。则 时,
下列说法正确的是( )
B
A. 溶液显碱性
B.溶液中存在
C.的溶液中,
D.向溶液中滴加溶液至中性时,
【解析】第一步完全电离,则溶液中,只电离不水解,溶液显酸性,A项错误; 溶液
中存在物料守恒:,B项正确;的 溶液中,
,,C项错误;向 溶
液中滴加溶液至中性时,, ,故
,D项错误。
2.[2024天星原创]常温下,将相同、体积均为的和溶液分别加水稀释至体积为,溶液随 的变
化如图所示。下列说法正确的是( )
B
A.的电离方程式为
B.、、三点溶液导电性最强的是 点
C.在的溶液中通入气体, 保持不变
D.将的和溶液等体积混合,溶液中离子浓度最大的是
【解析】图解剖析
是弱酸,电离方程式为,A错误;根据上述分析知,B正确;根据 的电离平衡知,
,在通入气体过程中,不变,增大,故减小,C错误;将浓度相同的和 溶
液等体积混合,由于的电离程度大于 ,故溶液中离子浓度由大到小的顺序为
,D错误。
3.[2024福建部分学校考试]常温下,向的溶液中滴入溶液,随着 变化,溶液中浓度最大
的含磷微粒如图所示 。下列说法正确的是( )
A
A.时,
B.时,
C.时,
D.若用的溶液进行实验, 将向左移动
【解析】, ,则
,则 ,即
,A项正确;时,,此时溶液中主要含有 ,根据
可得,
,
则,即,B项错误; 时,根据电荷守恒可知,
,C项错误;电离平衡常数只受温度的影响,故
不移动,D项错误。
4.[2023浙江卷1月]甲酸 是重要的化工原料。工业废水中的甲酸
及其盐,通过离子交换树脂(含固体活性成分, 为烷基)因静电
作用被吸附回收,其回收率(被吸附在树脂上甲酸根的物质的量分数)
与废水初始关系如图(已知甲酸 ),下列说法不正
确的是( )
D
A.活性成分在水中存在平衡:
B.的废水中
C.废水初始,随下降,甲酸的电离被抑制,与 作用
的 数目减少
D.废水初始,离子交换树脂活性成分主要以 形态存在
【解析】活性成分中能与水电离出的形成配位键,因此在水中存在平衡: ,A
项正确;的废水中,,根据甲酸 ,得
,B项正确;废水初始,随下降, 增大,电离平衡
逆向移动,甲酸的电离被抑制,减小,与作用的 数目减少,C项正
确;废水初始时回收率小于,说明吸附在树脂上的甲酸根较少,活性成分主要以 形态存在,D项错
误。
5.[2021湖北卷]常温下,已知溶液中含磷物种的浓度之和为 ,
溶液中各含磷物种的关系如图所示。图中 表示各含磷物种的浓度负
对数,表示的浓度负对数;、、 三
点的坐标:,, 。下列说法正确的是( )
D
A.曲线①表示随 的变化
B. 的结构简式为
C.的溶液中:
D.的平衡常数
【解析】图像分析
图像中含物质只有3种,说明为二元弱酸。随着逐渐增大, 减小,根据
、,知逐渐减小, 先增大后减
小,逐渐增大,,则逐渐增大,先减小后增大, 逐渐减小,
故曲线③表示,曲线②表示,曲线①表示。根据点知,
时,,则的,根据点知, 时,
,则的 。
曲线①表示随的变化,A项错误;为二元弱酸,其结构简式为 ,B项错误;
即,由图可知,此时,,即 ,而
,故 ,C项错误;由
减去,可得 ,则平衡常数
,D项正确。
5-1.变图像[2024河北邯郸部分学校模拟]常温下,向一定浓度的 (亚磷
酸, )溶液中滴加一定浓度的溶液,溶液中 或
随溶液的 的变化关系如图所示。下列叙述正确的是( )
C
A.直线代表与 的关系
B.点对应溶液的
C.的平衡常数为
D.时,
【解析】根据亚磷酸结构可知,其属于二元弱酸,随着溶液增大,减小, 先增大后减小,
增大,则减小,增大,故直线、分别代表、与 的关系,A错
误。
6.[2022湖北卷]如图是亚砷酸和酒石酸混合体系中部分物种的
图(浓度:总为,总为 )。下列说法错误的是( )
D
A.的为
B.的酸性比 的强
C.时,的浓度比 的高
D.时,溶液中浓度最高的物种为
【解析】的,由题图知,时, ,则
,A项正确;的,由题图知, 时,
,则的,故比 的酸性强,B项
正确;时,的浓度略低于,而的浓度略高于 ,
C项正确;结合题干和上述分析知,酒石酸的酸性远强于,且溶液中总的浓度小于总 的浓度,所以当
时,溶液中浓度最高的物种不是 ,D项错误。
6-1.变形式[2024内蒙古呼和浩特监测改编]亚砷酸 可用于治
疗白血病。亚砷酸在溶液中存在多种微粒形态,各种微粒的物质的
量分数与溶液 的关系如图所示。下列说法不正确的是( )
C
A.人体血液的为 ,给药后人体所含砷元素微粒主要是
B. 可发生电离和水解,溶液显碱性
C.当溶液的 时,
D.用 表示微粒的物质的量分数, 时
【解析】据图可知当在之间时,元素的主要存在形式为 ,A项正确;由题图及砷元素的存
在形态可知,可发生电离和水解,溶液显碱性,B项正确;当溶液的时,溶液中阳离子除 外
还有加入的碱的阳离子,则根据电荷守恒有 ,C项错误;
由图可知,当溶液的时,溶液中含的微粒主要有、、,用 表示微粒的物质的量
分数,则 ,D项正确。
创新1+1
1.新角度·酸碱质子理论[2022湖北卷]根据酸碱质子理论,给出质子 的物质是酸,给出质子的能力越强,酸性越
强。已知:
下列酸性强弱顺序正确的是( )
D
A. B.
C. D.
【解析】根据“酸碱质子理论”,由第一个反应可判断酸性 ,由第二个反应可判断酸性
,故D项正确。
2.新角度·不同浓度溶液的电导率[2023北京海淀区练习]分别测定不同浓度溶液、溶液和 溶液的电
导率 数值,测定结果的数据处理如下表。
溶液
溶液 4 839 2 478 1 252
溶液 10 958 5 593 2 797
溶液 267 182 126
已知:代表 溶液的电导率数值;其他条件相同时,电导率越大,溶液导电性越好。
下列说法不正确的是( )
B
A.仅由 的数据不能说明三种电解质的强弱
B.表中数据不能说明同等条件下与 的导电能力强弱
C. 比值数据能说明 存在电离平衡
D.溶液的 数据能说明溶液越稀, 的电离程度越大
【解析】、均为强电解质,不能仅由的数据说明、 电解质的强弱,A项正确;同等条件下,氯
离子浓度相同,氯离子的导电能力相同,溶液的电导率大于溶液的电导率,说明同等条件下 的导电能力
比的导电能力强,B项错误;由表中数据可知,溶液、溶液的 比值数据约等于浓度之比,说明两者
均不存在电离平衡,而溶液的 比值数据却大于浓度之比,说明 存在电离平衡,且由
和的值知,溶液越稀, 的电离程度越大,C项正确,D项正确。
3.新角度·氨水中的平衡[2023河北石家庄质检]时,已知 的氨水中存在如下平衡:
下列说法正确的是( )
C
A.反应①和②互为可逆反应
B.该氨水中存在
C.若该氨水中,则
D.向该氨水中加入硫酸,当 时,溶液呈中性
【解析】可逆反应是指在相同条件下既可正向进行,也可逆向进行的化学反应,反应①和②的反应物和生成物不
完全相同,不互为可逆反应,A项错误;根据电荷守恒,氨水中存在 ,B项错误;反应
反应②可得,则 ,结合电
荷守恒以及,可得 ,C项正确;溶液呈中性,则
,根据电荷守恒,知 ,D项错误。
4.新图像·两种溶液中多条曲线[2024山东日照考试] 时,两种不
同浓度、 的弱
酸溶液中,[即、、 和
]随变化的关系如图所示。为 的电离常数,电离
度 。下列说法错误的是( )
C
A.曲线表示溶液中 的变化情况
B.当溶液的时,溶液中满足
C.点时
D.溶液中的电离度 (忽略水的电离)
【解析】综合分析
的电离方程式为,增大,平衡正向移动,减小, 增大,结合初始浓度
、可知,、、、 曲线代表微粒如图所示。
由上述分析可知,A项正确;在溶液中,、曲线交点处,, ,得
,由图像可知,当溶液的大于时,,B项正确;点溶液中, ,
不满足 ,C项错误;
,D项正确。
考点23 水的电离和溶液的pH
02
经典3+2
1.[2024广东佛山南海区摸底]苯甲酸 是一种弱酸,可用于制备防腐剂苯甲酸钠。下列说法正确的是( )
A
A.稀释苯甲酸钠溶液,溶液的 减小
B.苯甲酸钠溶液中:
C.常温下,的苯甲酸溶液中,水电离的为
D.用 溶液滴定苯甲酸溶液测浓度时,选用甲基橙作指示剂
【解析】苯甲酸是一种弱酸,苯甲酸钠属于强碱弱酸盐,苯甲酸钠溶液由于 的水解而呈碱性:
,稀释苯甲酸钠溶液,能促进的水解,但溶液中减小,溶液的
减小,A项正确;苯甲酸钠溶液中电荷守恒为,由于 的水解是微弱
的,,则 ,B项错误;苯甲酸溶液中苯甲酸电离
出的抑制水的电离,常温下,的苯甲酸溶液中 ,
,则水电离的溶液中的 ,C项错误;
与苯甲酸溶液恰好完全反应生成的苯甲酸钠溶液呈碱性,用 溶液滴定苯甲酸溶液测浓度时应选择碱性
范围内发生颜色变化的指示剂,不能选用甲基橙作指示剂,可选用酚酞作指示剂,D项错误。
2.[2023上海卷]将溶液分别滴入 溶液与
溶液中,其随滴入 溶液体积变化的图像如图所示。
下列说法正确的是( )
D
A.点
B.点:
C.、 点溶液混合后呈酸性
D.水的电离程度:
【解析】点为溶液,由知,溶液中,由 ,
可知,A错误;点溶液为等物质的量的和 的混合溶液,根据电荷守恒,
溶液中,根据物料守恒,溶液中 ,两式联立得
,B错误;点溶液为等物质的量的和的混合溶液,点溶液为 溶液,
两点溶液混合得到、和的混合溶液,且和的物质的量相等,由点溶液(等物质的量的和
的混合溶液)可知,的水解程度大于的电离程度,则、点溶液混合后呈碱性,C错误;和 电
离出的抑制水的电离,电离出的越多,越小,对水的电离抑制程度越大,随溶液的加入, 减少,
水的电离程度增大,恰好完全中和时(加入的溶液为),水的电离程度最大,对比各点对应的 和
溶液体积可知,水的电离程度 ,D正确。
2-1.变角度[2024福建福州质检]室温下,将 溶液滴入
和 的混合溶液,测得混合
溶液的随滴加的 的变化关系如图所示。下列说法正确的是( )
B
A.点时,
B.点时,
C.点时,
D.过程中,水的电离程度大小关系为:
【解析】
为强酸完全电离,为弱酸部分电离,且 电离出的
抑制的电离,所以点,A选项错误; 点加入
溶液,溶液总体积变为原来的两倍,则 减小为
,B选项正确;点溶液为等物质的量的和 的混合
液,存在物料守恒: ,C选项错误;
由上述分析可知,点水的电离程度小于 点,D选项错误。
3.[2024天星原创]室温下,用溶液分别滴定 种一元弱酸溶液,
滴定曲线如图所示(滴定分数,A代表弱酸,B代表 ,曲线从下往上分别代表弱酸的
、4、5、6、7、8、9、10)。下列说法不正确的是( )
B
A.物质的量浓度相等时, 越小,滴定突变越不明显,滴定误差越大
B.滴定分数时,溶液中水的电离程度:溶液 溶液
C.滴定图像中的每种一元弱酸时,均可选择酚酞作为指示剂
D.计算的弱酸溶液的 时,不能忽略水的电离
【解析】由题图可知,越大, 越小,滴定突跃范围越小,允许的误差范围越小,则滴定误差越大,A正确。
由题图可知,滴定分数时,滴定后和 的溶液均呈酸性,即酸的电离大于盐的水解,水的电
离受到抑制,其中的溶液酸性更强,对水的电离抑制程度更大,B错误。题给8种一元弱酸与 溶液恰
好完全反应时,溶液均呈碱性,均可选择酚酞作为指示剂,C正确。由题图可知, 越大,一元弱酸的酸性越弱,
滴定前溶液的 越接近7,此时水的电离不能忽略,D正确。
4.[2023天津南开中学模拟]常温下,已知醋酸的电离常数,向 溶液
中逐滴加入的溶液,溶液中水电离的随加入 溶液体积的变化关系如图所示,下列
说法正确的是(已知 )( )
B
A.、两点对应溶液的 相同
B.点对应溶液中:
C.点对应溶液中,
D.点坐标为
【解析】
5.[2024吉林部分学校模拟]为了更好地表示溶液的酸碱性,科学家提出了酸度的概念: 。常温下,用
的溶液滴定溶液,溶液的酸度随滴入的 溶液体积的变化关系如
图所示(滴定过程中温度的变化忽略不计),已知 ,下列说法错误的是( )
B
A.该过程可以用酚酞作指示剂
B.滴定过程中, 的值逐渐减小
C.常温下,的电离常数
D.当(溶液)时,溶液中存在:
【解析】
6.[2024陕西宝鸡部分学校检测]人体血液存在和 等
缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值 表示
或与的关系如图所示。已知 ,
。下列说法正确的是( )
D
A.曲线Ⅰ表示与 的变化关系
B.点 点的过程中,水的电离程度逐渐减小
C.当增大时, 逐渐减小
D.当时,
【解析】由电离平衡和可知,随增大,溶液中 增大,电离平
衡向右移动,减小,增大,即减小,增大,所以曲线Ⅰ表示与 的变
化关系,曲线Ⅱ表示与的变化关系,A项错误;点点的过程中, 逐渐增大,对水的电离
的促进作用增大,所以水的电离程度逐渐增大,B项错误;根据 和
,可得,当增大时, 的电离被促
进,逐渐增大,、不变,所以 逐渐增大,C项错误;已知
,,当时,,,则此时的
为,由图可推断,时,,说明 ,D项正确。
7.[2023江西南昌模拟]常温下,用的盐酸滴定未知浓度的一元碱 溶液。溶液中,
、的分布分数 随滴加盐酸体积的变化关系如图所示。已知:的分布分数 。下列叙述
正确的是( )
B
A. B.滴定时,可以选择甲基橙作指示剂
C.滴定过程中,水的电离程度: D.点对应溶液中,粒子浓度大小为
【解析】
向溶液中滴加盐酸,溶液的碱性逐渐减弱,碱电离产生的 对水电离的抑制作用逐渐减弱,则在恰好完全
反应前,水的电离程度逐渐增大,因此水的电离程度: ,C错误。
创新1+1
1.新图像·柱状图[2024湘豫名校联考]常温下,向
(一元弱酸)溶液中滴加氨水,溶液 与
的关系如图所示。
下列叙述正确的是( )
D
A. 变化中,水的电离程度一直增大
B.点溶液中:
C.与选择酚酞作指示剂相比,本实验选择甲基橙溶液作指示剂更合适
D.常温下,的数量级为
【解析】综合分析
由物料守恒可知,溶液与氨水恰好反应时,溶液中,溶液中为 ,
由图可知,为1.0时,溶液为7,溶液呈中性,说明与在溶液中的电离程度相同,电离常数相等,
点为等浓度的和的混合溶液,溶液呈酸性,、点为和 的混合溶液,溶液呈碱性。
为1.0时,溶液与氨水恰好反应,反应生成的在溶液中水解促进水的电离,水的电离程度最大, 点为等
浓度的和的混合溶液,、点为和的混合溶液,酸、碱均会抑制水的电离,则 变化中,
水的电离程度先增大后减小,A项错误;点为等浓度的和的混合溶液,溶液呈酸性, ,
结合电荷守恒可知,溶液中,B项错误;为1.0时, 溶液与
氨水恰好反应,溶液为7,溶液更接近酚酞溶液的变色范围 ,所以选择酚酞作指示剂误差更
小,选择酚酞作指示剂比甲基橙(变色范围)更合适,C项错误;由溶液的 为2.85
可知,的电离常数,的电离常数与的电离常数 相等,
,数量级为 ,D项正确。
2.新考法·电流滴定法判断滴定终点[2023山东菏泽模拟]电流滴定法(电压 )是根据电流情况判断滴定
终点,如图1所示(夹持仪器略),仅、同时存在时才能产生电流。可用此法来测定 溶液的浓度。滴
定过程中电流随溶液的体积的变化曲线如图2所示。已知: 。下列说法正确的
是( )
D
图1
图2
A. 为滴定终点
B. 段电流减小是因为离子浓度降低
C.应选用淀粉溶液作指示剂
D.若碘液中含有的,硫代硫酸钠溶液的浓度为
【解析】根据题给信息,仅、同时存在时才能产生电流,处电流最大,说明仍含有 ,没有达到滴定终点,A
项错误;根据,段离子浓度增大,段电流减小是因为 的浓度降低,B项错误;达
到滴定终点时, 完全反应,根据电流为0判断滴定终点,不用再加指示剂,C项错误;根据
, ,则
,D项正确。
3.新考法·电位滴定法[2024湖南名校质检]某研究小组利用电位滴定法研究盐
酸滴定亚磷酸钠溶液过程中的化学变化,得到电极电位 和溶液
随盐酸滴加的体积 变化曲线如图所示[已知:①电位滴定法的原理:在
化学计量点附近,被测离子浓度发生突跃,指示电极电位也发生了突跃,进
而确定滴定终点。②亚磷酸 是二元弱酸,其电离常数分别是
, ]。下列说法正确的是( )
D
A.点对应溶液的溶质为和,
B.第二次电极电位突跃发生的离子反应为
C.水的电离程度:
D.点对应的溶液中一定存在:
【解析】点为第一次电极电位突跃,恰好完成第一步反应,对应溶质为和, 的电离常数
,的水解常数,则 的电离程度大于水解程度,溶液的
,A项错误;发生第二次突跃是和盐酸恰好完全反应,反应是 ,B项错误;
点溶液显酸性,点溶液酸性强于点,加盐酸过程中水的电离程度逐渐减小,因此水的电离程度: ,C项错
误;点对应溶质为、、 ,根据电荷守恒有:
,根据物料守恒可得 ,所以
,D项正确。
考点24 盐类的水解
03
经典3+2
1.[2024广东惠州调研]化学让生活更美好。下列事实与盐类的水解无关的是( )
C
A.用明矾净水 B.用热的纯碱溶液清洗油污
C.用稀盐酸清除铁锈 D.配制 溶液时加入少量盐酸
【解析】明矾电离出的 水解生成氢氧化铝胶体,胶体具有吸附性,可用于净水,A项与盐类的水解有关;纯碱水
解生成 ,加热纯碱水解程度增大,溶液碱性增强,在碱性条件下油脂水解生成溶于水的盐和醇,B项与盐类
的水解有关;铁锈的主要成分为氧化铁,属于碱性氧化物,能与盐酸反应生成盐和水,C项与盐类的水解无关;
为强酸弱碱盐,水解显酸性,配制 溶液时为抑制其水解,要加入少量盐酸,D项与盐类的水解有关。
2.[2023重庆卷] 溶解度随温度变化的曲线如图所示,关于各点
对应的溶液,下列说法正确的是( )
B
A.点等于点
B.点大于点
C. 点降温过程中有2个平衡发生移动
D.点
【解析】点和点温度不同,故 不相等,A错误;升高温度促进铵根
离子的水解,且 点铵根离子的浓度更大,水解生成的氢离子浓度更大,
故点大于点,B正确; 点降温过程中有水的电离平衡、铵根离
子的水解平衡、硫酸铵的溶解平衡3个平衡发生移动,C错误; 点为硫酸铵的不饱和溶液,溶液中存在电荷守恒
,故D错误。
2-1.变物质[2024陕西部分学校考试]某小组为了探究溶液和 溶液的相关
性质,进行如下实验:
实验1:常温下,用计测得溶液的为 ,向溶液中缓慢通
入,使溶质恰好变为(忽略溶液体积变化),测得溶液的 为5.28。
实验2:取溶液,先加热,后降温,测得溶液 与温度的
关系如图所示(忽略溶液体积变化)。下列叙述正确的是( )
A
A.常温下,
B.常温下,
C.,主要原因是升高温度抑制 水解,促进水电离
D.,主要原因是降低温度使 减小
【解析】由实验1可知,亚硫酸氢钠溶液显酸性,故的电离能力大于水解能力, ,A
项正确;向碳酸氢钠溶液中通入,转化为亚硫酸氢钠溶液,说明的酸性比 的强,
,B项错误;升高温度, 的水解程度、水的电离程度均增大,C项错误;如果是因
为降低温度导致水解程度降低,则点溶液和点溶液应该相等,但实验结果表明点溶液高于 点溶液,说明
点溶液中部分被空气中的氧气氧化是导致 减小的主要因素,D项错误。
3.[2023北京东城区练习]室温下,向纯碱(可能含有 )的稀溶液
中逐滴加入盐酸,滴定曲线如图,其中、 为滴定终点。
下列分析正确的是( )
D
A.处溶液,原因是
B.由滴定数据可推知,原纯碱中不含
C.和处的溶液中,均存在
D.原纯碱稀溶液中
【解析】图像分析
、为滴定终点,则发生反应, 发生反应
。设原纯碱溶液中的物质的量为,的物质的量为 ,则
,
, 。
处溶液中的溶质为和,溶液的的主要原因是 ,A项错误;由上
述分析知,原纯碱为和的混合物,B项错误;和 处的溶液中,均存在电荷守恒
,C项错误;原纯碱稀溶液中,
, ,则
,D项正确。
4.[2022江苏卷]一种捕集烟气中的过程如图所示。室温下以
溶液吸收,若通入所引起的溶液体积变化和 挥发可忽略,溶液中含碳
物种的浓度。 电离常数分别为
、 。下列说法正确的是( )
C
A.吸收所得到的溶液中:
B.完全转化为时,溶液中:
C.溶液吸收,溶液中:
D.题图所示的“吸收”“转化”过程中,溶液的温度下降
【解析】吸收可能生成,此时由于以第一步水解为主,故溶液中 ,也可
能生成,由于的水解很微弱,故此时溶液中,还可能生成和 的混合
物,同理,溶液中亦存在,A项错误; 溶液中存在质子守恒
,B项错误;由于溶液的浓度为, ,
即,此等式为溶液的物料守恒式,故此时所得溶液为 溶液,
存在水解平衡,电离平衡,由 可知,
的水解程度大于电离程度,故 ,C项正确;“吸收”时发生的反应和“转化”时发生的反应
均为放热反应(【提醒】以生成为例,“吸收”时发生的反应为 ,“转化”时发生的
反应为 。)
,故溶液的温度升高,D项错误。
4-1.变情境[2024江苏南京六校调研]硫代硫酸钠 的制备和应用相关流程如图所示。
已知:时,的,;的, 。
下列说法正确的是( )
D
A.步骤1所得的溶液中:
B.步骤1过程中时,
C.步骤3所得的清液中:
D.步骤3的离子方程式为
【解析】
由上述分析知,步骤1所得溶液中含、 ,
故A错误;时浓度为 ,则
,
故B错误;步骤3加入了足量的 ,则所得清液中
存在 ,C错误;由步骤3发生的化学反应知,D正确。
5.[2024四川成都七中模拟]时,向 柠檬酸三钠溶液中滴加
的盐酸,用电导率仪测得滴加盐酸体积与溶液电导率的关系如图所示。已知:柠
檬酸(分子式为 ,其结构简式为 )属于三元弱酸,其电离平衡常数的
,,, 。下列说法错误的是( )
D
A.点时溶液中的数量级为
B. 点溶液显酸性
C.点溶液满足:
D.时,溶液满足:
【解析】
,
则, 时,溶液中
,则 ,D项错
误。
6.[2023江苏南京联考]溶液中各含氮(或碳)微粒的分布分数 是指某含氮
(或碳)微粒的浓度占各含氮(或碳)微粒浓度之和的分数。 时,向
的溶液中滴加适量的盐酸或 溶液,溶
液中各含氮(或碳)微粒的分布分数 与 的变化关系如图所示(不考虑
溶液中的和 分子)。下列说法正确的是( )
C
A.
B.点时,溶液中
C.点时,溶液中
D.反应的平衡常数为 ,
【解析】综合分析
由题意可知,向溶液中滴加适量的盐酸时,发生反应,溶液中 减小,
增大;向溶液中滴加适量的溶液时,发生反应 、
,溶液中和均减小,和 均增大,由此推断出曲线①、
②、③、④、⑤分别代表、、、、的分布分数与 的变化关系。
当时,,;当 时,
,;当时, ,
,则
,A错误。点时,, ,
根据电荷守恒得 ,即
,B错误。由题图可知, 点时,溶液中
,C正确。反应 平衡常数
(【技法】采用
“凑常数法”,将表达式中分子、分母同乘以某一离子的浓度,将其转化为与电离常数、水的离子积常数等相关的
表达式进行计算。), ,D错误。
创新1+1
1.新考法·共价化合物的水解 [2024湖北黄冈调研]共价化合物的水解分为亲电水解和亲核水解。发生亲电水解的条
件是中心原子具有孤电子对,能接受的 的进攻,例如:
发生亲核水解的条件是中心原子具有 和空的价层轨道,例如:
D
A.中原子电负性大, 原子难以给出孤电子对,所以较难发生亲电水解
B. 中C原子外围空间小,且没有能量较低的空轨道,所以较难发生亲核水解
C.预测的水解产物为和
D.已知的水解产物为和 ,所以水解类型为亲电水解
【解析】发生亲电水解的条件是中心原子具有孤电子对,能接受的的进攻,中原子电负性大, 原子
难以给出孤电子对,所以较难发生亲电水解,A项正确;发生亲核水解的条件是中心原子具有 和空的价层轨
道,中C原子外围空间小,且没有能量较低的空轨道,所以较难发生亲核水解,B项正确; 可发生亲核水解,
水解产物为和,C项正确;的水解产物为和 ,符合亲核水解规律,D项错误。
下列说法错误的是( )
2.新考法·模块融合(盐类水解+实验探究)[2023广东广州测试节选]醋酸钠 是一种常用的防腐剂和缓
冲剂。
(1)某小组探究外界因素对水解程度的影响。甲同学设计实验方案如下 表中溶液浓度均为
ⅰ.实验___和___(填序号),探究加水稀释对 水解程度的影响;
ⅱ.实验1和3,探究加入对 水解程度的影响;
ⅲ.实验1和4,探究温度对 水解程度的影响。
序号 温度
1 40.0 0 0
2 4.0 0 36.0
3 20.0 10.0
4 40.0 0 0
1
2
①根据甲同学的实验方案,补充数据: ___。
②实验测得,该结果不足以证明加入促进了 的水解。根据__________(填一种微粒的化学
式)的浓度增大可以说明加入能促进 的水解。
③已知水解为吸热反应,甲同学预测,但实验结果为 。实验结果与预测不一致的原因是
_________________________________________________________________________________________。
0
温度升高,水解程度增大,水的电离程度也增大,二者综合影响导致增大,减小
【解题思路】实验1和2只有 的浓度不同,其他条件均相同,根据控制单一变量法,知两实验探究的是加
水稀释对水解程度的影响。①实验1和3,探究加入对水解程度的影响,则 浓度
应保持不变,因此。②加入能促进的水解,则 的浓度增大。
(2)小组通过测定不同温度下的水解常数确定温度对 水解程度的影响。
查阅资料:,为 溶液起始浓度。
试剂与仪器:溶液、盐酸、 计。
实验:测定下的水解常数 ,完成下表中序号7的实验。
序号 实验 记录的数据
5 取溶液,用 盐酸滴定至终点 消耗盐酸体积为
6 测纯水的
7 ________________________________
在和 下重复上述实验。
数据处理:下,_ ________________________(用含、、 的计算式表示)。
实验结论:,温度升高,促进 水解。
测时相同溶液的
或
【解题思路】根据实验5,可计算得到溶液的起始浓度 ,根据实验6,可计算得到
该温度下水的离子积为,因此实验7需测定时相同溶液的,从而计算得到 溶液
中,则 。
考点25 沉淀溶解平衡
04
经典3+2
1.[2023广东佛山考试]牙齿表面存在如下平衡:
。
已知的 。下列说法错误的是( )
B
A.在牙膏中添加适量的磷酸盐,能起到保护牙齿的作用
B.口腔中的食物残渣能产生有机酸,容易导致龋齿,使 增大
C.正常口腔的 接近中性,有利于牙齿健康
D.使用含氟牙膏,当与共存时,
【解析】在牙膏中添加适量的磷酸盐,使平衡 逆向移动,生
成覆盖在牙齿表面,能起到保护牙齿的作用,A项正确; 只与温度有关,与溶液的酸碱性无关,
B项错误;正常口腔的接近中性,防止 溶解,有利于牙齿健康,C项正确;
,D项正确。
2.[2024江西部分学校考试]时,和 的沉淀溶解平衡曲线如图所示。已
知为浓度的负对数, 为阴离子浓度的负对数。下列说法不正确的是( )
B
A.曲线Ⅰ是 的沉淀溶解平衡曲线
B.加热可使溶液由点变到 点
C.点对应的溶液可能为 的过饱和溶液
D.时,的平衡常数
由上述分析可知,曲线Ⅰ为 的沉淀溶解平衡曲
线,若加热, 的沉淀溶解平衡正向移动,溶
液中和会同时增大,则和
均会减小,则加热不能使溶液由点变到 点,B错
误;点在 的沉淀溶解平衡曲线的下方,该点
,即, ,
即 ,则
,故 点对应的溶液可能为
的过饱和溶液,C正确;由反应 可知,
,D正确。
【解析】
3.[2023全国甲卷]如图为、和 在水中达沉淀溶解
平衡时的关系图 ;
可认为离子沉淀完全 。下列叙述正确的是
( )
C
A.由点可求得
B.时的溶解度为
C.浓度均为的和 可通过分步沉淀进行分离
D.、混合溶液中 时二者不会同时沉淀
【解析】点、 ,则
,A错误;时对应的 ,即
,故的溶解度为,B错误;由图可知, 时的
小于时的,则可通过调分步沉淀浓度均为的和 ,C正确;由
图可知,时此时的,由于为定值, 沉淀的过程
中溶液中浓度增大,浓度减小,故、 会同时沉淀,D错误。
3-1.变图像[2024贵州贵阳摸底]易被氧化成 。为验证该事实,某实验小组利用数字化实验设备,从贴有“
”标签的溶液中取样品,逐滴加入 溶液,得到的
溶液 曲线如图所示。关于该实验,下列说法错误的是
已知:, 。( )
C
A.使产生沉淀的范围为
B. 时,产生红褐色沉淀
C.时,溶液中
D. 时,溶液中
【解析】第一步:根据溶度积计算和沉淀的范围。当离子浓度 时认为沉淀完全,根据
、的溶度积计算可得沉淀完全时约为,沉淀完全时约为 ,若样品溶液中的
未被氧化,则开始沉淀时的 约为7。
第二步:分析图像。由题图知,当溶液在范围内时,溶液变化缓慢,说明加入的
并未完全进入溶液中,结合易被氧化成及上面计算的范围知,此时和结合生成了 沉
淀,继续滴加溶液,进入溶液中,变化明显,同理,当溶液在 范围内时
产生沉淀。
第三步:分析选项。由上述分析知,A正确、B正确;时, ,
则, ,
,C错误;时,溶液中 没有完全沉淀,故根据电荷守恒有:
,D正确。
4.[2023浙江卷6月]草酸 是二元弱酸。某小组做如下两组实验:
实验Ⅰ:往溶液中滴加 溶液。
实验Ⅱ:往溶液中滴加 溶液。
已知:的电离常数,, ,溶液混合后体积变化忽略不
计 ,下列说法正确的是( )
D
A.实验Ⅰ可选用甲基橙作指示剂,指示反应终点
B.实验Ⅰ中时,存在
C.实验Ⅱ中发生反应
D.实验Ⅱ中时,溶液中
【解析】实验Ⅰ滴定终点溶液中的溶质是 ,溶液呈碱性,故不能选用甲基橙作指示剂,A错误;实验Ⅰ中
时,溶液中溶质是等物质的量的和, ,故
以电离为主,又,故的电离程度大于 的水解程度,溶液中
,B错误;实验Ⅱ中,当滴加少量的氯化钙时 过量,则初始阶段发生反应
,该反应的平衡常数为
,平衡常
数,说明反应能够进行完全,后面随着氯化钙的加入,和 也会发生反应,C错误;由题给数据
可知,当加入时,溶液中的 浓度为
,由
知,此时溶液中浓度为 ,D正确。
5.[2024山东潍坊部分学校模拟](双选)磷酸银可用于光催化降解含有机物的污水,一段时间后,溶液变为浅的棕黑色,磷酸银催化效果降低。实验室制备少量磷酸银的工艺流程如下:
已知:
;
②常温时, 。
下列说法正确的是( )
AD
A.银氨溶液中的平衡:
B.“析银”离子方程式:
C.“离心沉淀”所得母液中有两种溶质
D.磷酸银催化失效的原因可能是光照分解生成
【解析】关键一步
制备银氨溶液过程中发生反应: ,析银过程中发生
反应: 、
。
已知 、
,由可得:
,A项正确;由上述分析知,“析银”时发生反应:
,B项错误;“离心沉淀”所得母液中有
、、等溶质,C项错误;由溶液变为浅的棕黑色推测,磷酸银光照生成 单质,因此催
化效果降低,D项正确。
6.[2022全国乙卷]废旧铅蓄电池的铅膏中主要含有、、和,还有少量、、 的盐或氧化物等,
为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
一些难溶电解质的溶度积常数如下表:
难溶电解质
一定条件下,一些金属氢氧化物沉淀时的 如下表:
金属氢氧化物
开始沉淀的 2.3 6.8 3.5 7.2
完全沉淀的 3.2 8.3 4.6 9.1
回答下列问题:
(1)在“脱硫”中 转化反应的离子方程式为__________________________________________,
用沉淀溶解平衡原理解释选择 的原因
_ ________________________________________________________________________________________。
该反应的,反应正向进行的程度很大,可以进行到底
【解题思路】的远小于的,易发生生成 的沉淀转化,且进行较为彻底。
【解题思路】的大于的,不易发生生成 的沉淀转化,即使发生,反应进行的程度也很小。
(2)在“脱硫”中,加入不能使铅膏中 完全转化,原因是(
反应
的 ,反应正向进行的程度
很小
)。
(3)在“酸浸”中,除加入醋酸,还要加入 。
能被 氧化的离子是______;
促进了金属在醋酸中转化为 ,其化学方程式为___________________________________;
也能使转化为, 的作用是__________。
作还原剂
【解题思路】具有还原性,能被氧化;能氧化,使其转化成,再与 结合生成
,依据氧化还原反应的规律,即可写出反应的化学方程式;通过与、 反应转化为
,发生氧化还原反应,化合价降低, 作还原剂。
(4)“酸浸”后溶液的约为 ,滤渣的主要成分是_________________________。
、、
【解题思路】根据题给信息,当时,、完全转化为、 ;结合(2)知,加入的
不能使完全转化,故滤渣中还含有 。
(5)“沉铅”的滤液中,金属离子有___________。
、
【解题思路】加入溶液,发生沉铅的反应为 ,故滤液中含有的金属
阳离子有以及未沉淀的 。
【解析】 信息转换
加入使转化为,便于后续的酸浸;通过酸浸,铅元素全部转化为可溶性的 ,过滤
后在滤液中加入溶液,使转化为,加热分解得到 。
创新1+1
1.新图像·电动势与标准溶液体积关系图[2024浙江名校联考]某温度下,用
硝酸银标准溶液对含和的混合溶液进行电位滴定
与的反应可以忽略,获得电动势和硝酸银标准溶液体积 的电位滴定曲线
如图所示。
已知:, 。该温度下,
, 。下列说法不正确的是( )
D
A.主要发生了反应:
B.若为弱酸,则从 ,水的电离程度不断减小
C.原混合溶液中
D.的平衡常数为
【解析】综合分析
,可知含和的混合溶液滴加硝酸银,先与硝酸银反应; 发生反应
、发生反应,发生反应 。
由上述分析可知,A项正确;若为弱酸,则从,发生反应, 浓度减小,对水电离
的促进作用减小,水的电离程度不断减小,B项正确;主要发生了反应: ,则
,原混合溶液中
,C项正确; 的平衡常数为
,D项错误。
2.新考法·模块融合(沉淀溶解平衡+实验)[2024广东部分学校模拟]某学习小组在实验室进行了有关碘化铅
的实验探究。回答下列问题:
Ⅰ.制备 悬浊液
(1)溶液和溶液反应会产生金黄色的 沉淀,形成美丽的“黄金雨”。
① 溶液在空气中久置会变质,其原因是__________________________________。
具有还原性,会被空气中的氧化
②生成 的化学方程式为________________________________。充分反应后,
经一系列操作得到纯净的固体,向其中加入蒸馏水,得到 悬浊液。
Ⅱ.探究浓度对 沉淀溶解平衡的影响
【查阅资料】ⅰ.温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;
时,饱和溶液的电导率为 。
(2)稀释对沉淀溶解平衡的影响:时,向 悬浊液
中加入一定体积的蒸馏水,通过图甲所示装置测定电导率,并得到
电导率随时间变化的曲线(图乙)。
①实验装置中仪器 的名称为____________。
酸式滴定管
②由电导率变化曲线可知,实验中通过仪器 加入蒸馏水的方式是___(填标号)。
B
A.连续逐滴加入 B.分三次快速加入 C.一次性快速加入
③图乙中,_________________段(用字母表示,任写一段)表示达到沉淀溶解平衡状态; 段溶液的电导率
逐渐增大的原因是__________________,溶液中离子浓度不断增大。
或或或
固体不断溶解
(3)对沉淀溶解平衡的影响:时,将悬浊液静置后,取上层清液(即 饱和溶液)
于烧杯中,另取蒸馏水于相同规格的烧杯中进行对比实验,再分别向其中加入
溶液。实验数据记录如表:
累计加入的溶液的体积/ 电导率/ 饱和溶液 蒸馏水
0 368 4
0.50
1.00
①上述实验过程中,增大饱和溶液中 的浓度,可观察到的实验现象是________________。
②利用蒸馏水进行对比实验时,所取蒸馏水的体积为_____ 。
③表格数据______(填“大于”“小于”或“等于”),说明增大的浓度, 沉淀溶解平衡向生成沉
淀的方向移动。
产生金黄色沉淀
200
小于
【解析】 实验分析
实验目的 制备悬浊液并探究 沉淀溶解平衡的影响因素
实验原理
实验现象及 相关分析 增大饱和溶液中的浓度,平衡 逆向移动,可观察到溶液中
产生金黄色沉淀
实验探究及 相关分析 (3)②为保证变量唯一,所取蒸馏水的体积应与所取上层清液的体积相同,即 。
#b#
③增大的浓度,沉淀溶解平衡向生成沉淀的方向移动,导致上层清液中 浓度的增加量小于
蒸馏水中 浓度的增加量,故上层清液的电导率的变化量小于蒸馏水的电导率的变化量,则
小于
【解题思路】
热考题型11 溶液中微粒浓度大小关系
1.[2022重庆卷]某小组模拟成垢-除垢过程如下。
水溶液
忽略体积变化,且步骤②中反应完全。下列说法正确的是( )
D
A.经过步骤①,溶液中
B.经过步骤②,溶液中
C.经过步骤②,溶液中
D.经过步骤③,溶液中
【解析】步骤①,和恰好完全反应,,得到 和
,根据物料守恒 知,A项错误;步骤②,发生反应
,生成,剩余和 ,
,B项错误;经过步骤②,溶液中存在物料守恒 ,C
项错误;步骤③加入冰醋酸,根据物料守恒, ,D项正确。
2.[2023江苏卷]室温下,用含少量的溶液制备的过程如图所示。已知 ,
。下列说法正确的是( )
C
A.溶液中:
B.“除镁”得到的上层清液中:
C.溶液中:
D.“沉锰”后的滤液中:
【解析】根据电荷守恒可知,溶液中存在: ,A错误;“除镁”
得到的上层清液中存在的沉淀溶解平衡,其溶度积常数 ,则
,B错误; 溶液中存在电荷守恒
,物料守恒 ,二者联
立可得,C正确;“沉锰”后的滤液中还存在、 ,故D错误。
3.[2024湖北武汉部分学校调研]常温下,向饱和氯水中以恒定速率滴加 溶液,测
得溶液的随时间的变化如图所示。溶液中氯元素的存在形式仅考虑、 、
、,该过程不考虑 的分解。下列说法错误的是( )
D
A.点:
B.点:
C.从点到点, 逐渐减小
D.从点到 点,水的电离程度逐渐增大
【解析】点为饱和氯水,根据,完全电离, 部分电离,知
,A项正确;点溶液呈中性, ,根据电荷守恒:
,知,B项正确;从点到 点,不断滴加
溶液,减小,,不变,则逐渐减小,C项正确;从点到 点,水的电
离程度先增大后减小,D项错误。
4.[2024天星原创]电导率是衡量电解质溶液导电能力大小的物理量。常温下, 的电离常数
。向浓度均为的和的混合液中滴加 溶
液,测得溶液电导率与加入 溶液体积的关系如图所示。下列说法不正确的是( )
D
A.点溶液中约为
B.、、、四点对应溶液中,水电离程度最大的是 点
C.点对应溶液中:
D.该温度下的溶液在点与 点之间
【解析】
点对应溶液中,电离使溶液呈酸性,点对应溶液中, 水解使溶液呈碱性,常温
下的溶液呈中性,则在点与 点之间,D错误。
5.[2024天星原创]常温常压下,某化学兴趣小组在实验室中先将 缓慢通入饱和食盐水中至饱和,然后向所得
溶液中缓慢通入,测得溶液中水电离的 随通入气体体积的变化曲线如图所示(实验中不考虑氨水的挥
发)。下列叙述正确的是( )
C
A.由点到点的过程中,溶液中 增大
B. 点溶液呈中性
C.点所示溶液中:
D.点所示溶液中:
【解析】
6.[2024天星原创]高铁酸钠是一种品质优良的无机絮凝剂,能高效地
除去水中的微细悬浮物。常温下,将一定量稀硫酸逐滴滴入高铁酸钠
溶液中,溶液中含铁微粒存在平衡:
; ;
。各含铁微粒的物质的量分数
,表示含铁微粒]随 变化如图。下列说法不正确
的是( )
D
A.
B.随着的增大,溶液中 的值不变
C.点对应溶液中:
D.常温下,反应的平衡常数
,温度不变,、不变,则随着的增大,溶液中 的值不
变,B正确。反应 的平衡常数
,D错误。
【解析】
7.[2023浙江杭州质检]常温下,向 溶液中缓慢加入少量溶于水的
粉末(已知难溶,忽略溶液体积变化),溶液中与 变化如图所示
[横纵坐标未按比例画,已知:, 。下列
有关说法不正确的是( )
D
A.点溶液中约为
B.、、三点中由水电离产生的最小的是 点
C.的数量级约为
D.点溶液可能存在关系:
【解析】点溶液为溶液,设溶液中为,则 ,由
,解得,A项正确;根据化学反应
可知,随着反应进行浓度逐渐增大,对水的电离的抑制作用逐渐增强,所以、、 三点中由水电离产生的
最小的是点,B项正确;根据点数据计算, ,
,,此时溶液中 ,解得
,故
,C项正确;由于部
分元素以的形式存在,依据元素守恒,则有 ,D项错误。
8.[2023辽宁卷]某废水处理过程中始终保持 饱和,即
,通过调节使和 形成硫化物而分
离,体系中与关系如图所示,为、、和
的浓度,单位为。已知 ,下列说法正确
的是( )
D
A.
B.③为与 的关系曲线
C.
D.
【解析】饱和溶液中随着的增大,不变,
逐渐增大,逐渐增大,则有和 随着
增大而减小,当相同时, ,即
,则曲线③、④分别为 与
、的关系曲线,B错误;随着 的增大,
逐渐增大,则和 逐渐减小,又
,即相同时, ,
,即曲线①、②分别为 与
、 的关系曲线。
热考题型12 电解质溶液图像分析
05
1.[2024辽宁沈阳部分学校模拟]赖氨酸,用 表示]是人体必需氨基酸,其盐酸盐
在水溶液中存在电离平衡:。向一定浓度的溶液中滴加 溶液,溶
液中、、和的分布分数随 的变化关系如图所示。下列
说法正确的是( )
D
A.
B.点对应溶液中,
C.点对应溶液中,
D.点对应溶液中,
【解析】
2.[2024海南部分学校检测改编]已知。初始温度时,向 氨水中滴加
稀硫酸,测得混合溶液的温度、随加入稀硫酸的体积 的变化关系如图所示。下列说法正确的
是( )
D
A.、、三点对应的水解平衡常数:
B.水的电离程度:
C.图中点对应溶液中
D.若,则点对应溶液中
【解析】
3.[2024湖南部分学校联考]时,用气体调节氨水的。溶液中微粒浓度的对数值 、反应
物的物质的量之比与 的变化关系如图所示。忽略通入气体后溶液体积的变化。下列说法错误的是
( )
B
A.所示溶液中:
B.所示溶液中:
C.时,溶液中
D.时,水解平衡常数的数量级为
【解析】
4.[2024江西九校联考]是一种难溶于水、但可溶于酸的盐。在常温下,向 浊液中
通入氯化氢气体,得到了如图所示的图像,图像表现了该体系中为或
与的关系。已知 ,下列说法错误的是( )
B
A.
B.点的溶液中存在
C.点的溶液中存在
D.由图像可知的数量级为
【解析】图像分析
,两边取负对数,,、 符合
的函数关系,所以代表,代表 。
由图可知,当时,代入 的表达式可得
,A项正确; 点溶液中存在电荷守恒
和物料守恒 ,二式联立可得
,点溶液中含、,是强酸弱碱盐,故溶液呈酸性, ,
则,B项错误;点处,结合电荷守恒 ,
可得,C项正确;将代入 中可得
,,所以的数量级为 ,D项正确。
5.[2023北京卷]利用平衡移动原理,分析一定温度下在不同的 体系中的可能产物。
已知:①图1中曲线表示体系中各含碳粒子的物质的量分数与 的关系。
②图2中曲线Ⅰ的离子浓度关系符合 ;曲线Ⅱ的离子浓度关系符合
[注:起始,不同下 由图1得到]。
图1
图2
下列说法不正确的是( )
C
A.由图1,,
B.由图2,初始状态、 ,无沉淀生成
C.由图2,初始状态、 ,平衡后溶液中存在
D.由图1和图2,初始状态、,发生反应:
&6&【解析】&6&
6.[2023湖南部分学校联考改编]常温下,浓度相同的一元弱酸 稀溶液和一元弱
碱稀溶液相互滴定,其溶液的与或 的变化关系如图所示。
已知和的电离常数分别为和,且和 点的纵坐标之和为14。下列说
法错误的是( )
D
A. B.和 点的纵坐标之和为14
C.水的电离程度: D.溶液中点大于 点
【解析】由题图知,随浓度比值的增大,减小,则其代表溶液滴定溶液的图像, 随浓度比值的增
大,增大,则其代表溶液滴定溶液的图像,即直线代表与的变化关系,直线代表 与
的变化关系。点时,两直线相同,则该点的, ,由题图可知,该点的
,则,故该温度下,,即 ,A正确。
时,,该温度下,,同理,已知和
点的纵坐标之和为14,即,则;点时,,即 ,
此时,同理,点对应,,B正确。 和
点的纵坐标之和为14,由上述分析可知,点溶液中等于点溶液中 ,则两点对水的电离影响程度
相等,点两直线相同,该点的,因此点水的电离程度逐渐增大,即水的电离程度: ,
C正确。根据上述分析可知,直线是向溶液中滴加溶液,直线是向溶液中滴加溶液,和
的电离平衡常数相等,点时,,此时两种溶液恰好完全反应,因此点大于点 ,D错误。
7.[2023湖北卷] 为某邻苯二酚类配体,其
,。常温下构建(Ⅲ) 溶
液体系,其中 ,
。体系中含 物种的组分
分布系数 与 的关系如图所示,分布系数
,已知, 。下列
说法正确的是( )
C
A.当 时,体系中
B.在之间,含的物种主要为
C.的平衡常数的 约为14
D.当 时,参与配位的
【解析】由图可知,即时 ,又
,根据 知,此时
,结合 知,此时
,又时, ,故A错误;
在之间时 ,其中两种离子共含
,当时, ,
根据,,即 ,由
,得,即 ,B错误;该反应的平衡常数
,由题图知,当时,,由 ,得①
式 ①,此时
,代入①式,
,则,故 ,C
正确;时,则参与配位的 的总浓度为
,D错误。
专题综合训练
06
1.[2021重庆卷]下列叙述正确的是( )
C
A.向氨水中加入醋酸使溶液呈酸性,则
B.向溶液中加入少量 固体,则水的电离程度减小
C.向溶液中滴加盐酸至,则
D.向磷酸中加水至原体积的两倍,则
【解析】溶液中存在电荷守恒,溶液呈酸性, ,则
,A项错误;向溶液中加入少量固体,由于的水解程度比 的水解程
度大(因为的碱性比弱),故水的电离程度增大,B项错误;向 溶液中滴加盐酸至
,则和按物质的量之比为发生反应,反应后得到等物质的量的和 ,
的水解是微弱的,故,C项正确;向 磷酸中加水至原体积的2倍,
,但是弱酸,在水中不能完全电离,故 ,D项错误。
2.[2024江苏淮安考试改编]常温下,可用如图所示的方法制备。已知: ,
,,, 。下列
说法正确的是( )
C
A.溶液中:
B.溶液中:
C.反应的平衡常数约为
D.当混合液中时,应控制
【解析】A项,溶液中,和均发生水解, ,
,
,
,则 的水解程度小于
的水解程度,所以溶液中,错误;B项, 溶液中存在质子守恒
,错误;C项,反应 的平衡常数
,正确;D项,
,为避免生成 沉淀,
, ,
, ,错误。
3.[2024河北石家庄部分学校考试]已知常温下水溶液中、、、、 的分布分数
随变化曲线如图1;溶液中和 的关系如图2。用
溶液滴定 溶液,下列说法错误的是( )
D
A.曲线表示
B.的水解平衡常数
C.滴定过程中溶液会变浑浊
D.滴定过程中始终存在:
【解析】图像分析
随增大,溶液中、减少,、增多, 先增多后减少,结合粒子分布分数的计算公式可确定图1中
各曲线含义。
由上述分析知,A项正确;时 ,则
,B项正确;难溶,滴定过程中会生成 沉淀,
C项正确;若滴定过程中 不沉淀,则溶液中存在电荷守恒
,物料守恒 ,两式联立得:
,但生成 沉淀,故D项错误。
4.[2023豫北名校联考]下列依据有关实验操作和实验现象(或数据)能得出相应的实验结论且实验结论符合客观事
实的是( )
选 项 实验操作 实验现象(或 数据) 实验结论
A 将盐酸与 反应得到的气体直接通入硅酸钠溶液中 产生白色胶状 的沉淀 酸性:
B 向 溶液中滴加 溶液,再加入几滴同浓度的 溶液 先产生白色沉 淀,后产生黑 色沉淀
C 常温下,将等体积的饱和溶液与饱和 溶 液混合 试管中有白色 沉淀产生 常温下, 的溶解度小于
和 的
D 常温下,用计分别测定 和 溶液的 均等于7 同温下,不同浓度的
溶液中水的电离程度相同
C
【解析】 生成的中混有挥发出来的气体,故无法判断硅酸与碳酸的酸性强弱,A项不符合题意; 与
溶液反应后有剩余,剩余的与溶液反应生成沉淀,故无法比较和 的大
小,B项不符合题意;常温下,的溶解度小于和的溶解度,故将等体积的饱和 溶液
与饱和溶液混合后,产生的 因过饱和而析出,试管中有白色沉淀产生,C项符合题意;同温下,不同
浓度的 溶液中,水的电离程度不相同,但同一溶液中的醋酸根离子和铵根离子的水解程度相同,故两
溶液均呈中性,D项不符合题意。
5.[2023辽宁锦州模拟]时,用 溶液滴定同浓
度的溶液,滴定分数、 及微粒分布分数
,表示、或 的关系如图
所示。下列说法错误的是( )
D
A.时,
B.点对应溶液中:
C.、、、四点对应溶液中水的电离程度:
D.用溶液滴定 溶液可用甲基橙作指示剂
【解析】图像分析
由题图可知,、、、四点所在曲线为溶液滴定同浓度二元弱酸 的滴定曲线,当
时,溶液中溶质为和;当时,溶液中溶质为,对应溶液的,则
溶液显酸性;当时,溶液中溶质为和;当时,溶液中溶质为 ,对应溶
液的,则 溶液显碱性。
由题图可知,时,当时,对应溶液的约为4,则 ,
A正确。由上述分析可知,点对应溶液中溶质为和,且 ,由电荷守恒可知
,又点对应溶液, ,故
,B正确。未加氢氧化钠溶液时,电离出 ,抑制水的电离,
加入氢氧化钠溶液过程中,酸逐渐被中和生成盐,对水的电离抑制程度减弱,中和生成的、 能水解,促
进水的电离,当酸碱恰好中和生成,即点附近时,对水的电离促进程度最大,故、、、 四点对应
溶液中水的电离程度:,C正确。用溶液滴定 溶液时,滴定终点时溶质为
,溶液显碱性,应选择酚酞作指示剂,D错误。
速解
“特殊点结论法”速判:由“浓度相等的点”、,可得出、 ,A
正确。酸碱中和滴定曲线中,“恰好完全反应点”对应的是正盐,生成正盐时若存在对水电离的影响,则只存在盐
类对水电离的促进作用,此时水的电离程度最大,C正确。酸滴定碱一般选用甲基橙作指示剂,而碱滴定酸一般选
用酚酞作指示剂,则用溶液滴定 溶液可用酚酞作指示剂,D错误。
6.[2024天星原创]室温下,向一定浓度的溶液中滴加溶液,溶液中酸度 随溶液
、或 的变化如图所示。下列说法错误的是( )
D
A.室温下,的
B.室温下, 溶液显酸性
C.的平衡常数的数量级为
D.时,
【解析】
7.[2023新课标卷]向饱和溶液(有足量固体)中滴加氨水,发生反应 和
。与
的关系如图所示(其中代表、、或 )。
下列说法错误的是( )
A
A.曲线Ⅰ可视为溶解度随 浓度变化曲线
B.的溶度积常数
C.反应的平衡常数的值为
D. 时,溶液中
命题分析
本题以向 饱和溶液中滴加氨水的反应为背景,呈现了一个自
变量下的多个因变量变化过程图,图像复杂,但选项考查较为简
单,只要考生能够分析出每条曲线的含义,即可快速得到正确答
案,这对考生从图中提取和加工数据的能力提出了较高要求。本
题易错选B项,需注意,曲线Ⅲ、Ⅳ的起点在纵轴“ ”上方,而
不是“ ”。
【解析】
8.[2024河北秦皇岛部分学校联考]将或 悬浊液置于分压固定的
气相中,体系中与关系如图所示,为、、、 、
的浓度,单位为。已知: 。下列说法正
确的是( )
A
A.,
B. ,平衡常数
C.表示 曲线
D.向点溶液中加入,可以达到 点溶液
【解析】图像分析
分压固定的气相中,使溶液中浓度也相应固定,因此表示,随着逐渐增大, 、
的浓度逐渐增大,且较小时的浓度大于的浓度,所以表示,表示 ;根
据判断,表示,表示 。
,时,和的浓度相等,此时, 表
示、表示,两者交于,此时、的浓度均为 ,
,A项正确;通过与的交点说明 ,则
,点处 ,
,结合得出 ,
, 的平衡
常数,B项错误;由上述分析可知表示,C项错误;点可表示 的
不饱和溶液,向点溶液中加入可以达到点饱和溶液,而不是加 ,D项错误。
9.[2022广东卷节选]食醋是烹饪美食的调味品,有效成分主要为醋酸(用表示)。 的应用与其电离平衡密切
相关。时,的 。
(1)某小组研究下 电离平衡的影响因素。
提出假设 稀释溶液或改变浓度, 电离平衡会发生移动。
设计方案并完成实验 用浓度均为的和溶液,按下表配制总体积相同的系列溶液;测定 ,记录
数据。
①根据表中信息,补充数据:_____, ______。
3.00
33.00
【解题思路】实验中,,两种溶液的浓度相等,当 时,
,为保证溶液的总体积为,则 。
②由实验Ⅰ和Ⅱ可知,稀释 溶液,电离平衡____(填“正”或“逆”)向移动;结合表中数据,给出判断理由: ___________
___________________________________________________________________________________________________
________________ 。
正
【解题思路】由实验Ⅰ、Ⅱ的数据分析,实验Ⅱ中的浓度为实验Ⅰ中的,但是没有从2.86变为, 浓度相
对变大(实际为),说明稀释时,促进了 的电离。
③由实验Ⅱ可知,增大浓度, 电离平衡逆向移动。
实验结论 假设成立。
实验Ⅱ中的
的浓度为实验Ⅰ的,稀释10倍后,假设电离平衡不移动,理论为,实际为,说明稀释 时,
促进了 的电离
(2)小组分析上表数据发现:随着的增加,的值逐渐接近的 。
查阅资料获悉:一定条件下,按配制的溶液中,的值等于的 。
对比数据发现,实验中与资料数据 存在一定差异;推测可能由物质浓度准确程度不够引起,
故先准确测定 溶液的浓度再验证。
【解题思路】与以物质的量为反应,则 ,
。与 完全反应时,生成强碱弱酸
盐,滴定终点时,溶液显碱性,所以加入溶液时,对应的滴定终点溶液的 。
(ⅰ)移取溶液,加入2滴酚酞溶液,用溶液滴定至终点,消耗体积为 ,
则该溶液的浓度为________ 。画出上述过程的滴定曲线示意图并标注滴定终点。
(ⅱ)用上述溶液和溶液,配制等物质的量的与混合溶液,测定 ,结果与资料
数据相符。
【答案】&7& .
(3)小组进一步提出:如果只有浓度均约为的和溶液,如准确测定的 小组同学设计方
案并进行实验。请完成下表中Ⅱ的内容。
Ⅰ 移取溶液,用溶液滴定至终点,消耗溶液
Ⅱ ________________________________________________,测得溶液的 为4.76
移取溶液,向其中加入溶液
【解题思路】醋酸的电离平衡:,平衡常数,当时, ,
故在Ⅱ中,向溶液中加入溶液,反应后的溶液中和浓度相等,测定溶液的 ,即
可得出 。
实验总结 得到的结果与资料数据相符,方案可行。
(4)根据 可以判断弱酸的酸性强弱。写出一种无机弱酸及其用途____________________________________。
、杀菌消毒(其他合理答案也可)
【解题思路】 为弱酸,可以用于自来水的杀菌消毒。
同课章节目录
