2025届高考化学基础练作业课件 专题二 物质的量 课件(73张)
文档属性
| 名称 | 2025届高考化学基础练作业课件 专题二 物质的量 课件(73张) |

|
|
| 格式 | pptx | ||
| 文件大小 | 15.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-03 10:26:34 | ||
图片预览










文档简介
(共73张PPT)
考点4 物质的量、气体摩尔体积
考点5 物质的量浓度
热考题型3 阿伏加德罗常数的应用
专题综合训练
热考题型4 以物质的量为中心的计算
【考情分析】在高考中,阿伏加德罗常数的应用是高频考点,涉及面广;一定物质的量浓度溶液的配制会在实验
题中涉及,化学计算的考查主要是根据化学方程式、关系式等进行计算。
考点4 物质的量、气体摩尔体积
01
经典3+2
1.[2023北京东城区练习]下列指定微粒或化学键的个数比为 的是( )
B
A.原子中的质子和中子 B. 固体中的阴离子和阳离子
C.晶体中的硅原子和共价键 D.溶液中的和
【解析】原子中的质子数和中子数都为6,则质子和中子的个数比为,A项错误;固体中和 的
个数比为,B项正确;晶体中1个硅原子与4个氧原子形成4个硅氧共价键,则 晶体中的硅原子和共价键
的个数比为,C项错误;是强酸弱碱盐,在溶液中发生水解,和的个数比小于 ,D项错误。
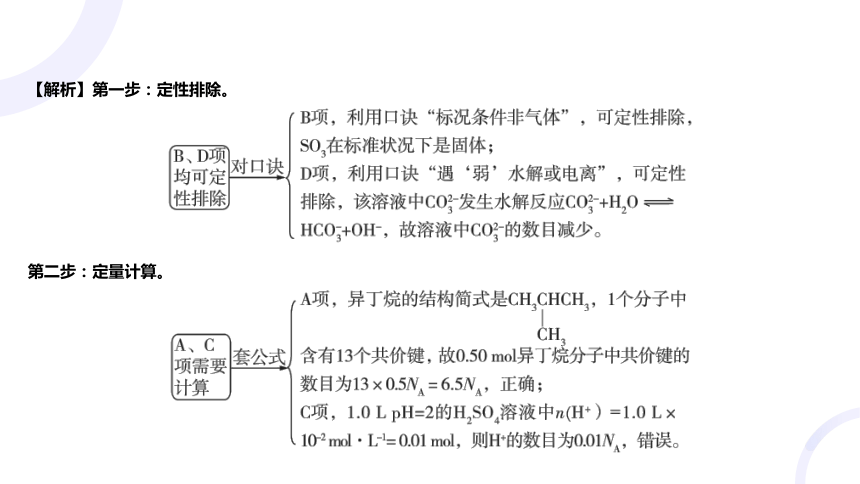
2.[2023全国甲卷] 为阿伏加德罗常数的值。下列说法正确的是( )
A
A.异丁烷分子中共价键的数目为
B.标准状况下,中电子的数目为
C.的溶液中的数目为
D.的溶液中的数目为
【解析】第一步:定性排除。
第二步:定量计算。
思维建模
秒破阿伏加德罗常数题
2-1.变物质[2023广东韶关模拟]设 为阿伏加德罗常数的值,下列说法正确的是( )
C
A.甲醛分子的中心原子的价层电子对数为
B.标准状况下,与充分反应后的分子总数为
C.和金刚石均含有 个碳原子
D.溶液中含有的氧原子数大于
【解析】第一步:定性排除。
第二步:定量计算。
3.[2024湖北武汉部分学校调研]设 为阿伏加德罗常数的值。下列说法正确的是( )
A
A.中氮的价层电子对数为
B.溶液中的数目为
C.标准状况下,氯仿中分子数为
D.常温下,与足量浓硝酸反应转移的电子数为
【解析】中的价层电子对数为,则中氮的价层电子对数为 ,A项正确;没
有提供溶液体积,的数目无法计算,B项错误;标准状况下氯仿为液体,氯仿不为 ,所含分子数不
为 ,C项错误;常温下铁遇浓硝酸钝化,D项错误。
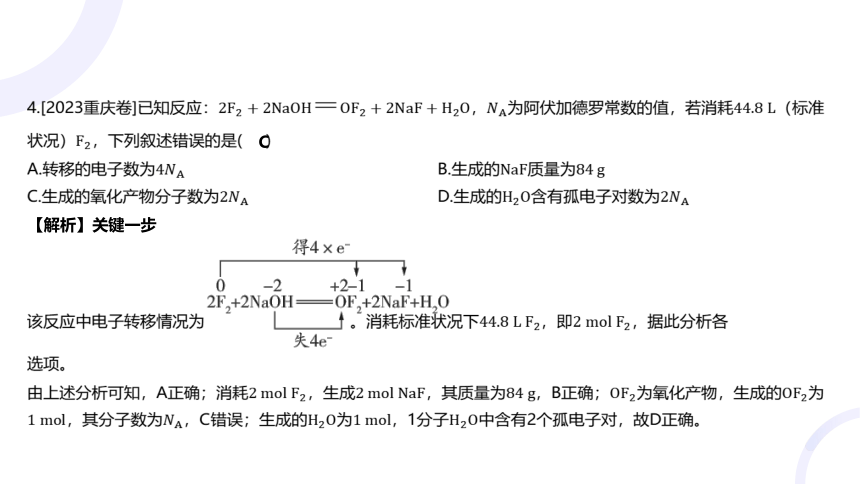
4.[2023重庆卷]已知反应:,为阿伏加德罗常数的值,若消耗 (标准
状况) ,下列叙述错误的是( )
C
A.转移的电子数为 B.生成的质量为
C.生成的氧化产物分子数为 D.生成的含有孤电子对数为
【解析】关键一步
该反应中电子转移情况为 。消耗标准状况下,即 ,据此分析各
选项。
由上述分析可知,A正确;消耗,生成,其质量为,B正确;为氧化产物,生成的 为
,其分子数为,C错误;生成的为,1分子 中含有2个孤电子对,故D正确。
4-1.变情境[2024广东惠州调研]反应 放热且产生气体,可用于冬天石油开采。
设 为阿伏加德罗常数的值。下列说法不正确的是( )
C
A.中含有的 键数目为
B.中所含电子数目为
C.常温时,的溶液中所含的数目为
D.上述反应中,每生成转移的电子数目为
【解析】中含有键,一个三键含一个 键、两个 键,则中含有 键的数目为 ,A项正
确;一个中含有10个电子,的物质的量为,所含电子数目为 ,B项正确;溶液体积未知,
不能计算的数目,C项错误;中的化合价为,中的化合价为,生成的中 的化合价为0,
则生成转移 电子,D项正确。
5.[2024黑龙江鸡西实验中学考试]下列说法错误的是( )
A
A.同温同体积下,和 分子数相同
B.同温等压下,与的密度之比等于
C.温度和容积相同的两气罐中分别盛有和,两容器中的压强之比等于
D.同温等压下,和的体积之比等于
【解析】
选项 分析
压强未知,温度和体积相同的和 分子数不一定相同
同温等压下,两种气体的密度之比等于其相对分子质量之比,则与的密度之比为64
同温同体积下,两种气体的压强之比等于其物质的量之比,故两容器中的压强之比等于5
同温等压下,两种气体的体积之比等于其物质的量之比,故和的体积之比等于5
6.[2024鄂东南省级示范高中联考]设 为阿伏加德罗常数的值,下列说法正确的是( )
D
A.铁完全发生吸氧腐蚀,则在电化学反应过程中转移的电子数为
B.足量与充分反应生成的分子数目为
C.中含 键个数为
D.常温下,的溶液中,水电离出的数目为
【解析】吸氧腐蚀时转化为,故铁完全发生吸氧腐蚀,此过程中转移的电子数为 ,A错误;酯化反
应是可逆反应,故B错误;与分子间的配位键也是 键,故中含 键个数为 ,C错
误;是强碱弱酸盐,能结合电离出的形成,故溶液中 全部来
自水的电离,故水电离的 ,D正确。
7.[2024安徽部分学校摸底]乙醛是一种重要的有机化工原料,制备原理之一是
。设阿伏加德罗常数的值为 ,下列有关说法错误的是( )
A
A.乙醇水溶液中含有氢原子的数目为
B.乙醛中所含 键的数目为
C.冰中含有氢键的数目为
D.每消耗标准状况下氧气,转移电子数为
选项 分析
水分子中也含有氢原子
乙醛的结构式为_________________________1个乙醛分子中含有4个键、1个键(1个双键中含有1个
键)、1个键,共6个 键,则乙醛中含有 键
冰中平均1个能形成2个氢键,故冰中含 个氢键
标准状况下氧气的物质的量是,转移电子数为
【解析】
创新1+1
1.新情境·碳达峰[2024福建福州质检]中国力争2030年前实现碳达峰,达到峰值之后逐步降低。其中由和 制
备合成气、,再由合成气制备的反应转化关系如图所示。设 为阿伏加德罗常数的值,下列说法错
误的是( )
B
A.标准状况下,所含的极性键数为
B.等物质的量的和,的质子数比多
C.制备合成气的反应中,若生成 ,理论上反应Ⅰ和Ⅱ共
转移电子数为
D.反应Ⅲ的化学方程式为 ,原子
利用率为 ,符合绿色化学理念
【解析】图像分析
每个分子中含有4个极性键,标准状况下,为,所含的极性键数为 ,A选项正确;B
选项未指明具体的量,所以无法得知两者质子数相差多少,B选项错误;由上述分析可知,每生成 ,反应
Ⅰ和反应Ⅱ共转移,则生成,转移电子数为,C选项正确;反应Ⅲ原子利用率达到 ,符合
绿色化学理念,D选项正确。
2.新考法·结合流程图考查[2024天星原创]由铬铁矿 制备金属铬的流程示意图如下。
已知:酸性条件下可发生反应。设 为阿伏加德罗常数的值,下列说法正确的是
( )
D
A.反应①中,若有完全反应,则消耗的数目为
B.溶液(调)中的数目为
C.反应③中,氧化产物为与,若有完全反应,反应过程中转移电子的数目为
D.反应④中,当生成单质时,反应过程中转移电子的数目为
【解析】制备金属铬的流程中涉及反应的化学方程式如表所示:
反应 化学方程式
反应①
反应②
反应③
反应④
根据表中反应①的化学方程式可知,若有完全反应,则消耗,故消耗的数目为 ,
A错误。结合题给已知信息可知,酸性条件下溶液中存在化学平衡 ,故
溶液(调)中的数目小于 (【易错警示】切勿忽略题干中给出的信息,
酸性条件下可转化为,二者数目之和为 。),B错误。根据表中反应③的化学方程式可知,若有
完全反应,则参与反应的的物质的量为,反应过程中转化为, 的化合价
由降低为,则反应过程中转移电子的数目为 ,C错误。根据表中反应④的化学方程式可知,当生成
单质时,反应过程中转移电子的数目为 ,D正确。
考点5 物质的量浓度
02
经典3+2
1.[2021广东卷]测定浓硫酸试剂中 含量的主要操作包括:①量取一定量的浓硫酸,稀释;②转移定容得待测
液;③移取待测液,用的 溶液滴定。上述操作中,不需要用到的仪器为( )
B
A.&2& B.&3& C.&4& D.&5&
【解析】①量取一定量的浓硫酸稀释要用到量筒、烧杯和玻璃棒;②转移定容制备待测液需用到容量瓶、胶头滴
管和玻璃棒;③移取待测液,用 溶液滴定需用到碱式滴定管、锥形瓶等。结合上
述分析可知,实验中不用分液漏斗,B项正确。
1-1.变物质[2024河南洛阳联考]用氢氧化钠固体配制的 溶液,下列图示对应的操作规范的
是 ( )
A.称量 B.转移
C.定容 D.摇匀
D
【解析】 称量固体时,由于固体易潮解,故应将 固体放入烧杯中称量,A不符合题意。 转移溶
液时,需要使用玻璃棒引流,B不符合题意。定容时,胶头滴管不能伸入容量瓶中,C不符合题意。摇匀时,要上
下颠倒摇匀,D符合题意。
2.[2024山西部分学校联考]易水解,实验室利用固体配制 溶液。下列说
法正确的是( )
D
A.配制溶液时, 容量瓶需要干燥 B.配制溶液的过程中,玻璃棒只起到引流的作用
C.需用托盘天平称量固体 D.溶解 固体时需要用浓盐酸代替蒸馏水
【解析】配制溶液时,应该使用 容量瓶,但不需要干燥,A项错误;配制溶液的过
程中,溶解时玻璃棒起到搅拌作用,转移溶液时玻璃棒起到引流作用,B项错误;需用托盘天平称量
的质量为,C项错误;由题中信息可知 容易水解,所以溶解时需
要将 固体溶解在浓盐酸中,抑制水解,D项正确。
3.[2024山东名校联考]某结晶水合物分子式为,其相对分子质量为,时,晶体溶于 水中形成
密度为 的饱和溶液,下列叙述错误的是( )
B
A.饱和溶液的质量分数为 B.,的溶解度为
C.饱和溶液的密度为 D.饱和溶液的物质的量浓度为
【解析】溶质的质量为,溶液的质量为 ,所以饱和溶液的质量分数为
,A项正确;溶质的质量为,溶剂的质量为 (【易错提
醒】不能忽视结晶水合物中的水。),所以其溶解度为 ,B项错误;溶液的质量为
,溶液体积为,则溶液的密度为,C项正确;溶质的物质的量为 ,溶液的物质的
量浓度为 ,D项正确。
4.[2023天津南开区联考改编]盐酸和氢氧化钠是工业上重要的化工原料,也是实验室常见的试剂。
欲使用的溶液,现拟用质量分数为的盐酸 来配制,请回答下列问
题:
(1)配制溶液所用质量分数为的盐酸的体积为____ 。
25
【解题思路】设质量分数为的盐酸的物质的量浓度为,体积为 ,由溶液中溶
质的质量一定可知, ,则质量分数为
的盐酸的物质的量浓度为 (【速解】根据公式直接代入数据
计算可得,质量分数为36.5%的盐酸( )的物质的量浓度为。),配制溶液
应选用容量瓶,根据稀释前后 的物质的量相等可得所用质量分数为的盐酸的体积为
。
(2)该实验需要使用到的玻璃仪器:量筒、烧杯、玻璃棒、胶头滴管、________________。
容量瓶
【解题思路】该实验需要使用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管,还有 容量瓶。
(3)下列操作会使所配溶液浓度小于 的是____(填标号)。
bd
a.容量瓶用蒸馏水洗净后没有烘干,瓶内有少量残留的蒸馏水
b.在操作中没有用蒸馏水洗涤烧杯和玻璃棒
c.定容时俯视刻度线
d.定容时加蒸馏水超过了刻度线,倒出一些溶液,再重新加蒸馏水定容到刻度线
e.将配制好的溶液转入试剂瓶的过程中不慎洒出了少许溶液
f.用量筒量取质量分数为 的盐酸时仰视读数
【解题思路】.容量瓶内有少量残留的蒸馏水,对实验无影响,不符合题意。 .在操作中没有用蒸馏水洗涤烧杯和
玻璃棒,导致溶质损失,所配溶液浓度偏小,符合题意。 .定容时俯视刻度线,导致实际溶液体积偏小,所配溶液
浓度偏大,不符合题意。 .定容时加蒸馏水超过了刻度线,倒出一些溶液,再重新加蒸馏水定容到刻度线,导致溶
质损失,所配溶液浓度偏小,符合题意。 .将配制好的溶液转入试剂瓶的过程中不慎洒出了少许溶液,对所配溶液
的浓度无影响,不符合题意。.用量筒量取质量分数为 的盐酸时仰视读数,导致量取的盐酸的体积偏大,所
配溶液浓度偏大,不符合题意。故应选 。
创新1+1
1.新情境·结合 溶解度曲线[2024广西部分学校考试]已知
的溶解度随温度 的变化曲线如图所示。下列有关叙述不正
确的是( )
C
A.温度越高, 饱和溶液中溶质的物质的量浓度越大
B.温度越高, 饱和溶液中溶质的质量分数越大
C.时,饱和溶液中溶质的物质的量浓度为
D.时,饱和溶液中溶质的质量分数为
【解析】由图可知,随着温度的升高,氯酸镁的溶解度增大,则温度越高,氯酸镁饱和溶液中溶质的物质的量浓
度越大,A项正确;温度越高,氯酸镁的溶解度越大,则温度越高,氯酸镁饱和溶液中氯酸镁的质量分数越大,B
项正确;不知道该条件下饱和溶液的密度,无法计算 时氯酸镁饱和溶液中溶质的物质的量浓度,C项错误;
时氯酸镁的溶解度为,则饱和溶液中溶质的质量分数为 ,
D项正确。
新角度·渗透在阅读材料题中考查[2024山东青岛调研]阅读下列材料,完成 题。
某化学研究小组制备硫酸亚铁铵晶体 并测定其纯度。
实验步骤如下:
①铁屑的处理与称量。在盛有适量铁屑的锥形瓶中加入 溶液,加热、过滤、洗涤、干燥、称量,铁屑
质量为 。
的制备。在盛有洗净铁屑的锥形瓶中加入一定量的稀硫酸,充分反应,过滤,收集滤液于蒸发皿中。
将锥形瓶中的铁屑和滤纸上的铁屑收集、干燥后称量,质量为 。
③硫酸亚铁铵晶体的制备。按反应配比准确称取所需质量为的 加入“步骤②”中的蒸发皿中,在
水浴上蒸发混合液,浓缩至表面出现晶膜为止,静置,让溶液自然冷却至室温,减压过滤。晶体用无水乙醇洗涤
并自然干燥,称量所得晶体质量为 。
④测定硫酸亚铁铵晶体的纯度。称取产品,配制成溶液,取出 置于锥形瓶中,用
酸性标准溶液滴定(不考虑杂质的反应),平行滴定三次,平均消耗酸性标准溶液 。
2.对于上述实验,下列说法正确的是( )
C
A.减压过滤时,布氏漏斗下端颈的斜口背向吸滤瓶支管口
B.检漏时,关闭酸式滴定管活塞,加水至最高刻度线,置于滴定管架上 ,若不漏水即可使用
C.酸式滴定管排气泡的操作为将酸式滴定管倾斜 左右,迅速打开活塞使溶液流出
D.滴定时,左手控制酸式滴定管活塞,右手摇动锥形瓶,眼睛观察酸式滴定管内液面变化
【解析】布氏漏斗下端颈的斜口要面向吸滤瓶支管口,以免滤液被吸入支管而进入安全瓶中,A错误。检查酸式滴
定管是否漏水的操作:关闭活塞,向酸式滴定管中加入适量水,用滴定管夹将酸式滴定管固定在铁架台上,观察
是否漏水,若内不漏水,将活塞旋转 ,重复上述操作,B错误。酸式滴定管排气泡时,将酸式滴定管倾
斜 左右,迅速打开活塞使溶液流出,从而使尖嘴部分充满溶液,C正确。滴定时,左手控制酸式滴定管活塞,
右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,D错误。
D
A.
B.硫酸亚铁铵晶体的产率为
C.配制的硫酸亚铁铵溶液的物质的量浓度为
D.硫酸亚铁铵晶体的纯度为
3.下列计算正确的是( )
【解析】由题中信息可知,参加反应的铁的质量为,其物质的量为 ,根据原子守恒可知,
硫酸亚铁铵晶体的制备反应中存在关系式,则按反应配比 准确称取
所需的质量,A错误。硫酸亚铁铵晶体的理论产量为,实际产量为 ,
则硫酸亚铁铵晶体的产率为,B错误。 产品不是纯的硫酸亚铁铵晶体,
配制的硫酸亚铁铵溶液的物质的量浓度不是,C错误。硫酸亚铁铵溶液中的被
氧化,发生反应的离子方程式为, 硫酸亚铁铵溶液消耗
的物质的量为,则溶液中硫酸亚铁铵的物质的量为 (【多解】也可根
据得失电子守恒得到关系式,进而求得25.00 mL溶液中硫酸亚铁铵的物质的量。), 产品中硫酸
亚铁铵的物质的量为 ,则硫酸亚铁铵晶体的纯度为
,D正确。
4.根据上述实验原理,下列说法错误的是( )
B
A.步骤③需保持溶液为, 过大会导致产品不纯且产率降低
B.步骤④用未干燥的容量瓶配制溶液,测定的硫酸亚铁铵晶体的纯度会偏低
C.步骤④滴定结束时俯视读数,测定的硫酸亚铁铵晶体的纯度会偏低
D.三次滴定都应从零刻度或零刻度附近的某一固定刻度开始,以减小系统误差
【解析】步骤③需保持溶液为是为了抑制硫酸亚铁、硫酸铵水解,若溶液 过大会因硫酸亚铁水解而导致
产品不纯,且转化为 逸出,导致产品产率降低,A正确。步骤④用未干燥的容量瓶配制溶液,对溶液浓度
无影响,故对测定的硫酸亚铁铵晶体的纯度无影响,B错误。步骤④滴定结束时俯视读数,测得的标准溶液的体积
偏小,测定的硫酸亚铁铵晶体的纯度会偏低,C正确。三次平行滴定时都应从零刻度或零刻度附近的某一固定刻度
开始,以减小系统误差,D正确。
热考题型3 阿伏加德罗常数的应用
03
1.[2024贵州贵阳摸底] 为阿伏加德罗常数的值。下列说法正确的是( )
C
A.单晶硅中所含的键的数目为 B.溶液中含有的数目为
C.苯甲酸完全燃烧生成的数目为 D.标准状况下,中含有的氟原子数目为
【解析】硅的物质的量为,单晶硅中每个形成4个键,每个键被2个共用,则 硅中所
含的键的数目为,A错误;溶液体积不知,不能计算溶液中含有的数目,B错误; 苯甲酸含有
个碳原子,完全燃烧产生,因此苯甲酸完全燃烧产生,C正确;标准状况下,
为液态,因此不能用气体摩尔体积计算其物质的量,D错误。
2.[2023海南卷] 代表阿伏加德罗常数的值。下列说法正确的是( )
A
A.镁条在空气中充分燃烧,转移的电子数目为
B.铁粉与的溶液充分反应,产生的气体分子数目为
C.标准状况下,与充分反应,生成的分子数目为
D.完全溶于所得溶液中的数目为
【解析】镁条在空气中充分燃烧生成氧化镁:,从0价被氧化为 价,故
转移的电子数目为,A正确;铁粉与稀溶液反应生成 和
,铁粉与的 溶液反应,铁粉过量,产生的氢
气的分子数目为,B错误;与生成的反应为可逆反应,反应不能进行到底,故生成的 分子数目
小于,C错误;溶于水发生反应:,因此
完全溶于所得溶液中的数目小于 ,D错误。
3.[2024内蒙古呼和浩特监测改编]我国科研团队在人工合成淀粉方面取得突破性进展,通过、制得 ,
进而合成了淀粉。用 代表阿伏加德罗常数的值,下列说法正确的是( )
D
A.和混合气体的分子数为 B.通过与制得,转移电子数为
C.标准状况下,中含有个键 D.淀粉中含C原子数为
【解析】和混合气体的分子数为,A项错误;中转移 ,则制得
,转移电子数为,B项错误;标准状况下为液体,不为 ,含有的
键数不为,C项错误;淀粉中含C原子数为 ,D项
正确。
4.[2023辽宁抚顺模拟] 是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备,反应为
。 为阿伏加德罗常数的值,下列说法正确的是( )
A
A.中含有的电子数为 B.固体中含有个 分子
C.每生成,转移的电子数为 D.的稀盐酸中含有的数目为
【解析】第一步:定性排除。
第二步:定量计算。
5.[2024吉林长春监测]过二硫酸钾,其中为价 是工业上一种重要的消毒剂和织物漂白剂,可通过电解
溶液制备。它在下能发生分解反应: (未配平),设 为阿伏加德罗
常数的值,下列说法正确的是( )
A
A.中含有非极性共价键的数目为 B.分解,生成的分子数为
C.标准状况下,含有的原子数为 D.溶液中的离子总数为
【解析】由和组成,的结构式为 ,所以 中含有非极性共
价键的数目为,A项正确;根据 可知,分解,生成 ,
分子数为,B项错误;标准状况下为固体,不为,含有的原子数不为 ,C项错误;没有提
供溶液体积,所含离子数目无法确定,D项错误。
6.[2024广东佛山顺德区质检改编]海洋碳循环是影响全球气候变
化的关键控制环节,下图为海洋中碳循环的原理图。设 为阿
伏加德罗常数的值。下列说法正确的是( )
C
A.的溶液中,和 数目之和为
B.“钙化”时,消耗,生成
C.“光合”时,每生成转移电子数为
D.中含有共用电子对数为
【解析】
选项 分析
溶液中,会分步水解,溶液中的含碳微粒有、、, 的
溶液中和数目之和小于
未说明气体所处状况,无法计算气体体积
“光合”时,,C元素化合价由变为0,转移个电子,则每生成 ,
转移电子数为
一个分子中含有共用电子对数为4,则中含有共用电子对数为
热考题型4 以物质的量为中心的计算
1.[2022上海卷]冰层表面摩擦力小,原因可能是其表面有一层液态水,现有一冰面面积为 ,液态水厚度为
,水的密度为 ,求液态水分子数( )
C
A. B. C. D.
【解析】由题目信息可知,液态水的体积为,再根据 得出其
质量为,物质的量,分子数 ,C正
确。
2.[2023黑龙江双鸭山一中考试]将一定质量的镁铜合金加入到稀硝酸中,二者恰好完全反应,假设反应过程中还原
产物全是。向所得溶液中加入物质的量浓度为的 溶液至沉淀完全,测得生成沉淀的质量比合金
的质量增加了 。下列有关叙述正确的是( )
A
A.加入合金的质量可能是 B.参加反应的硝酸的物质的量为
C.沉淀完全时消耗溶液的体积为 D.溶解合金时收集到气体的体积为
【解析】综合分析
将镁铜合金加入到稀中,金属完全溶解(假设反应中还原产物只有 )发生反应
, ,向反应后的溶液
中加入溶液至沉淀完全,发生反应 、
,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加
了,则氢氧化镁和氢氧化铜中含的质量为,则 ,根据反应方程式可
知,,,故镁和铜的总物质的量为 。
若合金全为镁,则合金的质量为 ,若合金全为铜,则合金的质量为
,则合金的质量可能为 ,A项正确;根据化学方程式可知参加反应的
,B项错误;反应消耗的物质的量为 ,故加
入的溶液的体积,C项错误;合金中镁和铜的总物质的量为 ,由化学方
程式可知,生成一氧化氮的物质的量 ,但没有说明气体所处的状况,故不能确定气体
的体积,D项错误。
3.[2023辽宁卷节选]我国古籍记载了硫酸的制备方法——“炼石
胆 取精华法”。借助现代仪器分析,该制备过
程中分解的曲线(热重)及 曲线(反映体
系热量变化情况,数值已省略)如下图所示。 左右有两
个吸热峰,则此时分解生成的氧化物有 、_____和_____
(填化学式)。
【解题思路】由图可知,起始时有 ,其物
质的量是,所含结晶水的质量为 ,则固体质
量剩余时所得固体为,加热过程中元素的质量不变,则固体质量剩余时所得的固体是 ,
结合题图DSC曲线有两个吸热峰可知,发生的反应为、 ,则生成的氧化
物除外,还有、 。
4.[2023全国乙卷节选]在气氛中, 的脱水热分解过程
如图所示:
根据上述实验结果,可知___, ___。
4
1
【解题思路】由图可知, 即7个结晶水完全
失去时失重比为,则失重比为 时,失去的结晶水数目
为,故,同理可推出 。
5.[2024山东部分学校模拟]
(1)利用滴定法测定 产品的纯度,实验如下。
称取产品,加入足量的水,使产品充分水解 。将上层清液全部转移
到容量瓶中,定容,移取于锥形瓶中,加入少量和几滴溶液,用的 标准
溶液滴定至终点时,消耗标准溶液(已知: )。
则产品中 的质量分数为________。
【解题思路】
(2)为测定三氯化六氨合钴(Ⅲ) 产品中钴的含量,进行下列实验。
称取产品,加入足量溶液蒸出,再加入稀硫酸,使全部转化为 ,然后将溶液
配制成,取于锥形瓶中,加入过量的溶液,用淀粉溶液作指示剂,用
标准溶液滴定至终点,重复操作次,消耗标准溶液平均体积为 。
已知:滴定过程中转化为 。则样品中钴元素的质量分数为______。
【解题思路】
思维建模
“关系式法”的应用
专题综合训练
04
1.[2022重庆卷]调工业上用和合成。 代表阿伏加德罗常数的值,下列说法正确的是( )
B
A.消耗生成分子数为 B.消耗生成键数为
C.生成标准状况下,电子转移数为 D.氧化生成,需分子数为
【解析】根据知,消耗即,生成的分子数为,A项错误;消耗 生成
,即生成的键数为,B项正确;转移,则生成标准状况下即 ,
转移电子数为,C项错误;根据知,氧化生成,需要的 分子数为
,D项错误。
2.[2024浙江杭州质检] 为阿伏加德罗常数的值,下列说法正确的是( )
B
A.密闭容器中与充分反应,产物的分子数为
B.正丁烷和异丁烷的混合物中含有 键的数目为
C.的溶液中的数目为
D.溶液水解生成氢氧化铁胶粒的数目为
【解析】、,所以产物的分子数小于,A项错误; 正丁烷和异丁烷的混合
物的物质的量为,一个正丁烷中含有13个 键,一个异丁烷中含有13个 键,则 正丁烷和异丁烷的混
合物中含有 键的数目为,B项正确;碳酸氢钠为强碱弱酸盐,水溶液中 会发生水解,故
的溶液中数目小于 ,C项错误;胶粒是多个粒子的集合体,所得氢氧化铁胶粒
的数目少于 ,D项错误。
有关阿伏加德罗常数的易混易错
1 水解和电离 未考虑溶液中弱电解质的电离、弱碱阳离子和弱酸的酸根离子的水解,导致计算某微
粒数目时出错
2 可逆反应未进行到底 忽略可逆反应不能进行到底,导致计算电子转移数目或产物微粒数目时出错
3 浓度变化 随着反应的进行,反应物浓度不断减小,当达到一定程度时,未考虑反应停止或发生
其他反应,可能会导致计算某微粒数目时出错
4 隐含反应 某些物质自身可发生反应,导致分子数目发生变化,如
5 胶体微粒、 #b# 聚合体 忽略某些胶体微粒是分子等的集合体或忽略有机高分子的聚合度,可能会导致计算某
微粒数目时出错
3.[2023湖北十一校联考] 为阿伏加德罗常数的值,下列说法正确的是( )
A
A.和的混合气体中含有的孤电子对数为
B.中 键的个数为
C.已知为正盐,则所含羟基数为
D.葡萄糖与新制的反应生成,转移电子数为
【解析】和的摩尔质量相同,二者互为等电子体,所含孤电子对数相等,一个或一个 中都含有两个孤电
子对,和的混合气体的物质的量为,含有的孤电子对数为,A项正确;、与 形成
的配位键为 键,3个氨分子中含有9个 键,1个中含有1个 键,因此中所含 键个数
为,B项错误;为正盐,则为二元酸,无机含氧酸电离出的 由羟基电离产生,因此
中含有的羟基数为,C项错误;中的化合价为,中的化合价为 ,生成
,转移电子的物质的量为,转移电子数为 ,D项错误。
4.[2024安徽十校联盟联考]氮化硅是一种重要的结构陶瓷材料,是一种超硬物质,常利用它来制造轴承、永久性模
具等机械构件。其制备原理为。设 为阿伏加德罗常数的值,下列说法错误的
是( )
B
A.晶体中含有的键数目为 B.该实验条件下,中分子数目为
C.每生成的,转移电子数目为 D.和混合气体中原子数目为
【解析】的结构中,1个硅原子连接4个氧原子,形成4个键,故晶体中键数目为 ,A
项正确;高温时,气体摩尔体积不是,无法计算气体的物质的量,B项错误; 元素化合价由0降
低到,每生成,转移电子数目为,C项正确;和的摩尔质量均为,和
混合气体的物质的量为,且二者均为双原子分子,故原子数目为 ,D项正确。
5.[2023河南郑州模拟]摩尔日 是一个流传于化学家之间的节日,通常在10月23日的上午6:02到下午6:0
2之间庆祝,被记为,恰似阿伏加德罗常数。设 为阿伏加德罗常数的值,下列说法正确的是( )
B
A.标准状况下肼中含有的键数目为
B.固体中含有的阳离子数目为
C.电解饱和食盐水时,若阴、阳两极产生气体的总体积为,则转移电子数为
D.与足量充分反应,生成的分子数目为
【解析】第一步:定性排除。
第二步:定量计算。
6.[2024重庆渝北中学质检]如图是某同学用 容量瓶配制
溶液的过程:
该同学的错误步骤有( )
B
A.1处 B.2处 C.3处 D.4处
【解析】第①步:不能把 固体放在称量纸上称量,应放在小烧杯
中称量;第⑤步:定容时应平视刻度线。错误有2处,选B。
7.[2024湖北部分学校联考]党的二十大报告指出:要“加强污染物协同控制,
基本消除重污染天气”。近地面臭氧已成为现阶段夏季主要大气污染物,近地
面臭氧产生和吸收机理如图所示。设 为阿伏加德罗常数的值,下列说法正
确的是( )
C
A.和的混合物含质子数为
B.每产生,需要的分子数为
C.反应③中有完全反应,转移电子数为
D.标准状况下,和各混合充分反应,体系中分子总数为
【解析】不确定混合气体所处状况,故不能确定混合物的物质的量,A项错误。反应①是在太阳光作用下, 分
解为和,反应②是空气中的与分解生成的结合生成,则产生需要提供 ,B
项错误。反应③是与反应生成和,则完全反应,有氧原子被还原,转移 电子,
C项正确。和充分反应生成,剩余,但存在可逆反应:
(【易错警示】切勿忽略体系中隐含的可逆反应。),则体系中分子总数小于 ,D项错误。
8. 皖豫名校联考]相同条件下,向如图所示的容器的左边
通入,右边通入和的混合气体,且和
的物质的量之比为 。下列说法错误的是( )
D
A.右边和的混合气体的平均摩尔质量为
B.左边与右边的原子个数比为
C.右边混合气体中的体积分数为
D.向右边通入 时,可移动挡板能移到3刻度处
【解析】和的混合气体的平均摩尔质量 ,A项
正确;由可知,,所以,则, ,左边与右边的原子个
数比为,项正确;右边和的物质的量之比为,则
的体积分数为,项正确;向右边通入时,消耗,所以右边剩余 和
,左边和右边气体的物质的量相等,所以挡板移动到 2.5处, 项错误。
9.[2024江西抚州临川区调研]在室温下,向饱和溶液中加入足量经酸化的 溶液,在暗处充分反应
一段时间后,用溶液滴定,消耗滴定溶液 。相关的离子反应有
,, 。原饱和溶液中
的物质的量浓度 为( )
D
A. B. C. D.
【解析】的电离方程式为,由题干中离子方程式可得 ,
,需要消耗 。
,D项正确。
10.[2023湖北武汉部分学校调研]碱式碳酸铜 是一种草绿色晶体,可用于铜盐、
油漆和烟花的制备。实验室制备碱式碳酸铜的步骤如下:
Ⅰ.分别配制溶液和 溶液。
Ⅱ.将溶液和 溶液混合、搅拌均匀。
Ⅲ.将Ⅱ的混合溶液加热至,搅拌 。
Ⅳ.静置使产物沉淀完全后,抽滤、洗涤、干燥、称重,分析样品组成和晶体结构。
回答下列问题:
(1)步骤Ⅰ中,配制 溶液时,不需要使用下列
仪器中的______(填仪器名称)。
坩埚
【解题思路】步骤Ⅰ中,配制 溶液时,需要使
用容量瓶、烧杯、天平、玻璃棒等,不需要使用的仪器是坩埚。
(2)步骤Ⅱ中,若误将溶液与 溶液等体积混合,二者恰好完全反应,生成蓝色的
晶体,其反应的离子方程式为
_____________________________________________________________________。
【解题思路】步骤Ⅱ中,将溶液与溶液等体积混合,二者恰好完全反应,生成
晶体,反应的离子方程式为 。
(3)步骤Ⅲ中,若温度高于 ,则产品中混有的黑色固体是_____。
【解题思路】步骤Ⅲ中,若温度高于,发生分解,生成、和 ,则产品中混有的黑色
固体是 。
(4)步骤Ⅳ中,检验沉淀是否洗涤干净的试剂是__________________;称得产品的质量为 ,则该实验所得
碱式碳酸铜的产率是______。
盐酸、氯化钡溶液
【解题思路】步骤Ⅳ中,沉淀表面容易吸附溶液中的,检验 的试剂是盐酸、氯化钡溶液。制取碱式碳酸
铜的离子方程式为 ,则理论上, 溶液
和溶液反应,生成 ,则碱式碳酸铜的产率是
。
(5)对样品进行热重分析得到的曲线如图所示,则铜元素的质量分数是______,
与理论值相差不大。通过___________实验可进一步测定样品的晶体结构。
射线衍射
【解题思路】样品灼烧后,所得固体为,质量保留百分数为 ,则
样品中铜元素的质量分数是 。
考点4 物质的量、气体摩尔体积
考点5 物质的量浓度
热考题型3 阿伏加德罗常数的应用
专题综合训练
热考题型4 以物质的量为中心的计算
【考情分析】在高考中,阿伏加德罗常数的应用是高频考点,涉及面广;一定物质的量浓度溶液的配制会在实验
题中涉及,化学计算的考查主要是根据化学方程式、关系式等进行计算。
考点4 物质的量、气体摩尔体积
01
经典3+2
1.[2023北京东城区练习]下列指定微粒或化学键的个数比为 的是( )
B
A.原子中的质子和中子 B. 固体中的阴离子和阳离子
C.晶体中的硅原子和共价键 D.溶液中的和
【解析】原子中的质子数和中子数都为6,则质子和中子的个数比为,A项错误;固体中和 的
个数比为,B项正确;晶体中1个硅原子与4个氧原子形成4个硅氧共价键,则 晶体中的硅原子和共价键
的个数比为,C项错误;是强酸弱碱盐,在溶液中发生水解,和的个数比小于 ,D项错误。
2.[2023全国甲卷] 为阿伏加德罗常数的值。下列说法正确的是( )
A
A.异丁烷分子中共价键的数目为
B.标准状况下,中电子的数目为
C.的溶液中的数目为
D.的溶液中的数目为
【解析】第一步:定性排除。
第二步:定量计算。
思维建模
秒破阿伏加德罗常数题
2-1.变物质[2023广东韶关模拟]设 为阿伏加德罗常数的值,下列说法正确的是( )
C
A.甲醛分子的中心原子的价层电子对数为
B.标准状况下,与充分反应后的分子总数为
C.和金刚石均含有 个碳原子
D.溶液中含有的氧原子数大于
【解析】第一步:定性排除。
第二步:定量计算。
3.[2024湖北武汉部分学校调研]设 为阿伏加德罗常数的值。下列说法正确的是( )
A
A.中氮的价层电子对数为
B.溶液中的数目为
C.标准状况下,氯仿中分子数为
D.常温下,与足量浓硝酸反应转移的电子数为
【解析】中的价层电子对数为,则中氮的价层电子对数为 ,A项正确;没
有提供溶液体积,的数目无法计算,B项错误;标准状况下氯仿为液体,氯仿不为 ,所含分子数不
为 ,C项错误;常温下铁遇浓硝酸钝化,D项错误。
4.[2023重庆卷]已知反应:,为阿伏加德罗常数的值,若消耗 (标准
状况) ,下列叙述错误的是( )
C
A.转移的电子数为 B.生成的质量为
C.生成的氧化产物分子数为 D.生成的含有孤电子对数为
【解析】关键一步
该反应中电子转移情况为 。消耗标准状况下,即 ,据此分析各
选项。
由上述分析可知,A正确;消耗,生成,其质量为,B正确;为氧化产物,生成的 为
,其分子数为,C错误;生成的为,1分子 中含有2个孤电子对,故D正确。
4-1.变情境[2024广东惠州调研]反应 放热且产生气体,可用于冬天石油开采。
设 为阿伏加德罗常数的值。下列说法不正确的是( )
C
A.中含有的 键数目为
B.中所含电子数目为
C.常温时,的溶液中所含的数目为
D.上述反应中,每生成转移的电子数目为
【解析】中含有键,一个三键含一个 键、两个 键,则中含有 键的数目为 ,A项正
确;一个中含有10个电子,的物质的量为,所含电子数目为 ,B项正确;溶液体积未知,
不能计算的数目,C项错误;中的化合价为,中的化合价为,生成的中 的化合价为0,
则生成转移 电子,D项正确。
5.[2024黑龙江鸡西实验中学考试]下列说法错误的是( )
A
A.同温同体积下,和 分子数相同
B.同温等压下,与的密度之比等于
C.温度和容积相同的两气罐中分别盛有和,两容器中的压强之比等于
D.同温等压下,和的体积之比等于
【解析】
选项 分析
压强未知,温度和体积相同的和 分子数不一定相同
同温等压下,两种气体的密度之比等于其相对分子质量之比,则与的密度之比为64
同温同体积下,两种气体的压强之比等于其物质的量之比,故两容器中的压强之比等于5
同温等压下,两种气体的体积之比等于其物质的量之比,故和的体积之比等于5
6.[2024鄂东南省级示范高中联考]设 为阿伏加德罗常数的值,下列说法正确的是( )
D
A.铁完全发生吸氧腐蚀,则在电化学反应过程中转移的电子数为
B.足量与充分反应生成的分子数目为
C.中含 键个数为
D.常温下,的溶液中,水电离出的数目为
【解析】吸氧腐蚀时转化为,故铁完全发生吸氧腐蚀,此过程中转移的电子数为 ,A错误;酯化反
应是可逆反应,故B错误;与分子间的配位键也是 键,故中含 键个数为 ,C错
误;是强碱弱酸盐,能结合电离出的形成,故溶液中 全部来
自水的电离,故水电离的 ,D正确。
7.[2024安徽部分学校摸底]乙醛是一种重要的有机化工原料,制备原理之一是
。设阿伏加德罗常数的值为 ,下列有关说法错误的是( )
A
A.乙醇水溶液中含有氢原子的数目为
B.乙醛中所含 键的数目为
C.冰中含有氢键的数目为
D.每消耗标准状况下氧气,转移电子数为
选项 分析
水分子中也含有氢原子
乙醛的结构式为_________________________1个乙醛分子中含有4个键、1个键(1个双键中含有1个
键)、1个键,共6个 键,则乙醛中含有 键
冰中平均1个能形成2个氢键,故冰中含 个氢键
标准状况下氧气的物质的量是,转移电子数为
【解析】
创新1+1
1.新情境·碳达峰[2024福建福州质检]中国力争2030年前实现碳达峰,达到峰值之后逐步降低。其中由和 制
备合成气、,再由合成气制备的反应转化关系如图所示。设 为阿伏加德罗常数的值,下列说法错
误的是( )
B
A.标准状况下,所含的极性键数为
B.等物质的量的和,的质子数比多
C.制备合成气的反应中,若生成 ,理论上反应Ⅰ和Ⅱ共
转移电子数为
D.反应Ⅲ的化学方程式为 ,原子
利用率为 ,符合绿色化学理念
【解析】图像分析
每个分子中含有4个极性键,标准状况下,为,所含的极性键数为 ,A选项正确;B
选项未指明具体的量,所以无法得知两者质子数相差多少,B选项错误;由上述分析可知,每生成 ,反应
Ⅰ和反应Ⅱ共转移,则生成,转移电子数为,C选项正确;反应Ⅲ原子利用率达到 ,符合
绿色化学理念,D选项正确。
2.新考法·结合流程图考查[2024天星原创]由铬铁矿 制备金属铬的流程示意图如下。
已知:酸性条件下可发生反应。设 为阿伏加德罗常数的值,下列说法正确的是
( )
D
A.反应①中,若有完全反应,则消耗的数目为
B.溶液(调)中的数目为
C.反应③中,氧化产物为与,若有完全反应,反应过程中转移电子的数目为
D.反应④中,当生成单质时,反应过程中转移电子的数目为
【解析】制备金属铬的流程中涉及反应的化学方程式如表所示:
反应 化学方程式
反应①
反应②
反应③
反应④
根据表中反应①的化学方程式可知,若有完全反应,则消耗,故消耗的数目为 ,
A错误。结合题给已知信息可知,酸性条件下溶液中存在化学平衡 ,故
溶液(调)中的数目小于 (【易错警示】切勿忽略题干中给出的信息,
酸性条件下可转化为,二者数目之和为 。),B错误。根据表中反应③的化学方程式可知,若有
完全反应,则参与反应的的物质的量为,反应过程中转化为, 的化合价
由降低为,则反应过程中转移电子的数目为 ,C错误。根据表中反应④的化学方程式可知,当生成
单质时,反应过程中转移电子的数目为 ,D正确。
考点5 物质的量浓度
02
经典3+2
1.[2021广东卷]测定浓硫酸试剂中 含量的主要操作包括:①量取一定量的浓硫酸,稀释;②转移定容得待测
液;③移取待测液,用的 溶液滴定。上述操作中,不需要用到的仪器为( )
B
A.&2& B.&3& C.&4& D.&5&
【解析】①量取一定量的浓硫酸稀释要用到量筒、烧杯和玻璃棒;②转移定容制备待测液需用到容量瓶、胶头滴
管和玻璃棒;③移取待测液,用 溶液滴定需用到碱式滴定管、锥形瓶等。结合上
述分析可知,实验中不用分液漏斗,B项正确。
1-1.变物质[2024河南洛阳联考]用氢氧化钠固体配制的 溶液,下列图示对应的操作规范的
是 ( )
A.称量 B.转移
C.定容 D.摇匀
D
【解析】 称量固体时,由于固体易潮解,故应将 固体放入烧杯中称量,A不符合题意。 转移溶
液时,需要使用玻璃棒引流,B不符合题意。定容时,胶头滴管不能伸入容量瓶中,C不符合题意。摇匀时,要上
下颠倒摇匀,D符合题意。
2.[2024山西部分学校联考]易水解,实验室利用固体配制 溶液。下列说
法正确的是( )
D
A.配制溶液时, 容量瓶需要干燥 B.配制溶液的过程中,玻璃棒只起到引流的作用
C.需用托盘天平称量固体 D.溶解 固体时需要用浓盐酸代替蒸馏水
【解析】配制溶液时,应该使用 容量瓶,但不需要干燥,A项错误;配制溶液的过
程中,溶解时玻璃棒起到搅拌作用,转移溶液时玻璃棒起到引流作用,B项错误;需用托盘天平称量
的质量为,C项错误;由题中信息可知 容易水解,所以溶解时需
要将 固体溶解在浓盐酸中,抑制水解,D项正确。
3.[2024山东名校联考]某结晶水合物分子式为,其相对分子质量为,时,晶体溶于 水中形成
密度为 的饱和溶液,下列叙述错误的是( )
B
A.饱和溶液的质量分数为 B.,的溶解度为
C.饱和溶液的密度为 D.饱和溶液的物质的量浓度为
【解析】溶质的质量为,溶液的质量为 ,所以饱和溶液的质量分数为
,A项正确;溶质的质量为,溶剂的质量为 (【易错提
醒】不能忽视结晶水合物中的水。),所以其溶解度为 ,B项错误;溶液的质量为
,溶液体积为,则溶液的密度为,C项正确;溶质的物质的量为 ,溶液的物质的
量浓度为 ,D项正确。
4.[2023天津南开区联考改编]盐酸和氢氧化钠是工业上重要的化工原料,也是实验室常见的试剂。
欲使用的溶液,现拟用质量分数为的盐酸 来配制,请回答下列问
题:
(1)配制溶液所用质量分数为的盐酸的体积为____ 。
25
【解题思路】设质量分数为的盐酸的物质的量浓度为,体积为 ,由溶液中溶
质的质量一定可知, ,则质量分数为
的盐酸的物质的量浓度为 (【速解】根据公式直接代入数据
计算可得,质量分数为36.5%的盐酸( )的物质的量浓度为。),配制溶液
应选用容量瓶,根据稀释前后 的物质的量相等可得所用质量分数为的盐酸的体积为
。
(2)该实验需要使用到的玻璃仪器:量筒、烧杯、玻璃棒、胶头滴管、________________。
容量瓶
【解题思路】该实验需要使用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管,还有 容量瓶。
(3)下列操作会使所配溶液浓度小于 的是____(填标号)。
bd
a.容量瓶用蒸馏水洗净后没有烘干,瓶内有少量残留的蒸馏水
b.在操作中没有用蒸馏水洗涤烧杯和玻璃棒
c.定容时俯视刻度线
d.定容时加蒸馏水超过了刻度线,倒出一些溶液,再重新加蒸馏水定容到刻度线
e.将配制好的溶液转入试剂瓶的过程中不慎洒出了少许溶液
f.用量筒量取质量分数为 的盐酸时仰视读数
【解题思路】.容量瓶内有少量残留的蒸馏水,对实验无影响,不符合题意。 .在操作中没有用蒸馏水洗涤烧杯和
玻璃棒,导致溶质损失,所配溶液浓度偏小,符合题意。 .定容时俯视刻度线,导致实际溶液体积偏小,所配溶液
浓度偏大,不符合题意。 .定容时加蒸馏水超过了刻度线,倒出一些溶液,再重新加蒸馏水定容到刻度线,导致溶
质损失,所配溶液浓度偏小,符合题意。 .将配制好的溶液转入试剂瓶的过程中不慎洒出了少许溶液,对所配溶液
的浓度无影响,不符合题意。.用量筒量取质量分数为 的盐酸时仰视读数,导致量取的盐酸的体积偏大,所
配溶液浓度偏大,不符合题意。故应选 。
创新1+1
1.新情境·结合 溶解度曲线[2024广西部分学校考试]已知
的溶解度随温度 的变化曲线如图所示。下列有关叙述不正
确的是( )
C
A.温度越高, 饱和溶液中溶质的物质的量浓度越大
B.温度越高, 饱和溶液中溶质的质量分数越大
C.时,饱和溶液中溶质的物质的量浓度为
D.时,饱和溶液中溶质的质量分数为
【解析】由图可知,随着温度的升高,氯酸镁的溶解度增大,则温度越高,氯酸镁饱和溶液中溶质的物质的量浓
度越大,A项正确;温度越高,氯酸镁的溶解度越大,则温度越高,氯酸镁饱和溶液中氯酸镁的质量分数越大,B
项正确;不知道该条件下饱和溶液的密度,无法计算 时氯酸镁饱和溶液中溶质的物质的量浓度,C项错误;
时氯酸镁的溶解度为,则饱和溶液中溶质的质量分数为 ,
D项正确。
新角度·渗透在阅读材料题中考查[2024山东青岛调研]阅读下列材料,完成 题。
某化学研究小组制备硫酸亚铁铵晶体 并测定其纯度。
实验步骤如下:
①铁屑的处理与称量。在盛有适量铁屑的锥形瓶中加入 溶液,加热、过滤、洗涤、干燥、称量,铁屑
质量为 。
的制备。在盛有洗净铁屑的锥形瓶中加入一定量的稀硫酸,充分反应,过滤,收集滤液于蒸发皿中。
将锥形瓶中的铁屑和滤纸上的铁屑收集、干燥后称量,质量为 。
③硫酸亚铁铵晶体的制备。按反应配比准确称取所需质量为的 加入“步骤②”中的蒸发皿中,在
水浴上蒸发混合液,浓缩至表面出现晶膜为止,静置,让溶液自然冷却至室温,减压过滤。晶体用无水乙醇洗涤
并自然干燥,称量所得晶体质量为 。
④测定硫酸亚铁铵晶体的纯度。称取产品,配制成溶液,取出 置于锥形瓶中,用
酸性标准溶液滴定(不考虑杂质的反应),平行滴定三次,平均消耗酸性标准溶液 。
2.对于上述实验,下列说法正确的是( )
C
A.减压过滤时,布氏漏斗下端颈的斜口背向吸滤瓶支管口
B.检漏时,关闭酸式滴定管活塞,加水至最高刻度线,置于滴定管架上 ,若不漏水即可使用
C.酸式滴定管排气泡的操作为将酸式滴定管倾斜 左右,迅速打开活塞使溶液流出
D.滴定时,左手控制酸式滴定管活塞,右手摇动锥形瓶,眼睛观察酸式滴定管内液面变化
【解析】布氏漏斗下端颈的斜口要面向吸滤瓶支管口,以免滤液被吸入支管而进入安全瓶中,A错误。检查酸式滴
定管是否漏水的操作:关闭活塞,向酸式滴定管中加入适量水,用滴定管夹将酸式滴定管固定在铁架台上,观察
是否漏水,若内不漏水,将活塞旋转 ,重复上述操作,B错误。酸式滴定管排气泡时,将酸式滴定管倾
斜 左右,迅速打开活塞使溶液流出,从而使尖嘴部分充满溶液,C正确。滴定时,左手控制酸式滴定管活塞,
右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,D错误。
D
A.
B.硫酸亚铁铵晶体的产率为
C.配制的硫酸亚铁铵溶液的物质的量浓度为
D.硫酸亚铁铵晶体的纯度为
3.下列计算正确的是( )
【解析】由题中信息可知,参加反应的铁的质量为,其物质的量为 ,根据原子守恒可知,
硫酸亚铁铵晶体的制备反应中存在关系式,则按反应配比 准确称取
所需的质量,A错误。硫酸亚铁铵晶体的理论产量为,实际产量为 ,
则硫酸亚铁铵晶体的产率为,B错误。 产品不是纯的硫酸亚铁铵晶体,
配制的硫酸亚铁铵溶液的物质的量浓度不是,C错误。硫酸亚铁铵溶液中的被
氧化,发生反应的离子方程式为, 硫酸亚铁铵溶液消耗
的物质的量为,则溶液中硫酸亚铁铵的物质的量为 (【多解】也可根
据得失电子守恒得到关系式,进而求得25.00 mL溶液中硫酸亚铁铵的物质的量。), 产品中硫酸
亚铁铵的物质的量为 ,则硫酸亚铁铵晶体的纯度为
,D正确。
4.根据上述实验原理,下列说法错误的是( )
B
A.步骤③需保持溶液为, 过大会导致产品不纯且产率降低
B.步骤④用未干燥的容量瓶配制溶液,测定的硫酸亚铁铵晶体的纯度会偏低
C.步骤④滴定结束时俯视读数,测定的硫酸亚铁铵晶体的纯度会偏低
D.三次滴定都应从零刻度或零刻度附近的某一固定刻度开始,以减小系统误差
【解析】步骤③需保持溶液为是为了抑制硫酸亚铁、硫酸铵水解,若溶液 过大会因硫酸亚铁水解而导致
产品不纯,且转化为 逸出,导致产品产率降低,A正确。步骤④用未干燥的容量瓶配制溶液,对溶液浓度
无影响,故对测定的硫酸亚铁铵晶体的纯度无影响,B错误。步骤④滴定结束时俯视读数,测得的标准溶液的体积
偏小,测定的硫酸亚铁铵晶体的纯度会偏低,C正确。三次平行滴定时都应从零刻度或零刻度附近的某一固定刻度
开始,以减小系统误差,D正确。
热考题型3 阿伏加德罗常数的应用
03
1.[2024贵州贵阳摸底] 为阿伏加德罗常数的值。下列说法正确的是( )
C
A.单晶硅中所含的键的数目为 B.溶液中含有的数目为
C.苯甲酸完全燃烧生成的数目为 D.标准状况下,中含有的氟原子数目为
【解析】硅的物质的量为,单晶硅中每个形成4个键,每个键被2个共用,则 硅中所
含的键的数目为,A错误;溶液体积不知,不能计算溶液中含有的数目,B错误; 苯甲酸含有
个碳原子,完全燃烧产生,因此苯甲酸完全燃烧产生,C正确;标准状况下,
为液态,因此不能用气体摩尔体积计算其物质的量,D错误。
2.[2023海南卷] 代表阿伏加德罗常数的值。下列说法正确的是( )
A
A.镁条在空气中充分燃烧,转移的电子数目为
B.铁粉与的溶液充分反应,产生的气体分子数目为
C.标准状况下,与充分反应,生成的分子数目为
D.完全溶于所得溶液中的数目为
【解析】镁条在空气中充分燃烧生成氧化镁:,从0价被氧化为 价,故
转移的电子数目为,A正确;铁粉与稀溶液反应生成 和
,铁粉与的 溶液反应,铁粉过量,产生的氢
气的分子数目为,B错误;与生成的反应为可逆反应,反应不能进行到底,故生成的 分子数目
小于,C错误;溶于水发生反应:,因此
完全溶于所得溶液中的数目小于 ,D错误。
3.[2024内蒙古呼和浩特监测改编]我国科研团队在人工合成淀粉方面取得突破性进展,通过、制得 ,
进而合成了淀粉。用 代表阿伏加德罗常数的值,下列说法正确的是( )
D
A.和混合气体的分子数为 B.通过与制得,转移电子数为
C.标准状况下,中含有个键 D.淀粉中含C原子数为
【解析】和混合气体的分子数为,A项错误;中转移 ,则制得
,转移电子数为,B项错误;标准状况下为液体,不为 ,含有的
键数不为,C项错误;淀粉中含C原子数为 ,D项
正确。
4.[2023辽宁抚顺模拟] 是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备,反应为
。 为阿伏加德罗常数的值,下列说法正确的是( )
A
A.中含有的电子数为 B.固体中含有个 分子
C.每生成,转移的电子数为 D.的稀盐酸中含有的数目为
【解析】第一步:定性排除。
第二步:定量计算。
5.[2024吉林长春监测]过二硫酸钾,其中为价 是工业上一种重要的消毒剂和织物漂白剂,可通过电解
溶液制备。它在下能发生分解反应: (未配平),设 为阿伏加德罗
常数的值,下列说法正确的是( )
A
A.中含有非极性共价键的数目为 B.分解,生成的分子数为
C.标准状况下,含有的原子数为 D.溶液中的离子总数为
【解析】由和组成,的结构式为 ,所以 中含有非极性共
价键的数目为,A项正确;根据 可知,分解,生成 ,
分子数为,B项错误;标准状况下为固体,不为,含有的原子数不为 ,C项错误;没有提
供溶液体积,所含离子数目无法确定,D项错误。
6.[2024广东佛山顺德区质检改编]海洋碳循环是影响全球气候变
化的关键控制环节,下图为海洋中碳循环的原理图。设 为阿
伏加德罗常数的值。下列说法正确的是( )
C
A.的溶液中,和 数目之和为
B.“钙化”时,消耗,生成
C.“光合”时,每生成转移电子数为
D.中含有共用电子对数为
【解析】
选项 分析
溶液中,会分步水解,溶液中的含碳微粒有、、, 的
溶液中和数目之和小于
未说明气体所处状况,无法计算气体体积
“光合”时,,C元素化合价由变为0,转移个电子,则每生成 ,
转移电子数为
一个分子中含有共用电子对数为4,则中含有共用电子对数为
热考题型4 以物质的量为中心的计算
1.[2022上海卷]冰层表面摩擦力小,原因可能是其表面有一层液态水,现有一冰面面积为 ,液态水厚度为
,水的密度为 ,求液态水分子数( )
C
A. B. C. D.
【解析】由题目信息可知,液态水的体积为,再根据 得出其
质量为,物质的量,分子数 ,C正
确。
2.[2023黑龙江双鸭山一中考试]将一定质量的镁铜合金加入到稀硝酸中,二者恰好完全反应,假设反应过程中还原
产物全是。向所得溶液中加入物质的量浓度为的 溶液至沉淀完全,测得生成沉淀的质量比合金
的质量增加了 。下列有关叙述正确的是( )
A
A.加入合金的质量可能是 B.参加反应的硝酸的物质的量为
C.沉淀完全时消耗溶液的体积为 D.溶解合金时收集到气体的体积为
【解析】综合分析
将镁铜合金加入到稀中,金属完全溶解(假设反应中还原产物只有 )发生反应
, ,向反应后的溶液
中加入溶液至沉淀完全,发生反应 、
,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加
了,则氢氧化镁和氢氧化铜中含的质量为,则 ,根据反应方程式可
知,,,故镁和铜的总物质的量为 。
若合金全为镁,则合金的质量为 ,若合金全为铜,则合金的质量为
,则合金的质量可能为 ,A项正确;根据化学方程式可知参加反应的
,B项错误;反应消耗的物质的量为 ,故加
入的溶液的体积,C项错误;合金中镁和铜的总物质的量为 ,由化学方
程式可知,生成一氧化氮的物质的量 ,但没有说明气体所处的状况,故不能确定气体
的体积,D项错误。
3.[2023辽宁卷节选]我国古籍记载了硫酸的制备方法——“炼石
胆 取精华法”。借助现代仪器分析,该制备过
程中分解的曲线(热重)及 曲线(反映体
系热量变化情况,数值已省略)如下图所示。 左右有两
个吸热峰,则此时分解生成的氧化物有 、_____和_____
(填化学式)。
【解题思路】由图可知,起始时有 ,其物
质的量是,所含结晶水的质量为 ,则固体质
量剩余时所得固体为,加热过程中元素的质量不变,则固体质量剩余时所得的固体是 ,
结合题图DSC曲线有两个吸热峰可知,发生的反应为、 ,则生成的氧化
物除外,还有、 。
4.[2023全国乙卷节选]在气氛中, 的脱水热分解过程
如图所示:
根据上述实验结果,可知___, ___。
4
1
【解题思路】由图可知, 即7个结晶水完全
失去时失重比为,则失重比为 时,失去的结晶水数目
为,故,同理可推出 。
5.[2024山东部分学校模拟]
(1)利用滴定法测定 产品的纯度,实验如下。
称取产品,加入足量的水,使产品充分水解 。将上层清液全部转移
到容量瓶中,定容,移取于锥形瓶中,加入少量和几滴溶液,用的 标准
溶液滴定至终点时,消耗标准溶液(已知: )。
则产品中 的质量分数为________。
【解题思路】
(2)为测定三氯化六氨合钴(Ⅲ) 产品中钴的含量,进行下列实验。
称取产品,加入足量溶液蒸出,再加入稀硫酸,使全部转化为 ,然后将溶液
配制成,取于锥形瓶中,加入过量的溶液,用淀粉溶液作指示剂,用
标准溶液滴定至终点,重复操作次,消耗标准溶液平均体积为 。
已知:滴定过程中转化为 。则样品中钴元素的质量分数为______。
【解题思路】
思维建模
“关系式法”的应用
专题综合训练
04
1.[2022重庆卷]调工业上用和合成。 代表阿伏加德罗常数的值,下列说法正确的是( )
B
A.消耗生成分子数为 B.消耗生成键数为
C.生成标准状况下,电子转移数为 D.氧化生成,需分子数为
【解析】根据知,消耗即,生成的分子数为,A项错误;消耗 生成
,即生成的键数为,B项正确;转移,则生成标准状况下即 ,
转移电子数为,C项错误;根据知,氧化生成,需要的 分子数为
,D项错误。
2.[2024浙江杭州质检] 为阿伏加德罗常数的值,下列说法正确的是( )
B
A.密闭容器中与充分反应,产物的分子数为
B.正丁烷和异丁烷的混合物中含有 键的数目为
C.的溶液中的数目为
D.溶液水解生成氢氧化铁胶粒的数目为
【解析】、,所以产物的分子数小于,A项错误; 正丁烷和异丁烷的混合
物的物质的量为,一个正丁烷中含有13个 键,一个异丁烷中含有13个 键,则 正丁烷和异丁烷的混
合物中含有 键的数目为,B项正确;碳酸氢钠为强碱弱酸盐,水溶液中 会发生水解,故
的溶液中数目小于 ,C项错误;胶粒是多个粒子的集合体,所得氢氧化铁胶粒
的数目少于 ,D项错误。
有关阿伏加德罗常数的易混易错
1 水解和电离 未考虑溶液中弱电解质的电离、弱碱阳离子和弱酸的酸根离子的水解,导致计算某微
粒数目时出错
2 可逆反应未进行到底 忽略可逆反应不能进行到底,导致计算电子转移数目或产物微粒数目时出错
3 浓度变化 随着反应的进行,反应物浓度不断减小,当达到一定程度时,未考虑反应停止或发生
其他反应,可能会导致计算某微粒数目时出错
4 隐含反应 某些物质自身可发生反应,导致分子数目发生变化,如
5 胶体微粒、 #b# 聚合体 忽略某些胶体微粒是分子等的集合体或忽略有机高分子的聚合度,可能会导致计算某
微粒数目时出错
3.[2023湖北十一校联考] 为阿伏加德罗常数的值,下列说法正确的是( )
A
A.和的混合气体中含有的孤电子对数为
B.中 键的个数为
C.已知为正盐,则所含羟基数为
D.葡萄糖与新制的反应生成,转移电子数为
【解析】和的摩尔质量相同,二者互为等电子体,所含孤电子对数相等,一个或一个 中都含有两个孤电
子对,和的混合气体的物质的量为,含有的孤电子对数为,A项正确;、与 形成
的配位键为 键,3个氨分子中含有9个 键,1个中含有1个 键,因此中所含 键个数
为,B项错误;为正盐,则为二元酸,无机含氧酸电离出的 由羟基电离产生,因此
中含有的羟基数为,C项错误;中的化合价为,中的化合价为 ,生成
,转移电子的物质的量为,转移电子数为 ,D项错误。
4.[2024安徽十校联盟联考]氮化硅是一种重要的结构陶瓷材料,是一种超硬物质,常利用它来制造轴承、永久性模
具等机械构件。其制备原理为。设 为阿伏加德罗常数的值,下列说法错误的
是( )
B
A.晶体中含有的键数目为 B.该实验条件下,中分子数目为
C.每生成的,转移电子数目为 D.和混合气体中原子数目为
【解析】的结构中,1个硅原子连接4个氧原子,形成4个键,故晶体中键数目为 ,A
项正确;高温时,气体摩尔体积不是,无法计算气体的物质的量,B项错误; 元素化合价由0降
低到,每生成,转移电子数目为,C项正确;和的摩尔质量均为,和
混合气体的物质的量为,且二者均为双原子分子,故原子数目为 ,D项正确。
5.[2023河南郑州模拟]摩尔日 是一个流传于化学家之间的节日,通常在10月23日的上午6:02到下午6:0
2之间庆祝,被记为,恰似阿伏加德罗常数。设 为阿伏加德罗常数的值,下列说法正确的是( )
B
A.标准状况下肼中含有的键数目为
B.固体中含有的阳离子数目为
C.电解饱和食盐水时,若阴、阳两极产生气体的总体积为,则转移电子数为
D.与足量充分反应,生成的分子数目为
【解析】第一步:定性排除。
第二步:定量计算。
6.[2024重庆渝北中学质检]如图是某同学用 容量瓶配制
溶液的过程:
该同学的错误步骤有( )
B
A.1处 B.2处 C.3处 D.4处
【解析】第①步:不能把 固体放在称量纸上称量,应放在小烧杯
中称量;第⑤步:定容时应平视刻度线。错误有2处,选B。
7.[2024湖北部分学校联考]党的二十大报告指出:要“加强污染物协同控制,
基本消除重污染天气”。近地面臭氧已成为现阶段夏季主要大气污染物,近地
面臭氧产生和吸收机理如图所示。设 为阿伏加德罗常数的值,下列说法正
确的是( )
C
A.和的混合物含质子数为
B.每产生,需要的分子数为
C.反应③中有完全反应,转移电子数为
D.标准状况下,和各混合充分反应,体系中分子总数为
【解析】不确定混合气体所处状况,故不能确定混合物的物质的量,A项错误。反应①是在太阳光作用下, 分
解为和,反应②是空气中的与分解生成的结合生成,则产生需要提供 ,B
项错误。反应③是与反应生成和,则完全反应,有氧原子被还原,转移 电子,
C项正确。和充分反应生成,剩余,但存在可逆反应:
(【易错警示】切勿忽略体系中隐含的可逆反应。),则体系中分子总数小于 ,D项错误。
8. 皖豫名校联考]相同条件下,向如图所示的容器的左边
通入,右边通入和的混合气体,且和
的物质的量之比为 。下列说法错误的是( )
D
A.右边和的混合气体的平均摩尔质量为
B.左边与右边的原子个数比为
C.右边混合气体中的体积分数为
D.向右边通入 时,可移动挡板能移到3刻度处
【解析】和的混合气体的平均摩尔质量 ,A项
正确;由可知,,所以,则, ,左边与右边的原子个
数比为,项正确;右边和的物质的量之比为,则
的体积分数为,项正确;向右边通入时,消耗,所以右边剩余 和
,左边和右边气体的物质的量相等,所以挡板移动到 2.5处, 项错误。
9.[2024江西抚州临川区调研]在室温下,向饱和溶液中加入足量经酸化的 溶液,在暗处充分反应
一段时间后,用溶液滴定,消耗滴定溶液 。相关的离子反应有
,, 。原饱和溶液中
的物质的量浓度 为( )
D
A. B. C. D.
【解析】的电离方程式为,由题干中离子方程式可得 ,
,需要消耗 。
,D项正确。
10.[2023湖北武汉部分学校调研]碱式碳酸铜 是一种草绿色晶体,可用于铜盐、
油漆和烟花的制备。实验室制备碱式碳酸铜的步骤如下:
Ⅰ.分别配制溶液和 溶液。
Ⅱ.将溶液和 溶液混合、搅拌均匀。
Ⅲ.将Ⅱ的混合溶液加热至,搅拌 。
Ⅳ.静置使产物沉淀完全后,抽滤、洗涤、干燥、称重,分析样品组成和晶体结构。
回答下列问题:
(1)步骤Ⅰ中,配制 溶液时,不需要使用下列
仪器中的______(填仪器名称)。
坩埚
【解题思路】步骤Ⅰ中,配制 溶液时,需要使
用容量瓶、烧杯、天平、玻璃棒等,不需要使用的仪器是坩埚。
(2)步骤Ⅱ中,若误将溶液与 溶液等体积混合,二者恰好完全反应,生成蓝色的
晶体,其反应的离子方程式为
_____________________________________________________________________。
【解题思路】步骤Ⅱ中,将溶液与溶液等体积混合,二者恰好完全反应,生成
晶体,反应的离子方程式为 。
(3)步骤Ⅲ中,若温度高于 ,则产品中混有的黑色固体是_____。
【解题思路】步骤Ⅲ中,若温度高于,发生分解,生成、和 ,则产品中混有的黑色
固体是 。
(4)步骤Ⅳ中,检验沉淀是否洗涤干净的试剂是__________________;称得产品的质量为 ,则该实验所得
碱式碳酸铜的产率是______。
盐酸、氯化钡溶液
【解题思路】步骤Ⅳ中,沉淀表面容易吸附溶液中的,检验 的试剂是盐酸、氯化钡溶液。制取碱式碳酸
铜的离子方程式为 ,则理论上, 溶液
和溶液反应,生成 ,则碱式碳酸铜的产率是
。
(5)对样品进行热重分析得到的曲线如图所示,则铜元素的质量分数是______,
与理论值相差不大。通过___________实验可进一步测定样品的晶体结构。
射线衍射
【解题思路】样品灼烧后,所得固体为,质量保留百分数为 ,则
样品中铜元素的质量分数是 。
同课章节目录
