江西省南昌市湾里区第一中学高中化学人教版选修5 1-4研究有机物的一般步骤和方法课件 (共9张PPT)
文档属性
| 名称 | 江西省南昌市湾里区第一中学高中化学人教版选修5 1-4研究有机物的一般步骤和方法课件 (共9张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 344.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-03-29 00:00:00 | ||
图片预览


文档简介
课件9张PPT。新课标人教版选修五《 有机化学基础》第一章 认识有机化合物第四节 研究有机化合物的
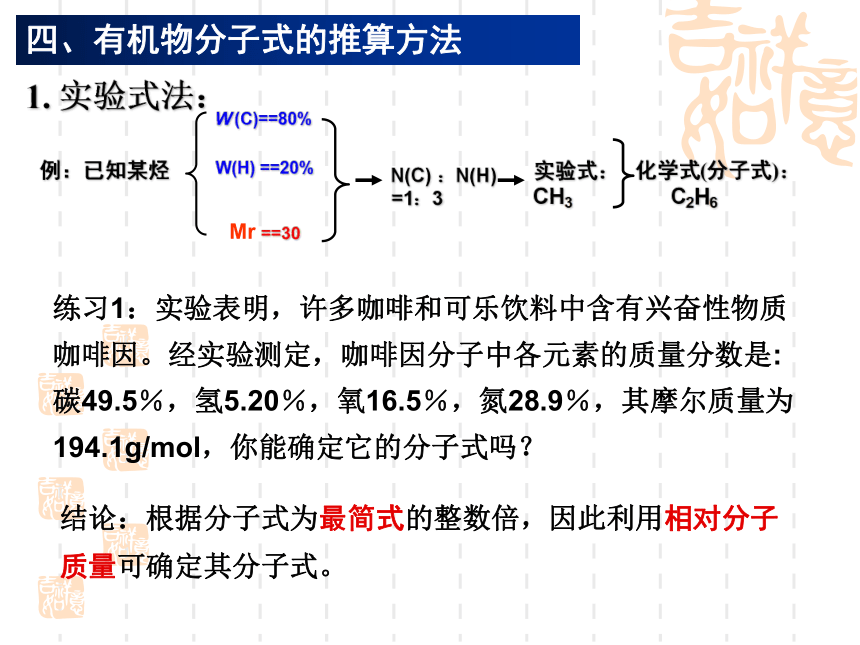
一般步骤和方法第3课时四、有机物分子式的推算方法例:已知某烃W(H) ==20%W (C)==80%Mr ==30N(C) :N(H)
=1:3实验式:
CH3化学式(分子式):
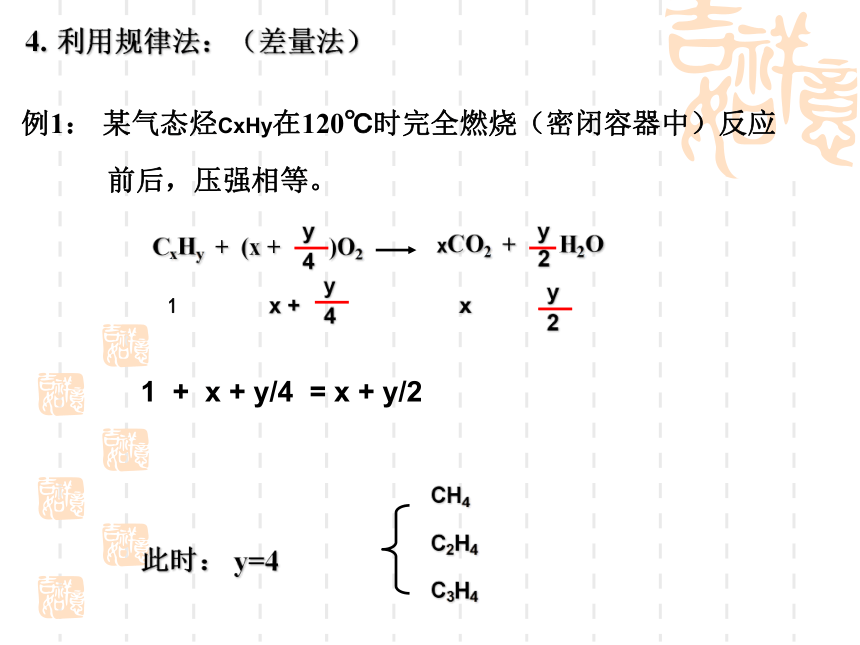
C2H61. 实验式法:结论:根据分子式为最简式的整数倍,因此利用相对分子质量可确定其分子式。练习1:实验表明,许多咖啡和可乐饮料中含有兴奋性物质咖啡因。经实验测定,咖啡因分子中各元素的质量分数是: 碳49.5%,氢5.20%,氧16.5%,氮28.9%,其摩尔质量为194.1g/mol,你能确定它的分子式吗?2. 利用分子通式法:例1: 已知某烷烃的相对分子质量为142。求分子式。3. 燃烧通式法:例:某含C、H的有机物相对于H2 的密度为21。5.8g该有机物完全燃烧,得CO2 13.2g , H2O 5.4g 。 求分子式?分析:相对分子质量 Mr =21×2=42n( 有机物) = 0.1moln(CO2) = 0.3moln(H2O) = 0.3mol CxHy+ (x +y/4)O2 xCO2 + y/2H2O1x0.10.30.3X=3Y=6C3H6例1: 某气态烃CxHy在120℃时完全燃烧(密闭容器中)反应
前后,压强相等。1 + x + y/4 = x + y/24. 利用规律法:(差量法)【练习2】 两种气态烃以任意比混合,在105℃时,1L 该混合气体
与9LO2混合,充分燃烧,(密闭容器中)恢复到原来的状况,
所得气体的体积仍是10L.下列组合不符合此条件的是 A. CH4 C2H4 C. C3H4 C2H4
D. C2H6 CH4B. CH4 C3H4D在常温、常压下,50ml三种气态烃的混合物在足量
的 O2里,点燃爆炸,恢复到原来的温度和压强,体
积共缩小100ml,则三种烃的可能组合是 ①. CH4 ②. C2H4 ③C3H6
④ C3H4 ⑤C3H8 ⑥C4H6
50100分析:y =4【练习3】5. 平均值法(求平均分子式): 两种气态烃组成的混合物0.1mol完全燃烧,得
0.16molCO2,0.2molH2O. 则该混合物中( ) A.一定有 CH4 C2H4 C.一定有 C2H2
D. 一定有 CH4B. 一定没有 C2H4 D 分析:0.1mol烃0.16molCO2,C:0.16mol0.2molH2O H: 0.4mol平均分子式: C1.6H41mol烃分析: 练习4、一种气态烷烃一种气态烯烃,其分子式中碳原子数相等。
1体积的混合气体完全燃烧,生成 CO2 2体积,水蒸气 2.4 体积。
(1)求烷烃、烯烃的分子式
(2)两种烃的体积比
烃的式量除以14,得到的商及余数可确定6. 商余法:例: 已知某烷烃的相对分子质量为142。求分子式。 特殊方法:
部分有机物的实验式中H已达饱和,则该有机物的实验式就是
分子式。
(如:CH4、CH3Cl、C2H6O等)
部分特殊组成的实验式如:CH3 当n=2时即达饱和,在不知相对分子质量时也可求得C10H22
一般步骤和方法第3课时四、有机物分子式的推算方法例:已知某烃W(H) ==20%W (C)==80%Mr ==30N(C) :N(H)
=1:3实验式:
CH3化学式(分子式):
C2H61. 实验式法:结论:根据分子式为最简式的整数倍,因此利用相对分子质量可确定其分子式。练习1:实验表明,许多咖啡和可乐饮料中含有兴奋性物质咖啡因。经实验测定,咖啡因分子中各元素的质量分数是: 碳49.5%,氢5.20%,氧16.5%,氮28.9%,其摩尔质量为194.1g/mol,你能确定它的分子式吗?2. 利用分子通式法:例1: 已知某烷烃的相对分子质量为142。求分子式。3. 燃烧通式法:例:某含C、H的有机物相对于H2 的密度为21。5.8g该有机物完全燃烧,得CO2 13.2g , H2O 5.4g 。 求分子式?分析:相对分子质量 Mr =21×2=42n( 有机物) = 0.1moln(CO2) = 0.3moln(H2O) = 0.3mol CxHy+ (x +y/4)O2 xCO2 + y/2H2O1x0.10.30.3X=3Y=6C3H6例1: 某气态烃CxHy在120℃时完全燃烧(密闭容器中)反应
前后,压强相等。1 + x + y/4 = x + y/24. 利用规律法:(差量法)【练习2】 两种气态烃以任意比混合,在105℃时,1L 该混合气体
与9LO2混合,充分燃烧,(密闭容器中)恢复到原来的状况,
所得气体的体积仍是10L.下列组合不符合此条件的是 A. CH4 C2H4 C. C3H4 C2H4
D. C2H6 CH4B. CH4 C3H4D在常温、常压下,50ml三种气态烃的混合物在足量
的 O2里,点燃爆炸,恢复到原来的温度和压强,体
积共缩小100ml,则三种烃的可能组合是 ①. CH4 ②. C2H4 ③C3H6
④ C3H4 ⑤C3H8 ⑥C4H6
50100分析:y =4【练习3】5. 平均值法(求平均分子式): 两种气态烃组成的混合物0.1mol完全燃烧,得
0.16molCO2,0.2molH2O. 则该混合物中( ) A.一定有 CH4 C2H4 C.一定有 C2H2
D. 一定有 CH4B. 一定没有 C2H4 D 分析:0.1mol烃0.16molCO2,C:0.16mol0.2molH2O H: 0.4mol平均分子式: C1.6H41mol烃分析: 练习4、一种气态烷烃一种气态烯烃,其分子式中碳原子数相等。
1体积的混合气体完全燃烧,生成 CO2 2体积,水蒸气 2.4 体积。
(1)求烷烃、烯烃的分子式
(2)两种烃的体积比
烃的式量除以14,得到的商及余数可确定6. 商余法:例: 已知某烷烃的相对分子质量为142。求分子式。 特殊方法:
部分有机物的实验式中H已达饱和,则该有机物的实验式就是
分子式。
(如:CH4、CH3Cl、C2H6O等)
部分特殊组成的实验式如:CH3 当n=2时即达饱和,在不知相对分子质量时也可求得C10H22
