第一节 原子 第二课时 课件(共29张PPT内嵌视频)
文档属性
| 名称 | 第一节 原子 第二课时 课件(共29张PPT内嵌视频) |  | |
| 格式 | pptx | ||
| 文件大小 | 31.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-05 22:17:11 | ||
图片预览








文档简介
(共29张PPT)
第一节 原子 (第2课时)
前置诊断
1.下列物质由原子直接构成的是( )
A.氧气 B.金 C.水 D.空气
B
2.1911年,英国科学家卢瑟福进行了著名的α粒子轰击金箔实验(如图),根据这个实验获得的正确结论是( )
A.金原子核带正电荷
B.金原子是实心球体,紧密排列
C.金原子中有带负电的电子
D.金原子核的质量与α粒子质量相当
A
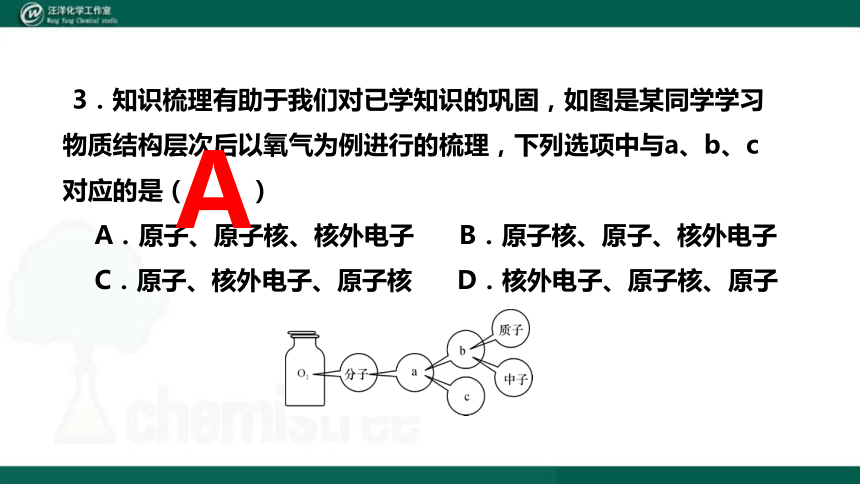
3.知识梳理有助于我们对已学知识的巩固,如图是某同学学习物质结构层次后以氧气为例进行的梳理,下列选项中与a、b、c对应的是( )
A.原子、原子核、核外电子 B.原子核、原子、核外电子
C.原子、核外电子、原子核 D.核外电子、原子核、原子
A
4.2015年10月,中国科研团队首次证实了天然铀单质的存在。用于核电工业的一种铀原子中含有92个质子和143个中子。有关该原子的说法不正确的是( )
A.属于金属原子 B.电子数为92
C.核电荷数为92 D.电子数为143
D
5.在分子、原子、质子、中子、电子等粒子中,找出符合下列条件的粒子,填在相应的横线上。
(1)能直接构成物质的粒子有 ;
(2)构成原子的粒子是 ;
(3)构成原子核的粒子是 ;
(4)带正电荷的粒子是 ;
(5)带负电荷的粒子是 ;
(6)不显电性的粒子是 。
分子、原子
质子、中子、电子
质子、中子
质子
电子
分子、原子、中子
学习目标
1.通过观看视频和小组合作,知道原子核外的电子根据能量的高低分层排布。
2.通过对原子结构示意图的自主学习,能说出各部分表示含义,画出1-20号原子的结构示意图。
3.通过分析核外电子排布规律,知道稳定结构,说出原子的性质与最外层电子数的关系。
4.通过分析氯化钠的形成过程,知道原子通过得失电子可以转变为离子,离子也能直接构成物质,初步形成微粒观,体会宏微结合的思维方式。
任务一 原子核外电子的排布
第一层
第二层
氧原子的结构(8个电子)
1.能量低的在离核近的区域运动,
能量高的在离核远的区域运动。
2. 第一层最多排2个电子
第二层最多排8个电子
3.最外层最多排8个电子(若只有一个电子层最多排2个电子).
1.电子排布规律:
+8
2.原子结构示意图:
原子核
质子数
圆圈表示
圈内数字表示
原子核带正电
“+”表示
最外层电子数
数字6也可以表示
2 6
第一层
第二层(最外层)
某原子的原子结构示意图为 ,该原子的
核电荷数为 ,核外有 个电子层,第二层上
有 个电子,最外电子层上有 个电子。
13
3
8
3
练1:
练2:
练习画出下列原子结构示意图
2.氦原子 3.锂原子 9.氟原子
10.氖原子 13.铝原子 16.硫原子
18.氩原子 20.钙原子
+2
2
+3
2 1
+9
2 7
+10
2 8
+13
2 8 3
+16
2 8 6
+18
2 8 8
+20
2 8 8 2
任务二 原子的性质与最外层电子的关系
氦(He)
氖(Ne)
氩(Ar)
像稀有气体元素原子这样最外层为8个电子(饱和)的结构叫8电子稳定结构,若只有一个电子层,则2电子也是稳定结构(如: He)。
1.原子的稳定结构
+2
2
+10
2 8
+18
2 8 8
任何原子都有使自己达到稳定结构的趋势
2.结构决定性质
(1)稀有气体元素的原子最外层电子数一般等于8个(氦是2个)
(2)金属元素的原子最外层电子数一般少于4个
(3)非金属元素的原子最外层电子数一般等于或多于4个
原子的分类 最外层的电子数 结构的稳定性 化学性质
稀有气体 一般为 , 只有氦为 。 结构 不活泼
金属元素 一般 个 结构 易 电子,活泼
非金属元素 一般 个 结构 易 电子,活泼
结论:最外层电子数决定元素(原子)的化学性质
8
稳定
2
<4
不稳定
失
≥4
不稳定
得
总结归纳 获得结论
下列原子结构属于稳定结构的是 ,易得电子的是 ,失电子的是_____,化学性质相似的是 。
AC
D
BE
针对训练
注意:判断微粒是否达到稳定结构,只需要看最外层电子数是否是8(氦是2)
判断化学性质是否相似,只需要看最外层电子数是否一样(注意氦2)
AC和BE
+2
2
A B C D E
+16
2 8 6
任务三 认识离子
+
氯化钠的形成
金属钠
氯气
氯化钠的形成
e-
Na
Cl
钠原子
氯原子
钠离子
氯离子
微点拨:原子得失电子形成离子,得电子带负电形成阴离子,失电子带正电形成阳离子。
归纳总结
(1)定义:带电荷的的原子或原子团叫做离子。
(2)分类:
阳离子:带正电荷的离子. 如Na+
阴离子:带负电荷的离子. 如Cl-
(3)表示:
(4)离子是构成物质的一种粒子。
离子符号 Na+ Cl-
离子结构示意图
(氯化钠、硝酸钾、氧化镁、氢氧化钠等都是由离子构成的)
质子数≠电子数
(先写出原子符号,然后在右上角写出带电荷的个数,注意带的电荷的确定方法是先画出原子结构示意图,然后根据最外层电子得失确定)
知识比较
分 子 原 子 离 子
相同点 根 本 区 别
构 成 物 质
联 系 都是构成物质的微粒;小;不断运动;有间隔
在化学变
化中可分
在化学变化
中 不 可 分
带电的微粒
分子 原子 离子
分解
构成
得失
电子
水,酒精
绝大数气体
金属、稀有气体、金刚石等
食盐等
1.下列粒子中表示带两个正电荷的阳离子的是( )
2.一种元素的原子变成离子时( )
+10
2
8
+11
2
8
+12
2
8
+13
2
8
A
B
C
D
C
A.一定失去电子 B.一定得到电子
C.电子层一定变化 D.得失电子都可能
D
针对训练
( )
+11
2
8
+8
2
6
+12
2
8
+8
2
8
A
B
C
D
D
4.某粒子结构示意图为
+x
2
8
则该粒子是
( )
A.一定是稀有气体原子 B.一定是阳离子
C.一定是阴离子 D.以上三种都有可能
3.下列粒子结构示意图中,表示阴离子的是
D
课堂小结
不良反应
2.相对原子质量 (近似值)≈ 质子数 + 中子数
1.原子的最外层电子数决定原子的化学性质;
2.微粒的稳定结构:最外层电子数为8(氦为2)即达到稳定结构;
3.原子得到或失去电子后转变为离子。离子也是构成物质的一种微粒。
(二)药理作用
1.下列微粒结构示意图中,表示相对稳定的原子结构是( )
A B C D
2.下列关于Mg、Mg2+两种粒子的判断中正确的是( )
A.质子数相同 B.质量不相等
C.Mg2+比Mg活泼 D.电子层数相同
A
A
当 堂 检 测
(二)药理作用
3.如下图所示,分别是铜元素、氢元素、氧元素、钠元素的原子结构
示意图。
(1)A 中 X 的值为_________;
(2)A、D 化学性质相似的原因是____________;
(3)B 形成的离子符号为____________;
29
最外层电子数相同
H+
本节课结束了
第一节 原子 (第2课时)
前置诊断
1.下列物质由原子直接构成的是( )
A.氧气 B.金 C.水 D.空气
B
2.1911年,英国科学家卢瑟福进行了著名的α粒子轰击金箔实验(如图),根据这个实验获得的正确结论是( )
A.金原子核带正电荷
B.金原子是实心球体,紧密排列
C.金原子中有带负电的电子
D.金原子核的质量与α粒子质量相当
A
3.知识梳理有助于我们对已学知识的巩固,如图是某同学学习物质结构层次后以氧气为例进行的梳理,下列选项中与a、b、c对应的是( )
A.原子、原子核、核外电子 B.原子核、原子、核外电子
C.原子、核外电子、原子核 D.核外电子、原子核、原子
A
4.2015年10月,中国科研团队首次证实了天然铀单质的存在。用于核电工业的一种铀原子中含有92个质子和143个中子。有关该原子的说法不正确的是( )
A.属于金属原子 B.电子数为92
C.核电荷数为92 D.电子数为143
D
5.在分子、原子、质子、中子、电子等粒子中,找出符合下列条件的粒子,填在相应的横线上。
(1)能直接构成物质的粒子有 ;
(2)构成原子的粒子是 ;
(3)构成原子核的粒子是 ;
(4)带正电荷的粒子是 ;
(5)带负电荷的粒子是 ;
(6)不显电性的粒子是 。
分子、原子
质子、中子、电子
质子、中子
质子
电子
分子、原子、中子
学习目标
1.通过观看视频和小组合作,知道原子核外的电子根据能量的高低分层排布。
2.通过对原子结构示意图的自主学习,能说出各部分表示含义,画出1-20号原子的结构示意图。
3.通过分析核外电子排布规律,知道稳定结构,说出原子的性质与最外层电子数的关系。
4.通过分析氯化钠的形成过程,知道原子通过得失电子可以转变为离子,离子也能直接构成物质,初步形成微粒观,体会宏微结合的思维方式。
任务一 原子核外电子的排布
第一层
第二层
氧原子的结构(8个电子)
1.能量低的在离核近的区域运动,
能量高的在离核远的区域运动。
2. 第一层最多排2个电子
第二层最多排8个电子
3.最外层最多排8个电子(若只有一个电子层最多排2个电子).
1.电子排布规律:
+8
2.原子结构示意图:
原子核
质子数
圆圈表示
圈内数字表示
原子核带正电
“+”表示
最外层电子数
数字6也可以表示
2 6
第一层
第二层(最外层)
某原子的原子结构示意图为 ,该原子的
核电荷数为 ,核外有 个电子层,第二层上
有 个电子,最外电子层上有 个电子。
13
3
8
3
练1:
练2:
练习画出下列原子结构示意图
2.氦原子 3.锂原子 9.氟原子
10.氖原子 13.铝原子 16.硫原子
18.氩原子 20.钙原子
+2
2
+3
2 1
+9
2 7
+10
2 8
+13
2 8 3
+16
2 8 6
+18
2 8 8
+20
2 8 8 2
任务二 原子的性质与最外层电子的关系
氦(He)
氖(Ne)
氩(Ar)
像稀有气体元素原子这样最外层为8个电子(饱和)的结构叫8电子稳定结构,若只有一个电子层,则2电子也是稳定结构(如: He)。
1.原子的稳定结构
+2
2
+10
2 8
+18
2 8 8
任何原子都有使自己达到稳定结构的趋势
2.结构决定性质
(1)稀有气体元素的原子最外层电子数一般等于8个(氦是2个)
(2)金属元素的原子最外层电子数一般少于4个
(3)非金属元素的原子最外层电子数一般等于或多于4个
原子的分类 最外层的电子数 结构的稳定性 化学性质
稀有气体 一般为 , 只有氦为 。 结构 不活泼
金属元素 一般 个 结构 易 电子,活泼
非金属元素 一般 个 结构 易 电子,活泼
结论:最外层电子数决定元素(原子)的化学性质
8
稳定
2
<4
不稳定
失
≥4
不稳定
得
总结归纳 获得结论
下列原子结构属于稳定结构的是 ,易得电子的是 ,失电子的是_____,化学性质相似的是 。
AC
D
BE
针对训练
注意:判断微粒是否达到稳定结构,只需要看最外层电子数是否是8(氦是2)
判断化学性质是否相似,只需要看最外层电子数是否一样(注意氦2)
AC和BE
+2
2
A B C D E
+16
2 8 6
任务三 认识离子
+
氯化钠的形成
金属钠
氯气
氯化钠的形成
e-
Na
Cl
钠原子
氯原子
钠离子
氯离子
微点拨:原子得失电子形成离子,得电子带负电形成阴离子,失电子带正电形成阳离子。
归纳总结
(1)定义:带电荷的的原子或原子团叫做离子。
(2)分类:
阳离子:带正电荷的离子. 如Na+
阴离子:带负电荷的离子. 如Cl-
(3)表示:
(4)离子是构成物质的一种粒子。
离子符号 Na+ Cl-
离子结构示意图
(氯化钠、硝酸钾、氧化镁、氢氧化钠等都是由离子构成的)
质子数≠电子数
(先写出原子符号,然后在右上角写出带电荷的个数,注意带的电荷的确定方法是先画出原子结构示意图,然后根据最外层电子得失确定)
知识比较
分 子 原 子 离 子
相同点 根 本 区 别
构 成 物 质
联 系 都是构成物质的微粒;小;不断运动;有间隔
在化学变
化中可分
在化学变化
中 不 可 分
带电的微粒
分子 原子 离子
分解
构成
得失
电子
水,酒精
绝大数气体
金属、稀有气体、金刚石等
食盐等
1.下列粒子中表示带两个正电荷的阳离子的是( )
2.一种元素的原子变成离子时( )
+10
2
8
+11
2
8
+12
2
8
+13
2
8
A
B
C
D
C
A.一定失去电子 B.一定得到电子
C.电子层一定变化 D.得失电子都可能
D
针对训练
( )
+11
2
8
+8
2
6
+12
2
8
+8
2
8
A
B
C
D
D
4.某粒子结构示意图为
+x
2
8
则该粒子是
( )
A.一定是稀有气体原子 B.一定是阳离子
C.一定是阴离子 D.以上三种都有可能
3.下列粒子结构示意图中,表示阴离子的是
D
课堂小结
不良反应
2.相对原子质量 (近似值)≈ 质子数 + 中子数
1.原子的最外层电子数决定原子的化学性质;
2.微粒的稳定结构:最外层电子数为8(氦为2)即达到稳定结构;
3.原子得到或失去电子后转变为离子。离子也是构成物质的一种微粒。
(二)药理作用
1.下列微粒结构示意图中,表示相对稳定的原子结构是( )
A B C D
2.下列关于Mg、Mg2+两种粒子的判断中正确的是( )
A.质子数相同 B.质量不相等
C.Mg2+比Mg活泼 D.电子层数相同
A
A
当 堂 检 测
(二)药理作用
3.如下图所示,分别是铜元素、氢元素、氧元素、钠元素的原子结构
示意图。
(1)A 中 X 的值为_________;
(2)A、D 化学性质相似的原因是____________;
(3)B 形成的离子符号为____________;
29
最外层电子数相同
H+
本节课结束了
同课章节目录
