第二节 元素第一课时 课件(共36张PPT)
文档属性
| 名称 | 第二节 元素第一课时 课件(共36张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-05 22:19:28 | ||
图片预览








文档简介
(共36张PPT)
第二节 元素 (第1课时)
1.如图是元素X的原子结构示意图.下列说法正确的是:
A.该原子最外电子层达到了稳定结构
B.该原子的核外电子数为7
C.该元素的原子易得到电子
D.X属于金属元素
C
前置诊断
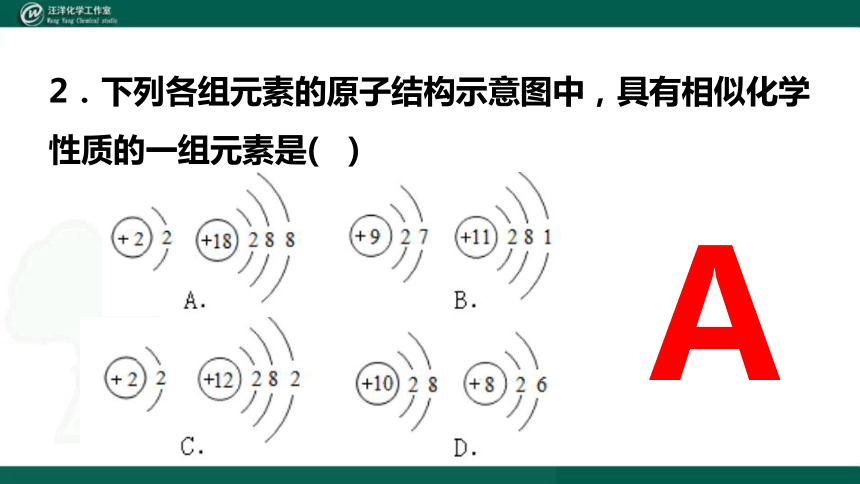
2.下列各组元素的原子结构示意图中,具有相似化学性质的一组元素是( )
A
3.某元素R的相对原子质量为m,能够形成核外有x个电子的Rn+离子,则R原子的核内中子数为( )
A. m+n+x
B. m -n+x
C. m- n- x
D. m+n-x
C
4.镁元素的原子结构示意图.请回答:
(1)镁是______元素(填“金属”或“非金属”);
(2)镁元素的原子在化学反应中易______电子(填“获得”或“失去”),形成______离子(填“阴”或“阳”),镁离子的符号表示为 .
(3)由此可以得出:原子在失去最外层电子或在最外层得到电子达到稳定结构后,一定不会发生改变的有 .
①元素的种类;②元素的化学性质;③相对原子质量;④粒子的电性;
⑤原子核;⑥最外层电子数;⑦电子层数;⑧核外电子总数;⑨质子个数.
金属
失去
阳
Mg2+
①
③
⑤
⑨
5.某元素R的微粒的结构示意图为:
(1)当x=10+y时 ,该粒子为 (填“原子””阳离子”或“阴离子”);当x<10+y时,该粒子为 (填“原子””阳离子”或“阴离子”)。
(2)若该粒子为原子,当y=2时,x= ,该元素能形成的离子符号为 。
(3)若该结构示意图表示的粒子是R-,则x= y= 。
原子
阴离子
12
Mg2+
17
8
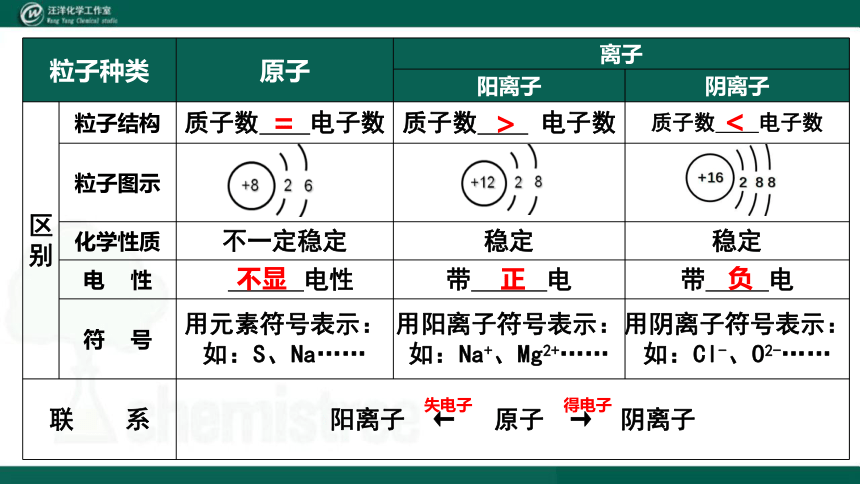
粒子种类 原子 离子 阳离子 阴离子
区 别 粒子结构 质子数 电子数 质子数 电子数 质子数 电子数
粒子图示
化学性质 不一定稳定 稳定 稳定
电 性 电性 带 电 带 电
符 号 用元素符号表示:如:S、Na…… 用阳离子符号表示:如:Na+、Mg2+…… 用阴离子符号表示:
如:Cl-、O2-……
联 系 阳离子 ← 原子 → 阴离子 =
>
<
不显
正
负
得电子
失电子
元素
任务一 元素
现代化学家对原子分类的依据
——原子核中质子的个数
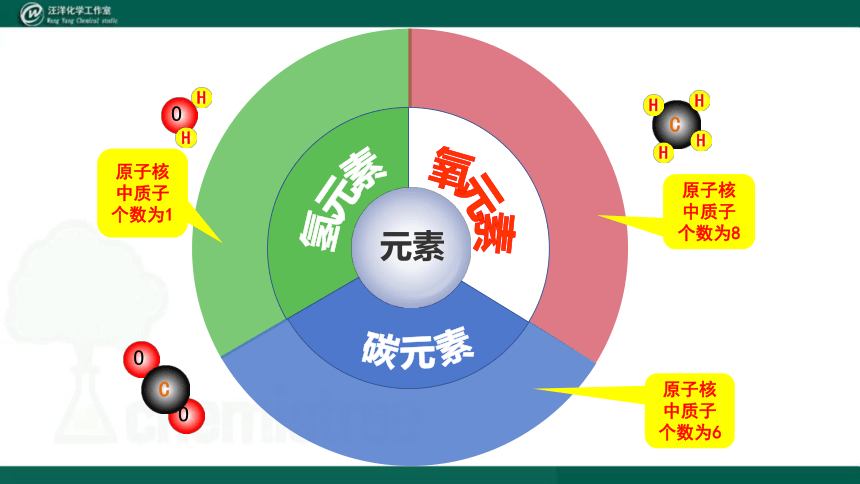
碳元素
氧元素
元素
氢元素
O
O
O
O
C
C
C
H
H
H
H
H
H
原子核中质子个数为1
原子核中质子个数为6
原子核中质子个数为8
具有相同质子数(即核电荷数)的同一类原子的总称。
微点拨:
(1)决定元素种类的是核内质子数
(2)同一类原子(质子数相同,中子数可以不同 电子数可以不同)
(3)总称:元素是一个宏观概念
1.元素的定义:
+11
2
8
1
Na
+11
2
8
Na
+
2.下面两种微粒属于同一种元素吗
1.它们属于碳元素家族吗?
我是C-12(表示核内6个质子,6个中子)
我是 C-13(表示核内6个质子,7个中子)
C-13
原子
C-12
原子
讨论交流
是 因为质子数相等
1.以下四种粒子的结构示意图中,表示原子的是 ,表示阳离子的是 ,表示同种元素的是 最外层为稳定结构的是______;图中共有 种元素。
ACD
B
BD
BC
针对性练习
3
2.物质、分子、原子、离子、元素区别与联系?
教师引领绘制思维导图
重点思维辨析
1.关于水(H2O)的组成结构分析:
水是由 组成的;
水是由 构成的;
水分子是由 构成的;
每个水分子是由 构成的。
氢元素和氧元素
水分子
氢原子和氧原子
2个氢原子和1个氧原子
3.地壳中的元素分布(质量计算)
地壳中含量前五位的元素是 。
氧 硅 铝 铁 钙
元素之最
地壳中含量最多的元素
地壳中含量最多的金属元素
人体中含量最多的元素
空气中含量最多的元素(人呼出的气体中含量最多的元素)
宇宙中含量最多的元素
氧元素 O
氧元素 O
铝元素 Al
氮元素 N
氢元素 H
4.物质的分类
纯净物
(一种物质)
混合物
(多种物质)
单质 (一物一元素)
例如:H2 、O2、C、Fe
化合物(一物多元素)
例如:H2O、CO2、Fe2O3
物质
微点拨:(1)根据 区分纯净物和混合物。
(2)根据组成纯净物的 区分单质和化合物。
(3)由一种元素组成的物质可能 或 ,但是绝对不是 。
单质
混合物
化合物
元素种类是否单一
物质种类是否单一
例如:海水、河水、湖水、食盐水、空气、铝合金
单质
混合物
化合物
微观探索
针对练习:
(1)表示混合物的有 (填序号,下同);
(2)表示单质的有 ,可以表示化合物的有 。
下图中“ ”和“O”” “分别表示不同元素的原子。
B
AD
C
评价练习(物质分类)
1.(2023·临沂)分类是化学学习中常用的思维方法。下列物质中,属于纯净物的是( )
A.空气 B.液氧 C.生铁 D.石油
B
2. 将下列常见的物质正确分类。(均填序号)①氮气;②二氧化碳;③食盐水;④奶茶;⑤冰水混合物:⑥铁⑦液态空气;⑧雨水;⑨锈铁钉。其中属于混合物的是 (填序号,下同):属于单质的是 ;属于化合物的是 。
写出物质的分类概念及分类的依据:
物质
混合物
依据
依据
( )
( )
③④
⑦⑧⑨
①⑥
②⑤
物质种类
元素种类
纯净物
单质
化合物
3.在下列A、B、C、D每瓶气体中,“ ”、“ ”、“ ”、“ ”代表不同原子,现对四瓶气体进行如下分类,用A、B…序号回答下列问题:
(1)属于①的是 ; 属于②的是 ; 属于③的是 ;
属于稀有气体的可能是 .
(2)上述将纯净物分类成①②,这种分类的依据是 .
BC
D
A
C
根据元素种类不同
任务二 元素符号
为了书写交流方便,国际上统一
采用元素拉丁文名称的第一个字母来
表示元素;当几种元素的拉丁文名称
第一个字母相同时,就附加一个小写字母。
如:H、He、Cl 等。
元素符号的书写
H
Ca
Fe
Mg
Ag
一大二小
元素符号表示的意义
①表示一种元素(宏观)
②表示这种元素的一个原子(微观)
③表示一种物质(宏观,由原子直接构成的三类物质)
H
①氢元素
②一个氢原子
Fe
①铁元素
②一个铁原子
③铁
你知道“3H”、“5C”“7Na”、“10Mg”
分别表示什么意思吗?
3个氢
原子
5个碳
原子
7个钠
原子
10个镁
原子
注意:元素符号前面加上数字,只表示微观含义,即表示原子的个数;
例如 2H 表示 。
两个氢原子
思维拓展
元素的分类
如:氦、氖、氩等
③稀有气体元素:“气”字头
①金属元素:“钅”字旁(汞除外)
如:铁、铜等
固态非金属元素(“石”字旁)
气态非金属元素(“气”字头)
非金属元素
②
如:碳、碘等
如:氢、氧等
1—20号元素名称及元素符号
氢 氦 锂 铍 硼 碳 氮 氧 氟 氖
H He Li Be B C N O F Ne
钠 镁 铝 硅 磷 硫 氯 氩 钾 钙
Na Mg Al Si P S Cl Ar K Ca
其它
锰 铁 铜 锌 银 钡 汞 金 铅
Mn Fe Cu Zn Ag Ba Hg Au Pb
O
N
Al
Fe
K
Cl
S
P
Ca
Zn
C
Na
Mg
Ag
H
请快速读出下面的元素符号
Iǜ
当堂达标检测
(二)药理作用
1.二硫化钼(MoS2)被认为是最有希望代替硅,成为未来应用在半导体、芯片等高精尖领域中的理想材料。确定Mo为42号元素是依据( )
A.电子数 B.中子数
C.质子数 D.相对原子质量
C
(二)药理作用
2. “加碘食盐”“含氟牙膏”中的“碘”和“氟”指的是( )
A.元素 B.原子
C.分子 D.离子
A
(二)药理作用
3.某粒子发生如图所示变化,下列说法正确的是( )
A.该变化属于物理变化
B.该变化属于化学变化
C.该变化过程元素种类发生改变
D.该变化过程粒子失去电子
B
(二)药理作用
4.下列元素符号书写完全正确的一组是( )
A.氦He,氖Ne,氩Ar,硫S B.碳C,磷P,硫S,硅SI
C.钠Na,铝Al,锌Sn,镁Mg D.氮N,氯Cl,氟Fe,氧O
A
(二)药理作用
5.铁的化学式用“Fe”来表示,对于该化学式表示的意义,描述错误的是( )
A.表示铁这种物质 B.表示铁是由铁元素组成的
C.表示铁是由铁原子构成的 D.表示铁分子
D
(二)药理作用
6.如图为核聚变的示意图,其中①②③表示三种原子,“ ”“ ”
“ ”表示原子中的不同微粒,③是氦元素的原子,①②③中属于同种元素的原子是__________(填序号)。
①和②
本节课结束了
第二节 元素 (第1课时)
1.如图是元素X的原子结构示意图.下列说法正确的是:
A.该原子最外电子层达到了稳定结构
B.该原子的核外电子数为7
C.该元素的原子易得到电子
D.X属于金属元素
C
前置诊断
2.下列各组元素的原子结构示意图中,具有相似化学性质的一组元素是( )
A
3.某元素R的相对原子质量为m,能够形成核外有x个电子的Rn+离子,则R原子的核内中子数为( )
A. m+n+x
B. m -n+x
C. m- n- x
D. m+n-x
C
4.镁元素的原子结构示意图.请回答:
(1)镁是______元素(填“金属”或“非金属”);
(2)镁元素的原子在化学反应中易______电子(填“获得”或“失去”),形成______离子(填“阴”或“阳”),镁离子的符号表示为 .
(3)由此可以得出:原子在失去最外层电子或在最外层得到电子达到稳定结构后,一定不会发生改变的有 .
①元素的种类;②元素的化学性质;③相对原子质量;④粒子的电性;
⑤原子核;⑥最外层电子数;⑦电子层数;⑧核外电子总数;⑨质子个数.
金属
失去
阳
Mg2+
①
③
⑤
⑨
5.某元素R的微粒的结构示意图为:
(1)当x=10+y时 ,该粒子为 (填“原子””阳离子”或“阴离子”);当x<10+y时,该粒子为 (填“原子””阳离子”或“阴离子”)。
(2)若该粒子为原子,当y=2时,x= ,该元素能形成的离子符号为 。
(3)若该结构示意图表示的粒子是R-,则x= y= 。
原子
阴离子
12
Mg2+
17
8
粒子种类 原子 离子 阳离子 阴离子
区 别 粒子结构 质子数 电子数 质子数 电子数 质子数 电子数
粒子图示
化学性质 不一定稳定 稳定 稳定
电 性 电性 带 电 带 电
符 号 用元素符号表示:如:S、Na…… 用阳离子符号表示:如:Na+、Mg2+…… 用阴离子符号表示:
如:Cl-、O2-……
联 系 阳离子 ← 原子 → 阴离子 =
>
<
不显
正
负
得电子
失电子
元素
任务一 元素
现代化学家对原子分类的依据
——原子核中质子的个数
碳元素
氧元素
元素
氢元素
O
O
O
O
C
C
C
H
H
H
H
H
H
原子核中质子个数为1
原子核中质子个数为6
原子核中质子个数为8
具有相同质子数(即核电荷数)的同一类原子的总称。
微点拨:
(1)决定元素种类的是核内质子数
(2)同一类原子(质子数相同,中子数可以不同 电子数可以不同)
(3)总称:元素是一个宏观概念
1.元素的定义:
+11
2
8
1
Na
+11
2
8
Na
+
2.下面两种微粒属于同一种元素吗
1.它们属于碳元素家族吗?
我是C-12(表示核内6个质子,6个中子)
我是 C-13(表示核内6个质子,7个中子)
C-13
原子
C-12
原子
讨论交流
是 因为质子数相等
1.以下四种粒子的结构示意图中,表示原子的是 ,表示阳离子的是 ,表示同种元素的是 最外层为稳定结构的是______;图中共有 种元素。
ACD
B
BD
BC
针对性练习
3
2.物质、分子、原子、离子、元素区别与联系?
教师引领绘制思维导图
重点思维辨析
1.关于水(H2O)的组成结构分析:
水是由 组成的;
水是由 构成的;
水分子是由 构成的;
每个水分子是由 构成的。
氢元素和氧元素
水分子
氢原子和氧原子
2个氢原子和1个氧原子
3.地壳中的元素分布(质量计算)
地壳中含量前五位的元素是 。
氧 硅 铝 铁 钙
元素之最
地壳中含量最多的元素
地壳中含量最多的金属元素
人体中含量最多的元素
空气中含量最多的元素(人呼出的气体中含量最多的元素)
宇宙中含量最多的元素
氧元素 O
氧元素 O
铝元素 Al
氮元素 N
氢元素 H
4.物质的分类
纯净物
(一种物质)
混合物
(多种物质)
单质 (一物一元素)
例如:H2 、O2、C、Fe
化合物(一物多元素)
例如:H2O、CO2、Fe2O3
物质
微点拨:(1)根据 区分纯净物和混合物。
(2)根据组成纯净物的 区分单质和化合物。
(3)由一种元素组成的物质可能 或 ,但是绝对不是 。
单质
混合物
化合物
元素种类是否单一
物质种类是否单一
例如:海水、河水、湖水、食盐水、空气、铝合金
单质
混合物
化合物
微观探索
针对练习:
(1)表示混合物的有 (填序号,下同);
(2)表示单质的有 ,可以表示化合物的有 。
下图中“ ”和“O”” “分别表示不同元素的原子。
B
AD
C
评价练习(物质分类)
1.(2023·临沂)分类是化学学习中常用的思维方法。下列物质中,属于纯净物的是( )
A.空气 B.液氧 C.生铁 D.石油
B
2. 将下列常见的物质正确分类。(均填序号)①氮气;②二氧化碳;③食盐水;④奶茶;⑤冰水混合物:⑥铁⑦液态空气;⑧雨水;⑨锈铁钉。其中属于混合物的是 (填序号,下同):属于单质的是 ;属于化合物的是 。
写出物质的分类概念及分类的依据:
物质
混合物
依据
依据
( )
( )
③④
⑦⑧⑨
①⑥
②⑤
物质种类
元素种类
纯净物
单质
化合物
3.在下列A、B、C、D每瓶气体中,“ ”、“ ”、“ ”、“ ”代表不同原子,现对四瓶气体进行如下分类,用A、B…序号回答下列问题:
(1)属于①的是 ; 属于②的是 ; 属于③的是 ;
属于稀有气体的可能是 .
(2)上述将纯净物分类成①②,这种分类的依据是 .
BC
D
A
C
根据元素种类不同
任务二 元素符号
为了书写交流方便,国际上统一
采用元素拉丁文名称的第一个字母来
表示元素;当几种元素的拉丁文名称
第一个字母相同时,就附加一个小写字母。
如:H、He、Cl 等。
元素符号的书写
H
Ca
Fe
Mg
Ag
一大二小
元素符号表示的意义
①表示一种元素(宏观)
②表示这种元素的一个原子(微观)
③表示一种物质(宏观,由原子直接构成的三类物质)
H
①氢元素
②一个氢原子
Fe
①铁元素
②一个铁原子
③铁
你知道“3H”、“5C”“7Na”、“10Mg”
分别表示什么意思吗?
3个氢
原子
5个碳
原子
7个钠
原子
10个镁
原子
注意:元素符号前面加上数字,只表示微观含义,即表示原子的个数;
例如 2H 表示 。
两个氢原子
思维拓展
元素的分类
如:氦、氖、氩等
③稀有气体元素:“气”字头
①金属元素:“钅”字旁(汞除外)
如:铁、铜等
固态非金属元素(“石”字旁)
气态非金属元素(“气”字头)
非金属元素
②
如:碳、碘等
如:氢、氧等
1—20号元素名称及元素符号
氢 氦 锂 铍 硼 碳 氮 氧 氟 氖
H He Li Be B C N O F Ne
钠 镁 铝 硅 磷 硫 氯 氩 钾 钙
Na Mg Al Si P S Cl Ar K Ca
其它
锰 铁 铜 锌 银 钡 汞 金 铅
Mn Fe Cu Zn Ag Ba Hg Au Pb
O
N
Al
Fe
K
Cl
S
P
Ca
Zn
C
Na
Mg
Ag
H
请快速读出下面的元素符号
Iǜ
当堂达标检测
(二)药理作用
1.二硫化钼(MoS2)被认为是最有希望代替硅,成为未来应用在半导体、芯片等高精尖领域中的理想材料。确定Mo为42号元素是依据( )
A.电子数 B.中子数
C.质子数 D.相对原子质量
C
(二)药理作用
2. “加碘食盐”“含氟牙膏”中的“碘”和“氟”指的是( )
A.元素 B.原子
C.分子 D.离子
A
(二)药理作用
3.某粒子发生如图所示变化,下列说法正确的是( )
A.该变化属于物理变化
B.该变化属于化学变化
C.该变化过程元素种类发生改变
D.该变化过程粒子失去电子
B
(二)药理作用
4.下列元素符号书写完全正确的一组是( )
A.氦He,氖Ne,氩Ar,硫S B.碳C,磷P,硫S,硅SI
C.钠Na,铝Al,锌Sn,镁Mg D.氮N,氯Cl,氟Fe,氧O
A
(二)药理作用
5.铁的化学式用“Fe”来表示,对于该化学式表示的意义,描述错误的是( )
A.表示铁这种物质 B.表示铁是由铁元素组成的
C.表示铁是由铁原子构成的 D.表示铁分子
D
(二)药理作用
6.如图为核聚变的示意图,其中①②③表示三种原子,“ ”“ ”
“ ”表示原子中的不同微粒,③是氦元素的原子,①②③中属于同种元素的原子是__________(填序号)。
①和②
本节课结束了
同课章节目录
