第三节 物质在水中的溶解 第三课时课件(共21张PPT)
文档属性
| 名称 | 第三节 物质在水中的溶解 第三课时课件(共21张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-07 21:16:56 | ||
图片预览







文档简介
(共21张PPT)
第三节 物质在水中的溶解(3)
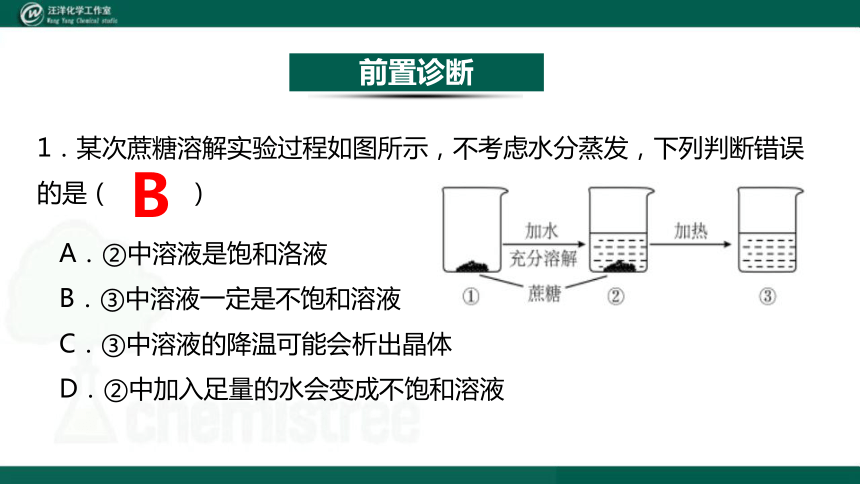
1.某次蔗糖溶解实验过程如图所示,不考虑水分蒸发,下列判断错误的是( )
A.②中溶液是饱和洛液
B.③中溶液一定是不饱和溶液
C.③中溶液的降温可能会析出晶体
D.②中加入足量的水会变成不饱和溶液
前置诊断
B
2.在其它条件不变的情况下,要使接近饱和溶液的硝酸钾溶液达到饱和溶液,下列措施中达不到目的的是( )
A.降低溶液温度
B.加入硝酸钾固体
C.加同温下硝酸钾饱和溶液
D.恒温蒸发溶剂
C
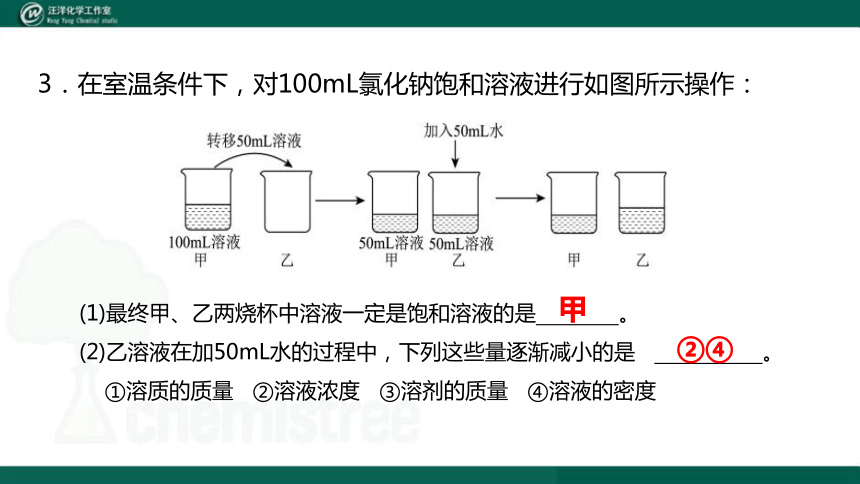
3.在室温条件下,对100mL氯化钠饱和溶液进行如图所示操作:
(1)最终甲、乙两烧杯中溶液一定是饱和溶液的是 。
(2)乙溶液在加50mL水的过程中,下列这些量逐渐减小的是 。
①溶质的质量 ②溶液浓度 ③溶剂的质量 ④溶液的密度
甲
②④
4.一木块漂浮于30℃的饱和硝酸钾溶液中,如图所示.
(1)当温度改变时(不考虑由此引起的木块和溶液体积的变化),发现木块排开水的体积增大了,由此推测出温度的变化是 ,同时可观察到烧杯底部的硝酸钾晶体 .
(2)若要在不用外力和另加溶液的情况下使木块上浮,
你准备采取的具体方法是:① ;② 。
降温
增多
加热
加入氯化钠固体
1.通过实验探究及讨论交流,能定量分析溶液的浓稀,进而总结归纳溶质质量分数的含义和公式。
2.通过公式的变形和具体实例计算分析,能根据溶质质量分数公式进行简单的计算。
3.通过硝酸钾溶液的稀释和浓缩实验探究分析,进一步熟练公式的应用。
学习目标
学习任务一 溶液的溶质质量分数
活动探究——哪杯糖水更甜
蔗糖
蔗糖
两杯同样多的水,一杯加入一汤勺蔗糖,另一杯加入两汤勺蔗糖,哪一杯糖水甜?为什么?
活动探究——哪杯糖水更甜
10g蔗糖
8g蔗糖
1.在一只盛有40mL水的烧杯中加入8g蔗糖,搅拌,使蔗糖溶解。
2.在另一只盛有50mL水的烧杯中加入10g蔗糖,搅拌,使蔗糖溶解。
40mL水
50mL水
思考与讨论:
1. 两种糖水,哪种更甜?
你判断的根据是什么?
2. 如果你的结论是通过计算获得,那么你列出的算式是怎样?
活动探究——哪杯糖水更甜
10g蔗糖
8g蔗糖
40mL水
50mL水
方法一:
8g
40g
=
10g
50g
溶质质量与溶剂质量的比
8g
48g
=
10g
60g
方法二:
溶质质量与溶液质量的比
溶液组成的定量表示方法——溶质质量分数
1. 定义:溶质的质量与溶液的质量的比值。
2. 公式:
溶质的质量分数=
溶质的质量
溶液的质量
———————
×100%
3. 含义:在100份质量的溶液里含有多少份质量的溶质。
例如:溶质质量分数25%的氯化钠溶液是指,在100份氯化钠溶液里含有25份质量的氯化钠,75份质量的水。
①比值,没有单位,以百分数表示
②物理量单位必须统一才能计算,如单位都是kg或g,计算过程中必须带上
情景启发 思考回答
图中葡萄糖注射液的“5%”表示什么意义呢?判断正误!
A .葡萄糖溶液的溶质的质量分数为5%
B .每100份质量的溶液中,溶质的质量为5份
C.该溶液中溶质、溶剂、溶液三者的质量比为
5:95:100即为1:19:20
D.每100份质量的水中溶解葡萄糖的质量为5份
E.静脉注射一半以后,剩余注射液质量分数为2.5%
溶液组成的定量表示方法——溶质质量分数
溶质的质量分数=
溶质的质量
溶液的质量
—————————
×100%
溶液的质量 = 溶质的质量 + 溶剂的质量
溶质的质量 = 溶液的质量 × 溶质的质量分数
溶剂的质量 = 溶液的质量 - 溶质的质量
微点拨:在溶液中知道任意两个量就可以求出另外两个量。
溶液的质量 = 溶质的质量 ÷ 溶质的质量分数
熟练公式 评价练习一
溶液质量 氯化钠溶液 溶剂质量 水 溶质质量 氯化钠 溶质的质量分数
100g 90g
200g 15%
380g 20g
10g
170g
30g
400g
10%
5%
1.快速口算,填写表格中空余的项目数据!熟悉公式及其变形的应用!
2.将50g食盐溶液加热蒸干后,获得了10g食盐,计算此食盐溶液的溶质质量分数?
3.现用500g生理盐水(溶质质量分数为0.9%)给病人输液,进入患者体内的氯化钠和水的质量各为多少克?
4.如果用10g硝酸钾配制10%的硝酸钾不饱和溶液,能配制出多少克这种溶液?
变式训练:
1.分别对90g10%的硝酸钾溶液进行如下操作,所得溶液的溶质质量分数分别是多少:
(1)若向溶液中加入10g硝酸钾固体充分溶解? ;
(2)若向此溶液中加入10g水? ;
(3)若向溶液加入10g 20%的硝酸钾溶液? 。
学习任务二 溶质质量分数的应用
应用一 溶液的稀释
微点拨:1.溶液稀释的原理是 。
100g 25%
的硝酸钾溶液
10%
的硝酸钾溶液
加入水
稀释前后溶质的质量不变
2.计算公式:mA·A% = mB·B%
应用一 溶液的稀释
将100g 25%的硝酸钾溶液用水稀释成溶质质量分数为10%的溶液。求稀释所需水的质量。(完整写出计算过程,注意计算格式和细节)
= 10%X
稀释时所用水的质量为:
250 g-100 g=150 g
解:设稀释后稀溶液的质量为X
100g × 25%
x=250 g
答:稀释时所用水的质量为150 g。
解:设加水的质量为X
x=150 g
100g×25%
= (100g+X)×10%
答:稀释时所用水的质量为150 g。
应用二 溶液的加浓
现有100g溶质质量分数为10%的食盐溶液,若要使其变为20%:
(1)若加入食盐固体,则需要加入多少克?
(2)若蒸发水,则需要蒸发掉水多少克?
(3)若向其加入30%的食盐溶液,则需要加入这种溶液多少克?
课程结束了,祝学习进步哦!
第三节 物质在水中的溶解(3)
1.某次蔗糖溶解实验过程如图所示,不考虑水分蒸发,下列判断错误的是( )
A.②中溶液是饱和洛液
B.③中溶液一定是不饱和溶液
C.③中溶液的降温可能会析出晶体
D.②中加入足量的水会变成不饱和溶液
前置诊断
B
2.在其它条件不变的情况下,要使接近饱和溶液的硝酸钾溶液达到饱和溶液,下列措施中达不到目的的是( )
A.降低溶液温度
B.加入硝酸钾固体
C.加同温下硝酸钾饱和溶液
D.恒温蒸发溶剂
C
3.在室温条件下,对100mL氯化钠饱和溶液进行如图所示操作:
(1)最终甲、乙两烧杯中溶液一定是饱和溶液的是 。
(2)乙溶液在加50mL水的过程中,下列这些量逐渐减小的是 。
①溶质的质量 ②溶液浓度 ③溶剂的质量 ④溶液的密度
甲
②④
4.一木块漂浮于30℃的饱和硝酸钾溶液中,如图所示.
(1)当温度改变时(不考虑由此引起的木块和溶液体积的变化),发现木块排开水的体积增大了,由此推测出温度的变化是 ,同时可观察到烧杯底部的硝酸钾晶体 .
(2)若要在不用外力和另加溶液的情况下使木块上浮,
你准备采取的具体方法是:① ;② 。
降温
增多
加热
加入氯化钠固体
1.通过实验探究及讨论交流,能定量分析溶液的浓稀,进而总结归纳溶质质量分数的含义和公式。
2.通过公式的变形和具体实例计算分析,能根据溶质质量分数公式进行简单的计算。
3.通过硝酸钾溶液的稀释和浓缩实验探究分析,进一步熟练公式的应用。
学习目标
学习任务一 溶液的溶质质量分数
活动探究——哪杯糖水更甜
蔗糖
蔗糖
两杯同样多的水,一杯加入一汤勺蔗糖,另一杯加入两汤勺蔗糖,哪一杯糖水甜?为什么?
活动探究——哪杯糖水更甜
10g蔗糖
8g蔗糖
1.在一只盛有40mL水的烧杯中加入8g蔗糖,搅拌,使蔗糖溶解。
2.在另一只盛有50mL水的烧杯中加入10g蔗糖,搅拌,使蔗糖溶解。
40mL水
50mL水
思考与讨论:
1. 两种糖水,哪种更甜?
你判断的根据是什么?
2. 如果你的结论是通过计算获得,那么你列出的算式是怎样?
活动探究——哪杯糖水更甜
10g蔗糖
8g蔗糖
40mL水
50mL水
方法一:
8g
40g
=
10g
50g
溶质质量与溶剂质量的比
8g
48g
=
10g
60g
方法二:
溶质质量与溶液质量的比
溶液组成的定量表示方法——溶质质量分数
1. 定义:溶质的质量与溶液的质量的比值。
2. 公式:
溶质的质量分数=
溶质的质量
溶液的质量
———————
×100%
3. 含义:在100份质量的溶液里含有多少份质量的溶质。
例如:溶质质量分数25%的氯化钠溶液是指,在100份氯化钠溶液里含有25份质量的氯化钠,75份质量的水。
①比值,没有单位,以百分数表示
②物理量单位必须统一才能计算,如单位都是kg或g,计算过程中必须带上
情景启发 思考回答
图中葡萄糖注射液的“5%”表示什么意义呢?判断正误!
A .葡萄糖溶液的溶质的质量分数为5%
B .每100份质量的溶液中,溶质的质量为5份
C.该溶液中溶质、溶剂、溶液三者的质量比为
5:95:100即为1:19:20
D.每100份质量的水中溶解葡萄糖的质量为5份
E.静脉注射一半以后,剩余注射液质量分数为2.5%
溶液组成的定量表示方法——溶质质量分数
溶质的质量分数=
溶质的质量
溶液的质量
—————————
×100%
溶液的质量 = 溶质的质量 + 溶剂的质量
溶质的质量 = 溶液的质量 × 溶质的质量分数
溶剂的质量 = 溶液的质量 - 溶质的质量
微点拨:在溶液中知道任意两个量就可以求出另外两个量。
溶液的质量 = 溶质的质量 ÷ 溶质的质量分数
熟练公式 评价练习一
溶液质量 氯化钠溶液 溶剂质量 水 溶质质量 氯化钠 溶质的质量分数
100g 90g
200g 15%
380g 20g
10g
170g
30g
400g
10%
5%
1.快速口算,填写表格中空余的项目数据!熟悉公式及其变形的应用!
2.将50g食盐溶液加热蒸干后,获得了10g食盐,计算此食盐溶液的溶质质量分数?
3.现用500g生理盐水(溶质质量分数为0.9%)给病人输液,进入患者体内的氯化钠和水的质量各为多少克?
4.如果用10g硝酸钾配制10%的硝酸钾不饱和溶液,能配制出多少克这种溶液?
变式训练:
1.分别对90g10%的硝酸钾溶液进行如下操作,所得溶液的溶质质量分数分别是多少:
(1)若向溶液中加入10g硝酸钾固体充分溶解? ;
(2)若向此溶液中加入10g水? ;
(3)若向溶液加入10g 20%的硝酸钾溶液? 。
学习任务二 溶质质量分数的应用
应用一 溶液的稀释
微点拨:1.溶液稀释的原理是 。
100g 25%
的硝酸钾溶液
10%
的硝酸钾溶液
加入水
稀释前后溶质的质量不变
2.计算公式:mA·A% = mB·B%
应用一 溶液的稀释
将100g 25%的硝酸钾溶液用水稀释成溶质质量分数为10%的溶液。求稀释所需水的质量。(完整写出计算过程,注意计算格式和细节)
= 10%X
稀释时所用水的质量为:
250 g-100 g=150 g
解:设稀释后稀溶液的质量为X
100g × 25%
x=250 g
答:稀释时所用水的质量为150 g。
解:设加水的质量为X
x=150 g
100g×25%
= (100g+X)×10%
答:稀释时所用水的质量为150 g。
应用二 溶液的加浓
现有100g溶质质量分数为10%的食盐溶液,若要使其变为20%:
(1)若加入食盐固体,则需要加入多少克?
(2)若蒸发水,则需要蒸发掉水多少克?
(3)若向其加入30%的食盐溶液,则需要加入这种溶液多少克?
课程结束了,祝学习进步哦!
同课章节目录
