第三节 物质在水中的溶解第一课时 课件(共22张PPT内嵌视频)
文档属性
| 名称 | 第三节 物质在水中的溶解第一课时 课件(共22张PPT内嵌视频) |  | |
| 格式 | pptx | ||
| 文件大小 | 220.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-05 23:21:33 | ||
图片预览








文档简介
第三节 物质在水中的溶解(1)
海水
河水
湖水
泉水
清澈透明的海水、河水、湖水、泉水等天然水是纯净物吗?为什么?
1.通过实验探究及微观分析,认识溶解现象,总结归纳溶液的概念、组成和特征,能判断溶液中的溶质和溶剂;
2.通过实验探究氢氧化钠和硝酸铵等物质溶解于水时的温度变化,知道物质溶解过程中的能量变化及其产生的原因;
3.通过自学探究,能说出溶液在生产、生活中的重要应用价值。
学习目标
学习任务一 溶解的过程
在一只盛有约50mL水的烧杯中,加入一小匙食盐(主要成分是氯化钠),用玻璃棒搅拌。仔细观察发生的变化,直至食盐颗粒在水中消失。触摸烧杯,感受温度是否变化。
氯化钠
水
氯化钠溶液
观察思考——食盐的溶解
思考:
1.食盐颗粒为什么不见了?
2.烧杯中食盐水的上部、中部、下部,任一处,是否一样咸?
3.如果把上述食盐水密封,保存一个月,一 年,两年……你猜测食盐会不会从水中分离出来?
归纳总结溶液的定义、组成和基本特征
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}重要知
识点序号
知识点标题
知识点具体内容
1
溶液定义
2
溶液组成
3
溶液特征
一种或几种物质分散到另一种物质里,形成均一、稳定的混合物。
溶质:被溶解的物质。(可以是一种或几种,例如啤酒)
溶剂:起溶解作用的物质。(溶液中只能有一种)
均一性:溶液各部分的性质相同,溶液各处的浓稀、密度相同。
稳定性:条件不变时,溶质与溶剂长期不会分离。
(浊液不具有均一性和稳定性)
关于溶液的易混淆点辨析
1.均一、稳定的液体一定是溶液吗?
2.溶液一定是液体吗?
3.溶液一定是无色的吗?
——水、酒精等纯净物不是溶液。
——只要符合均一、稳定、混合物都是溶液,如空气、合金。
蓝色
硫酸铜溶液
浅绿色
硫酸亚铁溶液
黄色
氯化铁溶液
紫红色
高锰酸钾溶液
——不一定,有些化学试剂有颜色、生活中也有很多有颜色的溶液。
关于溶液组成的定性研究
{5940675A-B579-460E-94D1-54222C63F5DA}固体、气体溶于液体
液体溶于液体时 (没有水)
只要有水的溶液
不指明溶剂时
1.溶液中溶质和溶剂的判断:
固体气体是溶质
液体是溶剂
量少的是溶质
量多的是溶剂
水为溶剂
水为溶剂
固液混合固为质;
气液混合气为质;
液液混合少为质;
有水存在水为剂。
巧记方法
关于溶液组成的定性研究
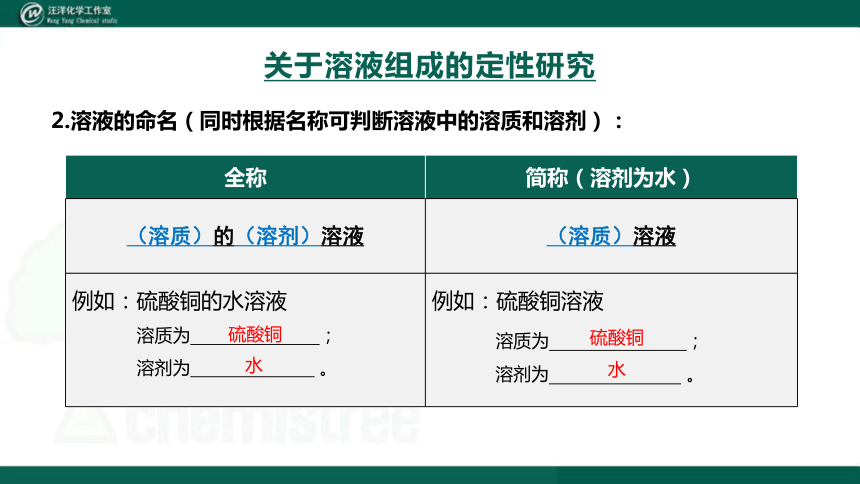
2.溶液的命名(同时根据名称可判断溶液中的溶质和溶剂):
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}全称
简称(溶剂为水)
(溶质)的(溶剂)溶液
(溶质)溶液
例如:硫酸铜的水溶液
溶质为 ;
溶剂为 。
例如:硫酸铜溶液
溶质为 ;
溶剂为 。
硫酸铜
水
硫酸铜
水
评价练习1
1.下列关于溶液的说法正确的是( )
A.均一、稳定的液体都是溶液 B.溶液是均一、稳定的纯净物
C.溶液都是无色透明的液体 D.溶液是均一、稳定的混合物
D
2.请填写下列溶液中溶质和溶剂名称。
{16D9F66E-5EB9-4882-86FB-DCBF35E3C3E4}溶液
生理盐水
白酒
碘酒
氢氧化
钠溶液
氯化氢的
水溶液
白磷的二硫化碳溶液
溶质
溶剂
氯化钠
水
水
水
水
酒精
碘
酒精
氢氧化钠
氯化氢气体
白磷
二硫化碳
学习任务二 物质溶解时溶液温度变化
活动探究——物质溶解时溶液温度的变化
{21E4AEA4-8DFA-4A89-87EB-49C32662AFE0}实验操作
数据结论
测水温
加氯化钠,测氯化钠溶液温度
加硝酸铵,测硝酸铵溶液温度
加氢氧化钠,测氢氧化钠溶液温度
22℃
22℃ 不变
19℃ 降低
33.8℃ 升高
{5940675A-B579-460E-94D1-54222C63F5DA}溶解
微观探秘——物质溶于水时溶液温度变化的原因
扩散过程:溶质分子(或离子)扩散到水分子中去----吸收热量
水合过程:水分子结合溶质分子(或离子)
----放出热量
①Q吸 = Q放,溶液温度 , 。
②Q吸 > Q放,溶液温度 , 。
③Q吸 < Q放,溶液温度 , 。
降低
升高
不变
同时进行
如:硝酸铵
如:氢氧化钠、浓硫酸
如:氯化钠
1.原来U型管内两臂在同一水平上的红墨水。如下图向试管里的水中加入某种物质后:
①U形管内红墨水左低右高,则加入的物质是( )
②U形管内红墨水左高右低,则加入的物质是( )
③U形管内液面无明显变化,则加入的物质是( )
A.食盐固体 B.硝酸铵固体 C.氢氧化钠固体
D.浓硫酸 E.氧化钙粉末
CDE
B
A
评价练习2
学习任务三 溶液在生活及生产中的应用
(溶液对于自然界中的生命活动和人类生产活动具有重要的意义)
动植物生命活动的需要
医疗上有广泛的应用
许多科学实验都需要在溶液中进行
学习溶液的意义
溶质
被 溶 解
的 物 质
一种或
几种物质
分 散 到
另一种 物 质
溶剂
均一、稳 定
的 混 合 物
溶液
能溶解其他
物质的物质
基本特征
用途
化学实验、无土栽培、医疗等
溶质、溶剂的判断方法
固液混合固为质 气液混合气为质
液液混合少为质
有水存在水为剂
课堂小结 归纳提升
课程结束了,祝学习进步哦!
食盐溶于水时,在水分子的作用下,氯离子和钠离子向水中扩散,所以食盐颗粒消失了;离子很小,(一般小于10-9m)在水中跟水分子一起不停的运动,均匀的分散到水中, 因此食盐水中各部分都是一样咸的,即食盐溶液具有均一性;同时如果水分子不减少(宏观上水不减少),则微粒的共同运动就不会停止,那么食盐就不会从水中自动分离出来,即食盐溶液具有稳定性。
氯化钠溶液形成的微观过程
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}悬浊液
乳浊液
(固体小颗粒悬浮在水中)
(液体小颗粒悬浮在水中)
浊液不具有均一性和稳定性
海水
河水
湖水
泉水
清澈透明的海水、河水、湖水、泉水等天然水是纯净物吗?为什么?
1.通过实验探究及微观分析,认识溶解现象,总结归纳溶液的概念、组成和特征,能判断溶液中的溶质和溶剂;
2.通过实验探究氢氧化钠和硝酸铵等物质溶解于水时的温度变化,知道物质溶解过程中的能量变化及其产生的原因;
3.通过自学探究,能说出溶液在生产、生活中的重要应用价值。
学习目标
学习任务一 溶解的过程
在一只盛有约50mL水的烧杯中,加入一小匙食盐(主要成分是氯化钠),用玻璃棒搅拌。仔细观察发生的变化,直至食盐颗粒在水中消失。触摸烧杯,感受温度是否变化。
氯化钠
水
氯化钠溶液
观察思考——食盐的溶解
思考:
1.食盐颗粒为什么不见了?
2.烧杯中食盐水的上部、中部、下部,任一处,是否一样咸?
3.如果把上述食盐水密封,保存一个月,一 年,两年……你猜测食盐会不会从水中分离出来?
归纳总结溶液的定义、组成和基本特征
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}重要知
识点序号
知识点标题
知识点具体内容
1
溶液定义
2
溶液组成
3
溶液特征
一种或几种物质分散到另一种物质里,形成均一、稳定的混合物。
溶质:被溶解的物质。(可以是一种或几种,例如啤酒)
溶剂:起溶解作用的物质。(溶液中只能有一种)
均一性:溶液各部分的性质相同,溶液各处的浓稀、密度相同。
稳定性:条件不变时,溶质与溶剂长期不会分离。
(浊液不具有均一性和稳定性)
关于溶液的易混淆点辨析
1.均一、稳定的液体一定是溶液吗?
2.溶液一定是液体吗?
3.溶液一定是无色的吗?
——水、酒精等纯净物不是溶液。
——只要符合均一、稳定、混合物都是溶液,如空气、合金。
蓝色
硫酸铜溶液
浅绿色
硫酸亚铁溶液
黄色
氯化铁溶液
紫红色
高锰酸钾溶液
——不一定,有些化学试剂有颜色、生活中也有很多有颜色的溶液。
关于溶液组成的定性研究
{5940675A-B579-460E-94D1-54222C63F5DA}固体、气体溶于液体
液体溶于液体时 (没有水)
只要有水的溶液
不指明溶剂时
1.溶液中溶质和溶剂的判断:
固体气体是溶质
液体是溶剂
量少的是溶质
量多的是溶剂
水为溶剂
水为溶剂
固液混合固为质;
气液混合气为质;
液液混合少为质;
有水存在水为剂。
巧记方法
关于溶液组成的定性研究
2.溶液的命名(同时根据名称可判断溶液中的溶质和溶剂):
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}全称
简称(溶剂为水)
(溶质)的(溶剂)溶液
(溶质)溶液
例如:硫酸铜的水溶液
溶质为 ;
溶剂为 。
例如:硫酸铜溶液
溶质为 ;
溶剂为 。
硫酸铜
水
硫酸铜
水
评价练习1
1.下列关于溶液的说法正确的是( )
A.均一、稳定的液体都是溶液 B.溶液是均一、稳定的纯净物
C.溶液都是无色透明的液体 D.溶液是均一、稳定的混合物
D
2.请填写下列溶液中溶质和溶剂名称。
{16D9F66E-5EB9-4882-86FB-DCBF35E3C3E4}溶液
生理盐水
白酒
碘酒
氢氧化
钠溶液
氯化氢的
水溶液
白磷的二硫化碳溶液
溶质
溶剂
氯化钠
水
水
水
水
酒精
碘
酒精
氢氧化钠
氯化氢气体
白磷
二硫化碳
学习任务二 物质溶解时溶液温度变化
活动探究——物质溶解时溶液温度的变化
{21E4AEA4-8DFA-4A89-87EB-49C32662AFE0}实验操作
数据结论
测水温
加氯化钠,测氯化钠溶液温度
加硝酸铵,测硝酸铵溶液温度
加氢氧化钠,测氢氧化钠溶液温度
22℃
22℃ 不变
19℃ 降低
33.8℃ 升高
{5940675A-B579-460E-94D1-54222C63F5DA}溶解
微观探秘——物质溶于水时溶液温度变化的原因
扩散过程:溶质分子(或离子)扩散到水分子中去----吸收热量
水合过程:水分子结合溶质分子(或离子)
----放出热量
①Q吸 = Q放,溶液温度 , 。
②Q吸 > Q放,溶液温度 , 。
③Q吸 < Q放,溶液温度 , 。
降低
升高
不变
同时进行
如:硝酸铵
如:氢氧化钠、浓硫酸
如:氯化钠
1.原来U型管内两臂在同一水平上的红墨水。如下图向试管里的水中加入某种物质后:
①U形管内红墨水左低右高,则加入的物质是( )
②U形管内红墨水左高右低,则加入的物质是( )
③U形管内液面无明显变化,则加入的物质是( )
A.食盐固体 B.硝酸铵固体 C.氢氧化钠固体
D.浓硫酸 E.氧化钙粉末
CDE
B
A
评价练习2
学习任务三 溶液在生活及生产中的应用
(溶液对于自然界中的生命活动和人类生产活动具有重要的意义)
动植物生命活动的需要
医疗上有广泛的应用
许多科学实验都需要在溶液中进行
学习溶液的意义
溶质
被 溶 解
的 物 质
一种或
几种物质
分 散 到
另一种 物 质
溶剂
均一、稳 定
的 混 合 物
溶液
能溶解其他
物质的物质
基本特征
用途
化学实验、无土栽培、医疗等
溶质、溶剂的判断方法
固液混合固为质 气液混合气为质
液液混合少为质
有水存在水为剂
课堂小结 归纳提升
课程结束了,祝学习进步哦!
食盐溶于水时,在水分子的作用下,氯离子和钠离子向水中扩散,所以食盐颗粒消失了;离子很小,(一般小于10-9m)在水中跟水分子一起不停的运动,均匀的分散到水中, 因此食盐水中各部分都是一样咸的,即食盐溶液具有均一性;同时如果水分子不减少(宏观上水不减少),则微粒的共同运动就不会停止,那么食盐就不会从水中自动分离出来,即食盐溶液具有稳定性。
氯化钠溶液形成的微观过程
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}悬浊液
乳浊液
(固体小颗粒悬浮在水中)
(液体小颗粒悬浮在水中)
浊液不具有均一性和稳定性
同课章节目录
