3.1.2 铁的氢氧化物 铁盐和亚铁盐 课时同步练(含解析)人教版(2019) 必修 第一册
文档属性
| 名称 | 3.1.2 铁的氢氧化物 铁盐和亚铁盐 课时同步练(含解析)人教版(2019) 必修 第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 258.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-05 17:11:23 | ||
图片预览


文档简介
第2课时 铁的氢氧化物 铁盐和亚铁盐
◆ 知识点一 铁的氢氧化物
1.下列对铁元素的代表物描述错误的是 ( )
选项 代表物 类别 铁元素 价态 部分性质描述
A Fe3O4 氧化物 +1价 具有磁性的黑色晶体
B Fe(OH)2 碱 +2价 白色,易被氧化
C Fe(OH)3 碱 +3价 红褐色,加热失去水生成红棕色粉末
D FeCl3 盐 +3价 FeCl3溶液中的Fe3+能被Fe还原成Fe2+
2.下列关于氢氧化铁和氢氧化亚铁的叙述中正确的是( )
A.向FeCl2溶液中加入NaOH溶液即可制得纯净的Fe(OH)2
B.Fe(OH)2在空气中加热,可得到FeO
C.隔绝空气的条件下,向FeCl2溶液中加入Na2O2后得到红褐色沉淀Fe(OH)3
D.Fe2O3不与水反应生成Fe(OH)3,所以不能通过化合反应得到Fe(OH)3
3. 在实验室里用以下方法制备并较长时间保存Fe(OH)2,能成功的是 ( )
A B
C D
4.实验室用FeCl2和烧碱制备Fe(OH)2,为使生成的产物不被氧化,下列说法错误的是 ( )
A.配制FeCl2溶液和烧碱溶液所用的蒸馏水要煮沸
B.可在FeCl2溶液和烧碱溶液上面加一层苯,以隔绝空气
C.向FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴不能伸入试管中
D.产生Fe(OH)2沉淀后,不能振荡试管
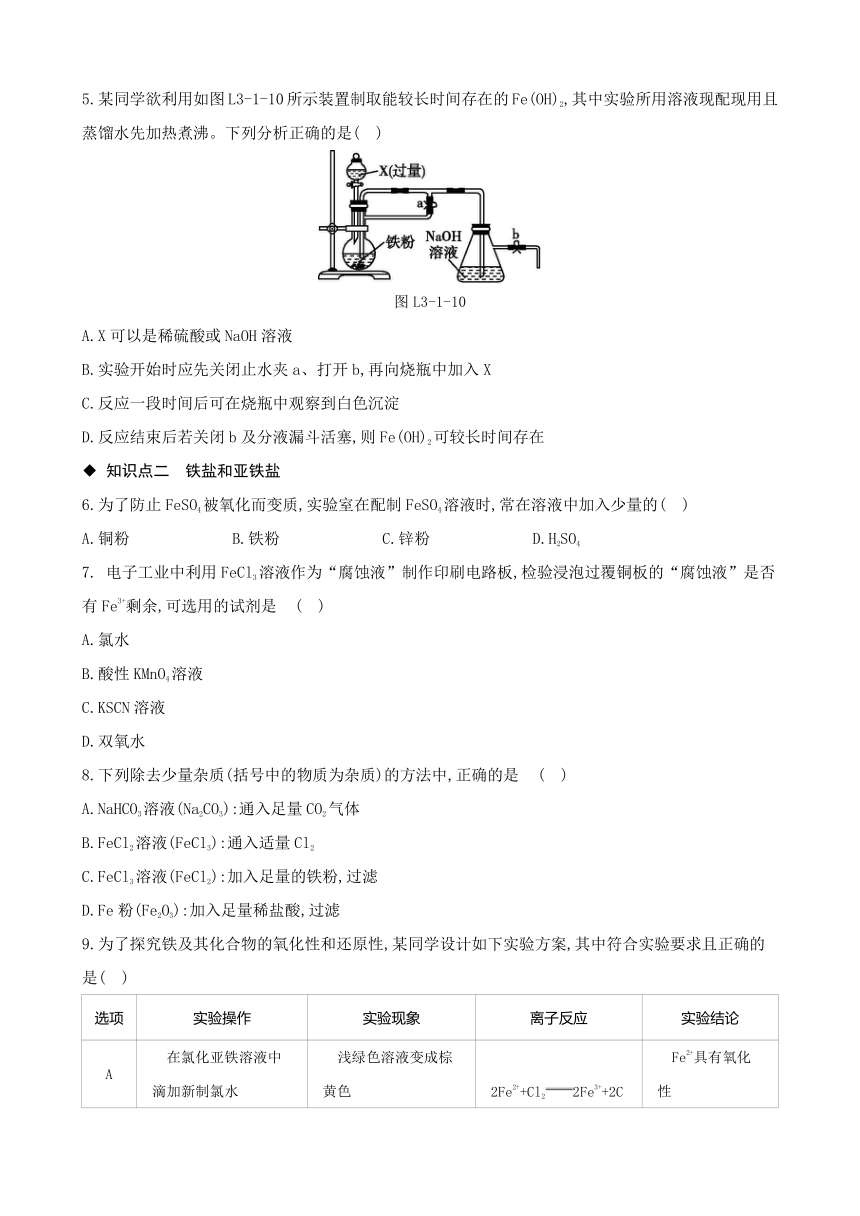
5.某同学欲利用如图L3-1-10所示装置制取能较长时间存在的Fe(OH)2,其中实验所用溶液现配现用且蒸馏水先加热煮沸。下列分析正确的是( )
图L3-1-10
A.X可以是稀硫酸或NaOH溶液
B.实验开始时应先关闭止水夹a、打开b,再向烧瓶中加入X
C.反应一段时间后可在烧瓶中观察到白色沉淀
D.反应结束后若关闭b及分液漏斗活塞,则Fe(OH)2可较长时间存在
◆ 知识点二 铁盐和亚铁盐
6.为了防止FeSO4被氧化而变质,实验室在配制FeSO4溶液时,常在溶液中加入少量的 ( )
A.铜粉 B.铁粉 C.锌粉 D.H2SO4
7. 电子工业中利用FeCl3溶液作为“腐蚀液”制作印刷电路板,检验浸泡过覆铜板的“腐蚀液”是否有Fe3+剩余,可选用的试剂是 ( )
A.氯水
B.酸性KMnO4溶液
C.KSCN溶液
D.双氧水
8.下列除去少量杂质(括号中的物质为杂质)的方法中,正确的是 ( )
A.NaHCO3溶液(Na2CO3):通入足量CO2气体
B.FeCl2溶液(FeCl3):通入适量Cl2
C.FeCl3溶液(FeCl2):加入足量的铁粉,过滤
D.Fe粉(Fe2O3):加入足量稀盐酸,过滤
9.为了探究铁及其化合物的氧化性和还原性,某同学设计如下实验方案,其中符合实验要求且正确的是( )
选项 实验操作 实验现象 离子反应 实验结论
A 在氯化亚铁溶液中滴加新制氯水 浅绿色溶液变成棕黄色 溶液 2Fe2++Cl22Fe3++2Cl- Fe2+具有氧化性
B 在氯化亚铁溶液中加入铜片 浅绿色溶液变成蓝色溶液 Fe2++CuFe+Cu2+ 铜具 有还原性
C 在氯化铁溶液中加入铁粉 棕黄色溶液变成浅绿色 溶液 2Fe3++Fe3Fe2+ 铁单质具有还原性
D 在氯化铁溶液中加入铜粉 棕黄色溶液变成蓝色溶液 2Fe3++Cu2Fe2++Cu2+ Fe3+具有还原性
10. 某化学兴趣小组在学习铁及其化合物知识时,做了如下探究实验:
图L3-1-11
下列说法不正确的是 ( )
A.现象1溶液呈淡红色,说明有少量的Fe2+被氧化了
B.现象2溶液变为红色,说明Fe2+被氧化为Fe3+,同时双氧水被还原为氧气
C.现象3溶液红色褪去,说明发生了反应:2Fe3++Fe3Fe2+
D.由现象4可推测加入过量的双氧水后SCN-可能被氧化生成了气体
11. 某兴趣小组用油性笔在一小块覆铜板上写上“化学”,然后浸入盛有FeCl3溶液的小烧杯中,过一段时间后,取出覆铜板,用水洗净并晾干(如图L3-1-12所示)。对反应后的溶液进行分析,溶液中c(Fe3+)与c(Cu2+)之比为2∶3。下列说法不正确的是 ( )
图L3-1-12
A.反应后的溶液中:c(Fe3+)∶c(Fe2+)=1∶1
B.反应的离子方程式为2Fe3++Cu2Fe2++Cu2+
C.反应后的溶液中:c(Cl-)>c(Fe2+)>c(Cu2+)>c(Fe3+)
D.反应后的溶液再生为FeCl3:加入足量铁粉,过滤,滤液中通入足量Cl2
12. 某工厂的工业废水中含有大量的Fe2+、Fe3+、Cu2+和少量Na+。工厂计划从该废水中回收硫酸亚铁和金属铜,设计如下流程。
图L3-1-13
下列说法正确的是 ( )
A.加入过量A,发生的反应均为置换反应
B.固体B为混合物而固体E为纯净物
C.物质D既可以用稀硫酸也可以用稀盐酸
D.滤液C和滤液F组成完全相同
13.某兴趣小组进行某补血剂中铁元素含量的测定实验流程如下:
补血剂10片 滤液红褐色悬浊液氧化铁固体w g
图L3-1-14
下列说法不正确的是 ( )
A.步骤①研磨时需要在烧杯中进行
B.步骤②加入氨水的作用是将Fe3+完全沉淀
C.步骤③多步操作为过滤、洗涤、灼烧至恒重、冷却称重
D.每片补血剂中铁元素的质量为0.07w g
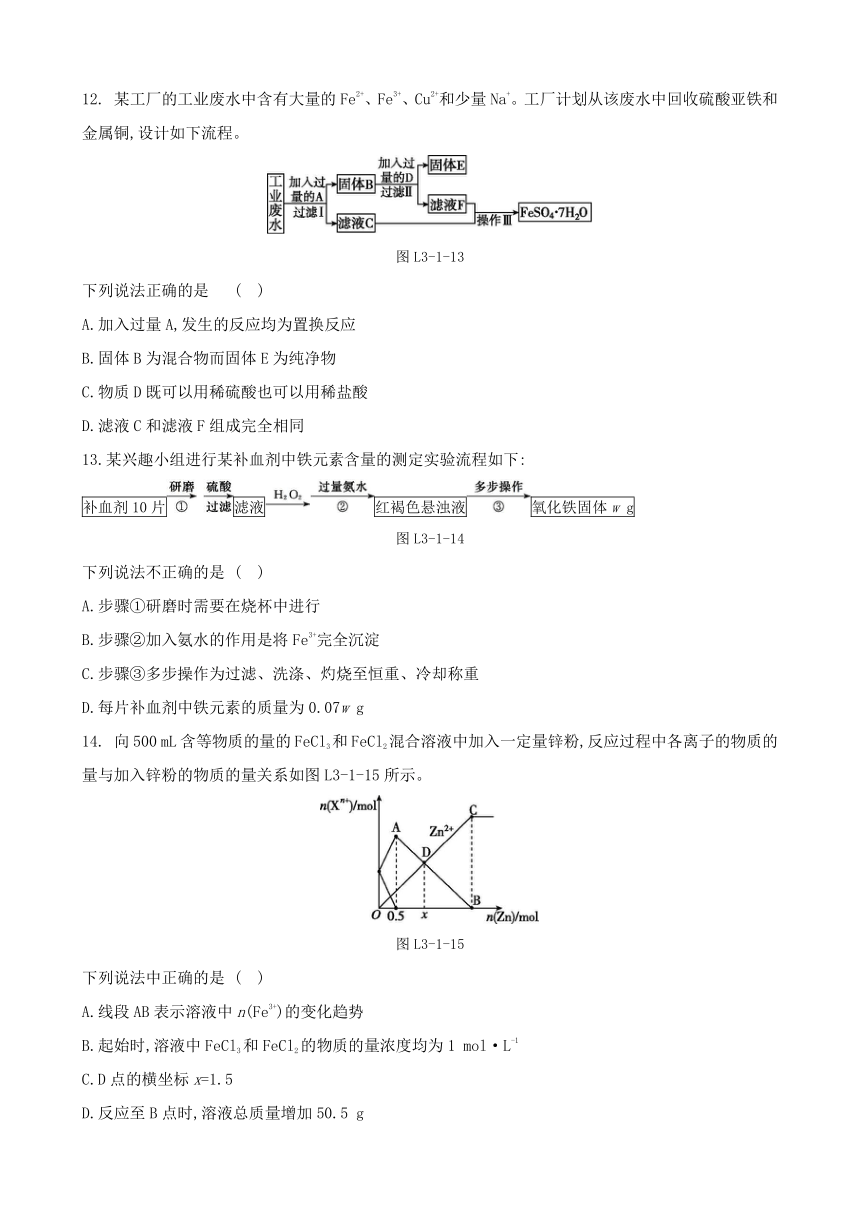
14. 向500 mL含等物质的量的FeCl3和FeCl2混合溶液中加入一定量锌粉,反应过程中各离子的物质的量与加入锌粉的物质的量关系如图L3-1-15所示。
图L3-1-15
下列说法中正确的是 ( )
A.线段AB表示溶液中n(Fe3+)的变化趋势
B.起始时,溶液中FeCl3和FeCl2的物质的量浓度均为1 mol·L-1
C.D点的横坐标x=1.5
D.反应至B点时,溶液总质量增加50.5 g
15. 碳酸亚铁与砂糖混用为补血剂。实验室用如下装置和步骤可以制备FeCO3(FeCO3易被氧化)。
图L3-1-16
步骤一:实验中先关闭活塞2,打开活塞1和3;
步骤二:一段时间后,关闭活塞3,打开活塞2,在c瓶中得到产品。
下列说法错误的是 ( )
A.步骤一的目的是排尽装置中的空气,防止Fe2+被氧化
B.步骤二可使FeSO4溶液和NH4HCO3溶液混合
C.装置c中发生反应的离子方程式为Fe2++2HCFeCO3↓+CO2↑+H2O
D.装置d的主要作用:吸收尾气,防止污染空气
16.某化学兴趣小组利用试剂铁粉、锌粉、0.1 mol·L-1 FeCl3溶液、0.1 mol·L-1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。
(1)用所给试剂写出体现Fe2+具有还原性的反应的化学方程式: 。
(2)设计实验方案,完成下列表格。
探究内容 实验方案 实验现象
探究Fe3+具有 氧化性 取少量0.1 mol·L-1 FeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液 加入铁粉后,溶液颜色变为 ,加入KSCN溶液后,溶液
(3)该兴趣小组为说明“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为 。
(4)某反应中反应物与生成物有Fe3+、Mn2+、H+、Mn、H2O和一种未知离子X。
①已知Mn在反应中得到电子,则X是 。
②该反应的离子方程式是 。
17.利用“价—类”二维图研究物质的性质是一种有效的学习方法。铁及其部分化合物的“价—类”二维图如图L3-1-17所示。
图L3-1-17
(1)X、Y的化学式分别为 、 。
(2)图中只具有还原性的物质是 (填化学式)。
(3)要证明FeCl2既有氧化性又有还原性的试剂分别为 、 。
(4)某实验小组设计如下实验探究亚铁盐的性质。
实验 操作 现象
Ⅰ 1.0 mL 0.1 mol·L-1 FeSO4溶液中滴入1.0 mL 0.5 mol·L-1 NaOH溶液 生成白色沉淀,3 min后沉淀基本变为红褐色
Ⅱ 1.0 mL 0.1 mol·L-1 FeSO4溶液中滴入1.0 mL 0.5 mol·L-1 NaHCO3溶液 生成白色沉淀,3 min后沉淀颜色几乎不变
①对实验Ⅱ所得白色沉淀进行研究[已知Fe(HCO3)2在水中不能大量存在]:
ⅰ.取Ⅱ中少量白色沉淀,充分洗涤,向其中加入稀硫酸,沉淀完全溶解,产生无色气泡;
ⅱ.向ⅰ所得溶液中滴入KSCN试剂,溶液几乎不变红;
ⅲ.向ⅱ所得溶液中再滴入少量H2O2溶液,溶液立即变为红色。
根据以上现象,实验Ⅱ中生成的白色沉淀的化学式为 。
②研究过程中发现实验Ⅱ中白色沉淀在空气中久置最终也变为红褐色。则该沉淀的还原性比实验Ⅰ中所得的Fe(OH)2的还原性 (填“强”或“弱”)。
第2课时 铁的氢氧化物 铁盐和亚铁盐
1.A [解析] Fe3O4中Fe元素显+2价和+3价,A错误。
2.C [解析] Fe(OH)2在空气中容易被氧化为Fe(OH)3,A项错误;Fe(OH)2在空气中容易被氧化为Fe(OH)3,加热时分解生成Fe2O3,B项错误;反应4Fe(OH)2+O2+2H2O4Fe(OH)3为化合反应,D项错误。
3.C [解析] NaOH溶液滴入FeSO4溶液中,二者反应生成Fe(OH)2沉淀,Fe(OH)2迅速被O2氧化,不能较长时间保存Fe(OH)2,A错误;NaOH溶液与FeCl3溶液反应生成红褐色沉淀Fe(OH)3,不能制取Fe(OH)2,B错误;先滴加稀硫酸,铁粉与稀硫酸反应生成H2,利用产生的H2排尽装置内的空气,再滴加NaOH溶液,反应生成白色沉淀Fe(OH)2,C正确;NaOH溶液通过长胶头滴管滴入FeCl2溶液中,在液体内部生成Fe(OH)2,未隔绝空气,不能较长时间保存Fe(OH)2,D错误。
4.C [解析] 向FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴伸入FeCl2溶液中,防止氢氧化钠溶液在滴入时溶解氧气,C错误,其他说法正确。
5.D [解析] Fe与NaOH溶液不发生反应,A错误;实验开始时应先打开止水夹a、b,利用生成的氢气将装置内的空气排尽,然后关闭a,B错误;利用氢气的压强将含有Fe2+的溶液排入锥形瓶中,OH-与Fe2+反应生成Fe(OH)2,应在锥形瓶中观察到白色沉淀,C错误;反应结束后若关闭b及分液漏斗活塞,装置内空气及溶液中氧气均已除去,则Fe(OH)2可较长时间存在,D正确。
6.B [解析] FeSO4具有还原性,极易被空气中的氧气氧化而生成Fe2(SO4)3,为防止亚铁离子被氧化,应该加入具有还原性的物质,且不能引进新的杂质。
7.C [解析] 检验“腐蚀液”中是否有Fe3+剩余,可滴加KSCN溶液,若溶液变为红色,则说明有Fe3+剩余,若不变色,则Fe3+无剩余。
8.A [解析] 除去NaHCO3溶液中少量Na2CO3,通入足量CO2气体,Na2CO3转化为NaHCO3,A正确;除去FeCl2溶液中少量FeCl3,要加入足量的铁粉,过滤,B错误;除去FeCl3溶液中少量FeCl2,要通入适量Cl2,或滴加适量氯水,C错误;Fe、Fe2O3都能与稀盐酸发生反应,不符合除杂要求,D错误。
9.C [解析] A项中Fe2+体现还原性,A项错误;B项反应不能发生,错误;C项正确;D项中体现Fe3+的氧化性,D项错误。
10.B [解析] 氯化亚铁溶液中滴加KSCN溶液,溶液呈淡红色,说明该溶液中含少量Fe3+,有少量的Fe2+被氧化,A正确;若H2O2被还原,则O元素化合价降低,不可能生成O2,B错误;加入过量铁粉,发生反应:2Fe3++Fe3Fe2+,溶液的红色褪去,C 正确;加入过量双氧水,可能是过量H2O2将SCN-氧化生成气体,溶液变为黄色,有少量气泡产生,D正确。
11.A [解析] FeCl3溶液腐蚀覆铜板发生反应:2FeCl3+Cu2FeCl2+CuCl2,离子方程式为2Fe3++Cu2Fe2++Cu2+,B正确;测得溶液中c(Fe3+)∶c(Cu2+)=2∶3,结合反应推知,溶液中c(Fe2+)∶c(Cu2+)=2∶1,从而推知溶液中c(Fe3+)∶c(Fe2+)=1∶3,A错误;结合A项分析可知,反应后的溶液中:c(Cl-)>c(Fe2+)>c(Cu2+)>c(Fe3+),C正确;反应后的溶液中含有FeCl2、CuCl2、FeCl3,加入足量铁粉置换出Cu,过滤,滤液中通入足量Cl2,将FeCl2氧化生成FeCl3,实现腐蚀液的再生,D正确。
12.B [解析] 从废水中回收硫酸亚铁和金属铜,加入过量铁粉,将Cu2+还原生成Cu,Fe3+与Fe反应生成Fe2+,发生置换反应和化合反应,A错误;固体B为Fe和Cu的混合物,加入过量稀硫酸溶解Fe生成FeSO4,过滤得到的固体E是Cu,B正确;最终制得FeSO4·7H2O,故物质D只能是稀硫酸,不能用稀盐酸,C错误;滤液C含FeSO4和Na2SO4(少量),滤液F中含有FeSO4和过量的硫酸,二者组成不相同,D错误。
13.A [解析] 研磨补血剂要在研钵中进行,A错误;向滤液中加入H2O2将Fe2+氧化成Fe3+,再加入过量氨水生成Fe(OH)3红褐色沉淀,B正确;Fe(OH)3悬浊液经过滤、洗涤、灼烧分解得到Fe2O3固体,冷却后称重得到氧化铁的质量,C正确;w g 氧化铁中含Fe元素的质量为 g,则每片补血剂中铁元素的质量为 g=0.07w g,D正确。
14.D [解析] 氯化铁的氧化性强于氯化亚铁,则氯化亚铁和氯化铁混合溶液中加入一定量锌粉时,氯化铁优先与锌反应生成亚铁离子和锌离子,反应的离子方程式为2Fe3++Zn2Fe2++Zn2+,溶液中铁离子浓度减小、亚铁离子浓度增大,由图可知,加入Zn为0.5 mol时,铁离子和锌恰好完全反应,则混合溶液中铁离子和亚铁离子的物质的量都为0.5 mol×2=1 mol;当铁离子完全反应后,亚铁离子与锌发生置换反应生成铁和锌离子,反应的离子方程式为Fe2++ZnFe+Zn2+,溶液中亚铁离子浓度减小,线段AB表示溶液中亚铁离子的物质的量的变化趋势,B点时,亚铁离子和锌恰好完全反应,AB段反应消耗Zn的物质的量为2 mol,则B点的横坐标为2.5。由分析可知,线段AB表示溶液中亚铁离子的物质的量的变化趋势,故A错误;由分析可知,混合溶液中铁离子和亚铁离子的物质的量都为1 mol,则起始时,溶液中氯化铁和氯化亚铁的浓度均为=2 mol·L-1,故B错误;由分析可知,加入Zn为0.5 mol时,溶液中亚铁离子的物质的量为2 mol,设AD段消耗Zn为a mol,由图可得2 mol-a mol=0.5 mol+a mol,解得a=0.75,则D点的横坐标x=1.25,故C错误;由分析可知,B点时,亚铁离子和锌恰好完全反应,溶液增加的质量为65 g·mol-1×2.5 mol-56 g·mol-1×2 mol=50.5 g,故D正确。
15.D [解析] 先关闭活塞2,打开活塞1和3,利用稀硫酸与Fe反应产生的H2排尽装置内的空气,防止生成的FeCO3被氧化,A正确;一段时间后,关闭活塞3,打开活塞2,蒸馏烧瓶中生成的FeSO4溶液被压入装置c中,FeSO4溶液和NH4HCO3溶液混合生成FeCO3:Fe2++2HCFeCO3↓+CO2↑+H2O,B、C正确;装置d中可以是水,其作用是液封,防止空气进入装置c使FeCO3被氧化,D错误。
16.(1)2FeCl2+Cl22FeCl3 (2)浅绿色 不变色 (3)Fe2++ZnZn2++Fe
(4)①Fe2+ ②Mn+5Fe2++8H+Mn2++5Fe3++4H2O
[解析] (1)在反应中Fe2+作还原剂,体现其还原性,因此应选择氧化剂,所以选用氯水,反应的化学方程式为2FeCl2+Cl22FeCl3。(2)向FeCl3溶液中加入铁粉,发生的反应为2Fe3++Fe3Fe2+,所以溶液由黄色变为浅绿色。向FeCl2溶液中滴加KSCN溶液不变色。(3)向FeCl2溶液中加入锌粉,离子方程式为Zn+Fe2+Fe+Zn2+。(4)已知Mn得电子,故Mn是氧化剂,Mn2+为还原产物,则题目提供的Fe3+是氧化产物,故还原剂为Fe2+,即X为Fe2+。该反应中反应物为Mn、Fe2+和H+,生成物为Mn2+、Fe3+和H2O,n(Mn)∶n(Fe2+)=1∶5。
17.(1)Fe2O3 Fe(OH)2
(2)Fe
(3)锌(或铝等) 新制氯水(或酸性KMnO4溶液等氧化性较强的物质)
(4)①FeCO3 ②弱
[解析] (1)由图可知,X是Fe元素化合价为+3价的氧化物,则X是Fe2O3;Y是Fe元素化合价为+2价的碱,则Y是Fe(OH)2。(2)单质Fe为铁元素的最低价态,化合价只能升高,只具有还原性。(3)要证明FeCl2具有氧化性,则需使用还原剂,如锌、铝等还原性较强的金属;要证明FeCl2具有还原性,则需使用氧化剂,如新制氯水、酸性KMnO4溶液等氧化性较强的物质。(4)①由ⅱ、ⅲ的现象可知该白色沉淀中含+2价铁,结合已知条件Fe(HCO3)2在水中不能大量存在及ⅰ中加稀硫酸产生无色气泡,可推知该白色沉淀是FeCO3;②FeCO3在空气中久置变为红褐色,证明FeCO3中的Fe元素从+2价被氧化到+3价,但被氧化所需时间比Fe(OH)2被氧化所需时间长,即FeCO3比Fe(OH)2难被氧化,所以FeCO3的还原性比Fe(OH)2的还原性弱。
◆ 知识点一 铁的氢氧化物
1.下列对铁元素的代表物描述错误的是 ( )
选项 代表物 类别 铁元素 价态 部分性质描述
A Fe3O4 氧化物 +1价 具有磁性的黑色晶体
B Fe(OH)2 碱 +2价 白色,易被氧化
C Fe(OH)3 碱 +3价 红褐色,加热失去水生成红棕色粉末
D FeCl3 盐 +3价 FeCl3溶液中的Fe3+能被Fe还原成Fe2+
2.下列关于氢氧化铁和氢氧化亚铁的叙述中正确的是( )
A.向FeCl2溶液中加入NaOH溶液即可制得纯净的Fe(OH)2
B.Fe(OH)2在空气中加热,可得到FeO
C.隔绝空气的条件下,向FeCl2溶液中加入Na2O2后得到红褐色沉淀Fe(OH)3
D.Fe2O3不与水反应生成Fe(OH)3,所以不能通过化合反应得到Fe(OH)3
3. 在实验室里用以下方法制备并较长时间保存Fe(OH)2,能成功的是 ( )
A B
C D
4.实验室用FeCl2和烧碱制备Fe(OH)2,为使生成的产物不被氧化,下列说法错误的是 ( )
A.配制FeCl2溶液和烧碱溶液所用的蒸馏水要煮沸
B.可在FeCl2溶液和烧碱溶液上面加一层苯,以隔绝空气
C.向FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴不能伸入试管中
D.产生Fe(OH)2沉淀后,不能振荡试管
5.某同学欲利用如图L3-1-10所示装置制取能较长时间存在的Fe(OH)2,其中实验所用溶液现配现用且蒸馏水先加热煮沸。下列分析正确的是( )
图L3-1-10
A.X可以是稀硫酸或NaOH溶液
B.实验开始时应先关闭止水夹a、打开b,再向烧瓶中加入X
C.反应一段时间后可在烧瓶中观察到白色沉淀
D.反应结束后若关闭b及分液漏斗活塞,则Fe(OH)2可较长时间存在
◆ 知识点二 铁盐和亚铁盐
6.为了防止FeSO4被氧化而变质,实验室在配制FeSO4溶液时,常在溶液中加入少量的 ( )
A.铜粉 B.铁粉 C.锌粉 D.H2SO4
7. 电子工业中利用FeCl3溶液作为“腐蚀液”制作印刷电路板,检验浸泡过覆铜板的“腐蚀液”是否有Fe3+剩余,可选用的试剂是 ( )
A.氯水
B.酸性KMnO4溶液
C.KSCN溶液
D.双氧水
8.下列除去少量杂质(括号中的物质为杂质)的方法中,正确的是 ( )
A.NaHCO3溶液(Na2CO3):通入足量CO2气体
B.FeCl2溶液(FeCl3):通入适量Cl2
C.FeCl3溶液(FeCl2):加入足量的铁粉,过滤
D.Fe粉(Fe2O3):加入足量稀盐酸,过滤
9.为了探究铁及其化合物的氧化性和还原性,某同学设计如下实验方案,其中符合实验要求且正确的是( )
选项 实验操作 实验现象 离子反应 实验结论
A 在氯化亚铁溶液中滴加新制氯水 浅绿色溶液变成棕黄色 溶液 2Fe2++Cl22Fe3++2Cl- Fe2+具有氧化性
B 在氯化亚铁溶液中加入铜片 浅绿色溶液变成蓝色溶液 Fe2++CuFe+Cu2+ 铜具 有还原性
C 在氯化铁溶液中加入铁粉 棕黄色溶液变成浅绿色 溶液 2Fe3++Fe3Fe2+ 铁单质具有还原性
D 在氯化铁溶液中加入铜粉 棕黄色溶液变成蓝色溶液 2Fe3++Cu2Fe2++Cu2+ Fe3+具有还原性
10. 某化学兴趣小组在学习铁及其化合物知识时,做了如下探究实验:
图L3-1-11
下列说法不正确的是 ( )
A.现象1溶液呈淡红色,说明有少量的Fe2+被氧化了
B.现象2溶液变为红色,说明Fe2+被氧化为Fe3+,同时双氧水被还原为氧气
C.现象3溶液红色褪去,说明发生了反应:2Fe3++Fe3Fe2+
D.由现象4可推测加入过量的双氧水后SCN-可能被氧化生成了气体
11. 某兴趣小组用油性笔在一小块覆铜板上写上“化学”,然后浸入盛有FeCl3溶液的小烧杯中,过一段时间后,取出覆铜板,用水洗净并晾干(如图L3-1-12所示)。对反应后的溶液进行分析,溶液中c(Fe3+)与c(Cu2+)之比为2∶3。下列说法不正确的是 ( )
图L3-1-12
A.反应后的溶液中:c(Fe3+)∶c(Fe2+)=1∶1
B.反应的离子方程式为2Fe3++Cu2Fe2++Cu2+
C.反应后的溶液中:c(Cl-)>c(Fe2+)>c(Cu2+)>c(Fe3+)
D.反应后的溶液再生为FeCl3:加入足量铁粉,过滤,滤液中通入足量Cl2
12. 某工厂的工业废水中含有大量的Fe2+、Fe3+、Cu2+和少量Na+。工厂计划从该废水中回收硫酸亚铁和金属铜,设计如下流程。
图L3-1-13
下列说法正确的是 ( )
A.加入过量A,发生的反应均为置换反应
B.固体B为混合物而固体E为纯净物
C.物质D既可以用稀硫酸也可以用稀盐酸
D.滤液C和滤液F组成完全相同
13.某兴趣小组进行某补血剂中铁元素含量的测定实验流程如下:
补血剂10片 滤液红褐色悬浊液氧化铁固体w g
图L3-1-14
下列说法不正确的是 ( )
A.步骤①研磨时需要在烧杯中进行
B.步骤②加入氨水的作用是将Fe3+完全沉淀
C.步骤③多步操作为过滤、洗涤、灼烧至恒重、冷却称重
D.每片补血剂中铁元素的质量为0.07w g
14. 向500 mL含等物质的量的FeCl3和FeCl2混合溶液中加入一定量锌粉,反应过程中各离子的物质的量与加入锌粉的物质的量关系如图L3-1-15所示。
图L3-1-15
下列说法中正确的是 ( )
A.线段AB表示溶液中n(Fe3+)的变化趋势
B.起始时,溶液中FeCl3和FeCl2的物质的量浓度均为1 mol·L-1
C.D点的横坐标x=1.5
D.反应至B点时,溶液总质量增加50.5 g
15. 碳酸亚铁与砂糖混用为补血剂。实验室用如下装置和步骤可以制备FeCO3(FeCO3易被氧化)。
图L3-1-16
步骤一:实验中先关闭活塞2,打开活塞1和3;
步骤二:一段时间后,关闭活塞3,打开活塞2,在c瓶中得到产品。
下列说法错误的是 ( )
A.步骤一的目的是排尽装置中的空气,防止Fe2+被氧化
B.步骤二可使FeSO4溶液和NH4HCO3溶液混合
C.装置c中发生反应的离子方程式为Fe2++2HCFeCO3↓+CO2↑+H2O
D.装置d的主要作用:吸收尾气,防止污染空气
16.某化学兴趣小组利用试剂铁粉、锌粉、0.1 mol·L-1 FeCl3溶液、0.1 mol·L-1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。
(1)用所给试剂写出体现Fe2+具有还原性的反应的化学方程式: 。
(2)设计实验方案,完成下列表格。
探究内容 实验方案 实验现象
探究Fe3+具有 氧化性 取少量0.1 mol·L-1 FeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液 加入铁粉后,溶液颜色变为 ,加入KSCN溶液后,溶液
(3)该兴趣小组为说明“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为 。
(4)某反应中反应物与生成物有Fe3+、Mn2+、H+、Mn、H2O和一种未知离子X。
①已知Mn在反应中得到电子,则X是 。
②该反应的离子方程式是 。
17.利用“价—类”二维图研究物质的性质是一种有效的学习方法。铁及其部分化合物的“价—类”二维图如图L3-1-17所示。
图L3-1-17
(1)X、Y的化学式分别为 、 。
(2)图中只具有还原性的物质是 (填化学式)。
(3)要证明FeCl2既有氧化性又有还原性的试剂分别为 、 。
(4)某实验小组设计如下实验探究亚铁盐的性质。
实验 操作 现象
Ⅰ 1.0 mL 0.1 mol·L-1 FeSO4溶液中滴入1.0 mL 0.5 mol·L-1 NaOH溶液 生成白色沉淀,3 min后沉淀基本变为红褐色
Ⅱ 1.0 mL 0.1 mol·L-1 FeSO4溶液中滴入1.0 mL 0.5 mol·L-1 NaHCO3溶液 生成白色沉淀,3 min后沉淀颜色几乎不变
①对实验Ⅱ所得白色沉淀进行研究[已知Fe(HCO3)2在水中不能大量存在]:
ⅰ.取Ⅱ中少量白色沉淀,充分洗涤,向其中加入稀硫酸,沉淀完全溶解,产生无色气泡;
ⅱ.向ⅰ所得溶液中滴入KSCN试剂,溶液几乎不变红;
ⅲ.向ⅱ所得溶液中再滴入少量H2O2溶液,溶液立即变为红色。
根据以上现象,实验Ⅱ中生成的白色沉淀的化学式为 。
②研究过程中发现实验Ⅱ中白色沉淀在空气中久置最终也变为红褐色。则该沉淀的还原性比实验Ⅰ中所得的Fe(OH)2的还原性 (填“强”或“弱”)。
第2课时 铁的氢氧化物 铁盐和亚铁盐
1.A [解析] Fe3O4中Fe元素显+2价和+3价,A错误。
2.C [解析] Fe(OH)2在空气中容易被氧化为Fe(OH)3,A项错误;Fe(OH)2在空气中容易被氧化为Fe(OH)3,加热时分解生成Fe2O3,B项错误;反应4Fe(OH)2+O2+2H2O4Fe(OH)3为化合反应,D项错误。
3.C [解析] NaOH溶液滴入FeSO4溶液中,二者反应生成Fe(OH)2沉淀,Fe(OH)2迅速被O2氧化,不能较长时间保存Fe(OH)2,A错误;NaOH溶液与FeCl3溶液反应生成红褐色沉淀Fe(OH)3,不能制取Fe(OH)2,B错误;先滴加稀硫酸,铁粉与稀硫酸反应生成H2,利用产生的H2排尽装置内的空气,再滴加NaOH溶液,反应生成白色沉淀Fe(OH)2,C正确;NaOH溶液通过长胶头滴管滴入FeCl2溶液中,在液体内部生成Fe(OH)2,未隔绝空气,不能较长时间保存Fe(OH)2,D错误。
4.C [解析] 向FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴伸入FeCl2溶液中,防止氢氧化钠溶液在滴入时溶解氧气,C错误,其他说法正确。
5.D [解析] Fe与NaOH溶液不发生反应,A错误;实验开始时应先打开止水夹a、b,利用生成的氢气将装置内的空气排尽,然后关闭a,B错误;利用氢气的压强将含有Fe2+的溶液排入锥形瓶中,OH-与Fe2+反应生成Fe(OH)2,应在锥形瓶中观察到白色沉淀,C错误;反应结束后若关闭b及分液漏斗活塞,装置内空气及溶液中氧气均已除去,则Fe(OH)2可较长时间存在,D正确。
6.B [解析] FeSO4具有还原性,极易被空气中的氧气氧化而生成Fe2(SO4)3,为防止亚铁离子被氧化,应该加入具有还原性的物质,且不能引进新的杂质。
7.C [解析] 检验“腐蚀液”中是否有Fe3+剩余,可滴加KSCN溶液,若溶液变为红色,则说明有Fe3+剩余,若不变色,则Fe3+无剩余。
8.A [解析] 除去NaHCO3溶液中少量Na2CO3,通入足量CO2气体,Na2CO3转化为NaHCO3,A正确;除去FeCl2溶液中少量FeCl3,要加入足量的铁粉,过滤,B错误;除去FeCl3溶液中少量FeCl2,要通入适量Cl2,或滴加适量氯水,C错误;Fe、Fe2O3都能与稀盐酸发生反应,不符合除杂要求,D错误。
9.C [解析] A项中Fe2+体现还原性,A项错误;B项反应不能发生,错误;C项正确;D项中体现Fe3+的氧化性,D项错误。
10.B [解析] 氯化亚铁溶液中滴加KSCN溶液,溶液呈淡红色,说明该溶液中含少量Fe3+,有少量的Fe2+被氧化,A正确;若H2O2被还原,则O元素化合价降低,不可能生成O2,B错误;加入过量铁粉,发生反应:2Fe3++Fe3Fe2+,溶液的红色褪去,C 正确;加入过量双氧水,可能是过量H2O2将SCN-氧化生成气体,溶液变为黄色,有少量气泡产生,D正确。
11.A [解析] FeCl3溶液腐蚀覆铜板发生反应:2FeCl3+Cu2FeCl2+CuCl2,离子方程式为2Fe3++Cu2Fe2++Cu2+,B正确;测得溶液中c(Fe3+)∶c(Cu2+)=2∶3,结合反应推知,溶液中c(Fe2+)∶c(Cu2+)=2∶1,从而推知溶液中c(Fe3+)∶c(Fe2+)=1∶3,A错误;结合A项分析可知,反应后的溶液中:c(Cl-)>c(Fe2+)>c(Cu2+)>c(Fe3+),C正确;反应后的溶液中含有FeCl2、CuCl2、FeCl3,加入足量铁粉置换出Cu,过滤,滤液中通入足量Cl2,将FeCl2氧化生成FeCl3,实现腐蚀液的再生,D正确。
12.B [解析] 从废水中回收硫酸亚铁和金属铜,加入过量铁粉,将Cu2+还原生成Cu,Fe3+与Fe反应生成Fe2+,发生置换反应和化合反应,A错误;固体B为Fe和Cu的混合物,加入过量稀硫酸溶解Fe生成FeSO4,过滤得到的固体E是Cu,B正确;最终制得FeSO4·7H2O,故物质D只能是稀硫酸,不能用稀盐酸,C错误;滤液C含FeSO4和Na2SO4(少量),滤液F中含有FeSO4和过量的硫酸,二者组成不相同,D错误。
13.A [解析] 研磨补血剂要在研钵中进行,A错误;向滤液中加入H2O2将Fe2+氧化成Fe3+,再加入过量氨水生成Fe(OH)3红褐色沉淀,B正确;Fe(OH)3悬浊液经过滤、洗涤、灼烧分解得到Fe2O3固体,冷却后称重得到氧化铁的质量,C正确;w g 氧化铁中含Fe元素的质量为 g,则每片补血剂中铁元素的质量为 g=0.07w g,D正确。
14.D [解析] 氯化铁的氧化性强于氯化亚铁,则氯化亚铁和氯化铁混合溶液中加入一定量锌粉时,氯化铁优先与锌反应生成亚铁离子和锌离子,反应的离子方程式为2Fe3++Zn2Fe2++Zn2+,溶液中铁离子浓度减小、亚铁离子浓度增大,由图可知,加入Zn为0.5 mol时,铁离子和锌恰好完全反应,则混合溶液中铁离子和亚铁离子的物质的量都为0.5 mol×2=1 mol;当铁离子完全反应后,亚铁离子与锌发生置换反应生成铁和锌离子,反应的离子方程式为Fe2++ZnFe+Zn2+,溶液中亚铁离子浓度减小,线段AB表示溶液中亚铁离子的物质的量的变化趋势,B点时,亚铁离子和锌恰好完全反应,AB段反应消耗Zn的物质的量为2 mol,则B点的横坐标为2.5。由分析可知,线段AB表示溶液中亚铁离子的物质的量的变化趋势,故A错误;由分析可知,混合溶液中铁离子和亚铁离子的物质的量都为1 mol,则起始时,溶液中氯化铁和氯化亚铁的浓度均为=2 mol·L-1,故B错误;由分析可知,加入Zn为0.5 mol时,溶液中亚铁离子的物质的量为2 mol,设AD段消耗Zn为a mol,由图可得2 mol-a mol=0.5 mol+a mol,解得a=0.75,则D点的横坐标x=1.25,故C错误;由分析可知,B点时,亚铁离子和锌恰好完全反应,溶液增加的质量为65 g·mol-1×2.5 mol-56 g·mol-1×2 mol=50.5 g,故D正确。
15.D [解析] 先关闭活塞2,打开活塞1和3,利用稀硫酸与Fe反应产生的H2排尽装置内的空气,防止生成的FeCO3被氧化,A正确;一段时间后,关闭活塞3,打开活塞2,蒸馏烧瓶中生成的FeSO4溶液被压入装置c中,FeSO4溶液和NH4HCO3溶液混合生成FeCO3:Fe2++2HCFeCO3↓+CO2↑+H2O,B、C正确;装置d中可以是水,其作用是液封,防止空气进入装置c使FeCO3被氧化,D错误。
16.(1)2FeCl2+Cl22FeCl3 (2)浅绿色 不变色 (3)Fe2++ZnZn2++Fe
(4)①Fe2+ ②Mn+5Fe2++8H+Mn2++5Fe3++4H2O
[解析] (1)在反应中Fe2+作还原剂,体现其还原性,因此应选择氧化剂,所以选用氯水,反应的化学方程式为2FeCl2+Cl22FeCl3。(2)向FeCl3溶液中加入铁粉,发生的反应为2Fe3++Fe3Fe2+,所以溶液由黄色变为浅绿色。向FeCl2溶液中滴加KSCN溶液不变色。(3)向FeCl2溶液中加入锌粉,离子方程式为Zn+Fe2+Fe+Zn2+。(4)已知Mn得电子,故Mn是氧化剂,Mn2+为还原产物,则题目提供的Fe3+是氧化产物,故还原剂为Fe2+,即X为Fe2+。该反应中反应物为Mn、Fe2+和H+,生成物为Mn2+、Fe3+和H2O,n(Mn)∶n(Fe2+)=1∶5。
17.(1)Fe2O3 Fe(OH)2
(2)Fe
(3)锌(或铝等) 新制氯水(或酸性KMnO4溶液等氧化性较强的物质)
(4)①FeCO3 ②弱
[解析] (1)由图可知,X是Fe元素化合价为+3价的氧化物,则X是Fe2O3;Y是Fe元素化合价为+2价的碱,则Y是Fe(OH)2。(2)单质Fe为铁元素的最低价态,化合价只能升高,只具有还原性。(3)要证明FeCl2具有氧化性,则需使用还原剂,如锌、铝等还原性较强的金属;要证明FeCl2具有还原性,则需使用氧化剂,如新制氯水、酸性KMnO4溶液等氧化性较强的物质。(4)①由ⅱ、ⅲ的现象可知该白色沉淀中含+2价铁,结合已知条件Fe(HCO3)2在水中不能大量存在及ⅰ中加稀硫酸产生无色气泡,可推知该白色沉淀是FeCO3;②FeCO3在空气中久置变为红褐色,证明FeCO3中的Fe元素从+2价被氧化到+3价,但被氧化所需时间比Fe(OH)2被氧化所需时间长,即FeCO3比Fe(OH)2难被氧化,所以FeCO3的还原性比Fe(OH)2的还原性弱。
