【核心素养】7.1 物质的溶解--科粤版(2024)九年级化学下册课件
文档属性
| 名称 | 【核心素养】7.1 物质的溶解--科粤版(2024)九年级化学下册课件 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-07 22:29:55 | ||
图片预览






文档简介
(共25张PPT)
第七单元 溶液
物质的溶解 第1课时
(科粤版)九年级
下
01
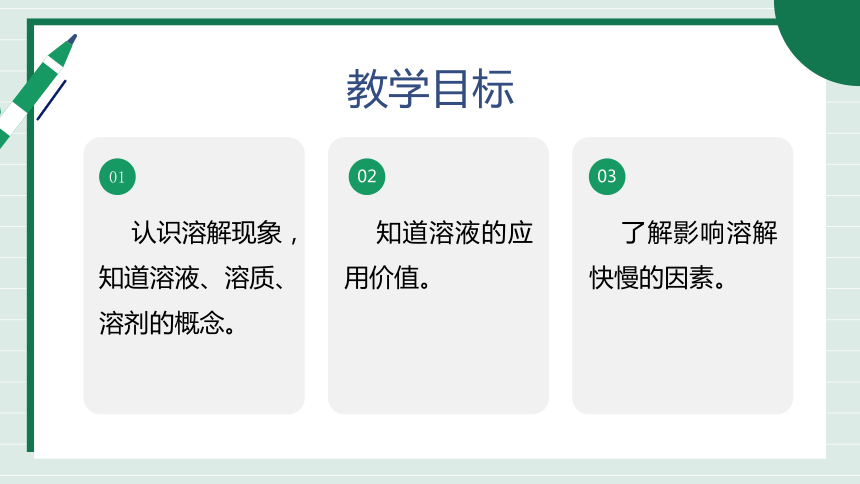
教学目标
内容总览
02
新知导入
03
探究新知
04
课堂练习
05
课堂总结
06
板书设计
教学目标
认识溶解现象,知道溶液、溶质、溶剂的概念。
01
02
知道溶液的应用价值。
03
了解影响溶解快慢的因素。
新知导入
新知导入
在寒冷的冬季,水易结成冰,而食盐水、食醋不易结冰,这是为什么?
探究新知
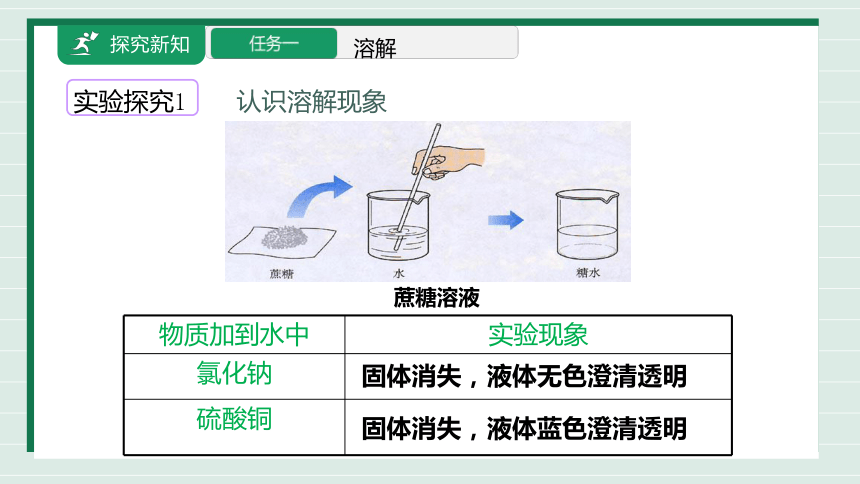
溶解
实验探究1 认识溶解现象
蔗糖溶液
物质加到水中 实验现象
氯化钠
硫酸铜
固体消失,液体无色澄清透明
固体消失,液体蓝色澄清透明
探究新知
溶解
1.溶液:由一种或一种以上的物质分散到另一种物质中所形成的均一而稳定的混合物。
溶液特性:均一性、稳定性。
2.溶剂:能溶解其他物质的物质。
3.溶质:被溶解的物质。
讨论:在上面的实验探究中,哪一个是溶液,溶液中的溶质和溶剂分别是什么?
探究新知
1. 均一、稳定的液体一定是溶液吗?
2.溶液是否都是无色的?
3.在上述实验的所得到的硫酸铜溶液,试管上面的溶液和下面的溶液成分一样吗?
4.日常生产和生活中,常见的溶液都有哪些?你能否指出其中的溶质和溶剂?
思考
不是,如水。
不是,如实验一中的硫酸铜溶液,为蓝色。
一样,因为溶液是均一的。
如生理盐水、葡萄糖注射液、酒、醋等。
探究新知
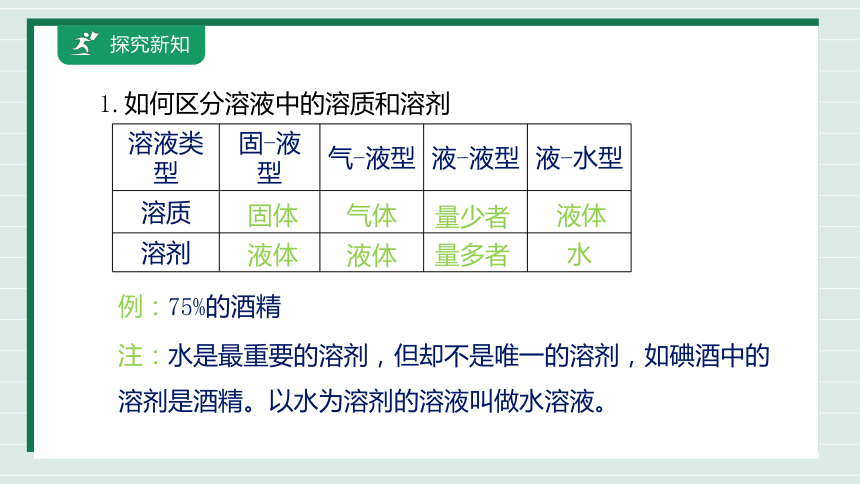
1.如何区分溶液中的溶质和溶剂
溶液类型 固-液型 气-液型 液-液型 液-水型
溶质
溶剂
固体
液体
气体
液体
量少者
量多者
液体
水
例:75%的酒精
注:水是最重要的溶剂,但却不是唯一的溶剂,如碘酒中的溶剂是酒精。以水为溶剂的溶液叫做水溶液。
探究新知
常见的有机溶剂
溶剂 用途 危险性 注意事项
酒精 配制碘酒 易燃 不可接近火源
汽油 去除油污 易燃 不可接近火源
香蕉水 配制油漆 易燃 不可接近火源
氯仿 有机玻璃的溶解与粘接 有害 不可接触眼睛
探究新知
【例1】〈湖南衡阳〉 将厨房里常用的下列四种物质分别放
入水中,不能形成溶液的是 ( )
A.白糖 B.食用油 C.味精 D.食盐
方法规律:该题利用溶液三特征分析解答。溶液是均一的、稳定的混合物。白糖、味精和食盐都能均一、稳定地分散到水中,形成混合物,即溶液,而食用油不溶于水,会浮在水面上,不均一,不是溶液。
B
探究新知
【例2】写出表 1所列溶液中溶质、溶剂的名称:
溶液 碘酒 澄清石灰水 酒精溶液 高锰酸钾溶液 盐酸
溶质
溶剂
碘
氢氧化钙
酒精
高锰酸钾
氯化氢
酒精
水
水
水
水
方法规律:该题利用口诀法解答。溶质、溶剂的判断口诀为:固气溶解液为剂;液液互溶多为剂;水多水少总为剂;不指溶剂水为剂。
课堂总结
溶液:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物,叫做溶液。
溶剂:能溶解其他物质的物质叫做溶剂。如:水
溶质:被溶解的物质叫做溶质。如:蔗糖、食盐
探究新知
溶解时的吸热或放热现象
任务二
实验探究2
分别取3g氯化钠、硝酸铵和氢氧化钠三种物质溶解于20ml水中,观察并记录加入溶质前后温度的变化。
探究新知
溶解时的吸热或放热现象
任务二
溶解物质 温度变化 溶于水时能量变化
溶解硝酸氢铵(NH4NO3)
溶解氯化钠(NaCl)
溶解氢氧化钠(NaOH)
明显下降
吸热
变化不明显
几乎不变
明显上升
放热
你的发现:
物质溶解的过程伴有热量的吸收或放出
结论:溶质溶解时,吸热和放热同时发生,只是吸收和放出的热量不同,从而使溶液的温度发生不同的变化。
探究新知
溶质溶解时为什么会放热或吸热呢?
溶质分散到溶剂中形成溶液的过程中,发生了两种变化。
①扩散过程:溶质的分子(或离子)向水中扩散,吸收热量;
②水合过程:溶质的分子(或离子)和水分子作用,生成水合分子(或水合离子),放出热量。
溶解过程中温度变化。
1.扩散过程中吸收热量>水合过程放出热量,溶液温度降低。
2.扩散过程吸收热量<水合过程中放出热量,溶液温度升高。
3.扩散过程吸收热量=水合过程放出热量,溶液温度不变。
探究新知
例题:下列物质分别放入水中,溶液温度明显降低的是( )
A.浓硫酸 B.硝酸铵
C.氧化钙 D.氢氧化钠
B
课堂总结
溶解过程
扩散过程
(吸热)
水合过程
(放热)
② 吸热 = 放热
(溶液温度不变)
例如:NaCl固体溶于水
③ 吸热<放热
(溶液温度升高)
例如:NaOH 固体和浓硫酸
(H2SO4)溶于水
① 吸热>放热
(溶液温度降低)
例如:NH4NO3固体溶于水
探究新知
实验探究3:影响溶质溶解快慢的因素
实验操作 现象 结论
溶解速率 A1____B1
溶解速率 A2____B2 溶解速率 A3____B3 <
>
>
①加热、②把固体溶质研细、③搅拌能加快溶质在溶剂里的溶解。
结论:
升高温度、颗粒越细(表面积越大)、加快搅拌
都能加快溶解速率
课堂总结
影响溶质溶解速率的因素:
1.温度、固体溶质的颗粒大小、是否搅拌等因素都会影响溶质的溶解速率。
2.通过升高温度、减小固体物质的颗粒大小、搅拌等方法能加快溶质在溶剂里的溶解速率。
课堂总结
小结
1.溶液:由一种或一种以上的物质分散到另一种物质中所形成的均一而稳定的混合物。
溶液特性:均一性、稳定性。
2.影响溶质溶解快慢的因素:①加热、②把固体溶质研细、
③搅拌能加快溶质在溶剂里的溶解。
3.物质溶解的过程伴有热量的吸收或放出
板书设计
溶质:被溶解的物质,可以是固体、液体、气体
溶剂:能溶解其他物质的物质。水是最常用的溶剂,汽油、酒精等也可以作溶剂
溶液
溶解
概念:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物特征:均一性、稳定性
吸热:一些物质溶于水后,整个过程中溶液温度降低,如NH4NO3(或硝酸铵)固体
放热:一些物质溶于水后,整个过程中溶液温度升高,如NaOH固体、浓H2SO4
吸放热不明显:多数物质溶于水后,整个过程中溶液温度变化不明显,如NaCl固体
【注意】a.氧化钙遇水放热是因为氧化钙与水反应放热。b.吸热、放热现象通常会引起密闭容器内压强的变化。
当堂小练
D
2.某一杯长期放置的食盐水,若上部的密度为a g/cm3,
则下部的密度为( )
A.大于a g/cm3 B.等于a g/cm3
C.小于a g/cm3 D.无法判断
B
1.下列液体属于溶液的是___________。(填序号)
①啤酒 ②水 ③泥水 ④澄清石灰水 ⑤盐酸
① ④ ⑤
3.下列清洗方法中,利用乳化作用的是( )
A.用自来水洗手 B.用汽油清洗油污
C.用清洗剂洗油腻的餐具 D.用盐酸清除铁锈
C
https://www.21cnjy.com/help/help_extract.php
让备课更有效
www.21cnjy.com
Thanks!
第七单元 溶液
物质的溶解 第1课时
(科粤版)九年级
下
01
教学目标
内容总览
02
新知导入
03
探究新知
04
课堂练习
05
课堂总结
06
板书设计
教学目标
认识溶解现象,知道溶液、溶质、溶剂的概念。
01
02
知道溶液的应用价值。
03
了解影响溶解快慢的因素。
新知导入
新知导入
在寒冷的冬季,水易结成冰,而食盐水、食醋不易结冰,这是为什么?
探究新知
溶解
实验探究1 认识溶解现象
蔗糖溶液
物质加到水中 实验现象
氯化钠
硫酸铜
固体消失,液体无色澄清透明
固体消失,液体蓝色澄清透明
探究新知
溶解
1.溶液:由一种或一种以上的物质分散到另一种物质中所形成的均一而稳定的混合物。
溶液特性:均一性、稳定性。
2.溶剂:能溶解其他物质的物质。
3.溶质:被溶解的物质。
讨论:在上面的实验探究中,哪一个是溶液,溶液中的溶质和溶剂分别是什么?
探究新知
1. 均一、稳定的液体一定是溶液吗?
2.溶液是否都是无色的?
3.在上述实验的所得到的硫酸铜溶液,试管上面的溶液和下面的溶液成分一样吗?
4.日常生产和生活中,常见的溶液都有哪些?你能否指出其中的溶质和溶剂?
思考
不是,如水。
不是,如实验一中的硫酸铜溶液,为蓝色。
一样,因为溶液是均一的。
如生理盐水、葡萄糖注射液、酒、醋等。
探究新知
1.如何区分溶液中的溶质和溶剂
溶液类型 固-液型 气-液型 液-液型 液-水型
溶质
溶剂
固体
液体
气体
液体
量少者
量多者
液体
水
例:75%的酒精
注:水是最重要的溶剂,但却不是唯一的溶剂,如碘酒中的溶剂是酒精。以水为溶剂的溶液叫做水溶液。
探究新知
常见的有机溶剂
溶剂 用途 危险性 注意事项
酒精 配制碘酒 易燃 不可接近火源
汽油 去除油污 易燃 不可接近火源
香蕉水 配制油漆 易燃 不可接近火源
氯仿 有机玻璃的溶解与粘接 有害 不可接触眼睛
探究新知
【例1】〈湖南衡阳〉 将厨房里常用的下列四种物质分别放
入水中,不能形成溶液的是 ( )
A.白糖 B.食用油 C.味精 D.食盐
方法规律:该题利用溶液三特征分析解答。溶液是均一的、稳定的混合物。白糖、味精和食盐都能均一、稳定地分散到水中,形成混合物,即溶液,而食用油不溶于水,会浮在水面上,不均一,不是溶液。
B
探究新知
【例2】写出表 1所列溶液中溶质、溶剂的名称:
溶液 碘酒 澄清石灰水 酒精溶液 高锰酸钾溶液 盐酸
溶质
溶剂
碘
氢氧化钙
酒精
高锰酸钾
氯化氢
酒精
水
水
水
水
方法规律:该题利用口诀法解答。溶质、溶剂的判断口诀为:固气溶解液为剂;液液互溶多为剂;水多水少总为剂;不指溶剂水为剂。
课堂总结
溶液:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物,叫做溶液。
溶剂:能溶解其他物质的物质叫做溶剂。如:水
溶质:被溶解的物质叫做溶质。如:蔗糖、食盐
探究新知
溶解时的吸热或放热现象
任务二
实验探究2
分别取3g氯化钠、硝酸铵和氢氧化钠三种物质溶解于20ml水中,观察并记录加入溶质前后温度的变化。
探究新知
溶解时的吸热或放热现象
任务二
溶解物质 温度变化 溶于水时能量变化
溶解硝酸氢铵(NH4NO3)
溶解氯化钠(NaCl)
溶解氢氧化钠(NaOH)
明显下降
吸热
变化不明显
几乎不变
明显上升
放热
你的发现:
物质溶解的过程伴有热量的吸收或放出
结论:溶质溶解时,吸热和放热同时发生,只是吸收和放出的热量不同,从而使溶液的温度发生不同的变化。
探究新知
溶质溶解时为什么会放热或吸热呢?
溶质分散到溶剂中形成溶液的过程中,发生了两种变化。
①扩散过程:溶质的分子(或离子)向水中扩散,吸收热量;
②水合过程:溶质的分子(或离子)和水分子作用,生成水合分子(或水合离子),放出热量。
溶解过程中温度变化。
1.扩散过程中吸收热量>水合过程放出热量,溶液温度降低。
2.扩散过程吸收热量<水合过程中放出热量,溶液温度升高。
3.扩散过程吸收热量=水合过程放出热量,溶液温度不变。
探究新知
例题:下列物质分别放入水中,溶液温度明显降低的是( )
A.浓硫酸 B.硝酸铵
C.氧化钙 D.氢氧化钠
B
课堂总结
溶解过程
扩散过程
(吸热)
水合过程
(放热)
② 吸热 = 放热
(溶液温度不变)
例如:NaCl固体溶于水
③ 吸热<放热
(溶液温度升高)
例如:NaOH 固体和浓硫酸
(H2SO4)溶于水
① 吸热>放热
(溶液温度降低)
例如:NH4NO3固体溶于水
探究新知
实验探究3:影响溶质溶解快慢的因素
实验操作 现象 结论
溶解速率 A1____B1
溶解速率 A2____B2 溶解速率 A3____B3 <
>
>
①加热、②把固体溶质研细、③搅拌能加快溶质在溶剂里的溶解。
结论:
升高温度、颗粒越细(表面积越大)、加快搅拌
都能加快溶解速率
课堂总结
影响溶质溶解速率的因素:
1.温度、固体溶质的颗粒大小、是否搅拌等因素都会影响溶质的溶解速率。
2.通过升高温度、减小固体物质的颗粒大小、搅拌等方法能加快溶质在溶剂里的溶解速率。
课堂总结
小结
1.溶液:由一种或一种以上的物质分散到另一种物质中所形成的均一而稳定的混合物。
溶液特性:均一性、稳定性。
2.影响溶质溶解快慢的因素:①加热、②把固体溶质研细、
③搅拌能加快溶质在溶剂里的溶解。
3.物质溶解的过程伴有热量的吸收或放出
板书设计
溶质:被溶解的物质,可以是固体、液体、气体
溶剂:能溶解其他物质的物质。水是最常用的溶剂,汽油、酒精等也可以作溶剂
溶液
溶解
概念:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物特征:均一性、稳定性
吸热:一些物质溶于水后,整个过程中溶液温度降低,如NH4NO3(或硝酸铵)固体
放热:一些物质溶于水后,整个过程中溶液温度升高,如NaOH固体、浓H2SO4
吸放热不明显:多数物质溶于水后,整个过程中溶液温度变化不明显,如NaCl固体
【注意】a.氧化钙遇水放热是因为氧化钙与水反应放热。b.吸热、放热现象通常会引起密闭容器内压强的变化。
当堂小练
D
2.某一杯长期放置的食盐水,若上部的密度为a g/cm3,
则下部的密度为( )
A.大于a g/cm3 B.等于a g/cm3
C.小于a g/cm3 D.无法判断
B
1.下列液体属于溶液的是___________。(填序号)
①啤酒 ②水 ③泥水 ④澄清石灰水 ⑤盐酸
① ④ ⑤
3.下列清洗方法中,利用乳化作用的是( )
A.用自来水洗手 B.用汽油清洗油污
C.用清洗剂洗油腻的餐具 D.用盐酸清除铁锈
C
https://www.21cnjy.com/help/help_extract.php
让备课更有效
www.21cnjy.com
Thanks!
