江苏省2025年1月普通高中学业水平合格性考试 导学案 课时4 氧化还原反应(含解析)
文档属性
| 名称 | 江苏省2025年1月普通高中学业水平合格性考试 导学案 课时4 氧化还原反应(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 417.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-06 15:37:30 | ||
图片预览


文档简介
课时4 氧化还原反应
知 识 梳 理
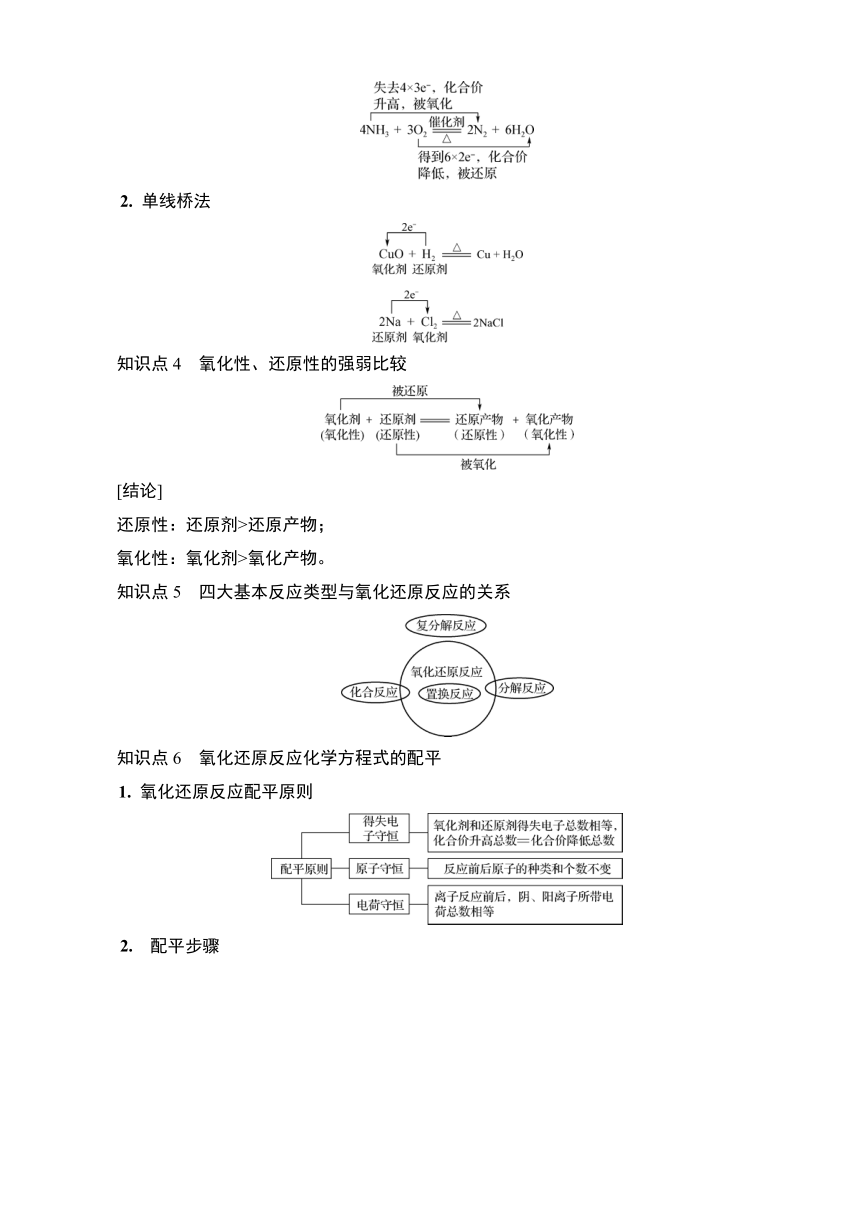
知识点1 氧化还原反应的基本概念
1. 氧化剂:在反应中________电子的物质(元素化合价________)。
2. 还原剂:在反应中________电子的物质(元素化合价________)。
3. 还原产物: 氧化剂被还原的生成物。
4. 氧化产物: 还原剂被氧化的生成物。
5. 氧化还原反应的两条线关系
知识点2 常见的氧化剂和还原剂
名称 分类 实例
常见氧化剂 活泼的非金属单质 O2、Cl2等
部分阳离子 Fe3+、Ag+等
含较高价态元素的物质 某些含氧化合物 MnO2、H2O2等
大多含氧酸 浓硫酸、HNO3等
某些盐 KMnO4、KClO3等
常见还原剂 活泼的金属单质 Al、Zn、Fe、Na、Mg等
非金属单质 C、H2等
含较低价态元素的物质 某些氧化物 CO、SO2等
非金属氢化物 HCl、H2S等
某些盐 KI、Na2S等
知识点3 氧化还原反应中电子转移方向及数目的表示方法
1. 双线桥法
2. 单线桥法
知识点4 氧化性、还原性的强弱比较
[结论]
还原性:还原剂>还原产物;
氧化性:氧化剂>氧化产物。
知识点5 四大基本反应类型与氧化还原反应的关系
知识点6 氧化还原反应化学方程式的配平
1. 氧化还原反应配平原则
2. 配平步骤
3. 举例
第1步:写出化学反应的反应物和生成物:
H2S+HNO3―→S↓+NO↑+H2O
第2步:标变价,标出变价元素的化合价:
H2+HO3―→↓+O↑+H2O
第3步:列得失,列出得失电子的数目:
第4步:求总数,从而确定氧化剂(或还原产物)和还原剂(或氧化产物)的化学计量数:
则得出H2S的化学计量数为3,HNO3的化学计量数为2。
第5步:配系数,先配平变价元素的原子,再利用原子守恒配平其他元素的原子。
3H2S+2HNO3===3S↓+2NO↑+4H2O
第6步:查守恒,最后可利用O原子守恒来进行验证。
典 型 例 题
(2023·江苏学测)汽车尾气净化装置会发生反应:2NO+2CO2CO2+N2。下列说法正确的是( )
A. CO是氧化剂
B. NO失去电子
C. 催化剂可以减慢反应速率
D. 该反应可以减少氮氧化物的排放
(2022·江苏学测)高炉炼铁时发生反应:Fe2O3+3CO2Fe+3CO2。下列说法正确的是( )
A. 铁元素的化合价降低 B. Fe2O3为还原剂
C. CO得电子 D. CO为氧化剂
(2021·江苏学测)液氨可作为汽车未来的新能源,反应为4NH3+3O22N2+6H2O。下列说法正确的是( )
A. NH3是氧化剂 B. NH3中的氢元素被氧化
C. O2发生还原反应 D. O2中的氧原子失去电子
(2020·江苏学测)反应4Al+3MnO23Mn+2Al2O3可用来制取Mn。下列有关该反应的说法正确的是( )
A. Al是还原剂 B. MnO2发生氧化反应
C. Al的化合价降低 D. MnO2中O元素被还原
(2023·扬州学测合格考)ClO2是一种良好的水处理剂,浓度高时易爆炸,可由反应KClO3+H2C2O4+H2SO4——ClO2↑+ K2SO4+CO2↑+H2O(未配平)制备。下列说法正确的是( )
A. KClO3失去电子
B. CO2是还原产物
C. 每生成1 mol ClO2,消耗2 mol H2C2O4
D. 生成的CO2气体稀释了ClO2,使之更安全
(2024·扬州合格考模拟)反应SiCl4+2H2Si+4HCl可用于Si的提纯。下列关于该反应的说法正确的是( )
A. H2是氧化剂 B. SiCl4是还原剂
C. H2被氧化 D. SiCl4发生氧化反应
下列反应中,硫酸作氧化剂的是( )
A. H2SO4+2KOH===K2SO4+2H2O
B. H2SO4+MgCO3===MgSO4+H2O+CO2↑
C. 3H2SO4+Fe2O3===Fe2(SO4)3+3H2O
D. H2SO4+2Na===Na2SO4+H2↑
(2022·盐城学测合格考)氢化钠(NaH) 是一种生氢剂,与水可发生如下反应:NaH+H2O===NaOH+H2↑。 下列对该反应的描述正确的是( )
A. H2既是氧化产物,又是还原产物
B. NaH既是还原剂,又是氧化剂
C. H2O没有参与氧化还原反应
D. 反应的氧化剂和还原剂的质量比是1∶1
(2020·如皋学考模拟)Na2FeO4可用于消毒净水,其制备反应为3NaClO+Fe2(SO4)3+10NaOH===2Na2FeO4+3Na2SO4+3NaCl+5H2O。下列说法正确的是( )
A. NaClO是还原剂 B. Fe2(SO4)3被还原
C. Fe2(SO4)3发生氧化反应 D. Fe2(SO4)3得到电子
根据反应:①2Fe2++Br2===2Fe3++2Br-,②2Br-+Cl2===Br2+2Cl-,③2Fe3++2I-===2Fe2++I2。判断下列物质的氧化性由强到弱的顺序正确的是( )
A. Cl2>Br2>Fe3+>I2 B. Br2>Fe3+>Cl2>I2
C. Cl2>Br2>I2>Fe3+ D. I2>Fe3+>Br2>Cl2
(2024·常州合格考模拟)反应2NO+2CON2+2CO2可应用于汽车尾气的净化。下列判断正确的是( )
A. N2是氧化产物 B. CO2是还原产物
C. CO是氧化剂 D. NO发生还原反应
(2024·徐州一中合格考模拟)火箭使用的推进剂为偏二甲肼(C2H8N2)和四氧化二氮(N2O4),发生反应的化学方程式为C2H8N2+2N2O4===2CO2↑+4H2O↑+3N2↑(已知偏二甲肼中C、N元素的化合价相等)。下列说法正确的是( )
A. C2H8N2是氧化剂
B. N2O4被氧化
C. C2H8N2发生还原反应
D. 1 mol N2O4完全反应,有8 mol电子转移
课时4 氧化还原反应
[知识梳理]
[知识点1] 1. 得到 降低 2. 失去 升高 5. 得到 失去
[典型例题]
例题1 D 【解析】在该反应中,CO中碳元素化合价由+2升高到CO2中的+4,失去电子,CO是还原剂,NO中氮元素化合价由+2降低到氮气中的0,得到电子,NO是氧化剂,A、B错误;该反应的催化剂可加快反应速率,C错误。
例题2 A 【解析】反应物Fe2O3中Fe元素化合价由+3降低到单质Fe中的0,得到电子,Fe2O3是氧化剂,A正确,B错误;CO中碳元素化合价由+2升高到CO2中的+4,失去电子,CO是还原剂,C、D错误。
例题3 C 【解析】NH3中的N元素化合价由-3升高到氮气中的0,失去电子,NH3是还原剂,氮元素被氧化,A、B错误;O2中O元素化合价由0降低到H2O中的-2,得电子,氧气是氧化剂,发生还原反应,C正确,D错误。
例题4 A 【解析】Al失去电子,元素化合价升高,是还原剂,A正确,C错误;MnO2得电子,是氧化剂,发生还原反应,B错误;MnO2中O元素的化合价没有变化,既不被氧化也不被还原,D错误。
例题5 D 【解析】KClO3中氯元素化合价由+5降低到ClO2的+4,得到电子,A错误; H2C2O4中的C元素化合价由+3升高到CO2的+4,失去电子, H2C2O4是还原剂,被氧化,CO2是氧化产物,B错误;根据得失电子守恒可知,每生成2 mol ClO2,消耗1 mol H2C2O4,C错误。
例题6 C 【解析】该反应中Si元素的化合价降低,H元素化合价升高,SiCl4是氧化剂,被还原,发生还原反应,H2是还原剂,被氧化,发生了氧化反应,C正确。
例题7 D
例题8 A 【解析】NaH中-1价的H元素和H2O中的+1价的H元素均转变为H2中的0价,H2既是氧化产物,又是还原产物,A正确;NaH是还原剂,B错误,H2O是氧化剂,C错误;反应的氧化剂和还原剂的物质的量之比是1∶1,质量之比为18∶24,D错误。
例题9 C 【解析】反应物NaClO中Cl元素化合价降低,得到电子,NaClO为氧化剂,A错误;Fe2(SO4)3中Fe元素的化合价升高,Fe2(SO4)3被氧化,发生了氧化反应,B错误,C正确;Fe2(SO4)3失去电子,D错误。
例题10 A 【解析】根据氧化剂的氧化性强于氧化产物的氧化性,在反应①中,氧化性:Br2>Fe3+,在反应②中,氧化性:Cl2>Br2,在反应③中,氧化性:Fe3+>I2,A正确。
例题11 D 【解析】反应中N元素化合价降低,NO是氧化剂,发生还原反应,得到还原产物N2,C元素化合价升高,CO是还原剂,发生氧化反应,得到氧化产物CO2,D正确。
例题12 D 【解析】C2H8N2中C、N元素化合价相等,已知H元素化合价为+1,则C、N元素化合价均为-2价,即该反应的C2H8N2中C、N元素的化合价均升高,C2H8N2是还原剂,被氧化,发生了还原反应,A、C错误;N2O4中氮元素的化合价降低,N2O4作氧化剂,被还原,B错误;由该反应可知,每2 mol N2O4参与反应,转移16 mol电子,则1 mol N2O4完全反应,有8 mol电子转移,D正确。
知 识 梳 理
知识点1 氧化还原反应的基本概念
1. 氧化剂:在反应中________电子的物质(元素化合价________)。
2. 还原剂:在反应中________电子的物质(元素化合价________)。
3. 还原产物: 氧化剂被还原的生成物。
4. 氧化产物: 还原剂被氧化的生成物。
5. 氧化还原反应的两条线关系
知识点2 常见的氧化剂和还原剂
名称 分类 实例
常见氧化剂 活泼的非金属单质 O2、Cl2等
部分阳离子 Fe3+、Ag+等
含较高价态元素的物质 某些含氧化合物 MnO2、H2O2等
大多含氧酸 浓硫酸、HNO3等
某些盐 KMnO4、KClO3等
常见还原剂 活泼的金属单质 Al、Zn、Fe、Na、Mg等
非金属单质 C、H2等
含较低价态元素的物质 某些氧化物 CO、SO2等
非金属氢化物 HCl、H2S等
某些盐 KI、Na2S等
知识点3 氧化还原反应中电子转移方向及数目的表示方法
1. 双线桥法
2. 单线桥法
知识点4 氧化性、还原性的强弱比较
[结论]
还原性:还原剂>还原产物;
氧化性:氧化剂>氧化产物。
知识点5 四大基本反应类型与氧化还原反应的关系
知识点6 氧化还原反应化学方程式的配平
1. 氧化还原反应配平原则
2. 配平步骤
3. 举例
第1步:写出化学反应的反应物和生成物:
H2S+HNO3―→S↓+NO↑+H2O
第2步:标变价,标出变价元素的化合价:
H2+HO3―→↓+O↑+H2O
第3步:列得失,列出得失电子的数目:
第4步:求总数,从而确定氧化剂(或还原产物)和还原剂(或氧化产物)的化学计量数:
则得出H2S的化学计量数为3,HNO3的化学计量数为2。
第5步:配系数,先配平变价元素的原子,再利用原子守恒配平其他元素的原子。
3H2S+2HNO3===3S↓+2NO↑+4H2O
第6步:查守恒,最后可利用O原子守恒来进行验证。
典 型 例 题
(2023·江苏学测)汽车尾气净化装置会发生反应:2NO+2CO2CO2+N2。下列说法正确的是( )
A. CO是氧化剂
B. NO失去电子
C. 催化剂可以减慢反应速率
D. 该反应可以减少氮氧化物的排放
(2022·江苏学测)高炉炼铁时发生反应:Fe2O3+3CO2Fe+3CO2。下列说法正确的是( )
A. 铁元素的化合价降低 B. Fe2O3为还原剂
C. CO得电子 D. CO为氧化剂
(2021·江苏学测)液氨可作为汽车未来的新能源,反应为4NH3+3O22N2+6H2O。下列说法正确的是( )
A. NH3是氧化剂 B. NH3中的氢元素被氧化
C. O2发生还原反应 D. O2中的氧原子失去电子
(2020·江苏学测)反应4Al+3MnO23Mn+2Al2O3可用来制取Mn。下列有关该反应的说法正确的是( )
A. Al是还原剂 B. MnO2发生氧化反应
C. Al的化合价降低 D. MnO2中O元素被还原
(2023·扬州学测合格考)ClO2是一种良好的水处理剂,浓度高时易爆炸,可由反应KClO3+H2C2O4+H2SO4——ClO2↑+ K2SO4+CO2↑+H2O(未配平)制备。下列说法正确的是( )
A. KClO3失去电子
B. CO2是还原产物
C. 每生成1 mol ClO2,消耗2 mol H2C2O4
D. 生成的CO2气体稀释了ClO2,使之更安全
(2024·扬州合格考模拟)反应SiCl4+2H2Si+4HCl可用于Si的提纯。下列关于该反应的说法正确的是( )
A. H2是氧化剂 B. SiCl4是还原剂
C. H2被氧化 D. SiCl4发生氧化反应
下列反应中,硫酸作氧化剂的是( )
A. H2SO4+2KOH===K2SO4+2H2O
B. H2SO4+MgCO3===MgSO4+H2O+CO2↑
C. 3H2SO4+Fe2O3===Fe2(SO4)3+3H2O
D. H2SO4+2Na===Na2SO4+H2↑
(2022·盐城学测合格考)氢化钠(NaH) 是一种生氢剂,与水可发生如下反应:NaH+H2O===NaOH+H2↑。 下列对该反应的描述正确的是( )
A. H2既是氧化产物,又是还原产物
B. NaH既是还原剂,又是氧化剂
C. H2O没有参与氧化还原反应
D. 反应的氧化剂和还原剂的质量比是1∶1
(2020·如皋学考模拟)Na2FeO4可用于消毒净水,其制备反应为3NaClO+Fe2(SO4)3+10NaOH===2Na2FeO4+3Na2SO4+3NaCl+5H2O。下列说法正确的是( )
A. NaClO是还原剂 B. Fe2(SO4)3被还原
C. Fe2(SO4)3发生氧化反应 D. Fe2(SO4)3得到电子
根据反应:①2Fe2++Br2===2Fe3++2Br-,②2Br-+Cl2===Br2+2Cl-,③2Fe3++2I-===2Fe2++I2。判断下列物质的氧化性由强到弱的顺序正确的是( )
A. Cl2>Br2>Fe3+>I2 B. Br2>Fe3+>Cl2>I2
C. Cl2>Br2>I2>Fe3+ D. I2>Fe3+>Br2>Cl2
(2024·常州合格考模拟)反应2NO+2CON2+2CO2可应用于汽车尾气的净化。下列判断正确的是( )
A. N2是氧化产物 B. CO2是还原产物
C. CO是氧化剂 D. NO发生还原反应
(2024·徐州一中合格考模拟)火箭使用的推进剂为偏二甲肼(C2H8N2)和四氧化二氮(N2O4),发生反应的化学方程式为C2H8N2+2N2O4===2CO2↑+4H2O↑+3N2↑(已知偏二甲肼中C、N元素的化合价相等)。下列说法正确的是( )
A. C2H8N2是氧化剂
B. N2O4被氧化
C. C2H8N2发生还原反应
D. 1 mol N2O4完全反应,有8 mol电子转移
课时4 氧化还原反应
[知识梳理]
[知识点1] 1. 得到 降低 2. 失去 升高 5. 得到 失去
[典型例题]
例题1 D 【解析】在该反应中,CO中碳元素化合价由+2升高到CO2中的+4,失去电子,CO是还原剂,NO中氮元素化合价由+2降低到氮气中的0,得到电子,NO是氧化剂,A、B错误;该反应的催化剂可加快反应速率,C错误。
例题2 A 【解析】反应物Fe2O3中Fe元素化合价由+3降低到单质Fe中的0,得到电子,Fe2O3是氧化剂,A正确,B错误;CO中碳元素化合价由+2升高到CO2中的+4,失去电子,CO是还原剂,C、D错误。
例题3 C 【解析】NH3中的N元素化合价由-3升高到氮气中的0,失去电子,NH3是还原剂,氮元素被氧化,A、B错误;O2中O元素化合价由0降低到H2O中的-2,得电子,氧气是氧化剂,发生还原反应,C正确,D错误。
例题4 A 【解析】Al失去电子,元素化合价升高,是还原剂,A正确,C错误;MnO2得电子,是氧化剂,发生还原反应,B错误;MnO2中O元素的化合价没有变化,既不被氧化也不被还原,D错误。
例题5 D 【解析】KClO3中氯元素化合价由+5降低到ClO2的+4,得到电子,A错误; H2C2O4中的C元素化合价由+3升高到CO2的+4,失去电子, H2C2O4是还原剂,被氧化,CO2是氧化产物,B错误;根据得失电子守恒可知,每生成2 mol ClO2,消耗1 mol H2C2O4,C错误。
例题6 C 【解析】该反应中Si元素的化合价降低,H元素化合价升高,SiCl4是氧化剂,被还原,发生还原反应,H2是还原剂,被氧化,发生了氧化反应,C正确。
例题7 D
例题8 A 【解析】NaH中-1价的H元素和H2O中的+1价的H元素均转变为H2中的0价,H2既是氧化产物,又是还原产物,A正确;NaH是还原剂,B错误,H2O是氧化剂,C错误;反应的氧化剂和还原剂的物质的量之比是1∶1,质量之比为18∶24,D错误。
例题9 C 【解析】反应物NaClO中Cl元素化合价降低,得到电子,NaClO为氧化剂,A错误;Fe2(SO4)3中Fe元素的化合价升高,Fe2(SO4)3被氧化,发生了氧化反应,B错误,C正确;Fe2(SO4)3失去电子,D错误。
例题10 A 【解析】根据氧化剂的氧化性强于氧化产物的氧化性,在反应①中,氧化性:Br2>Fe3+,在反应②中,氧化性:Cl2>Br2,在反应③中,氧化性:Fe3+>I2,A正确。
例题11 D 【解析】反应中N元素化合价降低,NO是氧化剂,发生还原反应,得到还原产物N2,C元素化合价升高,CO是还原剂,发生氧化反应,得到氧化产物CO2,D正确。
例题12 D 【解析】C2H8N2中C、N元素化合价相等,已知H元素化合价为+1,则C、N元素化合价均为-2价,即该反应的C2H8N2中C、N元素的化合价均升高,C2H8N2是还原剂,被氧化,发生了还原反应,A、C错误;N2O4中氮元素的化合价降低,N2O4作氧化剂,被还原,B错误;由该反应可知,每2 mol N2O4参与反应,转移16 mol电子,则1 mol N2O4完全反应,有8 mol电子转移,D正确。
同课章节目录
