江苏省2025年1月普通高中学业水平合格性考试 导学案 课时12 元素周期表和元素周期律(含解析)
文档属性
| 名称 | 江苏省2025年1月普通高中学业水平合格性考试 导学案 课时12 元素周期表和元素周期律(含解析) |
|
|
| 格式 | doc | ||
| 文件大小 | 416.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-06 00:00:00 | ||
图片预览


文档简介
课时12 元素周期表和元素周期律
知 识 梳 理
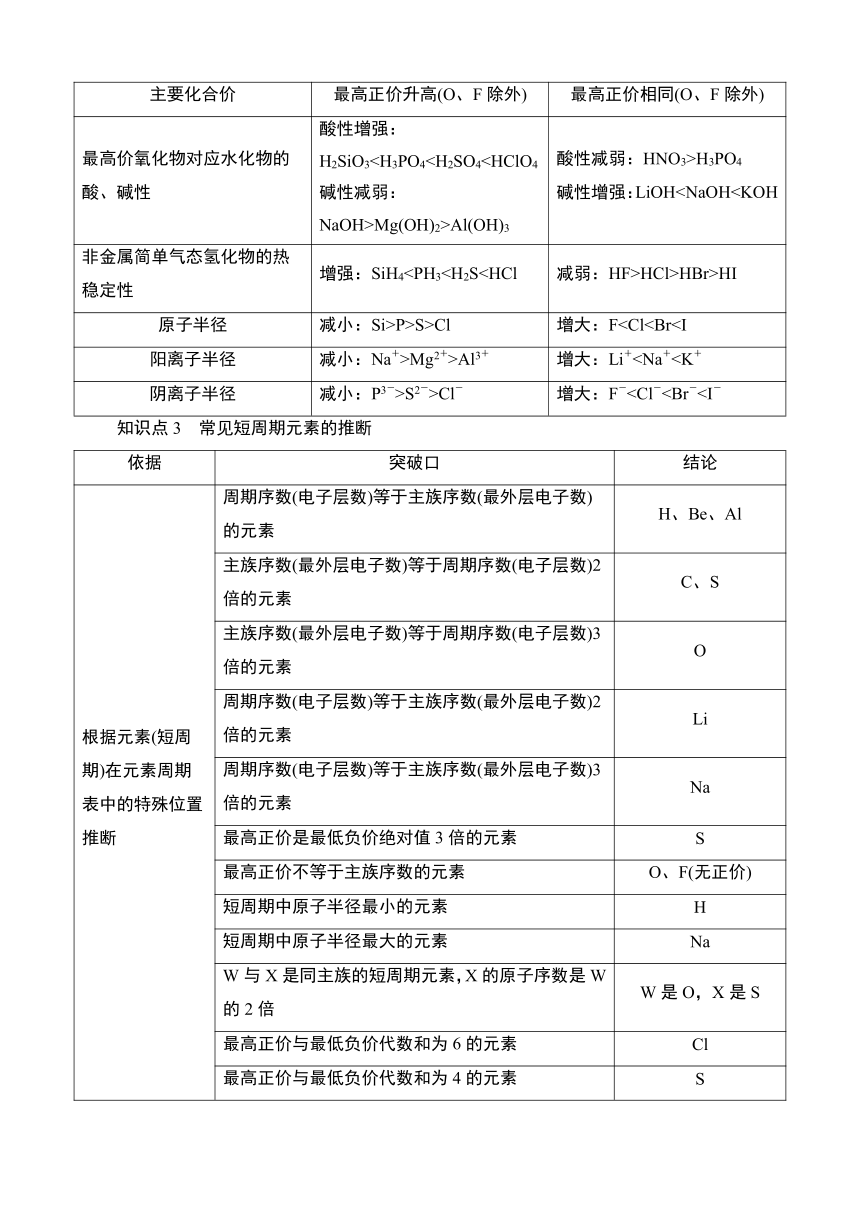
知识点1 元素周期表的结构
1. 元素周期表
备注:短周期元素,周期数=电子层数;主族序数=最外层电子数。
2. 元素周期表的周期与族
周期(7个)
族(18个纵列)
知识点2 元素周期律
性质 同周期(左→右) 同主族(上→下)
电子层结构 层数相同 层数增大
失电子能力 减弱 增强
得电子能力 增强 减弱
金属性 减弱 增强
非金属性 增强 减弱
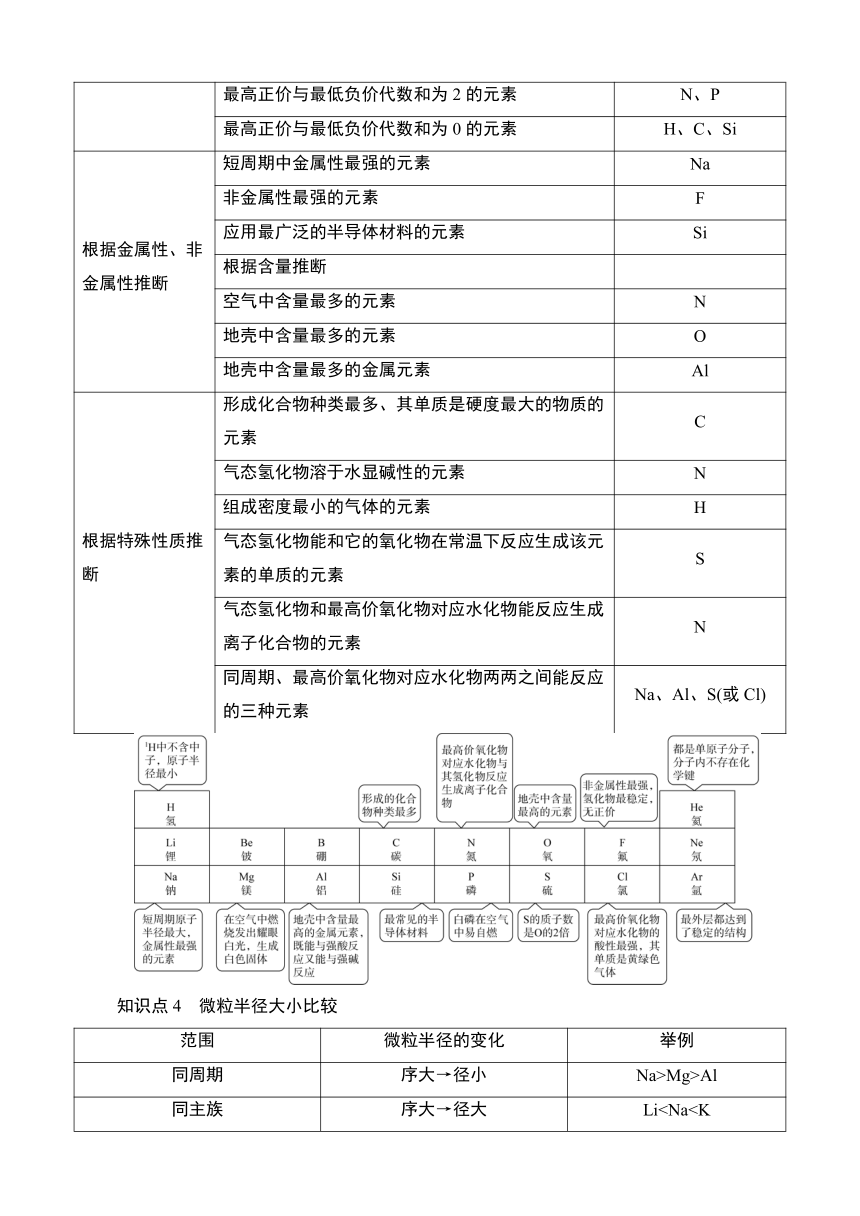
主要化合价 最高正价升高(O、F除外) 最高正价相同(O、F除外)
最高价氧化物对应水化物的酸、碱性 酸性增强:H2SiO3Mg(OH)2>Al(OH)3 酸性减弱:HNO3>H3PO4碱性增强:LiOH非金属简单气态氢化物的热稳定性 增强:SiH4HCl>HBr>HI
原子半径 减小:Si>P>S>Cl 增大:F阳离子半径 减小:Na+>Mg2+>Al3+ 增大:Li+阴离子半径 减小:P3->S2->Cl- 增大:F-知识点3 常见短周期元素的推断
依据 突破口 结论
根据元素(短周期)在元素周期表中的特殊位置推断 周期序数(电子层数)等于主族序数(最外层电子数)的元素 H、Be、Al
主族序数(最外层电子数)等于周期序数(电子层数)2倍的元素 C、S
主族序数(最外层电子数)等于周期序数(电子层数)3倍的元素 O
周期序数(电子层数)等于主族序数(最外层电子数)2倍的元素 Li
周期序数(电子层数)等于主族序数(最外层电子数)3倍的元素 Na
最高正价是最低负价绝对值3倍的元素 S
最高正价不等于主族序数的元素 O、F(无正价)
短周期中原子半径最小的元素 H
短周期中原子半径最大的元素 Na
W与X是同主族的短周期元素,X的原子序数是W的2倍 W是O,X是S
最高正价与最低负价代数和为6的元素 Cl
最高正价与最低负价代数和为4的元素 S
最高正价与最低负价代数和为2的元素 N、P
最高正价与最低负价代数和为0的元素 H、C、Si
根据金属性、非金属性推断 短周期中金属性最强的元素 Na
非金属性最强的元素 F
应用最广泛的半导体材料的元素 Si
根据含量推断
空气中含量最多的元素 N
地壳中含量最多的元素 O
地壳中含量最多的金属元素 Al
根据特殊性质推断 形成化合物种类最多、其单质是硬度最大的物质的元素 C
气态氢化物溶于水显碱性的元素 N
组成密度最小的气体的元素 H
气态氢化物能和它的氧化物在常温下反应生成该元素的单质的元素 S
气态氢化物和最高价氧化物对应水化物能反应生成离子化合物的元素 N
同周期、最高价氧化物对应水化物两两之间能反应的三种元素 Na、Al、S(或Cl)
知识点4 微粒半径大小比较
范围 微粒半径的变化 举例
同周期 序大→径小 Na>Mg>Al
同主族 序大→径大 Li具有相同核外电子排布的微粒 序大→径小 Al3+同种元素形成的微粒 阳离子<原子<阴离子 H+既不在同周期又不在同主族的元素 找和一种元素同周期且与另一种元素同主族的元素作参照物 F典 型 例 题
类型1 核素
(2023·江苏学测)我国研发高效率全钒液流电池。钒的一种核素 V,51是该核素的( )
A. 质量数 B. 质子数
C. 中子数 D. 电子数
(2022·江苏学测)质量数为28的硅原子表示为( )
A. Si B. Si
C. Si D. Si
(2021·江苏学测)“月壤”中含有 He,该原子的中子数是( )
A. 1 B. 2
C. 3 D. 5
(2020·江苏学测)为纪念门捷列夫,科学家将1955年人工合成的一种新元素用符号“Md”表示,中文命名为“钔”。核素 Md 的质量数为( )
A. 101 B. 157
C. 258 D. 359
(2024·扬州合格考模拟)O可用作示踪剂。该原子的质子数是( )
A. 8 B. 10
C. 18 D. 26
类型2 元素周期律应用——元素性质比较
(2023·江苏学测)下列说法正确的是( )
A. 原子半径:r(Cl)>r(Br) B. 非金属性:N>O
C. 碱性:NaOH>Mg(OH)2 D. 热稳定性:HBr>HCl
(2020·江苏学测)判断Cl元素的非金属性比S的强,可依据的事实是( )
A. HCl的热稳定性比H2S的强
B. 氯气能溶于水,硫难溶于水
C. 常温下,氯单质呈气态,硫单质呈固态
D. AgCl是白色固体,Ag2S是黑色固体
(2023·南京学测合格考)Na、Mg、S、Cl是短周期中的主族元素。下列叙述正确的是( )
A. 原子半径:r(Cl)>r(S)>r(Mg)>r(Na)
B. 非金属性:S>Cl
C. Na、S两种元素可形成化合物Na2S
D. 最高价氧化物的水化物的碱性:NaOH<Mg(OH)2
类型3 元素推断与性质比较
(2022·江苏学测)短周期主族元素X、Y、Z的原子序数依次增大,X与Z位于同一主族,Z的单质在常温下是黄绿色气体,Y原子的最外层只有一个电子。下列说法正确的是( )
A. X原子易失去电子
B. 原子半径:r(Z)>r(Y)>r(X)
C. Y的最高价氧化物对应的水化物是弱碱
D. Z的简单气态氢化物的热稳定性比X的弱
(2021·江苏学测)短周期主族元素X、Y、Z的原子序数依次增大,X原子最外层电子数是次外层电子数的3倍,Y是短周期中金属性最强的元素,Z与X位于同一主族。下列叙述正确的是( )
A. 原子半径:r(Z)>r(Y)>r(X)
B. X的简单气态氢化物的热稳定性比Z的弱
C. X、Y、Z三种元素可形成化合物Y2ZX4
D. Y形成的最高价氧化物对应水化物是弱碱
(2020·江苏学测)锂是元素周期表中第2周期ⅠA族元素,下列有关锂元素性质推测正确的是( )
A. 最高化合价为+2
B. 原子半径比钠的大
C. 单质与水的反应比钠更剧烈
D. 最高价氧化物对应水化物的碱性比钠的弱
(2024·常州合格考模拟)X、Y、Z、W、Q属于周期表前20号主族元素,且原子序数依次增大。X原子的最外层电子数是其内层电子数的3倍,Y是地壳中含量最多的金属元素,Z和X位于同一主族,Q是第19号元素。下列说法正确的是 ( )
A. 自然界中由X元素形成的单质只有一种
B. 原子半径:r(X)<r(Z)<r(Y)<r(Q)
C. 简单气态氢化物的热稳定性:Z>W
D. 最高价氧化物对应水化物碱性:Y>Q
(2023·盐城学测合格考)X、Y、Z、W是元素周期表中前20号元素,且原子序数依次增大。X的一种核素在考古时常用来鉴定一些文物的年代,Y原子最外层电子数是其内层电子数的3倍,Z元素的最高正化合价与最低化合价代数和为零,W元素原子最外层只有一个电子。下列关于这几种元素的说法正确的是( )
A. Z的氧化物是一种重要的半导体材料
B. Y跟W只能形成一种氧化物
C. X与Z为同主族元素
D. 原子半径:r(X)<r(Y)<r(W)
课时12 元素周期表和元素周期律
[知识梳理]
[知识点1] 1. 电子层数 核电荷数 最外层电子数
[典型例题]
例题1 A 【解析】V符号左上角表示的是质量数,A正确。
例题2 C 【解析】Si元素的质子数为14,用符号表示时,写在元素符号的左下角,左上角写质量数,即为 Si,C正确。
例题3 A 【解析】He的中子数=3-2=1,A正确。
例题4 C 【解析】元素符号的左上角是质量数,C正确。
变式1 A
例题5 C 【解析】同一主族元素电子层数越大,原子半径越大,Br原子的半径大于Cl原子,A错误;同周期主族元素,从左至右,非金属性逐渐增强,N元素的非金属性弱于O元素, B错误;同周期主族元素,从左至右,金属性逐渐减弱,金属元素最高价氧化物对应的水化物的碱性逐渐减弱,NaOH的碱性强于Mg(OH)2 ,C正确;同一主族元素,从上至下,非金属性逐渐减弱,简单氢化物的热稳定性逐渐减弱,HBr的热稳定性小于HCl,D错误。
例题6 A 【解析】比较非金属性可根据单质与氢气化合的难易程度、简单气态氢化物的热稳定性、最高价氧化物对应水化物的酸性强弱进行比较,A正确。
变式2 C 【解析】Na、Mg、S、Cl四种元素处于同一周期,从左至右,原子半径越来越小,非金属性越来越强,非金属性:S<Cl,A错误,B错误;最高价氧化物的水化物的碱性:NaOH>Mg(OH)2,D错误。
例题7 D 【解析】X、Y、Z三种元素分别为F、Na、Cl。F原子易得到电子,A错误;原子半径:r(Na)>r(Cl)>r(F),B错误;NaOH为强碱,C错误;Cl元素的非金属性弱于F,则HCl的热稳定性比HF的弱,D正确。
例题8 C 【解析】X、Y、Z分别为O、Na、S,原子半径:Na>S>O,A错误;非金属性越强,气态氢化物越稳定,热稳定性:H2O>H2S,B错误;O、Na、S可形成Na2SO4,C正确;NaOH属于强碱,D错误。
例题9 D 【解析】锂是第2周期ⅠA族元素,最高化合价是+1,A错误;同主族元素从上到下原子半径逐渐增大,锂的原子半径小于钠的原子半径,B错误;同主族元素的单质从上到下金属性逐渐增强,与水反应剧烈程度增大,最高价氧化物对应水化物的碱性增强,C错误;D正确。
例题10 B 【解析】X为O元素、Y为Al元素、Z为S元素、W为Cl元素、Q为K元素。O元素能形成氧气和臭氧,A错误; 原子半径:r(O)<r(S)<r(Al)<r(K),B正确;氯元素的非金属性比硫强,所以简单气态氢化物的热稳定性:HCl>H2S,C错误;K的金属性比Al的强,则最高价氧化物对应水化物碱性:KOH>Al(OH)3,D错误。
变式3 C 【解析】X、Y、Z、W四种元素分别为C、O、Si、K。硅为半导体材料,A错误;O和K元素可形成氧化钾和过氧化钾等,B错误;半径:r(O)<r(C),D错误。
知 识 梳 理
知识点1 元素周期表的结构
1. 元素周期表
备注:短周期元素,周期数=电子层数;主族序数=最外层电子数。
2. 元素周期表的周期与族
周期(7个)
族(18个纵列)
知识点2 元素周期律
性质 同周期(左→右) 同主族(上→下)
电子层结构 层数相同 层数增大
失电子能力 减弱 增强
得电子能力 增强 减弱
金属性 减弱 增强
非金属性 增强 减弱
主要化合价 最高正价升高(O、F除外) 最高正价相同(O、F除外)
最高价氧化物对应水化物的酸、碱性 酸性增强:H2SiO3
原子半径 减小:Si>P>S>Cl 增大:F
依据 突破口 结论
根据元素(短周期)在元素周期表中的特殊位置推断 周期序数(电子层数)等于主族序数(最外层电子数)的元素 H、Be、Al
主族序数(最外层电子数)等于周期序数(电子层数)2倍的元素 C、S
主族序数(最外层电子数)等于周期序数(电子层数)3倍的元素 O
周期序数(电子层数)等于主族序数(最外层电子数)2倍的元素 Li
周期序数(电子层数)等于主族序数(最外层电子数)3倍的元素 Na
最高正价是最低负价绝对值3倍的元素 S
最高正价不等于主族序数的元素 O、F(无正价)
短周期中原子半径最小的元素 H
短周期中原子半径最大的元素 Na
W与X是同主族的短周期元素,X的原子序数是W的2倍 W是O,X是S
最高正价与最低负价代数和为6的元素 Cl
最高正价与最低负价代数和为4的元素 S
最高正价与最低负价代数和为2的元素 N、P
最高正价与最低负价代数和为0的元素 H、C、Si
根据金属性、非金属性推断 短周期中金属性最强的元素 Na
非金属性最强的元素 F
应用最广泛的半导体材料的元素 Si
根据含量推断
空气中含量最多的元素 N
地壳中含量最多的元素 O
地壳中含量最多的金属元素 Al
根据特殊性质推断 形成化合物种类最多、其单质是硬度最大的物质的元素 C
气态氢化物溶于水显碱性的元素 N
组成密度最小的气体的元素 H
气态氢化物能和它的氧化物在常温下反应生成该元素的单质的元素 S
气态氢化物和最高价氧化物对应水化物能反应生成离子化合物的元素 N
同周期、最高价氧化物对应水化物两两之间能反应的三种元素 Na、Al、S(或Cl)
知识点4 微粒半径大小比较
范围 微粒半径的变化 举例
同周期 序大→径小 Na>Mg>Al
同主族 序大→径大 Li
类型1 核素
(2023·江苏学测)我国研发高效率全钒液流电池。钒的一种核素 V,51是该核素的( )
A. 质量数 B. 质子数
C. 中子数 D. 电子数
(2022·江苏学测)质量数为28的硅原子表示为( )
A. Si B. Si
C. Si D. Si
(2021·江苏学测)“月壤”中含有 He,该原子的中子数是( )
A. 1 B. 2
C. 3 D. 5
(2020·江苏学测)为纪念门捷列夫,科学家将1955年人工合成的一种新元素用符号“Md”表示,中文命名为“钔”。核素 Md 的质量数为( )
A. 101 B. 157
C. 258 D. 359
(2024·扬州合格考模拟)O可用作示踪剂。该原子的质子数是( )
A. 8 B. 10
C. 18 D. 26
类型2 元素周期律应用——元素性质比较
(2023·江苏学测)下列说法正确的是( )
A. 原子半径:r(Cl)>r(Br) B. 非金属性:N>O
C. 碱性:NaOH>Mg(OH)2 D. 热稳定性:HBr>HCl
(2020·江苏学测)判断Cl元素的非金属性比S的强,可依据的事实是( )
A. HCl的热稳定性比H2S的强
B. 氯气能溶于水,硫难溶于水
C. 常温下,氯单质呈气态,硫单质呈固态
D. AgCl是白色固体,Ag2S是黑色固体
(2023·南京学测合格考)Na、Mg、S、Cl是短周期中的主族元素。下列叙述正确的是( )
A. 原子半径:r(Cl)>r(S)>r(Mg)>r(Na)
B. 非金属性:S>Cl
C. Na、S两种元素可形成化合物Na2S
D. 最高价氧化物的水化物的碱性:NaOH<Mg(OH)2
类型3 元素推断与性质比较
(2022·江苏学测)短周期主族元素X、Y、Z的原子序数依次增大,X与Z位于同一主族,Z的单质在常温下是黄绿色气体,Y原子的最外层只有一个电子。下列说法正确的是( )
A. X原子易失去电子
B. 原子半径:r(Z)>r(Y)>r(X)
C. Y的最高价氧化物对应的水化物是弱碱
D. Z的简单气态氢化物的热稳定性比X的弱
(2021·江苏学测)短周期主族元素X、Y、Z的原子序数依次增大,X原子最外层电子数是次外层电子数的3倍,Y是短周期中金属性最强的元素,Z与X位于同一主族。下列叙述正确的是( )
A. 原子半径:r(Z)>r(Y)>r(X)
B. X的简单气态氢化物的热稳定性比Z的弱
C. X、Y、Z三种元素可形成化合物Y2ZX4
D. Y形成的最高价氧化物对应水化物是弱碱
(2020·江苏学测)锂是元素周期表中第2周期ⅠA族元素,下列有关锂元素性质推测正确的是( )
A. 最高化合价为+2
B. 原子半径比钠的大
C. 单质与水的反应比钠更剧烈
D. 最高价氧化物对应水化物的碱性比钠的弱
(2024·常州合格考模拟)X、Y、Z、W、Q属于周期表前20号主族元素,且原子序数依次增大。X原子的最外层电子数是其内层电子数的3倍,Y是地壳中含量最多的金属元素,Z和X位于同一主族,Q是第19号元素。下列说法正确的是 ( )
A. 自然界中由X元素形成的单质只有一种
B. 原子半径:r(X)<r(Z)<r(Y)<r(Q)
C. 简单气态氢化物的热稳定性:Z>W
D. 最高价氧化物对应水化物碱性:Y>Q
(2023·盐城学测合格考)X、Y、Z、W是元素周期表中前20号元素,且原子序数依次增大。X的一种核素在考古时常用来鉴定一些文物的年代,Y原子最外层电子数是其内层电子数的3倍,Z元素的最高正化合价与最低化合价代数和为零,W元素原子最外层只有一个电子。下列关于这几种元素的说法正确的是( )
A. Z的氧化物是一种重要的半导体材料
B. Y跟W只能形成一种氧化物
C. X与Z为同主族元素
D. 原子半径:r(X)<r(Y)<r(W)
课时12 元素周期表和元素周期律
[知识梳理]
[知识点1] 1. 电子层数 核电荷数 最外层电子数
[典型例题]
例题1 A 【解析】V符号左上角表示的是质量数,A正确。
例题2 C 【解析】Si元素的质子数为14,用符号表示时,写在元素符号的左下角,左上角写质量数,即为 Si,C正确。
例题3 A 【解析】He的中子数=3-2=1,A正确。
例题4 C 【解析】元素符号的左上角是质量数,C正确。
变式1 A
例题5 C 【解析】同一主族元素电子层数越大,原子半径越大,Br原子的半径大于Cl原子,A错误;同周期主族元素,从左至右,非金属性逐渐增强,N元素的非金属性弱于O元素, B错误;同周期主族元素,从左至右,金属性逐渐减弱,金属元素最高价氧化物对应的水化物的碱性逐渐减弱,NaOH的碱性强于Mg(OH)2 ,C正确;同一主族元素,从上至下,非金属性逐渐减弱,简单氢化物的热稳定性逐渐减弱,HBr的热稳定性小于HCl,D错误。
例题6 A 【解析】比较非金属性可根据单质与氢气化合的难易程度、简单气态氢化物的热稳定性、最高价氧化物对应水化物的酸性强弱进行比较,A正确。
变式2 C 【解析】Na、Mg、S、Cl四种元素处于同一周期,从左至右,原子半径越来越小,非金属性越来越强,非金属性:S<Cl,A错误,B错误;最高价氧化物的水化物的碱性:NaOH>Mg(OH)2,D错误。
例题7 D 【解析】X、Y、Z三种元素分别为F、Na、Cl。F原子易得到电子,A错误;原子半径:r(Na)>r(Cl)>r(F),B错误;NaOH为强碱,C错误;Cl元素的非金属性弱于F,则HCl的热稳定性比HF的弱,D正确。
例题8 C 【解析】X、Y、Z分别为O、Na、S,原子半径:Na>S>O,A错误;非金属性越强,气态氢化物越稳定,热稳定性:H2O>H2S,B错误;O、Na、S可形成Na2SO4,C正确;NaOH属于强碱,D错误。
例题9 D 【解析】锂是第2周期ⅠA族元素,最高化合价是+1,A错误;同主族元素从上到下原子半径逐渐增大,锂的原子半径小于钠的原子半径,B错误;同主族元素的单质从上到下金属性逐渐增强,与水反应剧烈程度增大,最高价氧化物对应水化物的碱性增强,C错误;D正确。
例题10 B 【解析】X为O元素、Y为Al元素、Z为S元素、W为Cl元素、Q为K元素。O元素能形成氧气和臭氧,A错误; 原子半径:r(O)<r(S)<r(Al)<r(K),B正确;氯元素的非金属性比硫强,所以简单气态氢化物的热稳定性:HCl>H2S,C错误;K的金属性比Al的强,则最高价氧化物对应水化物碱性:KOH>Al(OH)3,D错误。
变式3 C 【解析】X、Y、Z、W四种元素分别为C、O、Si、K。硅为半导体材料,A错误;O和K元素可形成氧化钾和过氧化钾等,B错误;半径:r(O)<r(C),D错误。
同课章节目录
