4.3 课时1 离子键与离子化合物 课件 (共21张PPT) 2024-2025学年高一化学人教版(2019)必修一
文档属性
| 名称 | 4.3 课时1 离子键与离子化合物 课件 (共21张PPT) 2024-2025学年高一化学人教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 15.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-07 21:40:38 | ||
图片预览






文档简介
(共21张PPT)
离子键与离子化合物
第四章 物质结构 元素周期律
宏观辨识与微观探析:
会用电子式表示常见离子化合物的形成过程,促进“宏观辩识与微观探析”化学核心素养的发展。
证据推理与模型认知:
通过实验的演示,提升观察分析实验现象、得出结论的能力。由离子通过离子键能 结合成离子化合物,学会微观的问题认知模型。
科学探究与创新意识:
体验发现问题、解决问题的化学乐趣,建立个性与共性、对立与统一的科学辩证观。
从元素周期表可以看出,到目前为止,已经发现的元素有一百多种。然而,由这一百多种元素的原子构成的物质已超过1亿种。
这些物质都是由原子,离子,分子等组成的,那么这些微粒缘何而聚呢?
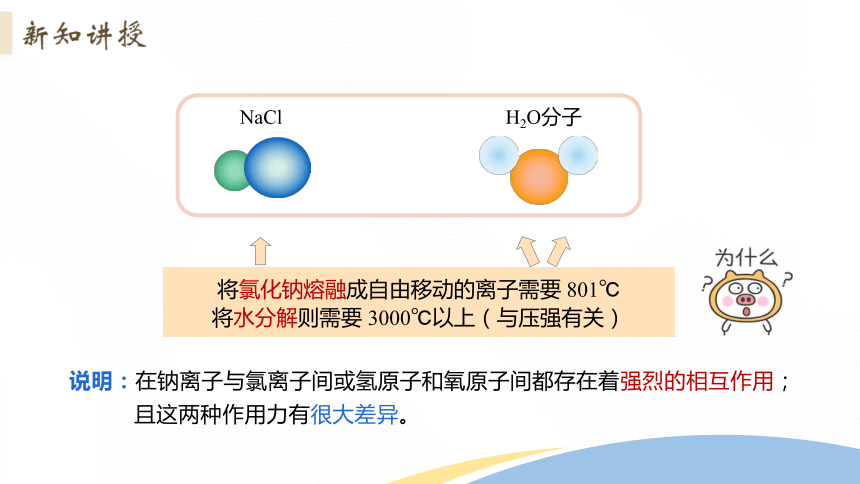
NaCl
金刚石
干冰
将氯化钠熔融成自由移动的离子需要 801℃
将水分解则需要 3000℃以上(与压强有关)
NaCl
H2O分子
说明:在钠离子与氯离子间或氢原子和氧原子间都存在着强烈的相互作用;
且这两种作用力有很大差异。
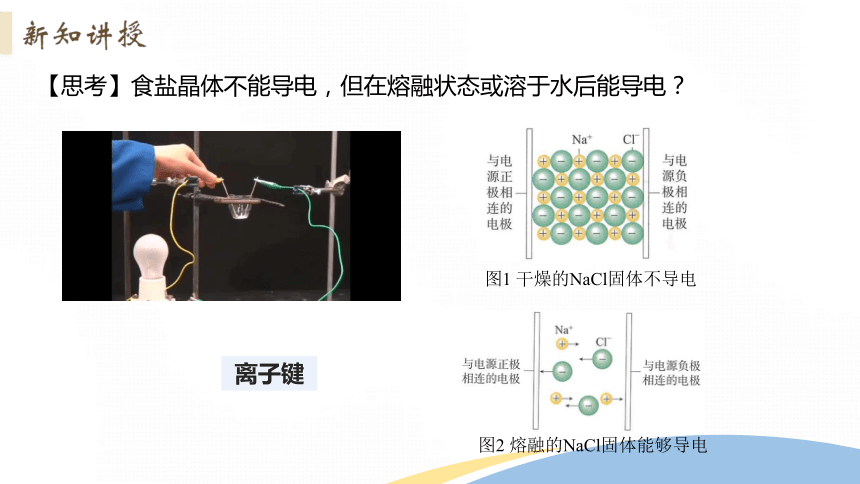
【思考】食盐晶体不能导电,但在熔融状态或溶于水后能导电?
离子键
图1 干燥的NaCl固体不导电
图2 熔融的NaCl固体能够导电
一、化学键
1.化学键:物质中直接相邻的原子或离子之间存在的强烈的相互作用
注意:①直接相邻 ②强烈的相互作用
在水分子中
O与H直接相邻
H与H非直接相邻
相互作用比较强烈
相互作用比较弱
2.化学键的分类:
什么是离子键和共价键呢?它们分别是通过什么作用形成物质的呢?
化学键
离子键
金属键
共价键
极性键
非极性键
二、离子键与离子化合物
NaCl
【思考讨论】氯化钠是我们熟悉的物质。从原子结构的角度来看,钠原子和氯原子是怎样形成氯化钠的呢?
离子键的形成 (以氯化钠的形成过程为例)
Na+
Cl-
电子转移
不稳定
稳定
体系能量降低
静电作用
离子键:阴、阳离子结合的相互作用(成键本质:强烈的静电作用)
离子化合物:许多阴、阳离子通过静电作用便形成了离子化合物。
即:含离子键的化合物
1.离子键
思考与讨论:
类比氯化钠,能否列举一些常见的离子化合物?
请根据常见的离子化合物,总结含有哪些元素的物质中更容易含有离子键?
强碱(NaOH、KOH);钾盐、钠盐、铵盐等大多数盐;活泼金属氧化物(Na2O、CaO)
静电引力和静电斥力
易形成阳离子和阴离子的元素
2.常见的离子化合物
物质类别 常见代表物 性质特点
离子化合物 NaOH、NaCl、MgCl2、KCl、Na2SO4、NH4Cl、Na2O、MgO 强碱、大多数盐及金属氧化物 熔融态能导电
熔沸点高、硬度大、难挥发
下列哪些物质是离子化合物?哪些存在离子键?
Na2O MgCl2 NH4Cl HCl
Na2O2 NaOH KNO3 SO2
经验之谈:
含有离子键的物质必为离子化合物;
离子化合物中一定含有离子键。
形成离子键肯定要有活泼金属离子或 NH4+ 参与。
三、用电子式表示微粒以及离子化合物
原子:H、O、Cl、Mg、Na
定义:在元素符号周围用“ ” 或 “× ”来表示原子最外层电子的式子。
H
O
Cl
Mg
Na
Mg
2
Cl
O
2-
Na
Cl
Na
Na
O
2-
Na
Cl
Mg
2
Cl
离子:Cl-、O2-、Mg2+、Na+
离子化合物:NaCl、Na2O、MgCl2
离子化合物的电子式:阴阳离子交替书写,相同离子不能合并
电子较均匀分散在元素符号四周,每个方向不超过 2 个
阴离子要加方括号,并注明所带电荷数;阳离子的电子式就是其离子符号。
下列电子式书写正确的有( )
Cl
E
F
G
H
D、G
用电子式表示离子化合物的形成过程
以氯化钠形成为例:
类比上式,用电子式表示离子化合物 K2S、MgBr2 的形成过程:
S
K
K
S
2-
K
K
Br
Mg
Br
Mg
2
Br
Br
下列电子式及形成过程是否正确,错误的请写出正确书写。
(1)S2-: _____________________________;
(2)Na2S: _______________________________;
(3)Cl-: ____________________________________;
(4)CaF2: __________________________________;
(5)KCl的形成过程: ____________________________________;
(6)MgCl2的形成过程: _____________________________。
错误,
错误,
错误,
错误,
错误,
错误,
注意:电子式、或用其表示离子化合物的形成过程时
1、离子须注明电荷数;
2 、相同的原子可以合并写,相同的离子要分开写;
3、阴离子要用方括号括起;
4、不能把 “→”写成 “ =”
5、用箭头表明电子转移方向
化学键
离子键
金属键
共价键
从微观角度理解离子键的形成
离子键
离子化合物
电子式
电子式的定义
电子式的书写
用电子式表示离子化合物的形成过程
1、下列说法正确的是( )
A.含有金属元素的化合物一定是离子化合物
B.第IA族和第VIIA族原子化合时,一定形成离子键
C.由非金属元素形成的化合物一定不是离子化合物
D.活泼金属与非金属化合时,能形成离子键
D
2. 下列物质中属于离子化合物的是 ( )
A.硝酸 B.氨气 C.氯化铵 D.氯化氢
3. 下列物质中,含有离子键的是( )
A.HCl B.H2O2 C.K2O D.H2SO4
C
C
离子键与离子化合物
第四章 物质结构 元素周期律
宏观辨识与微观探析:
会用电子式表示常见离子化合物的形成过程,促进“宏观辩识与微观探析”化学核心素养的发展。
证据推理与模型认知:
通过实验的演示,提升观察分析实验现象、得出结论的能力。由离子通过离子键能 结合成离子化合物,学会微观的问题认知模型。
科学探究与创新意识:
体验发现问题、解决问题的化学乐趣,建立个性与共性、对立与统一的科学辩证观。
从元素周期表可以看出,到目前为止,已经发现的元素有一百多种。然而,由这一百多种元素的原子构成的物质已超过1亿种。
这些物质都是由原子,离子,分子等组成的,那么这些微粒缘何而聚呢?
NaCl
金刚石
干冰
将氯化钠熔融成自由移动的离子需要 801℃
将水分解则需要 3000℃以上(与压强有关)
NaCl
H2O分子
说明:在钠离子与氯离子间或氢原子和氧原子间都存在着强烈的相互作用;
且这两种作用力有很大差异。
【思考】食盐晶体不能导电,但在熔融状态或溶于水后能导电?
离子键
图1 干燥的NaCl固体不导电
图2 熔融的NaCl固体能够导电
一、化学键
1.化学键:物质中直接相邻的原子或离子之间存在的强烈的相互作用
注意:①直接相邻 ②强烈的相互作用
在水分子中
O与H直接相邻
H与H非直接相邻
相互作用比较强烈
相互作用比较弱
2.化学键的分类:
什么是离子键和共价键呢?它们分别是通过什么作用形成物质的呢?
化学键
离子键
金属键
共价键
极性键
非极性键
二、离子键与离子化合物
NaCl
【思考讨论】氯化钠是我们熟悉的物质。从原子结构的角度来看,钠原子和氯原子是怎样形成氯化钠的呢?
离子键的形成 (以氯化钠的形成过程为例)
Na+
Cl-
电子转移
不稳定
稳定
体系能量降低
静电作用
离子键:阴、阳离子结合的相互作用(成键本质:强烈的静电作用)
离子化合物:许多阴、阳离子通过静电作用便形成了离子化合物。
即:含离子键的化合物
1.离子键
思考与讨论:
类比氯化钠,能否列举一些常见的离子化合物?
请根据常见的离子化合物,总结含有哪些元素的物质中更容易含有离子键?
强碱(NaOH、KOH);钾盐、钠盐、铵盐等大多数盐;活泼金属氧化物(Na2O、CaO)
静电引力和静电斥力
易形成阳离子和阴离子的元素
2.常见的离子化合物
物质类别 常见代表物 性质特点
离子化合物 NaOH、NaCl、MgCl2、KCl、Na2SO4、NH4Cl、Na2O、MgO 强碱、大多数盐及金属氧化物 熔融态能导电
熔沸点高、硬度大、难挥发
下列哪些物质是离子化合物?哪些存在离子键?
Na2O MgCl2 NH4Cl HCl
Na2O2 NaOH KNO3 SO2
经验之谈:
含有离子键的物质必为离子化合物;
离子化合物中一定含有离子键。
形成离子键肯定要有活泼金属离子或 NH4+ 参与。
三、用电子式表示微粒以及离子化合物
原子:H、O、Cl、Mg、Na
定义:在元素符号周围用“ ” 或 “× ”来表示原子最外层电子的式子。
H
O
Cl
Mg
Na
Mg
2
Cl
O
2-
Na
Cl
Na
Na
O
2-
Na
Cl
Mg
2
Cl
离子:Cl-、O2-、Mg2+、Na+
离子化合物:NaCl、Na2O、MgCl2
离子化合物的电子式:阴阳离子交替书写,相同离子不能合并
电子较均匀分散在元素符号四周,每个方向不超过 2 个
阴离子要加方括号,并注明所带电荷数;阳离子的电子式就是其离子符号。
下列电子式书写正确的有( )
Cl
E
F
G
H
D、G
用电子式表示离子化合物的形成过程
以氯化钠形成为例:
类比上式,用电子式表示离子化合物 K2S、MgBr2 的形成过程:
S
K
K
S
2-
K
K
Br
Mg
Br
Mg
2
Br
Br
下列电子式及形成过程是否正确,错误的请写出正确书写。
(1)S2-: _____________________________;
(2)Na2S: _______________________________;
(3)Cl-: ____________________________________;
(4)CaF2: __________________________________;
(5)KCl的形成过程: ____________________________________;
(6)MgCl2的形成过程: _____________________________。
错误,
错误,
错误,
错误,
错误,
错误,
注意:电子式、或用其表示离子化合物的形成过程时
1、离子须注明电荷数;
2 、相同的原子可以合并写,相同的离子要分开写;
3、阴离子要用方括号括起;
4、不能把 “→”写成 “ =”
5、用箭头表明电子转移方向
化学键
离子键
金属键
共价键
从微观角度理解离子键的形成
离子键
离子化合物
电子式
电子式的定义
电子式的书写
用电子式表示离子化合物的形成过程
1、下列说法正确的是( )
A.含有金属元素的化合物一定是离子化合物
B.第IA族和第VIIA族原子化合时,一定形成离子键
C.由非金属元素形成的化合物一定不是离子化合物
D.活泼金属与非金属化合时,能形成离子键
D
2. 下列物质中属于离子化合物的是 ( )
A.硝酸 B.氨气 C.氯化铵 D.氯化氢
3. 下列物质中,含有离子键的是( )
A.HCl B.H2O2 C.K2O D.H2SO4
C
C
