专题四 选择题专攻 常见电化学装置图分析(含解析)-2025高考化学二轮复习
文档属性
| 名称 | 专题四 选择题专攻 常见电化学装置图分析(含解析)-2025高考化学二轮复习 |  | |
| 格式 | docx | ||
| 文件大小 | 54.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-09 17:42:57 | ||
图片预览

文档简介
专题四 选择题专攻 常见电化学装置图分析
题型突破练 电化学装置图(一)——原电池 [分值:50分]
(选择题1~10题,每小题4分,11~12题,每小题5分,共50分)
1.(2024·苏州高三三模)如图所示装置中,C1、C2是石墨电极。A中盛有棕色的KI和I2的混合溶液,B中盛有无色的Na3AsO4和Na3AsO3的混合溶液。当连接开关K,并向B中滴加浓盐酸时,发现电流表的指针向右偏转。一段时间后,当电流表指针回到中间“0”位置时,再向B中滴加过量浓NaOH溶液,可观察到电流表指针向左偏转。下列说法正确的是( )
A.电流表的指针向右偏转时,化学能转变为电能;向左偏转时,电能转变为化学能
B.电流表的指针向右偏转时,C1电极反应为2I--2e-===I2
C.电流表的指针向左偏转时,C2电极反应为-2e-+H2O===As+2H+
D.由上述实验现象可知,氧化性:>I2
2.(2024·南京市玄武高级中学高三模拟)热电厂尾气经处理得到较纯的SO2,可用于原电池法生产硫酸,其工作原理如图所示。电池工作时,下列说法不正确的是( )
A.电极b为正极
B.溶液中H+由a极区向b极区迁移
C.电极a的电极反应式:SO2-2e-+2H2O===4H++
D.a极消耗SO2与b极消耗O2两者物质的量相等
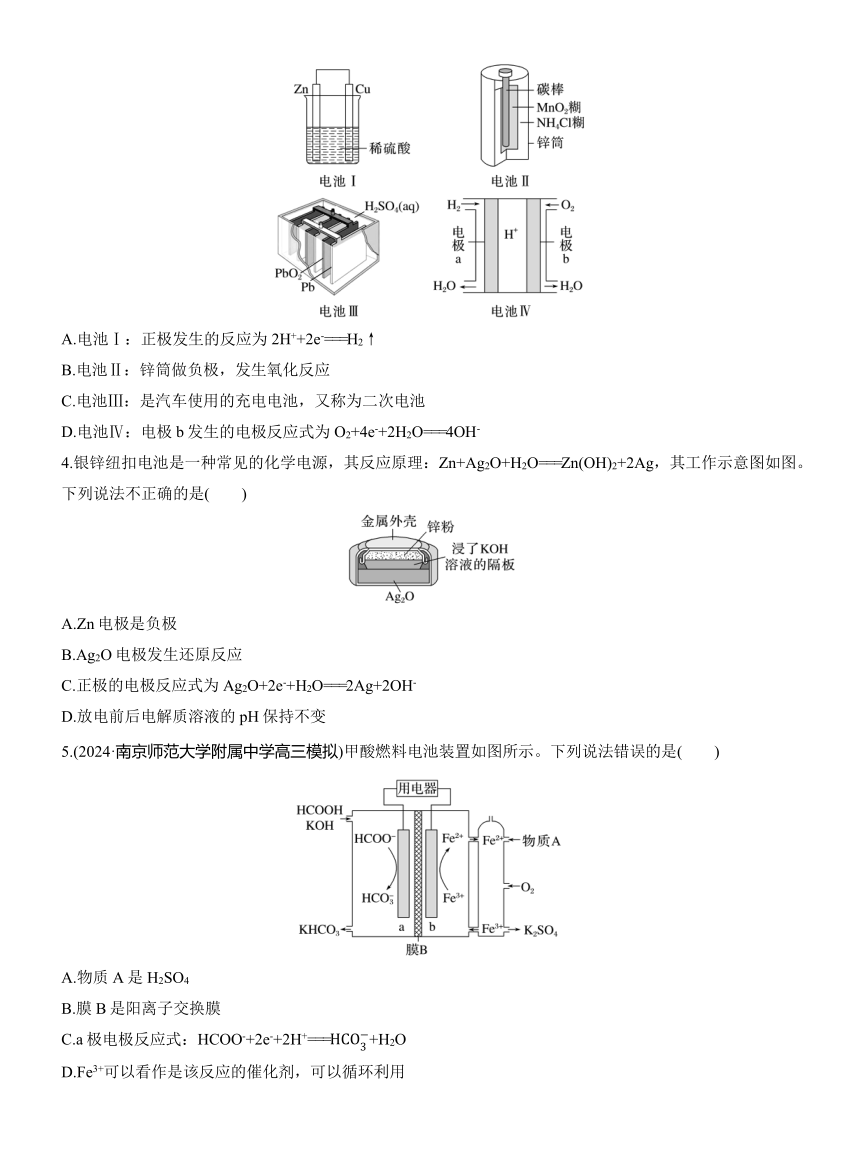
3.下列关于四种装置的叙述不正确的是( )
A.电池Ⅰ:正极发生的反应为2H++2e-===H2↑
B.电池Ⅱ:锌筒做负极,发生氧化反应
C.电池Ⅲ:是汽车使用的充电电池,又称为二次电池
D.电池Ⅳ:电极b发生的电极反应式为O2+4e-+2H2O===4OH-
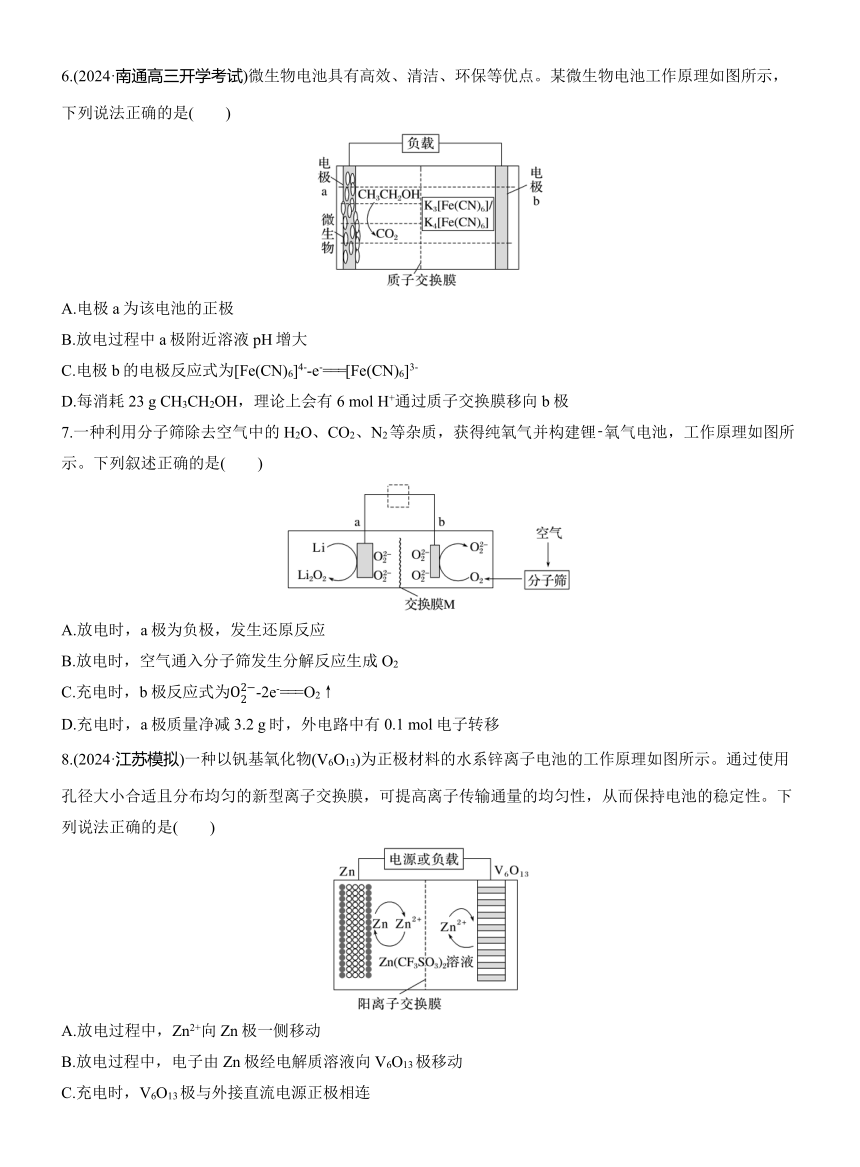
4.银锌纽扣电池是一种常见的化学电源,其反应原理:Zn+Ag2O+H2O===Zn(OH)2+2Ag,其工作示意图如图。下列说法不正确的是( )
A.Zn电极是负极
B.Ag2O电极发生还原反应
C.正极的电极反应式为Ag2O+2e-+H2O===2Ag+2OH-
D.放电前后电解质溶液的pH保持不变
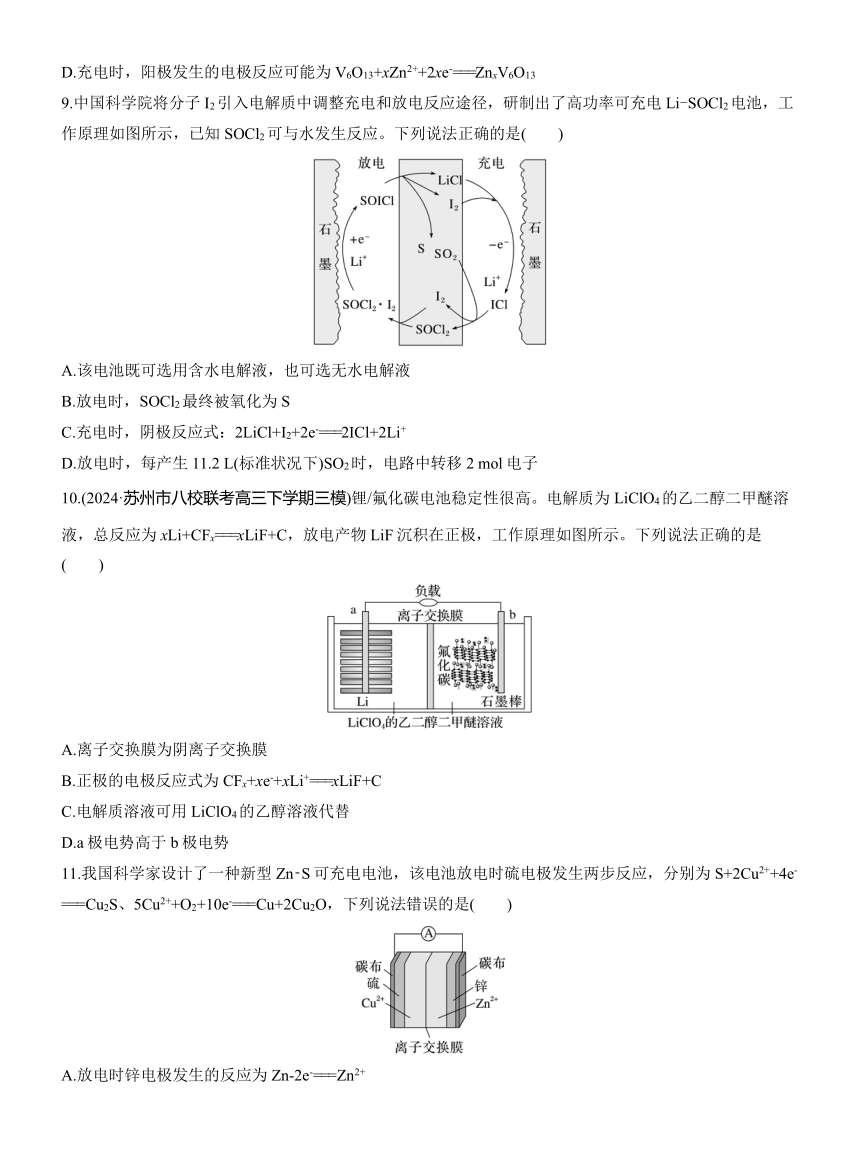
5.(2024·南京师范大学附属中学高三模拟)甲酸燃料电池装置如图所示。下列说法错误的是( )
A.物质A是H2SO4
B.膜B是阳离子交换膜
C.a极电极反应式:HCOO-+2e-+2H+===+H2O
D.Fe3+可以看作是该反应的催化剂,可以循环利用
6.(2024·南通高三开学考试)微生物电池具有高效、清洁、环保等优点。某微生物电池工作原理如图所示,下列说法正确的是( )
A.电极a为该电池的正极
B.放电过程中a极附近溶液pH增大
C.电极b的电极反应式为[Fe(CN)6]4--e-===[Fe(CN)6]3-
D.每消耗23 g CH3CH2OH,理论上会有6 mol H+通过质子交换膜移向b极
7.一种利用分子筛除去空气中的H2O、CO2、N2等杂质,获得纯氧气并构建锂 氧气电池,工作原理如图所示。下列叙述正确的是( )
A.放电时,a极为负极,发生还原反应
B.放电时,空气通入分子筛发生分解反应生成O2
C.充电时,b极反应式为-2e-===O2↑
D.充电时,a极质量净减3.2 g时,外电路中有0.1 mol电子转移
8.(2024·江苏模拟)一种以钒基氧化物(V6O13)为正极材料的水系锌离子电池的工作原理如图所示。通过使用孔径大小合适且分布均匀的新型离子交换膜,可提高离子传输通量的均匀性,从而保持电池的稳定性。下列说法正确的是( )
A.放电过程中,Zn2+向Zn极一侧移动
B.放电过程中,电子由Zn极经电解质溶液向V6O13极移动
C.充电时,V6O13极与外接直流电源正极相连
D.充电时,阳极发生的电极反应可能为V6O13+xZn2++2xe-===ZnxV6O13
9.中国科学院将分子I2引入电解质中调整充电和放电反应途径,研制出了高功率可充电Li-SOCl2电池,工作原理如图所示,已知SOCl2可与水发生反应。下列说法正确的是( )
A.该电池既可选用含水电解液,也可选无水电解液
B.放电时,SOCl2最终被氧化为S
C.充电时,阴极反应式:2LiCl+I2+2e-===2ICl+2Li+
D.放电时,每产生11.2 L(标准状况下)SO2时,电路中转移2 mol电子
10.(2024·苏州市八校联考高三下学期三模)锂/氟化碳电池稳定性很高。电解质为LiClO4的乙二醇二甲醚溶液,总反应为xLi+CFx===xLiF+C,放电产物LiF沉积在正极,工作原理如图所示。下列说法正确的是( )
A.离子交换膜为阴离子交换膜
B.正极的电极反应式为CFx+xe-+xLi+===xLiF+C
C.电解质溶液可用LiClO4的乙醇溶液代替
D.a极电势高于b极电势
11.我国科学家设计了一种新型Zn S可充电电池,该电池放电时硫电极发生两步反应,分别为S+2Cu2++4e-===Cu2S、5Cu2++O2+10e-===Cu+2Cu2O,下列说法错误的是( )
A.放电时锌电极发生的反应为Zn-2e-===Zn2+
B.该电池充电时Cu2+的浓度增大
C.该电池放电时电子从锌电极流出
D.每生成1 mol铜,外电路中通过10 mol电子
12.(2024·常州市第一中学高三模拟)LTO材料(Li4Ti5O12和Li4+xTi5O12)是新型锂离子电池的核心材料之一,放电时的工作原理如图1所示(为方便表示,忽略原子半径大小),LTO材料在充放电过程中的相互转化如图2所示,下列说法正确的是( )
A.KCl的有机溶液可以用KCl的水溶液代替
B.每转移1 mol电子,正极材料质量减少7 g
C.图2所示A→B的转化为放电时LTO材料中晶胞的变化
D.充电时,阳极的电极反应式为Li++e-===Li
题型突破练 电化学装置图(二)——电解池 [分值:50分]
(选择题1~10题,每小题4分,11~12题,每小题5分,共50分)
1.(2024·南通市高三下学期期中)利用CoP催化剂可实现肼氧化辅助制氢,下列叙述正确的是( )
A.图中甲池是电解池,乙池是原电池
B.电极C附近溶液pH下降
C.该装置可实现N2H4循环制氢
D.制得1 mol H2的同时可制得1 mol N2
2.(2024·苏州高三模拟)利用电解产生的H2O2与Fe2+发生反应生成高活性的羟基自由基(·OH,有很强氧化性),能有效降解水体中的有机污染物,原理如图所示。下列说法正确的是( )
A.电源的B极为负极
B.生成羟基自由基的反应仅有一个
C.利用羟基自由基来处理有机物,效率高、无污染
D.电解池外电路转移2 mol电子,理论上可产生的·OH为2 mol
3.(2024·南通市高三下学期模拟)利用如图所示装置可实现化学储氢。下列说法正确的是( )
A.Y为电源负极
B.电解后硫酸溶液的物质的量浓度减小
C.电极a上发生的反应为+6H++6e-===
D.电解过程中每生成11.2 L O2,理论上可储存1 mol H2
4.(2024·南京、盐城高三模拟)一种电解法制备Na2FeO4的装置如图所示。下列说法正确的是( )
A.电解时化学能转化为电能
B.电解时应将铂电极与直流电源正极相连
C.电解过程中转移2 mol e-,理论上可获得标准状况下的H2 11.2 L
D.电解时铁电极反应式:Fe-6e-+8OH-===Fe+4H2O
5.(2024·南京市高三下学期第二次模拟)一种电解乙酰基吡嗪废水中的SO4制备S2O8的电化学装置如图所示。下列说法正确的是( )
A.石墨电极与直流电源正极相连
B.电解时,铂网电极附近pH增大
C.离子交换膜应选择性透过阴离子
D.阴极上的电极反应为2+2e-===S2
6.(2024·南京市第十三中学高三下学期适应性考试)科学家设计了一种CO2-HMF协同转化装置,如图所示。图中的双极膜中间层中的H2O解离为H+和OH-,并在直流电源作用下分别向两极迁移。下列叙述正确的是( )
A.催化电极A的电势高于催化电极B
B.阳极的电极反应式为
C.每生成1 mol甲酸,双极膜处有1 mol的水解离
D.转移相同电子时,理论上消耗的CO2和HMF物质的量之比为1∶3
7.利用燃料电池原理可处理高浓度的氨氮废水,同时电解含有苯酚、乙腈(CH3CN)的水溶液合成扑热息痛(),装置如图所示,其中a、b的电极材料为石墨。下列说法正确的是( )
A.溶液中的H+由甲室向乙室迁移
B.工作一段时间后,甲室溶液pH下降
C.乙室每产生1 mol N2,a电极理论上可产生H2 33.6 L(标准状况下)
D.丙室中发生反应的总化学方程式为
8.(2024·南通如皋市高三模拟)以甲苯为原料通过间接氧化法可以制取苯甲醛、苯甲酸等物质,反应原理如图所示。下列说法正确的是( )
A.电解时的阳极反应为2Cr3++6e-+7H2O===Cr2+14H+
B.电解结束后,阴极区溶液pH升高
C.1 mol甲苯氧化为0.5 mol苯甲醛和0.5 mol苯甲酸时,共消耗 mol Cr2
D.甲苯、苯甲醛、苯甲酸的混合物可以通过分液的方法分离
9.(2024·南通市高三下学期第二次调研)一种电解装置如图所示,电解时H+从右室移向左室。通过电解获得的电解液可实现。下列说法正确的是( )
A.左室电解获得的电解液可用于实现“转化Ⅰ”
B.右室发生的电极反应为Cr2+14H++6e-===2Cr3++7H2O
C.“转化Ⅱ”发生的反应为+6Ti3++6H+===+6Ti4++2H2O
D.“转化Ⅰ”生成1 mol,理论上电路中通过3 mol e-
10.(2024·江苏省姜堰中学、如东中学、前黄中学三校高三模拟)乙醛酸(OHC—COOH)是一种重要的化工中间体。工业上以乙二醛为原料制备乙醛酸的装置如图所示,通电后,阳极产物将乙二醛氧化为乙醛酸。下列说法错误的是( )
A.a极电势高于b极
B.离子交换膜为阴离子交换膜
C.当有0.5 mol离子通过离子交换膜时,理论上最多可生成乙醛酸的质量为18.5 g
D.乙二醛被氧化的化学方程式:+H2O+Cl2+2HCl
11.(2024·江苏省部分重点高中高三模拟)利用如图的电化学装置,可实现对CO2的固定。下列说法错误的是( )
A.向b电极移动
B.a电极的电极反应式为
C.电解过程中有H+生成
D.b电极的Pt用Cu代替后总反应不变
12.(2023·南京师范大学附属中学高三模拟)科研人员发现利用低温固体质子导体作电解质,催化合成NH3,与传统的热催化合成氨相比,催化效率较高。其合成原理如图1所示,电源电压改变与生成NH3速率的关系如图2所示,下列说法不正确的是( )
A.Pt-C是该合成氨装置的阳极
B.Pt-C3N4电极上发生的反应为N2+6H++6e-===2NH3
C.若H2的进出口流量差为22.4 L·min-1,则固体质子导体中H+的流速为2 mol·min-1
D.当电压高于1.2 V时,混合气体中N2和NH3的体积分数之和小于100%
答案精析
电化学装置图(一)——原电池
1.B [当连接开关K,并向B中滴加浓盐酸时,发现电流表的指针向右偏转,说明此时C2电极是正极,C1电极是负极。一段时间后,当电流表指针回到中间“0”位置,再向B中滴加过量浓NaOH溶液,可观察到电流表指针向左偏转,说明此时C2电极是负极,C1电极是正极,据此解答。不论电流表的指针向右偏转还是向左偏转,均是原电池,都是化学能转变为电能,A错误;电流表的指针向右偏转时,C1电极是负极,其电极反应为2I--2e-I2,B正确;电流表的指针向左偏转时,C2电极是负极,其电极反应为-2e-+2OH-As+H2O,C错误;根据以上分析可知在酸性溶液中氧化性:>I2,在碱性溶液中氧化性:2.D [该装置为原电池,SO2转化成较浓H2SO4,S元素的化合价升高,失电子发生氧化反应,则电极a为负极,电极反应式为SO2-2e-+2H2O4H++S,电极b为正极,O2得电子发生还原反应,电极反应式为O2+4e-+4H+2H2O,H+从a极区移向b极区,根据得失电子守恒,a极消耗SO2与b极消耗O2两者物质的量之比为2∶1,故A、B、C正确,D错误。]
3.D [电池Ⅰ为Zn Cu 硫酸电池,Zn作负极,Cu作正极,氢离子在正极得电子生成氢气,电极反应为2H++2e-H2↑,故A正确;锌锰干电池中,Zn作负极,失电子发生氧化反应,故B正确;酸性条件下,电极b发生的电极反应式为O2+4e-+4H+2H2O,故D错误。]
4.D [Ag2O电极作正极,得电子发生还原反应,其电极反应为Ag2O+H2O+2e-2Ag+2OH-,B、C正确;氢氧根离子的物质的量虽然不变,但水的量减少,KOH的浓度增大,pH增大,D错误。]
5.C [Fe2+、Fe3+的存在环境为酸性,且生成物为K2SO4,故物质A为H2SO4,A正确;装置中K+由负极移向正极,则膜B是阳离子交换膜,B正确;a电极上HCOO-被氧化为HC,其电极反应式为HCOO--2e-+2OH-+H2O,C错误;Fe3+先被还原为Fe2+,Fe2+又被O2氧化生成Fe3+,Fe3+可以循环利用,可看作是该反应的催化剂,D正确。]
6.D [电极b为正极,电极反应为[Fe(CN)6]3-+e-[Fe(CN)6]4-,电极a为负极,电极反应为CH3CH2OH-12e-+3H2O2CO2↑+12H+,A、B、C错误;根据a极的电极反应式可知每消耗23 g CH3CH2OH(即0.5 mol),有6 mol H+通过质子交换膜移向b极,D正确。]
7.C [放电时,a极为负极,发生氧化反应,A错误;分子筛分离出氧气,属于物理变化,B错误;充电时,b极为阳极,过氧根离子发生氧化反应生成氧气,C正确;充电时,a极为阴极,电极反应式为Li2O2+2e-2Li+,阴极减少的质量等于脱去过氧根离子的质量,阴极净减3.2 g,相当于脱离0.1 mol ,电路中应有0.2 mol电子转移,D错误。]
8.C [放电过程中,Zn极为负极,Zn失电子生成Zn2+进入溶液,Zn2+向正极一侧移动,A不正确;电子不能经过电解质溶液,B不正确;充电时,V6O13极作阳极,与外接直流电源正极相连,C正确;充电时,阳极发生的电极反应可能为ZnxV6O13-2xe-V6O13+xZn2+,D不正确。]
9.D [Li能与氧气、水反应,SOCl2可与水反应,故电池工作环境必须在无水无氧的条件下进行,A错误;由工作原理图可知,放电时,正极上SOCl2转化为SOICl,SOICl再转化为S、SO2,SOCl2最终被还原,B错误;充电时,I2失电子发生氧化反应转化为ICl,阳极反应式为2LiCl+I2-2e-2ICl+2Li+,C错误;放电时,正极反应式为2SOCl2+4e-S+SO2↑+4Cl-,每产生11.2 L(标准状况下)SO2时,电路中转移2 mol电子,D正确。]
10.B [a极上Li失电子生成Li+,Li+通过离子交换膜在正极b上形成LiF,所以交换膜为阳离子交换膜,A错误;石墨棒电极为正极,在正极上附着的CFx得电子,正极的电极反应式为CFx+xe-+xLi+xLiF+C,B正确; 金属Li是活泼金属,能与乙醇反应,所以不能用乙醇溶液做电解质溶液,C错误;a为负极,b为正极,b极电势高于a极电势,D错误。]
11.D [由题意知放电时硫作正极,锌作负极,锌失去电子发生氧化反应:Zn-2e-Zn2+,A正确;放电时,铜离子转化为Cu2S、Cu2O、Cu,则充电时Cu2S、Cu2O、Cu转化为铜离子,Cu2+的浓度增大,B正确;该电池放电时电子从负极(锌电极)流出,C正确;由反应5Cu2++O2+10e-Cu+2Cu2O可知,每生成1 mol铜,通过10 mol电子,由于该电池放电时硫电极发生两步反应,故外电路中通过的电子大于10 mol,D错误。]
12.C [锂能与水反应生成氢氧化锂和氢气,所以氯化钾的有机溶液不能用氯化钾的水溶液代替,故A错误;放电时,LTO材料电极为正极,锂离子与Li4Ti5O12在正极反应生成Li4+xTi5O12,则转移1 mol电子时,正极材料增加7 g,故B错误;充电时,锂离子在阴极得到电子发生还原反应生成锂,电极反应式为Li++e-Li,故D错误。]
电化学装置图(二)——电解池
1.D [由图可知甲装置能自发的进行氧化还原反应,所以甲是原电池,电极B为负极,电极反应为N2H4-4e-+4OH-4H2O+N2,则电极A为正极,电极反应为O2+2H2O+4e-4OH-,总反应为N2H4+O22H2O+N2;乙装置属于电解池,与电源的负极B相连的电极C为阴极,电极反应为2H2O+2e-H2↑+2OH-,电极D为阳极,电极反应为N2H4-4e-+4OH-4H2O+N2↑,据此分析解题。图中甲池是原电池,乙池是电解池,A错误;电极C附近溶液pH增大,B错误;该装置消耗N2H4,无法实现N2H4循环制氢,C错误;当电极C上制得1 mol H2时,电极B、D上共制得1 mol N2,D正确。]
2.C [该装置为电解池,其中与电源A极相连的左侧电极的电极反应为Fe3++e-Fe2+、O2+2H++2e-H2O2,该电极为阴极,A极为电源负极,B极为正极,A错误;生成羟基自由基的反应有两个:H2O-e-H++·OH、H2O2+Fe2+Fe(OH)2++·OH,B错误;根据生成羟基自由基的反应,电解池外电路转移2 mol电子,则阳极反应:H2O-e-H++·OH,有2 mol·OH生成,阴极区也可生成·OH,故理论上可产生的·OH大于2 mol,D错误。]
3.C [由图可知,在惰性电极a得到电子生成,惰性电极a为阴极,惰性电极b为阳极,与电源的正极相连,Y为电源正极,A错误;惰性电极b为阳极,H2O在阳极失去电子生成O2,电极反应式为2H2O-4e-O2↑+4H+,H+通过质子交换膜进入阴极区,硫酸溶液中H+物质的量不变,但水消耗了,硫酸溶液的物质的量浓度增大,B错误;未说明11.2 L O2所处的温度和压强,无法计算O2的物质的量,D错误。]
4.D [该装置为电解池,将电能转化成化学能,故A错误;电解法制备Na2FeO4,铁元素化合价由0价升高到+6价,则铁电极作阳极,铂电极为阴极,与电源负极相连,故B错误;阴极反应式为2H2O+2e-H2↑+2OH-,转移2 mol电子,生成1 mol氢气,则标准状况下,生成氢气体积为22.4 L,故C错误;铁电极为阳极,电极反应式为Fe-6e-+8OH-Fe+4H2O,故D正确。]
5.B [电解乙酰基吡嗪废水中的SO4制备S2O8,由图可知,铂网电极上SO4失去电子发生氧化反应生成S2O8,为阳极,则石墨电极为阴极,与直流电源负极相连,A错误;电解时,铂网电极为阳极,电极反应式为-2e-S2,阴极反应式为2H++2e-H2↑,则右侧氢离子通过阳离子交换膜进入左侧,使得铂网电极附近pH增大,B正确,C、D错误。]
6.B [由图可知,二氧化碳得电子发生还原反应转化为甲酸,则催化电极A为阴极,催化电极B为阳极。阳极电势高于阴极,故催化电极A的电势低于催化电极B,A错误;在碱性条件下,阳极的失去电子发生氧化反应,电极反应式为,B正确;二氧化碳得电子发生还原反应生成甲酸:CO2+2e-+2H+HCOOH,则每生成1 mol甲酸,转移2 mol电子,双极膜处有2 mol的水解离,C错误;结合电极反应可知,转移相同电子时,理论上消耗的CO2和HMF物质的量之比为3∶1,D错误。]
7.D [燃料电池甲通入空气为正极,发生得电子的还原反应,乙中铵根离子发生氧化反应生成氮气,为负极;b极为阳极,a极为阴极;原电池中阳离子由负极移向正极,即溶液中的H+由乙室向甲室迁移,A错误;甲室为燃料电池的正极区,电极反应:O2+4e-+4H+2H2O,溶液pH增大,B错误;乙室每产生1 mol N2,转移6 mol电子,根据得失电子守恒,可生成标准状况下3 mol H2,对应气体体积为67.2 L,C错误。]
8.C [电解时阳极发生氧化反应,电极反应为2Cr3+-6e-+7H2OCr2+14H+,A错误;阳极区产生的氢离子透过质子交换膜进入阴极区,阴极上氢离子放电,电极反应为2H++2e-H2↑,电极上每消耗2 mol H+,就有2 mol H+进入阴极区,故电解结束后,阴极区溶液pH不变,B错误;结合3C6H5—CH3+2Cr2+16H+3C6H5—CHO +4Cr3++11H2O,0.5 mol甲苯被氧化为0.5 mol苯甲醛时消耗 mol Cr2,根据C6H5—CH3+Cr2+8H+C6H5—COOH +2Cr3++5H2O,0.5 mol甲苯被氧化为0.5 mol苯甲酸时消耗0.5 mol Cr2,则1 mol甲苯被氧化为0.5 mol苯甲醛和0.5 mol苯甲酸时,共消耗 mol Cr2,C正确;甲苯、苯甲醛、苯甲酸互溶,不可以通过分液的方法分离,D错误。]
9.C [根据氢离子在电解池中移动方向可知,a电极为阴极,b电极为阳极,阳极反应:2Cr3+-6e-+7H2OCr2+14H+,阴极反应:Ti4++e-Ti3+,阳极生成的Cr2具有强氧化性,阴极生成的Ti3+具有还原性,“转化 Ⅰ”为氧化反应,可加入右室电解获得的电解液氧化实现,“转化 Ⅱ”为还原反应,可加入左室电解获得的电解液还原实现:+6Ti3++6H++6Ti4++2H2O,A、B错误,C正确;~6e-~,根据得失电子守恒,生成1 mol 理论上电路中通过6 mol e-,D错误。]
10.B [通电后,阳极产物将乙二醛氧化为乙醛酸,结合题中装置图,可知a电极为阳极,生成的Cl2与乙二醛发生氧化还原反应,b电极为阴极,发生还原反应,生成H2,阳极的电极反应式为2Cl--2e-Cl2↑,阴极的电极反应式为2H++2e-H2↑。a极为阳极,b极为阴极,因此a极电势高于b极,故A正确;氢离子由左侧经离子交换膜进入右侧,则离子交换膜为阳离子交换膜,故B错误;根据得失电子守恒有1 mol OHC—COOH~1 mol Cl2~2 mol e-,则当有0.5 mol离子通过离子交换膜时,理论上最多可生成乙醛酸的质量为 mol×74 g·mol-1=18.5 g,故C正确;氯气将乙二醛氧化为乙醛酸,自身被还原为氯离子,化学方程式为+H2O+Cl2+2HCl,故D正确。]
11.D [由图可知,a电极上和CO2得电子,发生还原反应,为阴极,则b为阳极,电解池中阴离子移向阳极,向b电极移动,A正确;a电极上和CO2得电子,电极反应式为,B正确;b为阳极发生氧化反应,水放电生成O2和H+,C正确;b电极为阳极,Pt用Cu代替后,Cu放电生成Cu2+,D错误。]
12.C [图1可知,Pt C电极是电解池的阳极,氢气在阳极失去电子发生氧化反应生成氢离子,电极反应式为H2-2e-2H+,Pt C3N4电极为阴极,酸性条件下氮气在阴极得到电子发生还原反应生成氨气,电极反应式为N2+6H++6e-2NH3,故A、B正确;未说明标准状况下,无法计算22.4 L氢气的物质的量和反应生成氢离子的物质的量,则无法计算固体质子导体中氢离子的流速,故C错误;由图2可知,当电压高于1.2 V时,生成氨气速率变慢,说明氢离子在阴极得到电子生成氢气,导致混合气体中氮气和氨气的体积分数之和小于100%,故D正确。]
题型突破练 电化学装置图(一)——原电池 [分值:50分]
(选择题1~10题,每小题4分,11~12题,每小题5分,共50分)
1.(2024·苏州高三三模)如图所示装置中,C1、C2是石墨电极。A中盛有棕色的KI和I2的混合溶液,B中盛有无色的Na3AsO4和Na3AsO3的混合溶液。当连接开关K,并向B中滴加浓盐酸时,发现电流表的指针向右偏转。一段时间后,当电流表指针回到中间“0”位置时,再向B中滴加过量浓NaOH溶液,可观察到电流表指针向左偏转。下列说法正确的是( )
A.电流表的指针向右偏转时,化学能转变为电能;向左偏转时,电能转变为化学能
B.电流表的指针向右偏转时,C1电极反应为2I--2e-===I2
C.电流表的指针向左偏转时,C2电极反应为-2e-+H2O===As+2H+
D.由上述实验现象可知,氧化性:>I2
2.(2024·南京市玄武高级中学高三模拟)热电厂尾气经处理得到较纯的SO2,可用于原电池法生产硫酸,其工作原理如图所示。电池工作时,下列说法不正确的是( )
A.电极b为正极
B.溶液中H+由a极区向b极区迁移
C.电极a的电极反应式:SO2-2e-+2H2O===4H++
D.a极消耗SO2与b极消耗O2两者物质的量相等
3.下列关于四种装置的叙述不正确的是( )
A.电池Ⅰ:正极发生的反应为2H++2e-===H2↑
B.电池Ⅱ:锌筒做负极,发生氧化反应
C.电池Ⅲ:是汽车使用的充电电池,又称为二次电池
D.电池Ⅳ:电极b发生的电极反应式为O2+4e-+2H2O===4OH-
4.银锌纽扣电池是一种常见的化学电源,其反应原理:Zn+Ag2O+H2O===Zn(OH)2+2Ag,其工作示意图如图。下列说法不正确的是( )
A.Zn电极是负极
B.Ag2O电极发生还原反应
C.正极的电极反应式为Ag2O+2e-+H2O===2Ag+2OH-
D.放电前后电解质溶液的pH保持不变
5.(2024·南京师范大学附属中学高三模拟)甲酸燃料电池装置如图所示。下列说法错误的是( )
A.物质A是H2SO4
B.膜B是阳离子交换膜
C.a极电极反应式:HCOO-+2e-+2H+===+H2O
D.Fe3+可以看作是该反应的催化剂,可以循环利用
6.(2024·南通高三开学考试)微生物电池具有高效、清洁、环保等优点。某微生物电池工作原理如图所示,下列说法正确的是( )
A.电极a为该电池的正极
B.放电过程中a极附近溶液pH增大
C.电极b的电极反应式为[Fe(CN)6]4--e-===[Fe(CN)6]3-
D.每消耗23 g CH3CH2OH,理论上会有6 mol H+通过质子交换膜移向b极
7.一种利用分子筛除去空气中的H2O、CO2、N2等杂质,获得纯氧气并构建锂 氧气电池,工作原理如图所示。下列叙述正确的是( )
A.放电时,a极为负极,发生还原反应
B.放电时,空气通入分子筛发生分解反应生成O2
C.充电时,b极反应式为-2e-===O2↑
D.充电时,a极质量净减3.2 g时,外电路中有0.1 mol电子转移
8.(2024·江苏模拟)一种以钒基氧化物(V6O13)为正极材料的水系锌离子电池的工作原理如图所示。通过使用孔径大小合适且分布均匀的新型离子交换膜,可提高离子传输通量的均匀性,从而保持电池的稳定性。下列说法正确的是( )
A.放电过程中,Zn2+向Zn极一侧移动
B.放电过程中,电子由Zn极经电解质溶液向V6O13极移动
C.充电时,V6O13极与外接直流电源正极相连
D.充电时,阳极发生的电极反应可能为V6O13+xZn2++2xe-===ZnxV6O13
9.中国科学院将分子I2引入电解质中调整充电和放电反应途径,研制出了高功率可充电Li-SOCl2电池,工作原理如图所示,已知SOCl2可与水发生反应。下列说法正确的是( )
A.该电池既可选用含水电解液,也可选无水电解液
B.放电时,SOCl2最终被氧化为S
C.充电时,阴极反应式:2LiCl+I2+2e-===2ICl+2Li+
D.放电时,每产生11.2 L(标准状况下)SO2时,电路中转移2 mol电子
10.(2024·苏州市八校联考高三下学期三模)锂/氟化碳电池稳定性很高。电解质为LiClO4的乙二醇二甲醚溶液,总反应为xLi+CFx===xLiF+C,放电产物LiF沉积在正极,工作原理如图所示。下列说法正确的是( )
A.离子交换膜为阴离子交换膜
B.正极的电极反应式为CFx+xe-+xLi+===xLiF+C
C.电解质溶液可用LiClO4的乙醇溶液代替
D.a极电势高于b极电势
11.我国科学家设计了一种新型Zn S可充电电池,该电池放电时硫电极发生两步反应,分别为S+2Cu2++4e-===Cu2S、5Cu2++O2+10e-===Cu+2Cu2O,下列说法错误的是( )
A.放电时锌电极发生的反应为Zn-2e-===Zn2+
B.该电池充电时Cu2+的浓度增大
C.该电池放电时电子从锌电极流出
D.每生成1 mol铜,外电路中通过10 mol电子
12.(2024·常州市第一中学高三模拟)LTO材料(Li4Ti5O12和Li4+xTi5O12)是新型锂离子电池的核心材料之一,放电时的工作原理如图1所示(为方便表示,忽略原子半径大小),LTO材料在充放电过程中的相互转化如图2所示,下列说法正确的是( )
A.KCl的有机溶液可以用KCl的水溶液代替
B.每转移1 mol电子,正极材料质量减少7 g
C.图2所示A→B的转化为放电时LTO材料中晶胞的变化
D.充电时,阳极的电极反应式为Li++e-===Li
题型突破练 电化学装置图(二)——电解池 [分值:50分]
(选择题1~10题,每小题4分,11~12题,每小题5分,共50分)
1.(2024·南通市高三下学期期中)利用CoP催化剂可实现肼氧化辅助制氢,下列叙述正确的是( )
A.图中甲池是电解池,乙池是原电池
B.电极C附近溶液pH下降
C.该装置可实现N2H4循环制氢
D.制得1 mol H2的同时可制得1 mol N2
2.(2024·苏州高三模拟)利用电解产生的H2O2与Fe2+发生反应生成高活性的羟基自由基(·OH,有很强氧化性),能有效降解水体中的有机污染物,原理如图所示。下列说法正确的是( )
A.电源的B极为负极
B.生成羟基自由基的反应仅有一个
C.利用羟基自由基来处理有机物,效率高、无污染
D.电解池外电路转移2 mol电子,理论上可产生的·OH为2 mol
3.(2024·南通市高三下学期模拟)利用如图所示装置可实现化学储氢。下列说法正确的是( )
A.Y为电源负极
B.电解后硫酸溶液的物质的量浓度减小
C.电极a上发生的反应为+6H++6e-===
D.电解过程中每生成11.2 L O2,理论上可储存1 mol H2
4.(2024·南京、盐城高三模拟)一种电解法制备Na2FeO4的装置如图所示。下列说法正确的是( )
A.电解时化学能转化为电能
B.电解时应将铂电极与直流电源正极相连
C.电解过程中转移2 mol e-,理论上可获得标准状况下的H2 11.2 L
D.电解时铁电极反应式:Fe-6e-+8OH-===Fe+4H2O
5.(2024·南京市高三下学期第二次模拟)一种电解乙酰基吡嗪废水中的SO4制备S2O8的电化学装置如图所示。下列说法正确的是( )
A.石墨电极与直流电源正极相连
B.电解时,铂网电极附近pH增大
C.离子交换膜应选择性透过阴离子
D.阴极上的电极反应为2+2e-===S2
6.(2024·南京市第十三中学高三下学期适应性考试)科学家设计了一种CO2-HMF协同转化装置,如图所示。图中的双极膜中间层中的H2O解离为H+和OH-,并在直流电源作用下分别向两极迁移。下列叙述正确的是( )
A.催化电极A的电势高于催化电极B
B.阳极的电极反应式为
C.每生成1 mol甲酸,双极膜处有1 mol的水解离
D.转移相同电子时,理论上消耗的CO2和HMF物质的量之比为1∶3
7.利用燃料电池原理可处理高浓度的氨氮废水,同时电解含有苯酚、乙腈(CH3CN)的水溶液合成扑热息痛(),装置如图所示,其中a、b的电极材料为石墨。下列说法正确的是( )
A.溶液中的H+由甲室向乙室迁移
B.工作一段时间后,甲室溶液pH下降
C.乙室每产生1 mol N2,a电极理论上可产生H2 33.6 L(标准状况下)
D.丙室中发生反应的总化学方程式为
8.(2024·南通如皋市高三模拟)以甲苯为原料通过间接氧化法可以制取苯甲醛、苯甲酸等物质,反应原理如图所示。下列说法正确的是( )
A.电解时的阳极反应为2Cr3++6e-+7H2O===Cr2+14H+
B.电解结束后,阴极区溶液pH升高
C.1 mol甲苯氧化为0.5 mol苯甲醛和0.5 mol苯甲酸时,共消耗 mol Cr2
D.甲苯、苯甲醛、苯甲酸的混合物可以通过分液的方法分离
9.(2024·南通市高三下学期第二次调研)一种电解装置如图所示,电解时H+从右室移向左室。通过电解获得的电解液可实现。下列说法正确的是( )
A.左室电解获得的电解液可用于实现“转化Ⅰ”
B.右室发生的电极反应为Cr2+14H++6e-===2Cr3++7H2O
C.“转化Ⅱ”发生的反应为+6Ti3++6H+===+6Ti4++2H2O
D.“转化Ⅰ”生成1 mol,理论上电路中通过3 mol e-
10.(2024·江苏省姜堰中学、如东中学、前黄中学三校高三模拟)乙醛酸(OHC—COOH)是一种重要的化工中间体。工业上以乙二醛为原料制备乙醛酸的装置如图所示,通电后,阳极产物将乙二醛氧化为乙醛酸。下列说法错误的是( )
A.a极电势高于b极
B.离子交换膜为阴离子交换膜
C.当有0.5 mol离子通过离子交换膜时,理论上最多可生成乙醛酸的质量为18.5 g
D.乙二醛被氧化的化学方程式:+H2O+Cl2+2HCl
11.(2024·江苏省部分重点高中高三模拟)利用如图的电化学装置,可实现对CO2的固定。下列说法错误的是( )
A.向b电极移动
B.a电极的电极反应式为
C.电解过程中有H+生成
D.b电极的Pt用Cu代替后总反应不变
12.(2023·南京师范大学附属中学高三模拟)科研人员发现利用低温固体质子导体作电解质,催化合成NH3,与传统的热催化合成氨相比,催化效率较高。其合成原理如图1所示,电源电压改变与生成NH3速率的关系如图2所示,下列说法不正确的是( )
A.Pt-C是该合成氨装置的阳极
B.Pt-C3N4电极上发生的反应为N2+6H++6e-===2NH3
C.若H2的进出口流量差为22.4 L·min-1,则固体质子导体中H+的流速为2 mol·min-1
D.当电压高于1.2 V时,混合气体中N2和NH3的体积分数之和小于100%
答案精析
电化学装置图(一)——原电池
1.B [当连接开关K,并向B中滴加浓盐酸时,发现电流表的指针向右偏转,说明此时C2电极是正极,C1电极是负极。一段时间后,当电流表指针回到中间“0”位置,再向B中滴加过量浓NaOH溶液,可观察到电流表指针向左偏转,说明此时C2电极是负极,C1电极是正极,据此解答。不论电流表的指针向右偏转还是向左偏转,均是原电池,都是化学能转变为电能,A错误;电流表的指针向右偏转时,C1电极是负极,其电极反应为2I--2e-I2,B正确;电流表的指针向左偏转时,C2电极是负极,其电极反应为-2e-+2OH-As+H2O,C错误;根据以上分析可知在酸性溶液中氧化性:>I2,在碱性溶液中氧化性:
3.D [电池Ⅰ为Zn Cu 硫酸电池,Zn作负极,Cu作正极,氢离子在正极得电子生成氢气,电极反应为2H++2e-H2↑,故A正确;锌锰干电池中,Zn作负极,失电子发生氧化反应,故B正确;酸性条件下,电极b发生的电极反应式为O2+4e-+4H+2H2O,故D错误。]
4.D [Ag2O电极作正极,得电子发生还原反应,其电极反应为Ag2O+H2O+2e-2Ag+2OH-,B、C正确;氢氧根离子的物质的量虽然不变,但水的量减少,KOH的浓度增大,pH增大,D错误。]
5.C [Fe2+、Fe3+的存在环境为酸性,且生成物为K2SO4,故物质A为H2SO4,A正确;装置中K+由负极移向正极,则膜B是阳离子交换膜,B正确;a电极上HCOO-被氧化为HC,其电极反应式为HCOO--2e-+2OH-+H2O,C错误;Fe3+先被还原为Fe2+,Fe2+又被O2氧化生成Fe3+,Fe3+可以循环利用,可看作是该反应的催化剂,D正确。]
6.D [电极b为正极,电极反应为[Fe(CN)6]3-+e-[Fe(CN)6]4-,电极a为负极,电极反应为CH3CH2OH-12e-+3H2O2CO2↑+12H+,A、B、C错误;根据a极的电极反应式可知每消耗23 g CH3CH2OH(即0.5 mol),有6 mol H+通过质子交换膜移向b极,D正确。]
7.C [放电时,a极为负极,发生氧化反应,A错误;分子筛分离出氧气,属于物理变化,B错误;充电时,b极为阳极,过氧根离子发生氧化反应生成氧气,C正确;充电时,a极为阴极,电极反应式为Li2O2+2e-2Li+,阴极减少的质量等于脱去过氧根离子的质量,阴极净减3.2 g,相当于脱离0.1 mol ,电路中应有0.2 mol电子转移,D错误。]
8.C [放电过程中,Zn极为负极,Zn失电子生成Zn2+进入溶液,Zn2+向正极一侧移动,A不正确;电子不能经过电解质溶液,B不正确;充电时,V6O13极作阳极,与外接直流电源正极相连,C正确;充电时,阳极发生的电极反应可能为ZnxV6O13-2xe-V6O13+xZn2+,D不正确。]
9.D [Li能与氧气、水反应,SOCl2可与水反应,故电池工作环境必须在无水无氧的条件下进行,A错误;由工作原理图可知,放电时,正极上SOCl2转化为SOICl,SOICl再转化为S、SO2,SOCl2最终被还原,B错误;充电时,I2失电子发生氧化反应转化为ICl,阳极反应式为2LiCl+I2-2e-2ICl+2Li+,C错误;放电时,正极反应式为2SOCl2+4e-S+SO2↑+4Cl-,每产生11.2 L(标准状况下)SO2时,电路中转移2 mol电子,D正确。]
10.B [a极上Li失电子生成Li+,Li+通过离子交换膜在正极b上形成LiF,所以交换膜为阳离子交换膜,A错误;石墨棒电极为正极,在正极上附着的CFx得电子,正极的电极反应式为CFx+xe-+xLi+xLiF+C,B正确; 金属Li是活泼金属,能与乙醇反应,所以不能用乙醇溶液做电解质溶液,C错误;a为负极,b为正极,b极电势高于a极电势,D错误。]
11.D [由题意知放电时硫作正极,锌作负极,锌失去电子发生氧化反应:Zn-2e-Zn2+,A正确;放电时,铜离子转化为Cu2S、Cu2O、Cu,则充电时Cu2S、Cu2O、Cu转化为铜离子,Cu2+的浓度增大,B正确;该电池放电时电子从负极(锌电极)流出,C正确;由反应5Cu2++O2+10e-Cu+2Cu2O可知,每生成1 mol铜,通过10 mol电子,由于该电池放电时硫电极发生两步反应,故外电路中通过的电子大于10 mol,D错误。]
12.C [锂能与水反应生成氢氧化锂和氢气,所以氯化钾的有机溶液不能用氯化钾的水溶液代替,故A错误;放电时,LTO材料电极为正极,锂离子与Li4Ti5O12在正极反应生成Li4+xTi5O12,则转移1 mol电子时,正极材料增加7 g,故B错误;充电时,锂离子在阴极得到电子发生还原反应生成锂,电极反应式为Li++e-Li,故D错误。]
电化学装置图(二)——电解池
1.D [由图可知甲装置能自发的进行氧化还原反应,所以甲是原电池,电极B为负极,电极反应为N2H4-4e-+4OH-4H2O+N2,则电极A为正极,电极反应为O2+2H2O+4e-4OH-,总反应为N2H4+O22H2O+N2;乙装置属于电解池,与电源的负极B相连的电极C为阴极,电极反应为2H2O+2e-H2↑+2OH-,电极D为阳极,电极反应为N2H4-4e-+4OH-4H2O+N2↑,据此分析解题。图中甲池是原电池,乙池是电解池,A错误;电极C附近溶液pH增大,B错误;该装置消耗N2H4,无法实现N2H4循环制氢,C错误;当电极C上制得1 mol H2时,电极B、D上共制得1 mol N2,D正确。]
2.C [该装置为电解池,其中与电源A极相连的左侧电极的电极反应为Fe3++e-Fe2+、O2+2H++2e-H2O2,该电极为阴极,A极为电源负极,B极为正极,A错误;生成羟基自由基的反应有两个:H2O-e-H++·OH、H2O2+Fe2+Fe(OH)2++·OH,B错误;根据生成羟基自由基的反应,电解池外电路转移2 mol电子,则阳极反应:H2O-e-H++·OH,有2 mol·OH生成,阴极区也可生成·OH,故理论上可产生的·OH大于2 mol,D错误。]
3.C [由图可知,在惰性电极a得到电子生成,惰性电极a为阴极,惰性电极b为阳极,与电源的正极相连,Y为电源正极,A错误;惰性电极b为阳极,H2O在阳极失去电子生成O2,电极反应式为2H2O-4e-O2↑+4H+,H+通过质子交换膜进入阴极区,硫酸溶液中H+物质的量不变,但水消耗了,硫酸溶液的物质的量浓度增大,B错误;未说明11.2 L O2所处的温度和压强,无法计算O2的物质的量,D错误。]
4.D [该装置为电解池,将电能转化成化学能,故A错误;电解法制备Na2FeO4,铁元素化合价由0价升高到+6价,则铁电极作阳极,铂电极为阴极,与电源负极相连,故B错误;阴极反应式为2H2O+2e-H2↑+2OH-,转移2 mol电子,生成1 mol氢气,则标准状况下,生成氢气体积为22.4 L,故C错误;铁电极为阳极,电极反应式为Fe-6e-+8OH-Fe+4H2O,故D正确。]
5.B [电解乙酰基吡嗪废水中的SO4制备S2O8,由图可知,铂网电极上SO4失去电子发生氧化反应生成S2O8,为阳极,则石墨电极为阴极,与直流电源负极相连,A错误;电解时,铂网电极为阳极,电极反应式为-2e-S2,阴极反应式为2H++2e-H2↑,则右侧氢离子通过阳离子交换膜进入左侧,使得铂网电极附近pH增大,B正确,C、D错误。]
6.B [由图可知,二氧化碳得电子发生还原反应转化为甲酸,则催化电极A为阴极,催化电极B为阳极。阳极电势高于阴极,故催化电极A的电势低于催化电极B,A错误;在碱性条件下,阳极的失去电子发生氧化反应,电极反应式为,B正确;二氧化碳得电子发生还原反应生成甲酸:CO2+2e-+2H+HCOOH,则每生成1 mol甲酸,转移2 mol电子,双极膜处有2 mol的水解离,C错误;结合电极反应可知,转移相同电子时,理论上消耗的CO2和HMF物质的量之比为3∶1,D错误。]
7.D [燃料电池甲通入空气为正极,发生得电子的还原反应,乙中铵根离子发生氧化反应生成氮气,为负极;b极为阳极,a极为阴极;原电池中阳离子由负极移向正极,即溶液中的H+由乙室向甲室迁移,A错误;甲室为燃料电池的正极区,电极反应:O2+4e-+4H+2H2O,溶液pH增大,B错误;乙室每产生1 mol N2,转移6 mol电子,根据得失电子守恒,可生成标准状况下3 mol H2,对应气体体积为67.2 L,C错误。]
8.C [电解时阳极发生氧化反应,电极反应为2Cr3+-6e-+7H2OCr2+14H+,A错误;阳极区产生的氢离子透过质子交换膜进入阴极区,阴极上氢离子放电,电极反应为2H++2e-H2↑,电极上每消耗2 mol H+,就有2 mol H+进入阴极区,故电解结束后,阴极区溶液pH不变,B错误;结合3C6H5—CH3+2Cr2+16H+3C6H5—CHO +4Cr3++11H2O,0.5 mol甲苯被氧化为0.5 mol苯甲醛时消耗 mol Cr2,根据C6H5—CH3+Cr2+8H+C6H5—COOH +2Cr3++5H2O,0.5 mol甲苯被氧化为0.5 mol苯甲酸时消耗0.5 mol Cr2,则1 mol甲苯被氧化为0.5 mol苯甲醛和0.5 mol苯甲酸时,共消耗 mol Cr2,C正确;甲苯、苯甲醛、苯甲酸互溶,不可以通过分液的方法分离,D错误。]
9.C [根据氢离子在电解池中移动方向可知,a电极为阴极,b电极为阳极,阳极反应:2Cr3+-6e-+7H2OCr2+14H+,阴极反应:Ti4++e-Ti3+,阳极生成的Cr2具有强氧化性,阴极生成的Ti3+具有还原性,“转化 Ⅰ”为氧化反应,可加入右室电解获得的电解液氧化实现,“转化 Ⅱ”为还原反应,可加入左室电解获得的电解液还原实现:+6Ti3++6H++6Ti4++2H2O,A、B错误,C正确;~6e-~,根据得失电子守恒,生成1 mol 理论上电路中通过6 mol e-,D错误。]
10.B [通电后,阳极产物将乙二醛氧化为乙醛酸,结合题中装置图,可知a电极为阳极,生成的Cl2与乙二醛发生氧化还原反应,b电极为阴极,发生还原反应,生成H2,阳极的电极反应式为2Cl--2e-Cl2↑,阴极的电极反应式为2H++2e-H2↑。a极为阳极,b极为阴极,因此a极电势高于b极,故A正确;氢离子由左侧经离子交换膜进入右侧,则离子交换膜为阳离子交换膜,故B错误;根据得失电子守恒有1 mol OHC—COOH~1 mol Cl2~2 mol e-,则当有0.5 mol离子通过离子交换膜时,理论上最多可生成乙醛酸的质量为 mol×74 g·mol-1=18.5 g,故C正确;氯气将乙二醛氧化为乙醛酸,自身被还原为氯离子,化学方程式为+H2O+Cl2+2HCl,故D正确。]
11.D [由图可知,a电极上和CO2得电子,发生还原反应,为阴极,则b为阳极,电解池中阴离子移向阳极,向b电极移动,A正确;a电极上和CO2得电子,电极反应式为,B正确;b为阳极发生氧化反应,水放电生成O2和H+,C正确;b电极为阳极,Pt用Cu代替后,Cu放电生成Cu2+,D错误。]
12.C [图1可知,Pt C电极是电解池的阳极,氢气在阳极失去电子发生氧化反应生成氢离子,电极反应式为H2-2e-2H+,Pt C3N4电极为阴极,酸性条件下氮气在阴极得到电子发生还原反应生成氨气,电极反应式为N2+6H++6e-2NH3,故A、B正确;未说明标准状况下,无法计算22.4 L氢气的物质的量和反应生成氢离子的物质的量,则无法计算固体质子导体中氢离子的流速,故C错误;由图2可知,当电压高于1.2 V时,生成氨气速率变慢,说明氢离子在阴极得到电子生成氢气,导致混合气体中氮气和氨气的体积分数之和小于100%,故D正确。]
同课章节目录
