专题五 选择题专攻1 化学反应机理、速率与平衡的综合判断A、B两练(含解析)-2025高考化学二轮复习
文档属性
| 名称 | 专题五 选择题专攻1 化学反应机理、速率与平衡的综合判断A、B两练(含解析)-2025高考化学二轮复习 |  | |
| 格式 | docx | ||
| 文件大小 | 53.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-09 17:49:11 | ||
图片预览


文档简介
专题五 选择题专攻1 化学反应机理、速率与平衡的综合判断 A、B两练
题型突破练(A)
(选择题1~5题,每小题4分,6~11题,每小题5分,共50分)
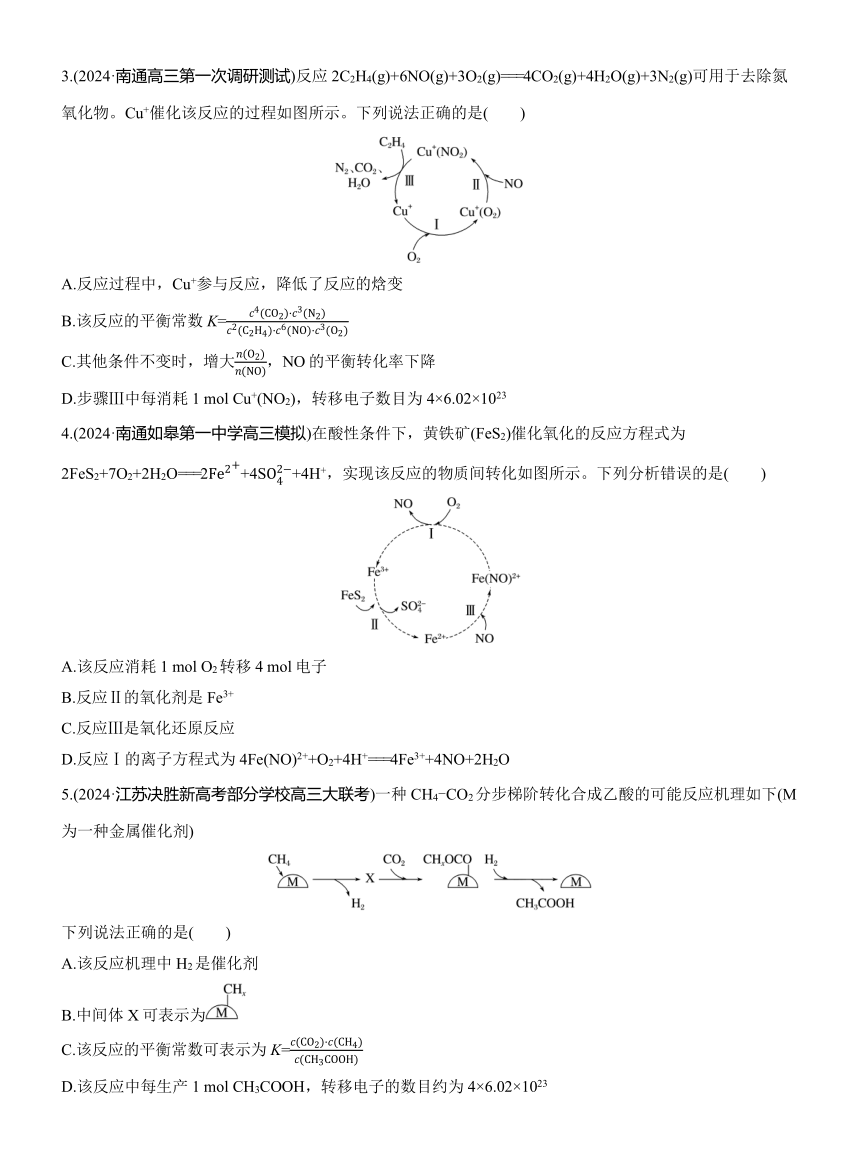
1.不对称催化羟醛缩合反应的循环机理如图所示。下列说法不正确的是( )
A.步骤①和②的有机产物可通过红外光谱鉴别
B.步骤③和④的反应均涉及手性碳原子的生成
C.步骤⑤的产物L-脯氨酸是该反应的催化剂
D.若用苯甲醛和作为原料,也可完成上述羟醛缩合反应
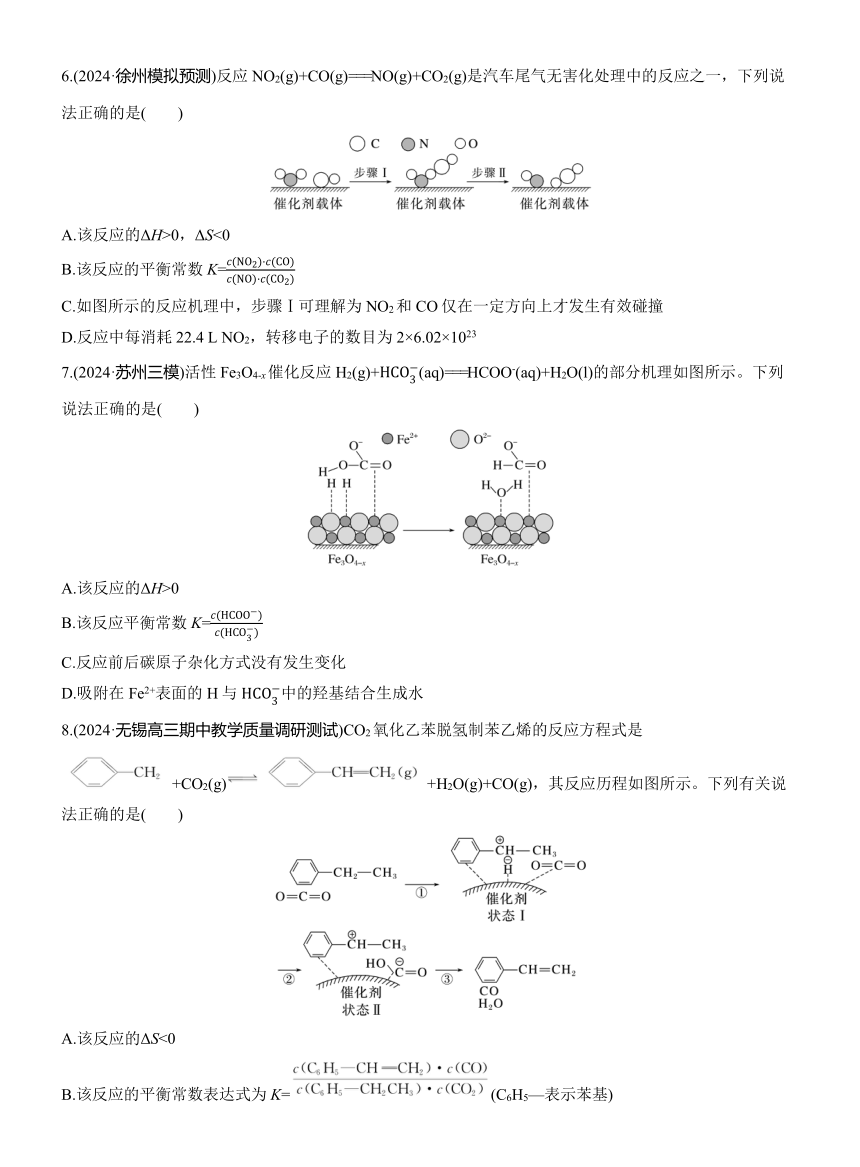
2.(2024·连云港高三期中)我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气制H2,反应: CO(g)+H2O(g)===CO2(g)+H2(g) ΔH<0,在低温下获得高转化率与高反应速率。反应部分过程如图所示:
下列说法正确的是( )
A.该反应高温下不能自发进行,则反应的ΔS<0
B.该反应的平衡常数K=
C.在整个转化过程中,氧元素的化合价始终不变
D.步骤Ⅰ吸收的能量大于步骤Ⅱ放出的能量
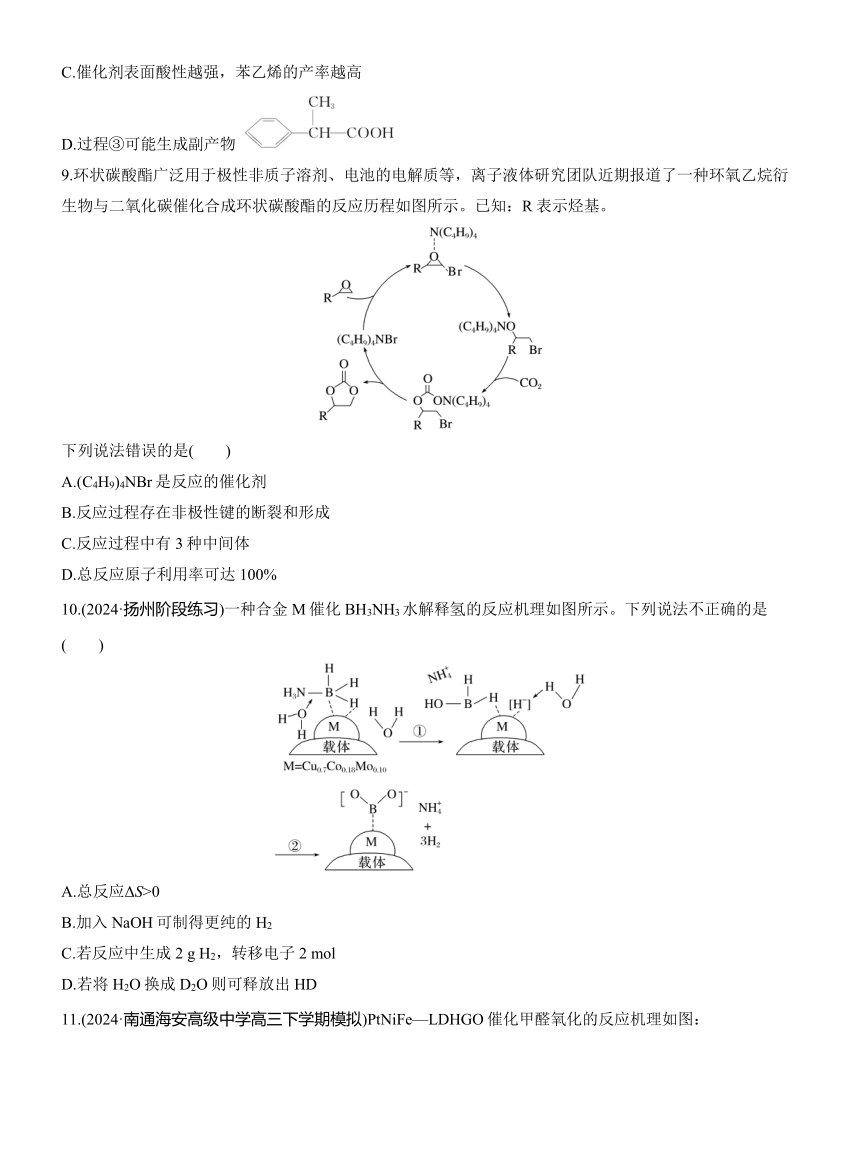
3.(2024·南通高三第一次调研测试)反应2C2H4(g)+6NO(g)+3O2(g)===4CO2(g)+4H2O(g)+3N2(g)可用于去除氮氧化物。Cu+催化该反应的过程如图所示。下列说法正确的是( )
A.反应过程中,Cu+参与反应,降低了反应的焓变
B.该反应的平衡常数K=
C.其他条件不变时,增大,NO的平衡转化率下降
D.步骤Ⅲ中每消耗1 mol Cu+(NO2),转移电子数目为4×6.02×1023
4.(2024·南通如皋第一中学高三模拟)在酸性条件下,黄铁矿(FeS2)催化氧化的反应方程式为2FeS2+7O2+2H2O===2+4S+4H+,实现该反应的物质间转化如图所示。下列分析错误的是( )
A.该反应消耗1 mol O2转移4 mol电子
B.反应Ⅱ的氧化剂是Fe3+
C.反应Ⅲ是氧化还原反应
D.反应Ⅰ的离子方程式为4Fe(NO)2++O2+4H+===4Fe3++4NO+2H2O
5.(2024·江苏决胜新高考部分学校高三大联考)一种CH4-CO2分步梯阶转化合成乙酸的可能反应机理如下(M为一种金属催化剂)
下列说法正确的是( )
A.该反应机理中H2是催化剂
B.中间体X可表示为
C.该反应的平衡常数可表示为K=
D.该反应中每生产1 mol CH3COOH,转移电子的数目约为4×6.02×1023
6.(2024·徐州模拟预测)反应NO2(g)+CO(g)===NO(g)+CO2(g)是汽车尾气无害化处理中的反应之一,下列说法正确的是( )
A.该反应的ΔH>0,ΔS<0
B.该反应的平衡常数K=
C.如图所示的反应机理中,步骤Ⅰ可理解为NO2和CO仅在一定方向上才发生有效碰撞
D.反应中每消耗22.4 L NO2,转移电子的数目为2×6.02×1023
7.(2024·苏州三模)活性Fe3O4-x催化反应H2(g)+(aq)===HCOO-(aq)+H2O(l)的部分机理如图所示。下列说法正确的是( )
A.该反应的ΔH>0
B.该反应平衡常数K=
C.反应前后碳原子杂化方式没有发生变化
D.吸附在Fe2+表面的H与中的羟基结合生成水
8.(2024·无锡高三期中教学质量调研测试)CO2氧化乙苯脱氢制苯乙烯的反应方程式是+CO2(g)+H2O(g)+CO(g),其反应历程如图所示。下列有关说法正确的是( )
A.该反应的ΔS<0
B.该反应的平衡常数表达式为K=(C6H5—表示苯基)
C.催化剂表面酸性越强,苯乙烯的产率越高
D.过程③可能生成副产物
9.环状碳酸酯广泛用于极性非质子溶剂、电池的电解质等,离子液体研究团队近期报道了一种环氧乙烷衍生物与二氧化碳催化合成环状碳酸酯的反应历程如图所示。已知:R表示烃基。
下列说法错误的是( )
A.(C4H9)4NBr是反应的催化剂
B.反应过程存在非极性键的断裂和形成
C.反应过程中有3种中间体
D.总反应原子利用率可达100%
10.(2024·扬州阶段练习)一种合金M催化BH3NH3水解释氢的反应机理如图所示。下列说法不正确的是( )
A.总反应ΔS>0
B.加入NaOH可制得更纯的H2
C.若反应中生成2 g H2,转移电子2 mol
D.若将H2O换成D2O则可释放出HD
11.(2024·南通海安高级中学高三下学期模拟)PtNiFe—LDHGO催化甲醛氧化的反应机理如图:
下列说法不正确的是( )
A.步骤Ⅰ中甲醛通过氢键吸附在催化剂表面的—OH上
B.上述反应机理涉及极性键和非极性键的形成
C.该反应每生成1 mol CO2,转移电子的数目约为4×6.02×1023
D.PtNiFe—LDHGO降低了该反应的活化能
题型突破练(B)
(选择题1~5题,每小题4分,6~11题,每小题5分,共50分)
1.(2024·江苏名校联盟高三联考)无催化剂作用下,以乙二醛和O2为原料制取乙醛酸的可能反应历程如图所示,TS表示过渡态,IM表示中间体。下列说法错误的是( )
A.乙二醛被O2氧化可得3种有机产物
B.反应很短一段时间内,IM4多于IM1
C.乙二醛制乙二酸的最大能垒(活化能)为181.5 kJ·mol-1
D.选择合适的催化剂可提高乙醛酸的选择性
2.亚硝酰氯在有机合成中有重要应用。2NO(g)+Cl2(g)===2NOCl(g)的反应历程如图所示。下列说法错误的是( )
A.催化剂能提高反应物的相对能量
B.相对于曲线Ⅱ,曲线Ⅰ表示加入催化剂
C.曲线Ⅱ正反应的活化能为15.5 kJ·mol-1
D.2NO(g)+Cl2(g)===2NOCl(g) ΔH=-77.1 kJ·mol-1
3.(2024·连云港模拟预测)工业上用CH2==CH2与O2在银催化作用下制备和CH3CHO的反应历程如图所示,下列说法正确的是( )
A.由乙烯生成环氧乙烷总反应的ΔS>0
B.中间体生成吸附态CH3CHO(ads)的活化能为52 kJ·mol-1
C.由生成CH3CHO(g)热化学方程式为===CH3CHO(g) ΔH=+102 kJ·mol-1
D.相同条件下,生成环氧乙烷的速率比生成乙醛的快
4.(2024·淮安高三开学考试)炼油、石化等含S2-工业废水可通过催化氧化法进行处理。将MnO2嵌于聚苯胺(高温会分解)表面制成催化剂,碱性条件下,催化氧化废水的机理如图所示。下列说法不正确的是( )
A.催化剂因S覆盖表面或进入空位而失效,高温灼烧后也不可继续使用
B.该反应过程的总方程式为O2+2H2O+2S2-4OH-+2S↓
C.反应过程中只有硫元素被氧化
D.反应Ⅲ的ΔH>0
5.(2024·常州普通高中学业水平合格性考试适应性训练)Mn3O4是重要的电子工业磁性原料,可由下列两种方法制得:
方法1:将MnOOH (其中Mn为+3价)焙烧成Mn2O3,再加热使Mn2O3转化为Mn3O4。
方法2:将Mn和(NH4)2SO4反应生成配合物{[Mn(NH3)n]SO4},配合物与水反应生成Mn(OH)2,Mn(OH)2再与O2反应得Mn3O4。前两步的反应原理如图所示:
下列说法正确的是( )
A.MnOOH中存在—O—O—
B.Mn2O3转化为Mn3O4需结合O
C.图中气体X为H2
D.方法2生成Mn3O4总反应的反应物为Mn与H2O
6.(2024·徐州期中)Na2S2O8-Co3O4可作为光催化水生产物质X的高效催化剂,反应部分机理如图所示。下列说法正确的是( )
A.Co元素位于元素周期表中第ⅠB族
B.在激光作用下,Na2S2O8发生氧化反应
C.物质X为H2
D.工业上煅烧CoCO3制备Co3O4的反应为6CoCO3+O22Co3O4+6CO2
7.(2024·南通如皋高三适应性考试)氯气在生产、生活中应用广泛。可用地康法制备Cl2。450 ℃,以CuCl2作催化剂,地康法原理如图所示。
关于地康法制Cl2,下列说法正确的是( )
A.反应的平衡常数可表示为K=
B.其他条件不变,升高温度HCl的平衡转化率降低说明该反应ΔH<0
C.CuCl2的使用可以增大反应的活化能
D.每生成22.4 L Cl2时,转移电子的数目为2×6.02×1023
8.(2024·南京、盐城高三第一次模拟考试)利用铜-铈氧化物(xCuO-yCeO2,Ce是活泼金属)催化氧化除去H2中少量CO,总反应为2CO(g)+O2(g)2CO2(g) ΔH,反应机理如图所示。下列说法正确的是( )
A.该总反应的平衡常数K=
B.步骤(i)中有两种元素化合价发生变化
C.步骤(i)、(iii)生成CO2的机理相同
D.步骤(iii)中存在共价键的断裂和共价键的生成
9.(2024·扬州新华中学高三月考)一种由CO2和CH4制备CH3COOH的反应为CO2(g)+CH4(g)===CH3COOH(g),催化反应历程如图所示。下列说法正确的是( )
A.该催化剂可以降低该反应的活化能
B.①→②放出能量并形成了C==C
C.该反应的平衡常数K=
D.该反应中每生成1 mol CH3COOH转移电子的数目约为8×6.02×1023
10.如图表示2-甲基-2-溴丙烷发生水解的反应历程。下列说法正确的是( )
A.由图可知反应有两个过渡态,无法判断反应的热效应
B.增大c(NaOH),总反应的速率会增大
C.反应中存在C—Br的断裂和C—O的形成
D.若第一阶段转化率为30%,第二阶段转化率为40%,则最终产物的产率为12%
11.我国科学家以Bi为电极在酸性水溶液中可实现电催化还原CO2,两种途径的反应机理如图所示,其中TS表示过渡态、数字表示微粒的相对总能量。
下列说法错误的是( )
A.HCOOH分解生成CO和H2O的反应为吸热反应
B.电催化还原CO2生成HCOOH的选择性高于生成CO的选择性
C.HCOOH是阴极产物
D.途径二的电极反应式为CO2+2H++2e-===CO+H2O
答案精析
A
1.D [①和②的有机产物含有不同的官能团,可通过红外光谱鉴别,A正确;连接四个不同的原子或者原子团的碳原子为手性碳原子,步骤③和④均有手性碳原子的生成,B正确;L 脯氨酸在步骤①参与反应,在步骤⑤又生成,是该反应的催化剂,C正确。]
2.A [反应为放热反应,根据ΔH-TΔS<0反应能自发进行,而该反应高温下不能自发进行,则反应的ΔS<0,A正确;该反应的平衡常数K=,B错误;在步骤Ⅰ转化过程中,氧形成的共价键由2个变为1个,故氧元素化合价发生改变,C错误;化学键断裂吸收能量,化学键形成放出能量,反应为放热反应,则步骤Ⅰ吸收的能量小于步骤Ⅱ放出的能量,D错误。]
3.D [反应过程中,Cu+为催化剂,降低反应活化能但不改变焓变,A错误;该反应的平衡常数K=,B错误;增大一种反应物的量,可以提高另一种反应物的转化率,增大,则NO的转化率增大,C错误;由反应Ⅲ可知,Cu+(NO2)转化为N2,N元素由+4价变为0价,消耗1 mol Cu+(NO2)转移4 mol电子,所以转移电子数目为4×6.02×1023,D正确。]
4.C [由图可知,O元素由0价下降到-2价,该反应消耗1 mol O2转移4 mol电子,故A正确;反应Ⅱ的铁元素由+3价变成+2价,所以反应Ⅱ的氧化剂是Fe3+,故B正确;反应Ⅲ中无元素化合价变化,所以反应Ⅲ不是氧化还原反应,故C错误。]
5.B [在该反应中,先生成氢气,后消耗氢气,H2参与合成乙酸,故H2不是催化剂,故A错误;X与CO2反应生成,根据元素守恒可知,中间体X可表示为,故B正确;根据反应机理可知,总反应方程式为CH4+CO2CH3COOH,该反应的平衡常数K=,故C错误;CH4 CO2分步梯阶转化合成乙酸经历了三步反应,每一步都发生电子的转移,故转移电子的数目大于4×6.02×1023,故D错误。]
6.C [由化学方程式知,K=,B错误;有效碰撞在一定方向上才能发生化学反应,根据图示,步骤Ⅰ可理解为NO2和CO仅在一定方向上才发生有效碰撞,C正确;未指明标准状况,不能用标准状况下的气体摩尔体积计算,D错误。]
7.C [该自发反应熵减,按ΔH-TΔS<0可知该反应为放热反应,则ΔH<0,A错误;反应的平衡常数K=,B错误;反应前后HC、HCOO-中均存在CO,故碳原子杂化方式始终为sp2杂化,杂化方式没有发生变化,C正确;由图知,吸附在O2-表面的H与中的羟基中的氧结合生成水,D错误。]
8.D [由题干反应方程式可知,该反应正反应是一个气体体积增大的方向,故该反应的ΔS>0,A错误;由题干反应方程式可知,产物中H2O为气态,故该反应的平衡常数表达式为K=,B错误;根据反应历程可知,催化剂表面需要活化吸附,该微粒带负电荷,如果催化剂表面酸性较强,则带负电荷的氢氧根离子较少,有利于的吸附,且酸性物质不和二氧化碳反应,从而提高了乙苯的转化率,但酸性太强,催化剂表面吸附大量的带正电荷的H+,导致的吸附能力减弱,不利于乙苯转化率的提高,故并不是催化剂表面酸性越强,苯乙烯的产率越高,C错误。]
9.B [由反应历程图可知反应过程中没有非极性键的断裂和形成,B错误;反应中、、为中间体,故一共有3种中间体,C正确;根据图知,总反应方程式为,则该反应为加成反应,总反应原子利用率可达100%,D正确。]
10.B [由图可知总反应为BH3NH3+2H2ON+B+3H2↑,所以总反应ΔS>0,故A正确;加入氢氧化钠和铵根离子反应有利于整个反应向右进行,但同时有氨气生成,从而使制得的氢气中混有氨气,故B错误;由总反应可知,生成2 g H2,转移电子2 mol,故C正确;根据机理图可知,参加反应的两个水分子中只有一个氢原子转化为铵根离子,其余三个氢原子和—BH3中的氢原子结合生成H2,若将水换成D2O,则可释放出HD同时生成NH3D+,故D正确。]
11.B [上述反应机理涉及氧氢极性键、碳氧极性键的形成,没有涉及非极性键的形成,故B错误;该反应甲醛变为CO2,碳元素由0价变为+4价,则每生成1 mol CO2,转移电子的数目约为4×6.02×1023,故C正确;PtNiFe—LDHGO催化甲醛氧化,加快反应速率,降低了该反应的活化能,故D正确。]
B
1.C [乙二醛被O2氧化可得HOOCCOOH、HCOOH、OHCCOOH三种有机产物,A正确;生成IM4反应的活化能小于生成IM1反应的活化能,所以前者速率大,反应很短一段时间内,IM4多于IM1,B正确;乙二醛制乙二酸的最大能垒(活化能)为295.4 kJ·mol-1,C错误;选择合适的催化剂可提高乙醛酸的选择性,使反应向有利于生成乙醛酸的方向进行,D正确。]
2.A [催化剂能降低“过渡态”物质的相对能量,使活化能降低,A项错误,B项正确;曲线Ⅱ正反应的活化能为196 kJ·mol-1-180.5 kJ·mol-1=15.5 kJ·mol-1,C项正确;反应热等于生成物的总能量减反应物的总能量,即ΔH=103.4 kJ·mol-1-180.5 kJ·mol-1=-77.1 kJ·mol-1,D项正确。]
3.B [由题意可知,乙烯生成环氧乙烷的反应为2CH2CH2(g)+O2(g)2(g),该反应是熵减的反应,即ΔS<0,故A错误;由图可知,中间体生成吸附态CH3CHO(ads)的活化能为(-124 kJ·mol-1)-(-176 kJ·mol-1)=52 kJ·mol-1,故B正确;由图可知,环氧乙烷转化为乙醛的反应中,反应的ΔH=(-219 kJ·mol-1)-(-117 kJ·mol-1)=-102 kJ·mol-1,故C错误;反应的活化能越大,反应速率越慢,由图可知,生成环氧乙烷的决速步骤的活化能大于生成乙醛的,则生成环氧乙烷的速率比生成乙醛的慢,故D错误。]
4.C [反应中生成硫单质,生成的S覆盖在催化剂表面或进入催化剂内空位处,阻碍了反应的进行,导致催化剂使用一段时间后催化效率会下降,高温下聚苯胺会分解,故高温灼烧后也不可继续使用,A正确;由图可知,催化氧化过程的总反应为氧气、水、硫离子在催化作用下生成氢氧根离子和硫单质:O2+2H2O+2S2-4OH-+2S↓,B正确;由图可知,反应Ⅱ过程中锰元素化合价也升高被氧化,C错误;由图可知,反应Ⅲ为化学键断裂的吸热反应,故ΔH>0,D正确。]
5.C [MnOOH中Mn为+3价,存在氢氧根离子,不存在—O—O—,A错误;Mn2O3转化为Mn3O4过程中Mn元素化合价降低,需要氧元素化合价升高,需释放O,B错误;结合图示信息,Mn和(NH4)2SO4反应生成[Mn(NH3)n]SO4,需要释放出多余的氢,X为H2,C正确;结合图示反应过程,方法2生成的Mn(OH)2再与O2反应得Mn3O4,则方法2生成Mn3O4总反应的反应物为Mn、H2O与O2,D错误。]
6.D [Co为27号元素,位于元素周期表中第四周期第Ⅷ族,A错误;Co4+和H2O反应生Co3O4和X,根据得失电子守恒、元素守恒和电荷守恒可得3Co4++6H2OCo3O4+O2↑+12H+,则X为O2,C错误。]
7.B [由图知,450 ℃,以CuCl2作催化剂,地康法制备氯气的总反应为4HCl(g)+O2(g)2H2O(g)+2Cl2(g)。该反应的平衡常数可表示为K=,故A错误;其他条件不变,升高温度HCl的平衡转化率降低,说明升温平衡左移,则说明该反应正向放热,即ΔH<0,故B正确;地康法制备氯气时CuCl2作催化剂,CuCl2的使用可以降低反应的活化能,故C错误;未指明标准状况,气体摩尔体积不确定,则无法计算每生成22.4 L Cl2时转移电子的数目,故D错误。]
8.D [根据总反应方程式,可得该总反应的平衡常数K=,A项错误;通过步骤(i)可知,CO变成CO2,碳元素化合价升高,故Cu和Ce化合价会降低,所以步骤(i)中有三种元素化合价发生变化,B项错误;由反应机理可知,步骤(i)是一氧化碳与铜 铈氧化物中的氧元素结合生成二氧化碳,步骤(iii)是一氧化碳与氧气中的氧元素结合生成二氧化碳,C项错误;步骤(iii)中氧气中的氧氧共价键发生断裂,同时有碳氧共价键生成,存在共价键的断裂和共价键的生成,D项正确。]
9.A [由反应历程图可知,①→②为化学键的形成,形成了C—C,故可放出能量,B错误;根据反应方程式可知,该反应的平衡常数K=,C错误;根据反应方程式可知,CH3COOH中C的平均化合价为0,即反应过程中CO2中+4价的C降低为0价,CH4中-4价的C升高到0价,故该反应中每生成1 mol CH3COOH转移电子的数目约为4×6.02×1023,D错误。]
10.C [由图可知,反应物的总能量比生成物的总能量高,反应为放热反应,A项错误;反应分两步进行,第一步反应的活化能大,是反应的决速步骤,但是第一步反应没有NaOH参与,增大c(NaOH),总反应的速率不会增大,B项错误;产率是目标产物的实际产量与理论产量的比值,而转化率是反应物反应的百分数,由转化率无法计算产物的产率,D项错误。]
11.A [由图可知HCOOH的能量高于CO和H2O的能量,所以HCOOH分解生成CO和H2O的反应为放热反应,A错误;过渡态物质的总能量与反应物总能量的差值为活化能,活化能越大反应速率越慢,由图可知,电催化还原CO2的途径一的活化能更低,导致反应更容易进行,生成HCOOH的选择性高于生成CO的选择性,B正确;HCOOH是CO2得电子之后的产物,所以是阴极产物,C正确;途径二的产物是CO和H2O,所以电极反应式为CO2+2H++2e-CO+H2O,D正确。]
题型突破练(A)
(选择题1~5题,每小题4分,6~11题,每小题5分,共50分)
1.不对称催化羟醛缩合反应的循环机理如图所示。下列说法不正确的是( )
A.步骤①和②的有机产物可通过红外光谱鉴别
B.步骤③和④的反应均涉及手性碳原子的生成
C.步骤⑤的产物L-脯氨酸是该反应的催化剂
D.若用苯甲醛和作为原料,也可完成上述羟醛缩合反应
2.(2024·连云港高三期中)我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气制H2,反应: CO(g)+H2O(g)===CO2(g)+H2(g) ΔH<0,在低温下获得高转化率与高反应速率。反应部分过程如图所示:
下列说法正确的是( )
A.该反应高温下不能自发进行,则反应的ΔS<0
B.该反应的平衡常数K=
C.在整个转化过程中,氧元素的化合价始终不变
D.步骤Ⅰ吸收的能量大于步骤Ⅱ放出的能量
3.(2024·南通高三第一次调研测试)反应2C2H4(g)+6NO(g)+3O2(g)===4CO2(g)+4H2O(g)+3N2(g)可用于去除氮氧化物。Cu+催化该反应的过程如图所示。下列说法正确的是( )
A.反应过程中,Cu+参与反应,降低了反应的焓变
B.该反应的平衡常数K=
C.其他条件不变时,增大,NO的平衡转化率下降
D.步骤Ⅲ中每消耗1 mol Cu+(NO2),转移电子数目为4×6.02×1023
4.(2024·南通如皋第一中学高三模拟)在酸性条件下,黄铁矿(FeS2)催化氧化的反应方程式为2FeS2+7O2+2H2O===2+4S+4H+,实现该反应的物质间转化如图所示。下列分析错误的是( )
A.该反应消耗1 mol O2转移4 mol电子
B.反应Ⅱ的氧化剂是Fe3+
C.反应Ⅲ是氧化还原反应
D.反应Ⅰ的离子方程式为4Fe(NO)2++O2+4H+===4Fe3++4NO+2H2O
5.(2024·江苏决胜新高考部分学校高三大联考)一种CH4-CO2分步梯阶转化合成乙酸的可能反应机理如下(M为一种金属催化剂)
下列说法正确的是( )
A.该反应机理中H2是催化剂
B.中间体X可表示为
C.该反应的平衡常数可表示为K=
D.该反应中每生产1 mol CH3COOH,转移电子的数目约为4×6.02×1023
6.(2024·徐州模拟预测)反应NO2(g)+CO(g)===NO(g)+CO2(g)是汽车尾气无害化处理中的反应之一,下列说法正确的是( )
A.该反应的ΔH>0,ΔS<0
B.该反应的平衡常数K=
C.如图所示的反应机理中,步骤Ⅰ可理解为NO2和CO仅在一定方向上才发生有效碰撞
D.反应中每消耗22.4 L NO2,转移电子的数目为2×6.02×1023
7.(2024·苏州三模)活性Fe3O4-x催化反应H2(g)+(aq)===HCOO-(aq)+H2O(l)的部分机理如图所示。下列说法正确的是( )
A.该反应的ΔH>0
B.该反应平衡常数K=
C.反应前后碳原子杂化方式没有发生变化
D.吸附在Fe2+表面的H与中的羟基结合生成水
8.(2024·无锡高三期中教学质量调研测试)CO2氧化乙苯脱氢制苯乙烯的反应方程式是+CO2(g)+H2O(g)+CO(g),其反应历程如图所示。下列有关说法正确的是( )
A.该反应的ΔS<0
B.该反应的平衡常数表达式为K=(C6H5—表示苯基)
C.催化剂表面酸性越强,苯乙烯的产率越高
D.过程③可能生成副产物
9.环状碳酸酯广泛用于极性非质子溶剂、电池的电解质等,离子液体研究团队近期报道了一种环氧乙烷衍生物与二氧化碳催化合成环状碳酸酯的反应历程如图所示。已知:R表示烃基。
下列说法错误的是( )
A.(C4H9)4NBr是反应的催化剂
B.反应过程存在非极性键的断裂和形成
C.反应过程中有3种中间体
D.总反应原子利用率可达100%
10.(2024·扬州阶段练习)一种合金M催化BH3NH3水解释氢的反应机理如图所示。下列说法不正确的是( )
A.总反应ΔS>0
B.加入NaOH可制得更纯的H2
C.若反应中生成2 g H2,转移电子2 mol
D.若将H2O换成D2O则可释放出HD
11.(2024·南通海安高级中学高三下学期模拟)PtNiFe—LDHGO催化甲醛氧化的反应机理如图:
下列说法不正确的是( )
A.步骤Ⅰ中甲醛通过氢键吸附在催化剂表面的—OH上
B.上述反应机理涉及极性键和非极性键的形成
C.该反应每生成1 mol CO2,转移电子的数目约为4×6.02×1023
D.PtNiFe—LDHGO降低了该反应的活化能
题型突破练(B)
(选择题1~5题,每小题4分,6~11题,每小题5分,共50分)
1.(2024·江苏名校联盟高三联考)无催化剂作用下,以乙二醛和O2为原料制取乙醛酸的可能反应历程如图所示,TS表示过渡态,IM表示中间体。下列说法错误的是( )
A.乙二醛被O2氧化可得3种有机产物
B.反应很短一段时间内,IM4多于IM1
C.乙二醛制乙二酸的最大能垒(活化能)为181.5 kJ·mol-1
D.选择合适的催化剂可提高乙醛酸的选择性
2.亚硝酰氯在有机合成中有重要应用。2NO(g)+Cl2(g)===2NOCl(g)的反应历程如图所示。下列说法错误的是( )
A.催化剂能提高反应物的相对能量
B.相对于曲线Ⅱ,曲线Ⅰ表示加入催化剂
C.曲线Ⅱ正反应的活化能为15.5 kJ·mol-1
D.2NO(g)+Cl2(g)===2NOCl(g) ΔH=-77.1 kJ·mol-1
3.(2024·连云港模拟预测)工业上用CH2==CH2与O2在银催化作用下制备和CH3CHO的反应历程如图所示,下列说法正确的是( )
A.由乙烯生成环氧乙烷总反应的ΔS>0
B.中间体生成吸附态CH3CHO(ads)的活化能为52 kJ·mol-1
C.由生成CH3CHO(g)热化学方程式为===CH3CHO(g) ΔH=+102 kJ·mol-1
D.相同条件下,生成环氧乙烷的速率比生成乙醛的快
4.(2024·淮安高三开学考试)炼油、石化等含S2-工业废水可通过催化氧化法进行处理。将MnO2嵌于聚苯胺(高温会分解)表面制成催化剂,碱性条件下,催化氧化废水的机理如图所示。下列说法不正确的是( )
A.催化剂因S覆盖表面或进入空位而失效,高温灼烧后也不可继续使用
B.该反应过程的总方程式为O2+2H2O+2S2-4OH-+2S↓
C.反应过程中只有硫元素被氧化
D.反应Ⅲ的ΔH>0
5.(2024·常州普通高中学业水平合格性考试适应性训练)Mn3O4是重要的电子工业磁性原料,可由下列两种方法制得:
方法1:将MnOOH (其中Mn为+3价)焙烧成Mn2O3,再加热使Mn2O3转化为Mn3O4。
方法2:将Mn和(NH4)2SO4反应生成配合物{[Mn(NH3)n]SO4},配合物与水反应生成Mn(OH)2,Mn(OH)2再与O2反应得Mn3O4。前两步的反应原理如图所示:
下列说法正确的是( )
A.MnOOH中存在—O—O—
B.Mn2O3转化为Mn3O4需结合O
C.图中气体X为H2
D.方法2生成Mn3O4总反应的反应物为Mn与H2O
6.(2024·徐州期中)Na2S2O8-Co3O4可作为光催化水生产物质X的高效催化剂,反应部分机理如图所示。下列说法正确的是( )
A.Co元素位于元素周期表中第ⅠB族
B.在激光作用下,Na2S2O8发生氧化反应
C.物质X为H2
D.工业上煅烧CoCO3制备Co3O4的反应为6CoCO3+O22Co3O4+6CO2
7.(2024·南通如皋高三适应性考试)氯气在生产、生活中应用广泛。可用地康法制备Cl2。450 ℃,以CuCl2作催化剂,地康法原理如图所示。
关于地康法制Cl2,下列说法正确的是( )
A.反应的平衡常数可表示为K=
B.其他条件不变,升高温度HCl的平衡转化率降低说明该反应ΔH<0
C.CuCl2的使用可以增大反应的活化能
D.每生成22.4 L Cl2时,转移电子的数目为2×6.02×1023
8.(2024·南京、盐城高三第一次模拟考试)利用铜-铈氧化物(xCuO-yCeO2,Ce是活泼金属)催化氧化除去H2中少量CO,总反应为2CO(g)+O2(g)2CO2(g) ΔH,反应机理如图所示。下列说法正确的是( )
A.该总反应的平衡常数K=
B.步骤(i)中有两种元素化合价发生变化
C.步骤(i)、(iii)生成CO2的机理相同
D.步骤(iii)中存在共价键的断裂和共价键的生成
9.(2024·扬州新华中学高三月考)一种由CO2和CH4制备CH3COOH的反应为CO2(g)+CH4(g)===CH3COOH(g),催化反应历程如图所示。下列说法正确的是( )
A.该催化剂可以降低该反应的活化能
B.①→②放出能量并形成了C==C
C.该反应的平衡常数K=
D.该反应中每生成1 mol CH3COOH转移电子的数目约为8×6.02×1023
10.如图表示2-甲基-2-溴丙烷发生水解的反应历程。下列说法正确的是( )
A.由图可知反应有两个过渡态,无法判断反应的热效应
B.增大c(NaOH),总反应的速率会增大
C.反应中存在C—Br的断裂和C—O的形成
D.若第一阶段转化率为30%,第二阶段转化率为40%,则最终产物的产率为12%
11.我国科学家以Bi为电极在酸性水溶液中可实现电催化还原CO2,两种途径的反应机理如图所示,其中TS表示过渡态、数字表示微粒的相对总能量。
下列说法错误的是( )
A.HCOOH分解生成CO和H2O的反应为吸热反应
B.电催化还原CO2生成HCOOH的选择性高于生成CO的选择性
C.HCOOH是阴极产物
D.途径二的电极反应式为CO2+2H++2e-===CO+H2O
答案精析
A
1.D [①和②的有机产物含有不同的官能团,可通过红外光谱鉴别,A正确;连接四个不同的原子或者原子团的碳原子为手性碳原子,步骤③和④均有手性碳原子的生成,B正确;L 脯氨酸在步骤①参与反应,在步骤⑤又生成,是该反应的催化剂,C正确。]
2.A [反应为放热反应,根据ΔH-TΔS<0反应能自发进行,而该反应高温下不能自发进行,则反应的ΔS<0,A正确;该反应的平衡常数K=,B错误;在步骤Ⅰ转化过程中,氧形成的共价键由2个变为1个,故氧元素化合价发生改变,C错误;化学键断裂吸收能量,化学键形成放出能量,反应为放热反应,则步骤Ⅰ吸收的能量小于步骤Ⅱ放出的能量,D错误。]
3.D [反应过程中,Cu+为催化剂,降低反应活化能但不改变焓变,A错误;该反应的平衡常数K=,B错误;增大一种反应物的量,可以提高另一种反应物的转化率,增大,则NO的转化率增大,C错误;由反应Ⅲ可知,Cu+(NO2)转化为N2,N元素由+4价变为0价,消耗1 mol Cu+(NO2)转移4 mol电子,所以转移电子数目为4×6.02×1023,D正确。]
4.C [由图可知,O元素由0价下降到-2价,该反应消耗1 mol O2转移4 mol电子,故A正确;反应Ⅱ的铁元素由+3价变成+2价,所以反应Ⅱ的氧化剂是Fe3+,故B正确;反应Ⅲ中无元素化合价变化,所以反应Ⅲ不是氧化还原反应,故C错误。]
5.B [在该反应中,先生成氢气,后消耗氢气,H2参与合成乙酸,故H2不是催化剂,故A错误;X与CO2反应生成,根据元素守恒可知,中间体X可表示为,故B正确;根据反应机理可知,总反应方程式为CH4+CO2CH3COOH,该反应的平衡常数K=,故C错误;CH4 CO2分步梯阶转化合成乙酸经历了三步反应,每一步都发生电子的转移,故转移电子的数目大于4×6.02×1023,故D错误。]
6.C [由化学方程式知,K=,B错误;有效碰撞在一定方向上才能发生化学反应,根据图示,步骤Ⅰ可理解为NO2和CO仅在一定方向上才发生有效碰撞,C正确;未指明标准状况,不能用标准状况下的气体摩尔体积计算,D错误。]
7.C [该自发反应熵减,按ΔH-TΔS<0可知该反应为放热反应,则ΔH<0,A错误;反应的平衡常数K=,B错误;反应前后HC、HCOO-中均存在CO,故碳原子杂化方式始终为sp2杂化,杂化方式没有发生变化,C正确;由图知,吸附在O2-表面的H与中的羟基中的氧结合生成水,D错误。]
8.D [由题干反应方程式可知,该反应正反应是一个气体体积增大的方向,故该反应的ΔS>0,A错误;由题干反应方程式可知,产物中H2O为气态,故该反应的平衡常数表达式为K=,B错误;根据反应历程可知,催化剂表面需要活化吸附,该微粒带负电荷,如果催化剂表面酸性较强,则带负电荷的氢氧根离子较少,有利于的吸附,且酸性物质不和二氧化碳反应,从而提高了乙苯的转化率,但酸性太强,催化剂表面吸附大量的带正电荷的H+,导致的吸附能力减弱,不利于乙苯转化率的提高,故并不是催化剂表面酸性越强,苯乙烯的产率越高,C错误。]
9.B [由反应历程图可知反应过程中没有非极性键的断裂和形成,B错误;反应中、、为中间体,故一共有3种中间体,C正确;根据图知,总反应方程式为,则该反应为加成反应,总反应原子利用率可达100%,D正确。]
10.B [由图可知总反应为BH3NH3+2H2ON+B+3H2↑,所以总反应ΔS>0,故A正确;加入氢氧化钠和铵根离子反应有利于整个反应向右进行,但同时有氨气生成,从而使制得的氢气中混有氨气,故B错误;由总反应可知,生成2 g H2,转移电子2 mol,故C正确;根据机理图可知,参加反应的两个水分子中只有一个氢原子转化为铵根离子,其余三个氢原子和—BH3中的氢原子结合生成H2,若将水换成D2O,则可释放出HD同时生成NH3D+,故D正确。]
11.B [上述反应机理涉及氧氢极性键、碳氧极性键的形成,没有涉及非极性键的形成,故B错误;该反应甲醛变为CO2,碳元素由0价变为+4价,则每生成1 mol CO2,转移电子的数目约为4×6.02×1023,故C正确;PtNiFe—LDHGO催化甲醛氧化,加快反应速率,降低了该反应的活化能,故D正确。]
B
1.C [乙二醛被O2氧化可得HOOCCOOH、HCOOH、OHCCOOH三种有机产物,A正确;生成IM4反应的活化能小于生成IM1反应的活化能,所以前者速率大,反应很短一段时间内,IM4多于IM1,B正确;乙二醛制乙二酸的最大能垒(活化能)为295.4 kJ·mol-1,C错误;选择合适的催化剂可提高乙醛酸的选择性,使反应向有利于生成乙醛酸的方向进行,D正确。]
2.A [催化剂能降低“过渡态”物质的相对能量,使活化能降低,A项错误,B项正确;曲线Ⅱ正反应的活化能为196 kJ·mol-1-180.5 kJ·mol-1=15.5 kJ·mol-1,C项正确;反应热等于生成物的总能量减反应物的总能量,即ΔH=103.4 kJ·mol-1-180.5 kJ·mol-1=-77.1 kJ·mol-1,D项正确。]
3.B [由题意可知,乙烯生成环氧乙烷的反应为2CH2CH2(g)+O2(g)2(g),该反应是熵减的反应,即ΔS<0,故A错误;由图可知,中间体生成吸附态CH3CHO(ads)的活化能为(-124 kJ·mol-1)-(-176 kJ·mol-1)=52 kJ·mol-1,故B正确;由图可知,环氧乙烷转化为乙醛的反应中,反应的ΔH=(-219 kJ·mol-1)-(-117 kJ·mol-1)=-102 kJ·mol-1,故C错误;反应的活化能越大,反应速率越慢,由图可知,生成环氧乙烷的决速步骤的活化能大于生成乙醛的,则生成环氧乙烷的速率比生成乙醛的慢,故D错误。]
4.C [反应中生成硫单质,生成的S覆盖在催化剂表面或进入催化剂内空位处,阻碍了反应的进行,导致催化剂使用一段时间后催化效率会下降,高温下聚苯胺会分解,故高温灼烧后也不可继续使用,A正确;由图可知,催化氧化过程的总反应为氧气、水、硫离子在催化作用下生成氢氧根离子和硫单质:O2+2H2O+2S2-4OH-+2S↓,B正确;由图可知,反应Ⅱ过程中锰元素化合价也升高被氧化,C错误;由图可知,反应Ⅲ为化学键断裂的吸热反应,故ΔH>0,D正确。]
5.C [MnOOH中Mn为+3价,存在氢氧根离子,不存在—O—O—,A错误;Mn2O3转化为Mn3O4过程中Mn元素化合价降低,需要氧元素化合价升高,需释放O,B错误;结合图示信息,Mn和(NH4)2SO4反应生成[Mn(NH3)n]SO4,需要释放出多余的氢,X为H2,C正确;结合图示反应过程,方法2生成的Mn(OH)2再与O2反应得Mn3O4,则方法2生成Mn3O4总反应的反应物为Mn、H2O与O2,D错误。]
6.D [Co为27号元素,位于元素周期表中第四周期第Ⅷ族,A错误;Co4+和H2O反应生Co3O4和X,根据得失电子守恒、元素守恒和电荷守恒可得3Co4++6H2OCo3O4+O2↑+12H+,则X为O2,C错误。]
7.B [由图知,450 ℃,以CuCl2作催化剂,地康法制备氯气的总反应为4HCl(g)+O2(g)2H2O(g)+2Cl2(g)。该反应的平衡常数可表示为K=,故A错误;其他条件不变,升高温度HCl的平衡转化率降低,说明升温平衡左移,则说明该反应正向放热,即ΔH<0,故B正确;地康法制备氯气时CuCl2作催化剂,CuCl2的使用可以降低反应的活化能,故C错误;未指明标准状况,气体摩尔体积不确定,则无法计算每生成22.4 L Cl2时转移电子的数目,故D错误。]
8.D [根据总反应方程式,可得该总反应的平衡常数K=,A项错误;通过步骤(i)可知,CO变成CO2,碳元素化合价升高,故Cu和Ce化合价会降低,所以步骤(i)中有三种元素化合价发生变化,B项错误;由反应机理可知,步骤(i)是一氧化碳与铜 铈氧化物中的氧元素结合生成二氧化碳,步骤(iii)是一氧化碳与氧气中的氧元素结合生成二氧化碳,C项错误;步骤(iii)中氧气中的氧氧共价键发生断裂,同时有碳氧共价键生成,存在共价键的断裂和共价键的生成,D项正确。]
9.A [由反应历程图可知,①→②为化学键的形成,形成了C—C,故可放出能量,B错误;根据反应方程式可知,该反应的平衡常数K=,C错误;根据反应方程式可知,CH3COOH中C的平均化合价为0,即反应过程中CO2中+4价的C降低为0价,CH4中-4价的C升高到0价,故该反应中每生成1 mol CH3COOH转移电子的数目约为4×6.02×1023,D错误。]
10.C [由图可知,反应物的总能量比生成物的总能量高,反应为放热反应,A项错误;反应分两步进行,第一步反应的活化能大,是反应的决速步骤,但是第一步反应没有NaOH参与,增大c(NaOH),总反应的速率不会增大,B项错误;产率是目标产物的实际产量与理论产量的比值,而转化率是反应物反应的百分数,由转化率无法计算产物的产率,D项错误。]
11.A [由图可知HCOOH的能量高于CO和H2O的能量,所以HCOOH分解生成CO和H2O的反应为放热反应,A错误;过渡态物质的总能量与反应物总能量的差值为活化能,活化能越大反应速率越慢,由图可知,电催化还原CO2的途径一的活化能更低,导致反应更容易进行,生成HCOOH的选择性高于生成CO的选择性,B正确;HCOOH是CO2得电子之后的产物,所以是阴极产物,C正确;途径二的产物是CO和H2O,所以电极反应式为CO2+2H++2e-CO+H2O,D正确。]
同课章节目录
