专题六 主观题突破1 化工生产中物质转化条件的控制(含解析)-2025高考化学二轮复习
文档属性
| 名称 | 专题六 主观题突破1 化工生产中物质转化条件的控制(含解析)-2025高考化学二轮复习 |  | |
| 格式 | docx | ||
| 文件大小 | 22.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-09 17:51:17 | ||
图片预览

文档简介
专题六 主观题突破1 化工生产中物质转化条件的控制
1.(10分)研究从太阳能电池的碲化镉吸收层(主要含CdTe、CdS)中回收碲具有重要的意义。某回收工艺的流程如下:
(1)反应釜中,溶液的pH、温度(T)与生成沉淀的关系如图,图中区域分别表示铁的化合物稳定存在的区域。则制备FeOOH适宜的pH和温度分别为 (填字母)。
a.2,80 ℃ b.4,90 ℃
c.5,160 ℃ d.6,25 ℃
(2)制备磁性纳米铁棒时,加入NaBH4前先通入N2的作用是 。
(3)常温下,若在含Cd2+、Te4+滤液中加入NaOH溶液调节pH为7,溶液中c(Cd2+)的最大值为
(已知:Ksp[Cd(OH)2]=5.3×10-15)。
(4)从含Te滤液得到“吸附Te”,利用了磁性纳米铁棒的性质有 、 。
2.(6分)废催化剂(含TiO2、V2O5、WO3等成分)提取钛、钒工艺流程如图所示。
已知:①钛酸钠(Na2TiO3)难溶于水;
②溶液的酸性较强时,+5价钒主要以的形式存在。
(1)“沉钒”过程中,一般要加入过量NH4Cl,其原因是 。
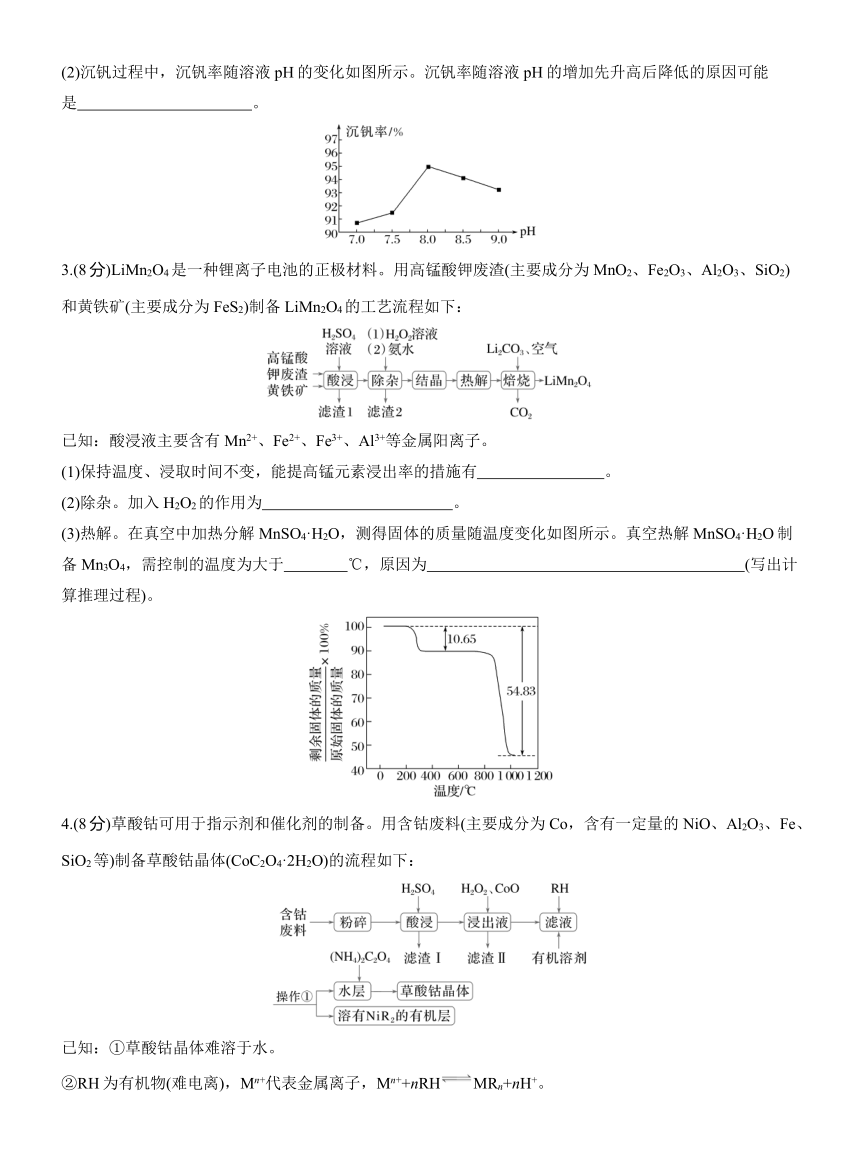
(2)沉钒过程中,沉钒率随溶液pH的变化如图所示。沉钒率随溶液pH的增加先升高后降低的原因可能是 。
3.(8分)LiMn2O4是一种锂离子电池的正极材料。用高锰酸钾废渣(主要成分为MnO2、Fe2O3、Al2O3、SiO2)和黄铁矿(主要成分为FeS2)制备LiMn2O4的工艺流程如下:
已知:酸浸液主要含有Mn2+、Fe2+、Fe3+、Al3+等金属阳离子。
(1)保持温度、浸取时间不变,能提高锰元素浸出率的措施有 。
(2)除杂。加入H2O2的作用为 。
(3)热解。在真空中加热分解MnSO4·H2O,测得固体的质量随温度变化如图所示。真空热解MnSO4·H2O制备Mn3O4,需控制的温度为大于 ℃,原因为 (写出计算推理过程)。
4.(8分)草酸钴可用于指示剂和催化剂的制备。用含钴废料(主要成分为Co,含有一定量的NiO、Al2O3、Fe、SiO2等)制备草酸钴晶体(CoC2O4·2H2O)的流程如下:
已知:①草酸钴晶体难溶于水。
②RH为有机物(难电离),Mn+代表金属离子,Mn++nRHMRn+nH+。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 Fe(OH)3 Fe(OH)2 Co(OH)2 Al(OH)3 Ni(OH)2
开始沉淀 2.7 7.6 7.6 4.0 7.5
完全沉淀 3.7 9.6 9.2 5.2 8.0
④滤液中Co元素以Co2+形式存在。
(1)为提高浸出速率,除将含钴废料粉碎外,还可采取的措施有 (写出两条)。
(2)加入氧化钴调节溶液的pH,调节的pH范围是 。
(3)可否考虑先将Co2+转化为CoCO3,再利用反应CoCO3(s)+C2(aq)CoC2O4(s)+C(aq)将CoCO3转化为CoC2O4: (填“能”或“不能”),说明理由: 。
[Ksp(CoCO3)=1.5×10-13,Ksp(CoC2O4)=6.0×10-8]
5.(9分,每空3分)钯催化剂(主要成分为Pd、α Al2O3,还含少量铁、铜等)是石油化工中催化加氢和催化氧化等反应的重要催化剂。一种从废钯催化剂中回收海绵钯的工艺流程如下:
已知:①钯催化剂在使用过程中Pd易被氧化为难溶于酸的PdO而失活;H2PdCl4是一种二元强酸;②常温下,Ksp[Fe(OH)3]=1×10-38,Ksp[Cu(OH)2]=1×10-20。
(1)“还原Ⅰ”过程中加入甲酸的主要目的是还原 (填化学式)。
(2)“酸浸”过程中温度、固液比对浸取率的影响如图,则“酸浸”的最佳条件为 。
(3)“离子交换”过程可简单表示为+2RClR2PdCl4+2Cl-,流出液通入NH3调节pH后过滤,滤液经一系列操作可以得到CuCl2·2H2O。假设流出液中各金属离子的浓度均为0.01 mol·L-1,常温下需调节pH的范围是 。
6.(9分)以接触法制硫酸的废催化剂(主要成分是V2O5,含少量Al2O3、Fe2O3、MoO3、NiO等)为原料回收金属化合物的工艺流程如图:
(1)如图所示曲线Ⅰ、曲线Ⅱ分别表示“沉钒”中沉钒率与加铵系数(K)(指氯化铵与钒元素质量之比)、温度的关系。
最佳“沉钒”条件是 。温度超过80 ℃时沉钒率下降的主要原因是 。
(2)“水浸”中浸渣可制备高纯度铁红。操作过程包括酸溶、沉铁等。“沉铁”有两种方法:
方法1:调节溶液pH。
已知:沉铁的滤液中c(Ni2+)=0.02 mol·L-1。当c(Fe3+)=1.0×10-5 mol·L-1时被视为完全沉淀。用Na2CO3溶液调节pH分离Ni2+、Fe3+,pH范围为 (已知:Ksp≈1.0×10-38,Ksp≈2.0×10-15)。
方法2:结合法。
已知:Ni(OH)2+4NH3·H2O===+2OH-+4H2O。从含Fe3+、Ni2+的溶液中提取Fe(OH)3的方法是 、过滤、洗涤、干燥。
答案精析
1.(1)b (2)排出设备中的空气,防止磁性纳米铁棒和NaBH4被氧化 (3)0.53 mol·L-1 (4)吸附性 还原性
解析 (2)磁性纳米铁棒和NaBH4都容易被氧化,所以在加入NaBH4之前需通入N2排出反应容器中的空气。(3)常温下,溶液的pH=7,则c(OH-)=1.0×10-7mol·L-1,根据Ksp[Cd(OH)2]=5.3×10-15,则c(Cd2+)== mol·L-1=0.53 mol·L-1。(4)Te中Te的化合价降低,被磁性纳米铁棒还原,磁性纳米铁棒还能吸附Te,故在得到Te的过程中,磁性纳米铁棒呈现了还原性和吸附性。
2.(1)增大浓度,使NH4VO3(s)N(aq)+V(aq)平衡逆向移动,利于NH4VO3尽可能析出完全 (2)pH过低,V转化为V的程度较大;pH过高,N转化为NH3·H2O的程度较大;两因素均使沉钒率降低
3.(1)适当增加硫酸浓度,将固体原料粉碎,加快搅拌速率(任答一条即可,其他合理答案也可) (2)氧化剂,将Fe2+氧化为Fe3+ (3)1 000 3MnSO4·H2O~Mn3O4,×100%=×100%≈54.83%,所以需控制温度大于1 000 ℃
4.(1)适当提高酸浸温度、适当增加硫酸浓度等(答案合理即可) (2)5.2≤pH<7.5 (3)不能 该反应的平衡常数K=2.5×10-6,转化程度小,不能实现转化
解析 (2)加入氧化钴,发生反应:CoO+2H+Co2++H2O,根据阳离子以氢氧化物形式沉淀时溶液的pH可知,调节溶液的pH为5.2≤pH<7.5,使Fe3+和Al3+完全转化为沉淀Fe(OH)3、Al(OH)3,同时不能影响镍和钴。(3)CoCO3(s)+C2(aq)CoC2O4(s)+(aq)的平衡常数K=====2.5×10-6,转化程度小,不能实现该转化。
5.(1)PdO (2)温度80 ℃,固液比4∶1
(3)3≤pH<5
解析 (3)通入NH3调节pH,对于铁离子:c(OH-)== mol·L-1=10-11 mol·L-1,则对应最低pH为3,对于铜离子:c(OH-)<= mol·L-1=10-9 mol·L-1,则对应pH=5,故需调节pH的范围是3≤pH<5。
6.(1)K为4附近、温度为80 ℃左右 温度过高,水解程度增大,生成的NH3挥发,c(N)降低较快,故沉钒率下降 (2)3≤pH<7.5 向混合液中加入过量氨水
解析 (1)加入NH4Cl溶液调节pH,将钒元素以偏钒酸铵的形式分离出来,根据图像可知,当K在4附近时,沉钒率可达到最大,温度最佳值约为80 ℃;因为NH4Cl受热易分解,温度过高氯化铵分解,同时促进铵根离子水解,溶液中铵根离子浓度下降,会使沉钒率下降。(2)铁离子完全沉淀时溶液中c(OH-)= mol·L-1=10-11 mol·L-1,pH=3;当镍离子开始沉淀时溶液中c(OH-)= mol·L-1=10-6.5 mol·L-1,pH=7.5,即沉铁的pH范围为3≤pH<7.5,根据Ni(OH)2+4NH3·H2O+2OH-+4H2O可知,氢氧化镍能溶于过量的氨水中,氢氧化铁不能,则从含Fe3+、Ni2+的溶液中提取Fe(OH)3的方法是向混合液中加入过量氨水、过滤、洗涤、干燥。
1.(10分)研究从太阳能电池的碲化镉吸收层(主要含CdTe、CdS)中回收碲具有重要的意义。某回收工艺的流程如下:
(1)反应釜中,溶液的pH、温度(T)与生成沉淀的关系如图,图中区域分别表示铁的化合物稳定存在的区域。则制备FeOOH适宜的pH和温度分别为 (填字母)。
a.2,80 ℃ b.4,90 ℃
c.5,160 ℃ d.6,25 ℃
(2)制备磁性纳米铁棒时,加入NaBH4前先通入N2的作用是 。
(3)常温下,若在含Cd2+、Te4+滤液中加入NaOH溶液调节pH为7,溶液中c(Cd2+)的最大值为
(已知:Ksp[Cd(OH)2]=5.3×10-15)。
(4)从含Te滤液得到“吸附Te”,利用了磁性纳米铁棒的性质有 、 。
2.(6分)废催化剂(含TiO2、V2O5、WO3等成分)提取钛、钒工艺流程如图所示。
已知:①钛酸钠(Na2TiO3)难溶于水;
②溶液的酸性较强时,+5价钒主要以的形式存在。
(1)“沉钒”过程中,一般要加入过量NH4Cl,其原因是 。
(2)沉钒过程中,沉钒率随溶液pH的变化如图所示。沉钒率随溶液pH的增加先升高后降低的原因可能是 。
3.(8分)LiMn2O4是一种锂离子电池的正极材料。用高锰酸钾废渣(主要成分为MnO2、Fe2O3、Al2O3、SiO2)和黄铁矿(主要成分为FeS2)制备LiMn2O4的工艺流程如下:
已知:酸浸液主要含有Mn2+、Fe2+、Fe3+、Al3+等金属阳离子。
(1)保持温度、浸取时间不变,能提高锰元素浸出率的措施有 。
(2)除杂。加入H2O2的作用为 。
(3)热解。在真空中加热分解MnSO4·H2O,测得固体的质量随温度变化如图所示。真空热解MnSO4·H2O制备Mn3O4,需控制的温度为大于 ℃,原因为 (写出计算推理过程)。
4.(8分)草酸钴可用于指示剂和催化剂的制备。用含钴废料(主要成分为Co,含有一定量的NiO、Al2O3、Fe、SiO2等)制备草酸钴晶体(CoC2O4·2H2O)的流程如下:
已知:①草酸钴晶体难溶于水。
②RH为有机物(难电离),Mn+代表金属离子,Mn++nRHMRn+nH+。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 Fe(OH)3 Fe(OH)2 Co(OH)2 Al(OH)3 Ni(OH)2
开始沉淀 2.7 7.6 7.6 4.0 7.5
完全沉淀 3.7 9.6 9.2 5.2 8.0
④滤液中Co元素以Co2+形式存在。
(1)为提高浸出速率,除将含钴废料粉碎外,还可采取的措施有 (写出两条)。
(2)加入氧化钴调节溶液的pH,调节的pH范围是 。
(3)可否考虑先将Co2+转化为CoCO3,再利用反应CoCO3(s)+C2(aq)CoC2O4(s)+C(aq)将CoCO3转化为CoC2O4: (填“能”或“不能”),说明理由: 。
[Ksp(CoCO3)=1.5×10-13,Ksp(CoC2O4)=6.0×10-8]
5.(9分,每空3分)钯催化剂(主要成分为Pd、α Al2O3,还含少量铁、铜等)是石油化工中催化加氢和催化氧化等反应的重要催化剂。一种从废钯催化剂中回收海绵钯的工艺流程如下:
已知:①钯催化剂在使用过程中Pd易被氧化为难溶于酸的PdO而失活;H2PdCl4是一种二元强酸;②常温下,Ksp[Fe(OH)3]=1×10-38,Ksp[Cu(OH)2]=1×10-20。
(1)“还原Ⅰ”过程中加入甲酸的主要目的是还原 (填化学式)。
(2)“酸浸”过程中温度、固液比对浸取率的影响如图,则“酸浸”的最佳条件为 。
(3)“离子交换”过程可简单表示为+2RClR2PdCl4+2Cl-,流出液通入NH3调节pH后过滤,滤液经一系列操作可以得到CuCl2·2H2O。假设流出液中各金属离子的浓度均为0.01 mol·L-1,常温下需调节pH的范围是 。
6.(9分)以接触法制硫酸的废催化剂(主要成分是V2O5,含少量Al2O3、Fe2O3、MoO3、NiO等)为原料回收金属化合物的工艺流程如图:
(1)如图所示曲线Ⅰ、曲线Ⅱ分别表示“沉钒”中沉钒率与加铵系数(K)(指氯化铵与钒元素质量之比)、温度的关系。
最佳“沉钒”条件是 。温度超过80 ℃时沉钒率下降的主要原因是 。
(2)“水浸”中浸渣可制备高纯度铁红。操作过程包括酸溶、沉铁等。“沉铁”有两种方法:
方法1:调节溶液pH。
已知:沉铁的滤液中c(Ni2+)=0.02 mol·L-1。当c(Fe3+)=1.0×10-5 mol·L-1时被视为完全沉淀。用Na2CO3溶液调节pH分离Ni2+、Fe3+,pH范围为 (已知:Ksp≈1.0×10-38,Ksp≈2.0×10-15)。
方法2:结合法。
已知:Ni(OH)2+4NH3·H2O===+2OH-+4H2O。从含Fe3+、Ni2+的溶液中提取Fe(OH)3的方法是 、过滤、洗涤、干燥。
答案精析
1.(1)b (2)排出设备中的空气,防止磁性纳米铁棒和NaBH4被氧化 (3)0.53 mol·L-1 (4)吸附性 还原性
解析 (2)磁性纳米铁棒和NaBH4都容易被氧化,所以在加入NaBH4之前需通入N2排出反应容器中的空气。(3)常温下,溶液的pH=7,则c(OH-)=1.0×10-7mol·L-1,根据Ksp[Cd(OH)2]=5.3×10-15,则c(Cd2+)== mol·L-1=0.53 mol·L-1。(4)Te中Te的化合价降低,被磁性纳米铁棒还原,磁性纳米铁棒还能吸附Te,故在得到Te的过程中,磁性纳米铁棒呈现了还原性和吸附性。
2.(1)增大浓度,使NH4VO3(s)N(aq)+V(aq)平衡逆向移动,利于NH4VO3尽可能析出完全 (2)pH过低,V转化为V的程度较大;pH过高,N转化为NH3·H2O的程度较大;两因素均使沉钒率降低
3.(1)适当增加硫酸浓度,将固体原料粉碎,加快搅拌速率(任答一条即可,其他合理答案也可) (2)氧化剂,将Fe2+氧化为Fe3+ (3)1 000 3MnSO4·H2O~Mn3O4,×100%=×100%≈54.83%,所以需控制温度大于1 000 ℃
4.(1)适当提高酸浸温度、适当增加硫酸浓度等(答案合理即可) (2)5.2≤pH<7.5 (3)不能 该反应的平衡常数K=2.5×10-6,转化程度小,不能实现转化
解析 (2)加入氧化钴,发生反应:CoO+2H+Co2++H2O,根据阳离子以氢氧化物形式沉淀时溶液的pH可知,调节溶液的pH为5.2≤pH<7.5,使Fe3+和Al3+完全转化为沉淀Fe(OH)3、Al(OH)3,同时不能影响镍和钴。(3)CoCO3(s)+C2(aq)CoC2O4(s)+(aq)的平衡常数K=====2.5×10-6,转化程度小,不能实现该转化。
5.(1)PdO (2)温度80 ℃,固液比4∶1
(3)3≤pH<5
解析 (3)通入NH3调节pH,对于铁离子:c(OH-)== mol·L-1=10-11 mol·L-1,则对应最低pH为3,对于铜离子:c(OH-)<= mol·L-1=10-9 mol·L-1,则对应pH=5,故需调节pH的范围是3≤pH<5。
6.(1)K为4附近、温度为80 ℃左右 温度过高,水解程度增大,生成的NH3挥发,c(N)降低较快,故沉钒率下降 (2)3≤pH<7.5 向混合液中加入过量氨水
解析 (1)加入NH4Cl溶液调节pH,将钒元素以偏钒酸铵的形式分离出来,根据图像可知,当K在4附近时,沉钒率可达到最大,温度最佳值约为80 ℃;因为NH4Cl受热易分解,温度过高氯化铵分解,同时促进铵根离子水解,溶液中铵根离子浓度下降,会使沉钒率下降。(2)铁离子完全沉淀时溶液中c(OH-)= mol·L-1=10-11 mol·L-1,pH=3;当镍离子开始沉淀时溶液中c(OH-)= mol·L-1=10-6.5 mol·L-1,pH=7.5,即沉铁的pH范围为3≤pH<7.5,根据Ni(OH)2+4NH3·H2O+2OH-+4H2O可知,氢氧化镍能溶于过量的氨水中,氢氧化铁不能,则从含Fe3+、Ni2+的溶液中提取Fe(OH)3的方法是向混合液中加入过量氨水、过滤、洗涤、干燥。
同课章节目录
