2016春九年级化学(人教版下册)同步教学课件:第八单元 课题2 金属的化学性质(共20张PPT)
文档属性
| 名称 | 2016春九年级化学(人教版下册)同步教学课件:第八单元 课题2 金属的化学性质(共20张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 4.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-03-31 00:00:00 | ||
图片预览








文档简介
课件20张PPT。课题2 金属的化学性质
第1课时本节导读一、创设情景 明确目标铁丝在空气中红热,在氧气中燃烧,生成四氧化三铁镁条在空气中燃烧,生成氧化镁镁比铁活泼知识回顾二、自主学习 指向目标自读课本P9-P11,
完成学生用书当堂作业部分。三、合作探究 达成目标探究点一:金属与氧气的反应铜由红色变为黑色三、合作探究 达成目标 世界上铝的年产量仅次于铁,居第二位。不仅是因为改进了铝的冶炼方法,使其成本大大降低,以及铝的密度较小外,还由于铝的抗腐蚀性能好。铝及其合金在电线电缆工业、飞机、汽车等制造业有广泛的用途。Al三、合作探究 达成目标相信你能发现:
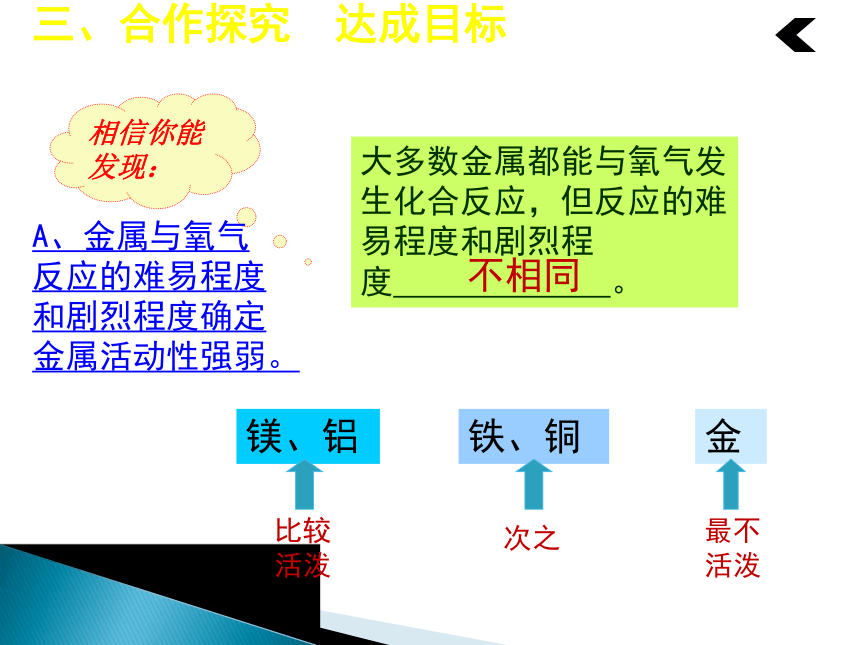
大多数金属都能与氧气发生化合反应,但反应的难易程度和剧烈程度 。比较活泼次之最不活泼不相同A、金属与氧气反应的难易程度和剧烈程度确定金属活动性强弱。【教师点拨】
实验表明,大多数金属都能与氧气发生反应,但反应的难易和剧烈程度是不同的。如镁、铝等在常温下就能与氧气反应,铁、铜等在常温下几乎不与氧气反应,但在高温时能与氧气反应。“真金不怕火炼”说明金即使在高温时也不与氧气反应。根据上述事实,我们可判断出这些金属的活泼程度,即金属活动性。
三、合作探究 达成目标【一试身手】
请同学们完成学生用书当堂作业部分。三、合作探究 达成目标三、合作探究 达成目标探究点二:金属与酸溶液的反应 在4支试管里分别放入两小块铜、铁、锌、镁,再依次加入约占试管容积1/4的稀盐酸(或稀硫酸),仔细观察金属表面与溶液的变化,比较反应的剧烈程度。选择反应比较快的用燃着的小木条放在试管口,检验产生的气体。请记录实验现象。友情提醒:实验操作要规范,取用稀盐酸或稀硫酸千万要小心哦!三、合作探究 达成目标 由一种单质与一种化合物反应, 生成另一种单质与另一种化合物的反应。单质 化合物 化合物 单质置换反应:三、合作探究 达成目标化学反应的基本类型思考:你知道哪些反应类型请各写出一例?置换反应:
由一种单质与一种化合物反应,生成另一种单质和化合物的反应
单质+化合物=另一单质+另一化合物
置换反应:A + BC → AC + B化合反应:A + B + … → AB…(多变一)
分解反应:AB →A + B + … (一变多)三、合作探究 达成目标相信你能发现:
1.很多金属都能与盐酸或稀硫酸发生 ,但反应的剧烈程度 。B、金属与酸能否反应以及反应的剧烈程度可确定金属的活泼程度。Mg、Zn、Fe的金属活动性比Cu铜强,能置换出盐酸或稀硫酸中的氢。置换反应不相同三、合作探究 达成目标【教师点拨】
1、 不仅知道哪些金属能与酸反应,还要知道反应的剧烈程度。
2、 不能与酸反应的金属有哪些,也是学习的重点。
3、 置换反应是化学反应基本类型中的第三种。
三、合作探究 达成目标【一试身手】
请同学们完成学生用书当堂作业部分。三、合作探究 达成目标【典例精讲】下列物质能否发生反应?写出能发生反应的化学方程式并判断它们是否为置换反应。
(1)金与氧气 (2)锌与硫酸溶液
(3)铜与硫酸溶液 (4)铁与盐酸溶液思路点拨:考察的是金属与氧气、金属与酸反应的规律。金与氧气不能发生反应,锌与硫酸反应生成硫酸锌和氢气,Zn+H2SO4=ZnSO4+H2↑,置换反应;铜与硫酸不能反应;铁与盐酸反应生成硫酸亚铁和氢气,Fe+2HCl=FeCl2+H2↑,发生的是置换反应。
答案:(1)金与氧气不能发生反应;(2)Zn+H2SO4=ZnSO4+H2↑,置换反应;
(3)铜与硫酸不能反应;(4)Fe+2HCl=FeCl2+H2↑,发生的是置换反应。
归纳:金属与酸与氧气的反应,一定要掌握,哪些金属能与氧气反应,哪些金属能与酸反应。只有能反应的才能书写化学方程式。四、总结梳理 内化目标1、很多金属能与盐酸、硫酸等发生反应, 但反应的难易和剧烈程度不同,把金属分为活泼金属和不活泼金属2、置换反应【易错易混提示】
不同的金属与氧气反应所需要的条件不同;不同的金属有的能酸反应,有的不能与酸反应。五、达标检测 反思目标CDDCCBABCD1、小兰家中收藏一件清末的铝制佛像,
该佛像至今保存十分完好。其主要原因是( )
A.铝不易发生化学反应
B.铝的氧化物容易发生还原反应
C.铝不易被氧化
D.铝易氧化,但氧化铝具有保护内部铝的作用
2、下列反应属于置换反应的是( )
①H2+CuO === Cu+H2O
②2CO+O2 === 2CO2
③Zn+2HCl===ZnCl+H2
④Fe2O3+3CO === 2Fe+3CO2
A、①④ B、②③ C、①③ D、②④ 3、一般情况下,金属越活泼,与酸反应的速度越快。
为了探究金属Mg、Zn、Fe与酸反应的快慢,
某研究性学习小组设计了如下的实验。
【实验步骤】
①取A、B、C三支试管,分别加入2mL浓度相同的盐酸溶液,
②分别加入足量的、大小相等的Mg、Zn、Fe,立即
把三个相同的气球分别套在各试管口上。
【实验预测与分析】
(1)写出铁与盐酸反应的化学方程式_________。
(2)气球膨胀速度最快的是______(填试管编号)。
(3)该实验表明,实验室一般选用锌而不选用镁、铁
制取氢气的主要原因是 。
(4)步骤②是实验获得成功的关键,
你认为在操作过程中小组成员之间应该: 。
(1)Fe+2HCl==FeCl2+H2↑
(2)A
(3)镁与酸反应太快了,铁与酸反应太慢了。
(4)要配合默契,同时操作。五、达标检测 反思目标The end,thank you!谢谢大家
第1课时本节导读一、创设情景 明确目标铁丝在空气中红热,在氧气中燃烧,生成四氧化三铁镁条在空气中燃烧,生成氧化镁镁比铁活泼知识回顾二、自主学习 指向目标自读课本P9-P11,
完成学生用书当堂作业部分。三、合作探究 达成目标探究点一:金属与氧气的反应铜由红色变为黑色三、合作探究 达成目标 世界上铝的年产量仅次于铁,居第二位。不仅是因为改进了铝的冶炼方法,使其成本大大降低,以及铝的密度较小外,还由于铝的抗腐蚀性能好。铝及其合金在电线电缆工业、飞机、汽车等制造业有广泛的用途。Al三、合作探究 达成目标相信你能发现:
大多数金属都能与氧气发生化合反应,但反应的难易程度和剧烈程度 。比较活泼次之最不活泼不相同A、金属与氧气反应的难易程度和剧烈程度确定金属活动性强弱。【教师点拨】
实验表明,大多数金属都能与氧气发生反应,但反应的难易和剧烈程度是不同的。如镁、铝等在常温下就能与氧气反应,铁、铜等在常温下几乎不与氧气反应,但在高温时能与氧气反应。“真金不怕火炼”说明金即使在高温时也不与氧气反应。根据上述事实,我们可判断出这些金属的活泼程度,即金属活动性。
三、合作探究 达成目标【一试身手】
请同学们完成学生用书当堂作业部分。三、合作探究 达成目标三、合作探究 达成目标探究点二:金属与酸溶液的反应 在4支试管里分别放入两小块铜、铁、锌、镁,再依次加入约占试管容积1/4的稀盐酸(或稀硫酸),仔细观察金属表面与溶液的变化,比较反应的剧烈程度。选择反应比较快的用燃着的小木条放在试管口,检验产生的气体。请记录实验现象。友情提醒:实验操作要规范,取用稀盐酸或稀硫酸千万要小心哦!三、合作探究 达成目标 由一种单质与一种化合物反应, 生成另一种单质与另一种化合物的反应。单质 化合物 化合物 单质置换反应:三、合作探究 达成目标化学反应的基本类型思考:你知道哪些反应类型请各写出一例?置换反应:
由一种单质与一种化合物反应,生成另一种单质和化合物的反应
单质+化合物=另一单质+另一化合物
置换反应:A + BC → AC + B化合反应:A + B + … → AB…(多变一)
分解反应:AB →A + B + … (一变多)三、合作探究 达成目标相信你能发现:
1.很多金属都能与盐酸或稀硫酸发生 ,但反应的剧烈程度 。B、金属与酸能否反应以及反应的剧烈程度可确定金属的活泼程度。Mg、Zn、Fe的金属活动性比Cu铜强,能置换出盐酸或稀硫酸中的氢。置换反应不相同三、合作探究 达成目标【教师点拨】
1、 不仅知道哪些金属能与酸反应,还要知道反应的剧烈程度。
2、 不能与酸反应的金属有哪些,也是学习的重点。
3、 置换反应是化学反应基本类型中的第三种。
三、合作探究 达成目标【一试身手】
请同学们完成学生用书当堂作业部分。三、合作探究 达成目标【典例精讲】下列物质能否发生反应?写出能发生反应的化学方程式并判断它们是否为置换反应。
(1)金与氧气 (2)锌与硫酸溶液
(3)铜与硫酸溶液 (4)铁与盐酸溶液思路点拨:考察的是金属与氧气、金属与酸反应的规律。金与氧气不能发生反应,锌与硫酸反应生成硫酸锌和氢气,Zn+H2SO4=ZnSO4+H2↑,置换反应;铜与硫酸不能反应;铁与盐酸反应生成硫酸亚铁和氢气,Fe+2HCl=FeCl2+H2↑,发生的是置换反应。
答案:(1)金与氧气不能发生反应;(2)Zn+H2SO4=ZnSO4+H2↑,置换反应;
(3)铜与硫酸不能反应;(4)Fe+2HCl=FeCl2+H2↑,发生的是置换反应。
归纳:金属与酸与氧气的反应,一定要掌握,哪些金属能与氧气反应,哪些金属能与酸反应。只有能反应的才能书写化学方程式。四、总结梳理 内化目标1、很多金属能与盐酸、硫酸等发生反应, 但反应的难易和剧烈程度不同,把金属分为活泼金属和不活泼金属2、置换反应【易错易混提示】
不同的金属与氧气反应所需要的条件不同;不同的金属有的能酸反应,有的不能与酸反应。五、达标检测 反思目标CDDCCBABCD1、小兰家中收藏一件清末的铝制佛像,
该佛像至今保存十分完好。其主要原因是( )
A.铝不易发生化学反应
B.铝的氧化物容易发生还原反应
C.铝不易被氧化
D.铝易氧化,但氧化铝具有保护内部铝的作用
2、下列反应属于置换反应的是( )
①H2+CuO === Cu+H2O
②2CO+O2 === 2CO2
③Zn+2HCl===ZnCl+H2
④Fe2O3+3CO === 2Fe+3CO2
A、①④ B、②③ C、①③ D、②④ 3、一般情况下,金属越活泼,与酸反应的速度越快。
为了探究金属Mg、Zn、Fe与酸反应的快慢,
某研究性学习小组设计了如下的实验。
【实验步骤】
①取A、B、C三支试管,分别加入2mL浓度相同的盐酸溶液,
②分别加入足量的、大小相等的Mg、Zn、Fe,立即
把三个相同的气球分别套在各试管口上。
【实验预测与分析】
(1)写出铁与盐酸反应的化学方程式_________。
(2)气球膨胀速度最快的是______(填试管编号)。
(3)该实验表明,实验室一般选用锌而不选用镁、铁
制取氢气的主要原因是 。
(4)步骤②是实验获得成功的关键,
你认为在操作过程中小组成员之间应该: 。
(1)Fe+2HCl==FeCl2+H2↑
(2)A
(3)镁与酸反应太快了,铁与酸反应太慢了。
(4)要配合默契,同时操作。五、达标检测 反思目标The end,thank you!谢谢大家
同课章节目录
