2024中考九年级化学专题复习化学与技术课件(共36张PPT)
文档属性
| 名称 | 2024中考九年级化学专题复习化学与技术课件(共36张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-10 13:00:42 | ||
图片预览








文档简介
(共36张PPT)
2024中考九年级化学专题复习化学与技术
返回
目录
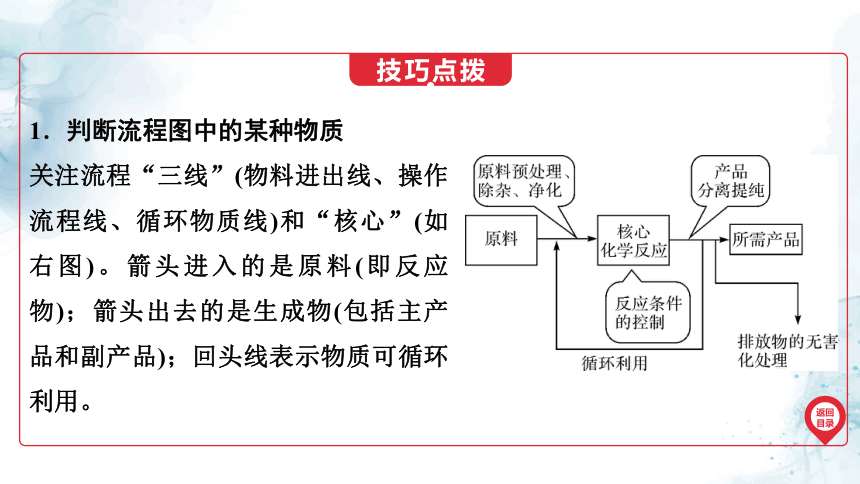
1.判断流程图中的某种物质
关注流程“三线”(物料进出线、操作流程线、循环物质线)和“核心”(如右图)。箭头进入的是原料(即反应物);箭头出去的是生成物(包括主产品和副产品);回头线表示物质可循环利用。
要求分析流程图中的每一步操作,了解每一步操作中进出的物质,发生的反应,该操作的目的,对制造或提纯产品能起到的作用等。
(1)判断所加的试剂:可以从加入试剂的目的、反应的产物入手进行分析。
(2)判断流程图中某一步中的物质:可以从上一步操作中反应物可能发生的反应入手进行分析,同时需注意上一步所加试剂是否有剩余。
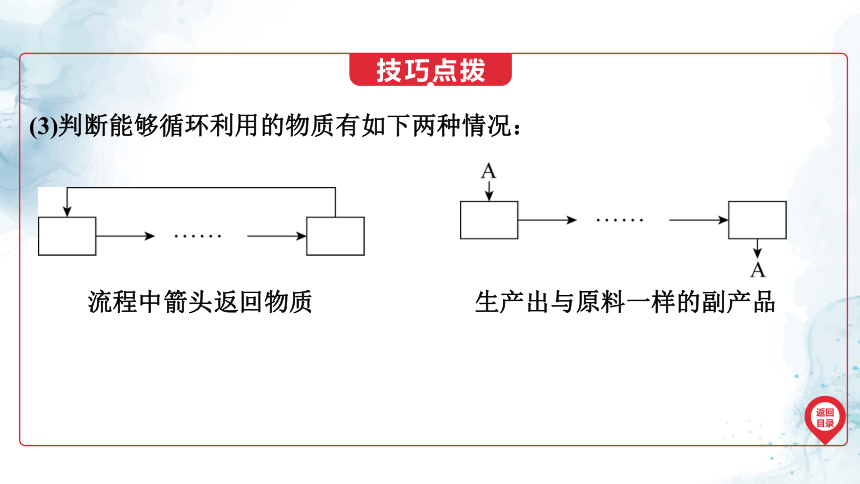
(3)判断能够循环利用的物质有如下两种情况:
流程中箭头返回物质
生产出与原料一样的副产品
2.对原料预处理的方法及作用
(1)粉碎、研磨或喷淋注入:增大反应物的接触面积,加快反应速率,使反应更充分。
(2)清洗或打磨:除去物质表面的污物或氧化物。
(3)溶解:溶于水、酸或碱,不溶物通过过滤除去。
(4)灼烧:除去可燃性杂质或使原料初步转化。
(5)煅烧:使杂质在高温下氧化或分解。
3.流程中化学方程式的书写
(1)根据流程图书写其中某步发生反应的化学方程式:首先要找出进入该步操作中的物质,根据所学知识判断其可能发生的反应,然后写出产物,并进行配平。
(2)依据信息书写未学过的化学方程式:首先要从流程图中找出反应物和生成物,若从已知信息中找出的反应物和生成物满足元素守恒,则根据化学方程式的书写原则进行配平,标注条件、气体或沉淀符号;若不满足元素守恒,则要分析反应环境(在溶液中进行或在空气中进行),在反应物或生成物中加上对应的物质(水或氧气等),使化学方程式满足反应前后元素种类不变,然后进行配平等。
4.混合物分离、提纯的操作及所需实验用品的判断
(1)过滤:分离固体和液体的混合物。实验室进行该操作所需的用品有铁架台(带铁圈)、漏斗、烧杯、玻璃棒、滤纸。
(2)蒸馏:分离沸点不同的几种液体混合物。
(3)结晶:从物质的溶液中得到该物质的常用方法。
①蒸发结晶:适用于溶解度受温度变化影响较小的物质。
②降温结晶:适用于溶解度受温度变化影响较大的物质,具体操作过程为蒸发浓缩→冷却结晶→过滤→洗涤→干燥。
5.工艺流程的评价
(1)科学性:能否达到目的,杂质是否完全除去,是否引入新的杂质等。
(2)安全性:尽量选用较温和的反应条件,避免高温、高压等条件。
(3)简便性:操作简便,便于提纯、分离物质。
(4)节约性:原料利用率要尽量高。
(5)对环境的影响:是否符合绿色化学理念,是否产生有毒气体等。
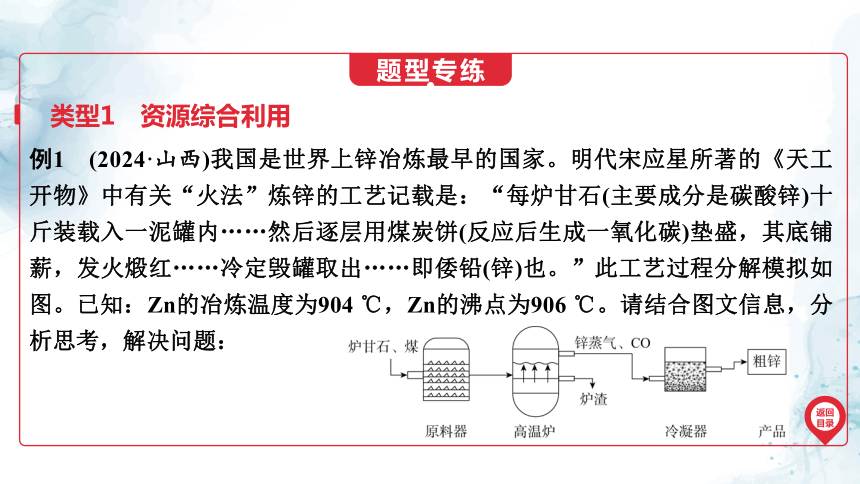
例1 (2024·山西)我国是世界上锌冶炼最早的国家。明代宋应星所著的《天工开物》中有关“火法”炼锌的工艺记载是:“每炉甘石(主要成分是碳酸锌)十斤装载入一泥罐内……然后逐层用煤炭饼(反应后生成一氧化碳)垫盛,其底铺薪,发火煅红……冷定毁罐取出……即倭铅(锌)也。”此工艺过程分解模拟如图。已知:Zn的冶炼温度为904 ℃,Zn的沸点为906 ℃。请结合图文信息,分析思考,解决问题:
类型1 资源综合利用
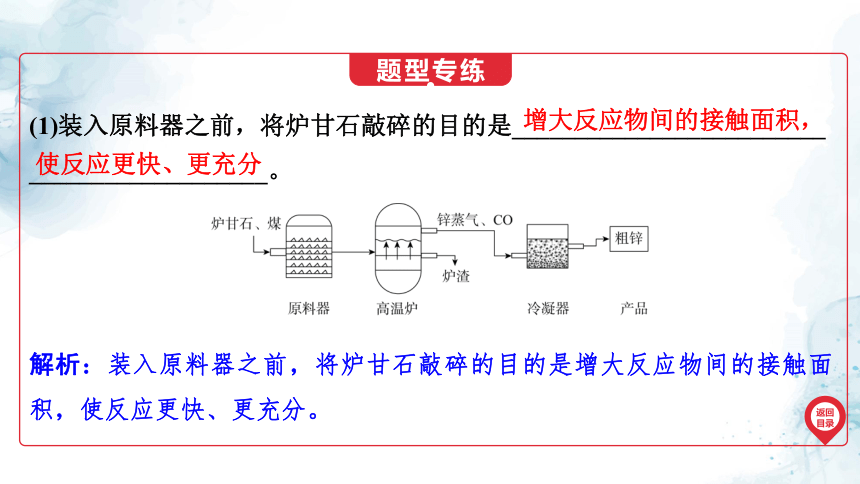
(1)装入原料器之前,将炉甘石敲碎的目的是_________________________
___________________。
增大反应物间的接触面积,
使反应更快、更充分
解析:装入原料器之前,将炉甘石敲碎的目的是增大反应物间的接触面积,使反应更快、更充分。
(2)高温炉内,碳酸锌(ZnCO3)在高温条件下与煤的主要成分发生反应生成Zn和CO,反应的化学方程式为__________________________________。该反应生成物中碳元素的化合价为_____。
+2
解析:高温炉内,ZnCO3在高温条件下与煤的主要成分发生反应生成Zn和CO,结合流程可知反应的化学方程式为2C+ZnCO3 Zn↑+3CO↑。该反应中含碳元素的生成物是CO,CO中氧元素显-2价,根据化合物中各元素正、负化合价的代数和为0可知,其中碳元素的化合价为+2。
(3)冷凝器中发生的变化属于___________。
物理变化
解析:冷凝器中,锌蒸气变成固态锌,没有新物质生成,发生的变化属于物理变化。
(4)我国古代冶锌晚于铁和铜,结合已知信息,分析说明其中的原因是____________________________________________________________________。
Zn的冶炼温度与沸点接近,冶炼时生成的Zn呈气态,不易收集(合理即
可)
解析:我国古代冶锌晚于铁和铜,原因是Zn的冶炼温度与沸点接近,冶炼时生成的Zn呈气态,不易收集等。
例2 (2021·山西)造纸术是中国古代四大发明之一。一直以来,传统工艺不断改进。现阶段,利用方解石(主要成分为CaCO3,还含有少量MgO、Fe2O3、SiO2等杂质)造纸已较为普遍,它取代传统的植物纤维造纸,全程无须用水,原料造价仅为传统造纸
的1/3(已知:SiO2、聚乙烯塑料、
黏合剂均难溶于水,且不与盐酸反
应)。分析生产过程,回答下列问题:
(1)将方解石粉碎成纳米级超细粉末的目的是_________________________
___________________。
(2)混合器内需要进行的操作是______。
(3)利用方解石作原料生产纸张的优点是___________________________。
提高纸张质量(或提高纸张的
平整度,合理即可)
搅拌
成本低(或节省木材,合理即可)
(4)从绿色环保的角度分析,对使用的原料需要改进的地方是___________
_______________。
(5)成品纸张在保存过程中应避免与酸接触,若遇到稀盐酸,则可能发生反应的化学方程式为______________________________________________
____________________________________(写一个)。
使用可降解
塑料(合理即可)
CaCO3+2HCl=== CaCl2+H2O+CO2↑(或Fe2O3+
6HCl=== 2FeCl3+3H2O,合理即可)
例3 铝灰是金属冶炼过程中产生的废渣。以铝灰(主要成分为Al2O3及可溶性物质,还含有少量SiO2、FeO、Fe2O3等)为原料制备硫酸铝的生产流程如下图所示。分析流程,回答问题:
类型2 废物合理利用
注:过氧化氢可以将Fe2+氧化为Fe3+。SiO2不溶于水,也不与常见的酸反应。
(1)除杂器中加入水的目的是________________________。
(2)酸浸池中发生反应的化学方程式为_______________________________
________________(写一个),从酸浸池得到的残渣中主要含有________。
(3)氧化池中为使双氧水充分反应,可进行的操作是________________。
(4)用铝灰制备硫酸铝的意义是______________________________。
除去铝灰中的可溶性物质
Al2O3+3H2SO4=== Al2(SO4)3+
3H2O(合理即可)
SiO2
搅拌(合理即可)
废物利用,节约资源(合理即可)
例4 生物质燃气是以有机废料为原料转换成的可燃性能源,其中含有CH4、CO和H2等可燃性气体。用有机废料生产生物质燃气的主要流程如下图所示。请分析流程,回答有关问题。
(1)常见的有机废料是______________________(写一种),将有机废料进行粉碎的目的是____________________________________。
农作物秸秆(合理即可)
便于分离有机物和无机材料(合理即可)
解析:常见的有机废料有植物落叶、动物粪便、农作物秸秆等。将有机废料进行粉碎的目的是便于在清沙器中分离有机物和无机材料等。
(2)清沙器将混合物分为上层有机层和下层无机层,利用了物质的______不同。
密度
解析:清沙器将混合物分为上层有机层和下层无机层,利用了物质的密度不同。
(3)发酵池中发生的变化属于______变化。生物质燃气充分燃烧的化学方程式为___________________________________(写一个)。
化学
解析:在发酵池中,有机物转化成生物质燃气,这一过程中有新物质生成,发生的是化学变化。根据题干可知,生物质燃气中含有CH4、CO和H2等可燃性气体,故生物质燃气充分燃烧时发生反应的化学方程式有CH4+2O2 CO2+2H2O、2CO+O2 2CO2、2H2+O2
2H2O。
例5 (2023·山西)制作豆腐过程中用到了盐卤。盐卤是我国数千年来豆腐制作的传统凝固剂,有较好的溶解性和凝固性,主要成分为氯化钠(含量约2%~6%)和氯化钾(含量约2%~4%)等。豆腐的制作流程如下,请结合图文信息,分析思考,解决问题。
类型3 生活物质制备
(1)研磨机将豆子研碎、研细的目的是_____________________________。
使豆子得到充分利用(合理即可)
解析:研磨机将豆子研碎、研细的目的是使豆子得到充分利用,得到更多的豆浆。
(2)在煮浆器内的煮沸过程中,可将有毒豆浆转化为无毒豆浆,发生的变化是__________。
化学变化
解析:在煮浆器内的煮沸过程中,将有毒豆浆转化为无毒豆浆,这一过程中有新物质生成,发生的是化学变化。
(3)为加快凝固速度,当把盐卤慢慢加入混合器时,需进行的操作是______。
搅拌
解析:为加快凝固速度,当把盐卤慢慢加入混合器时,需进行的操作是搅拌,增大盐卤与豆浆之间的接触面积。
(4)向盐卤中滴加AgNO3溶液,发生反应的化学方程式为_______________
____________________________________________________(写一个)。
AgNO3+NaCl
=== AgCl↓+NaNO3(或AgNO3+KCl=== AgCl↓+KNO3)
解析:由题可知,盐卤的主要成分为氯化钠和氯化钾等,故向盐卤中滴加AgNO3溶液,发生反应的化学方程式为AgNO3+NaCl===AgCl↓+NaNO3、AgNO3+KCl===AgCl↓+KNO3。
(5)“花开富贵”是一道吃出咸辣味、品出世间美的豆腐制品,它有强筋骨、防贫血等功效,由此推知,这种食物含有的微量元素是____。
铁
解析:“花开富贵”有强筋骨、防贫血等功效,说明其中含有钙、铁元素,而钙元素属于人体必需的常量元素,铁元素属于人体必需的微量元素。
例6 (2024·太原一模)胡麻油是山西特产,自古以来被民间视为美食珍品。《本草纲目》上记载:“胡麻取油……能润燥也。”古法制作胡麻油的过程如图所示,请分析流程,回答问题。
(1)胡麻籽在炒锅中发生的变化属于__________。
(2)用石磨研磨胡麻籽的目的是_________________________________。
(3)蒸笼所用的锅为铁制品,用赤铁矿石(主要成分是Fe2O3)冶炼金属铁的化学方程式为____________________________________________。
(4)胡麻油为人体提供的营养物质主要是______,它对人体所起的作用是__________。
化学变化
使胡麻籽的出油率更高(合理即可)
油脂
提供能量
例7 (2022·山西)新型发光陶瓷是将高科技蓄光材料融入传统陶瓷釉料中,经高温烧制而成。它吸蓄光能后,可在阴暗环境中自行发光,以下是其部分生产流程。分析流程,回答问题:
类型4 化工产品制备
(1)上述设备中,有化学变化发生的是________。
(2)练泥机将水和坯料充分调和,其作用相当于实验操作中的______。
(3)施釉机先将蓄光釉料印刷在坯体上,再涂抹一层透明釉料的作用是________________________________________。
(4)生产蓄光材料需要在稀有气体环境中进行,利用稀有气体的性质是__________________。
(5)若坯料中铁粉未被除去,则烧制的陶瓷会出现黑点,其原因是_______
_____________________________(用化学方程式解释)。
烧成炉
搅拌
保护蓄光釉料(或提高釉面性能,合理即可)
化学性质很不活泼
3Fe+
例8 (2020·山西节选)“庄稼一枝花,全靠肥当家”。近年来,随着农业生产的不断发展,对硫酸镁(MgSO4)肥料的需求量逐年上升。以氧化镁矿粉(主要成分为氧化镁,还含有少量氧化铁、烧碱等杂质)和浓硫酸为原料,生产MgSO4的部分生产流程如图1
所示。已知氧化镁与硫酸发生反应的
化学方程式为:MgO+H2SO4===
MgSO4+H2O。
分析制备过程,回答下列问题:
(1)图1中,石墨配酸塔由石墨制成,
说明石墨具有的性质是____________
______。
(2)生产中,稀硫酸与杂质发生反应的化学方程式为___________________
_________________________(写一个)。
耐腐蚀(合理
即可)
H2SO4+2NaOH===
Na2SO4+2H2O(合理即可)
(3)分析图2,使用硫酸的最佳浓度为______。
(4)生产过程无废物排放,符合绿色化学要求,其中可循环利用的物质是______________________。
66%
酸雾和水蒸气(或稀硫酸)
2024中考九年级化学专题复习化学与技术
返回
目录
1.判断流程图中的某种物质
关注流程“三线”(物料进出线、操作流程线、循环物质线)和“核心”(如右图)。箭头进入的是原料(即反应物);箭头出去的是生成物(包括主产品和副产品);回头线表示物质可循环利用。
要求分析流程图中的每一步操作,了解每一步操作中进出的物质,发生的反应,该操作的目的,对制造或提纯产品能起到的作用等。
(1)判断所加的试剂:可以从加入试剂的目的、反应的产物入手进行分析。
(2)判断流程图中某一步中的物质:可以从上一步操作中反应物可能发生的反应入手进行分析,同时需注意上一步所加试剂是否有剩余。
(3)判断能够循环利用的物质有如下两种情况:
流程中箭头返回物质
生产出与原料一样的副产品
2.对原料预处理的方法及作用
(1)粉碎、研磨或喷淋注入:增大反应物的接触面积,加快反应速率,使反应更充分。
(2)清洗或打磨:除去物质表面的污物或氧化物。
(3)溶解:溶于水、酸或碱,不溶物通过过滤除去。
(4)灼烧:除去可燃性杂质或使原料初步转化。
(5)煅烧:使杂质在高温下氧化或分解。
3.流程中化学方程式的书写
(1)根据流程图书写其中某步发生反应的化学方程式:首先要找出进入该步操作中的物质,根据所学知识判断其可能发生的反应,然后写出产物,并进行配平。
(2)依据信息书写未学过的化学方程式:首先要从流程图中找出反应物和生成物,若从已知信息中找出的反应物和生成物满足元素守恒,则根据化学方程式的书写原则进行配平,标注条件、气体或沉淀符号;若不满足元素守恒,则要分析反应环境(在溶液中进行或在空气中进行),在反应物或生成物中加上对应的物质(水或氧气等),使化学方程式满足反应前后元素种类不变,然后进行配平等。
4.混合物分离、提纯的操作及所需实验用品的判断
(1)过滤:分离固体和液体的混合物。实验室进行该操作所需的用品有铁架台(带铁圈)、漏斗、烧杯、玻璃棒、滤纸。
(2)蒸馏:分离沸点不同的几种液体混合物。
(3)结晶:从物质的溶液中得到该物质的常用方法。
①蒸发结晶:适用于溶解度受温度变化影响较小的物质。
②降温结晶:适用于溶解度受温度变化影响较大的物质,具体操作过程为蒸发浓缩→冷却结晶→过滤→洗涤→干燥。
5.工艺流程的评价
(1)科学性:能否达到目的,杂质是否完全除去,是否引入新的杂质等。
(2)安全性:尽量选用较温和的反应条件,避免高温、高压等条件。
(3)简便性:操作简便,便于提纯、分离物质。
(4)节约性:原料利用率要尽量高。
(5)对环境的影响:是否符合绿色化学理念,是否产生有毒气体等。
例1 (2024·山西)我国是世界上锌冶炼最早的国家。明代宋应星所著的《天工开物》中有关“火法”炼锌的工艺记载是:“每炉甘石(主要成分是碳酸锌)十斤装载入一泥罐内……然后逐层用煤炭饼(反应后生成一氧化碳)垫盛,其底铺薪,发火煅红……冷定毁罐取出……即倭铅(锌)也。”此工艺过程分解模拟如图。已知:Zn的冶炼温度为904 ℃,Zn的沸点为906 ℃。请结合图文信息,分析思考,解决问题:
类型1 资源综合利用
(1)装入原料器之前,将炉甘石敲碎的目的是_________________________
___________________。
增大反应物间的接触面积,
使反应更快、更充分
解析:装入原料器之前,将炉甘石敲碎的目的是增大反应物间的接触面积,使反应更快、更充分。
(2)高温炉内,碳酸锌(ZnCO3)在高温条件下与煤的主要成分发生反应生成Zn和CO,反应的化学方程式为__________________________________。该反应生成物中碳元素的化合价为_____。
+2
解析:高温炉内,ZnCO3在高温条件下与煤的主要成分发生反应生成Zn和CO,结合流程可知反应的化学方程式为2C+ZnCO3 Zn↑+3CO↑。该反应中含碳元素的生成物是CO,CO中氧元素显-2价,根据化合物中各元素正、负化合价的代数和为0可知,其中碳元素的化合价为+2。
(3)冷凝器中发生的变化属于___________。
物理变化
解析:冷凝器中,锌蒸气变成固态锌,没有新物质生成,发生的变化属于物理变化。
(4)我国古代冶锌晚于铁和铜,结合已知信息,分析说明其中的原因是____________________________________________________________________。
Zn的冶炼温度与沸点接近,冶炼时生成的Zn呈气态,不易收集(合理即
可)
解析:我国古代冶锌晚于铁和铜,原因是Zn的冶炼温度与沸点接近,冶炼时生成的Zn呈气态,不易收集等。
例2 (2021·山西)造纸术是中国古代四大发明之一。一直以来,传统工艺不断改进。现阶段,利用方解石(主要成分为CaCO3,还含有少量MgO、Fe2O3、SiO2等杂质)造纸已较为普遍,它取代传统的植物纤维造纸,全程无须用水,原料造价仅为传统造纸
的1/3(已知:SiO2、聚乙烯塑料、
黏合剂均难溶于水,且不与盐酸反
应)。分析生产过程,回答下列问题:
(1)将方解石粉碎成纳米级超细粉末的目的是_________________________
___________________。
(2)混合器内需要进行的操作是______。
(3)利用方解石作原料生产纸张的优点是___________________________。
提高纸张质量(或提高纸张的
平整度,合理即可)
搅拌
成本低(或节省木材,合理即可)
(4)从绿色环保的角度分析,对使用的原料需要改进的地方是___________
_______________。
(5)成品纸张在保存过程中应避免与酸接触,若遇到稀盐酸,则可能发生反应的化学方程式为______________________________________________
____________________________________(写一个)。
使用可降解
塑料(合理即可)
CaCO3+2HCl=== CaCl2+H2O+CO2↑(或Fe2O3+
6HCl=== 2FeCl3+3H2O,合理即可)
例3 铝灰是金属冶炼过程中产生的废渣。以铝灰(主要成分为Al2O3及可溶性物质,还含有少量SiO2、FeO、Fe2O3等)为原料制备硫酸铝的生产流程如下图所示。分析流程,回答问题:
类型2 废物合理利用
注:过氧化氢可以将Fe2+氧化为Fe3+。SiO2不溶于水,也不与常见的酸反应。
(1)除杂器中加入水的目的是________________________。
(2)酸浸池中发生反应的化学方程式为_______________________________
________________(写一个),从酸浸池得到的残渣中主要含有________。
(3)氧化池中为使双氧水充分反应,可进行的操作是________________。
(4)用铝灰制备硫酸铝的意义是______________________________。
除去铝灰中的可溶性物质
Al2O3+3H2SO4=== Al2(SO4)3+
3H2O(合理即可)
SiO2
搅拌(合理即可)
废物利用,节约资源(合理即可)
例4 生物质燃气是以有机废料为原料转换成的可燃性能源,其中含有CH4、CO和H2等可燃性气体。用有机废料生产生物质燃气的主要流程如下图所示。请分析流程,回答有关问题。
(1)常见的有机废料是______________________(写一种),将有机废料进行粉碎的目的是____________________________________。
农作物秸秆(合理即可)
便于分离有机物和无机材料(合理即可)
解析:常见的有机废料有植物落叶、动物粪便、农作物秸秆等。将有机废料进行粉碎的目的是便于在清沙器中分离有机物和无机材料等。
(2)清沙器将混合物分为上层有机层和下层无机层,利用了物质的______不同。
密度
解析:清沙器将混合物分为上层有机层和下层无机层,利用了物质的密度不同。
(3)发酵池中发生的变化属于______变化。生物质燃气充分燃烧的化学方程式为___________________________________(写一个)。
化学
解析:在发酵池中,有机物转化成生物质燃气,这一过程中有新物质生成,发生的是化学变化。根据题干可知,生物质燃气中含有CH4、CO和H2等可燃性气体,故生物质燃气充分燃烧时发生反应的化学方程式有CH4+2O2 CO2+2H2O、2CO+O2 2CO2、2H2+O2
2H2O。
例5 (2023·山西)制作豆腐过程中用到了盐卤。盐卤是我国数千年来豆腐制作的传统凝固剂,有较好的溶解性和凝固性,主要成分为氯化钠(含量约2%~6%)和氯化钾(含量约2%~4%)等。豆腐的制作流程如下,请结合图文信息,分析思考,解决问题。
类型3 生活物质制备
(1)研磨机将豆子研碎、研细的目的是_____________________________。
使豆子得到充分利用(合理即可)
解析:研磨机将豆子研碎、研细的目的是使豆子得到充分利用,得到更多的豆浆。
(2)在煮浆器内的煮沸过程中,可将有毒豆浆转化为无毒豆浆,发生的变化是__________。
化学变化
解析:在煮浆器内的煮沸过程中,将有毒豆浆转化为无毒豆浆,这一过程中有新物质生成,发生的是化学变化。
(3)为加快凝固速度,当把盐卤慢慢加入混合器时,需进行的操作是______。
搅拌
解析:为加快凝固速度,当把盐卤慢慢加入混合器时,需进行的操作是搅拌,增大盐卤与豆浆之间的接触面积。
(4)向盐卤中滴加AgNO3溶液,发生反应的化学方程式为_______________
____________________________________________________(写一个)。
AgNO3+NaCl
=== AgCl↓+NaNO3(或AgNO3+KCl=== AgCl↓+KNO3)
解析:由题可知,盐卤的主要成分为氯化钠和氯化钾等,故向盐卤中滴加AgNO3溶液,发生反应的化学方程式为AgNO3+NaCl===AgCl↓+NaNO3、AgNO3+KCl===AgCl↓+KNO3。
(5)“花开富贵”是一道吃出咸辣味、品出世间美的豆腐制品,它有强筋骨、防贫血等功效,由此推知,这种食物含有的微量元素是____。
铁
解析:“花开富贵”有强筋骨、防贫血等功效,说明其中含有钙、铁元素,而钙元素属于人体必需的常量元素,铁元素属于人体必需的微量元素。
例6 (2024·太原一模)胡麻油是山西特产,自古以来被民间视为美食珍品。《本草纲目》上记载:“胡麻取油……能润燥也。”古法制作胡麻油的过程如图所示,请分析流程,回答问题。
(1)胡麻籽在炒锅中发生的变化属于__________。
(2)用石磨研磨胡麻籽的目的是_________________________________。
(3)蒸笼所用的锅为铁制品,用赤铁矿石(主要成分是Fe2O3)冶炼金属铁的化学方程式为____________________________________________。
(4)胡麻油为人体提供的营养物质主要是______,它对人体所起的作用是__________。
化学变化
使胡麻籽的出油率更高(合理即可)
油脂
提供能量
例7 (2022·山西)新型发光陶瓷是将高科技蓄光材料融入传统陶瓷釉料中,经高温烧制而成。它吸蓄光能后,可在阴暗环境中自行发光,以下是其部分生产流程。分析流程,回答问题:
类型4 化工产品制备
(1)上述设备中,有化学变化发生的是________。
(2)练泥机将水和坯料充分调和,其作用相当于实验操作中的______。
(3)施釉机先将蓄光釉料印刷在坯体上,再涂抹一层透明釉料的作用是________________________________________。
(4)生产蓄光材料需要在稀有气体环境中进行,利用稀有气体的性质是__________________。
(5)若坯料中铁粉未被除去,则烧制的陶瓷会出现黑点,其原因是_______
_____________________________(用化学方程式解释)。
烧成炉
搅拌
保护蓄光釉料(或提高釉面性能,合理即可)
化学性质很不活泼
3Fe+
例8 (2020·山西节选)“庄稼一枝花,全靠肥当家”。近年来,随着农业生产的不断发展,对硫酸镁(MgSO4)肥料的需求量逐年上升。以氧化镁矿粉(主要成分为氧化镁,还含有少量氧化铁、烧碱等杂质)和浓硫酸为原料,生产MgSO4的部分生产流程如图1
所示。已知氧化镁与硫酸发生反应的
化学方程式为:MgO+H2SO4===
MgSO4+H2O。
分析制备过程,回答下列问题:
(1)图1中,石墨配酸塔由石墨制成,
说明石墨具有的性质是____________
______。
(2)生产中,稀硫酸与杂质发生反应的化学方程式为___________________
_________________________(写一个)。
耐腐蚀(合理
即可)
H2SO4+2NaOH===
Na2SO4+2H2O(合理即可)
(3)分析图2,使用硫酸的最佳浓度为______。
(4)生产过程无废物排放,符合绿色化学要求,其中可循环利用的物质是______________________。
66%
酸雾和水蒸气(或稀硫酸)
同课章节目录
