第八单元第三节 碳酸氢钠和碳酸钠 课件(共59张PPT)鲁教版化学九年级下册
文档属性
| 名称 | 第八单元第三节 碳酸氢钠和碳酸钠 课件(共59张PPT)鲁教版化学九年级下册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-10 20:40:56 | ||
图片预览








文档简介
(共59张PPT)
第八单元 海洋化学资源的利用
第三节
碳酸氢钠和碳酸钠
注:碳酸氢钠、碳酸钠主要是以食盐为原料制得的;我国化工专家侯德榜发明了联合制碱法(又称侯氏制碱法)。
知识点
碳酸氢钠与碳酸钠的物理性质及用途
1
知1-讲
知1-讲
知识拓展:
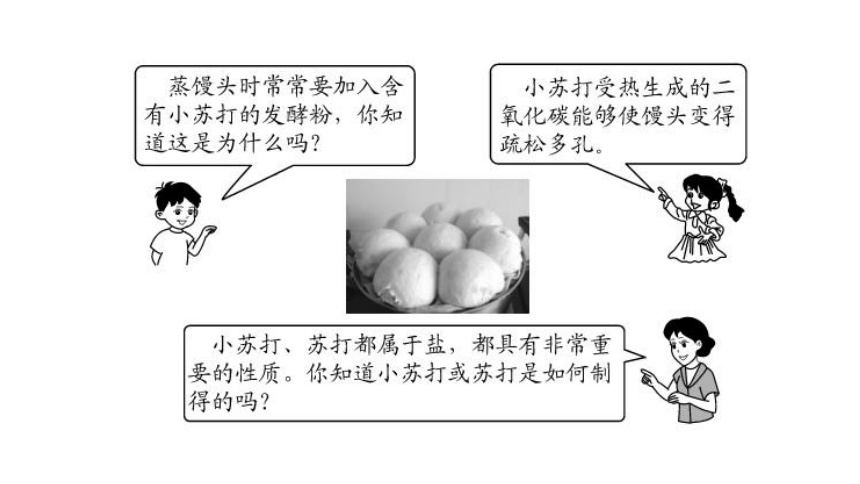
在蒸馒头时,发酵过程中会产生一些酸类物质,加入少量的Na2CO3或NaHCO3,可以将生成的酸反应掉,同时生成气体CO2,使馒头松软。
例1
[中考·淄博]下列物质的名称、俗名(或主要成分)与化学式对应完全正确的是( )
A. 氢氧化钙——熟石灰的主要成分——Ca(OH)2
B. 碳酸钙——石灰石——CaO
C. 氢氧化钠——纯碱——NaOH
D. 碳酸钠——小苏打——Na2CO3
A
知1-练
考向 常见盐的物理性质及用途
题型1 考查对物质名称、俗名及化学式的认知
知1-练
解题秘方:熟记常见碱、盐的俗名,学会根据组成来进行分类,注意纯碱不是碱。
解:碳酸钙的化学式为CaCO3;氢氧化钠的俗称是火碱、烧碱或苛性钠;碳酸钠的俗称是苏打或纯碱。故选A。
知1-练
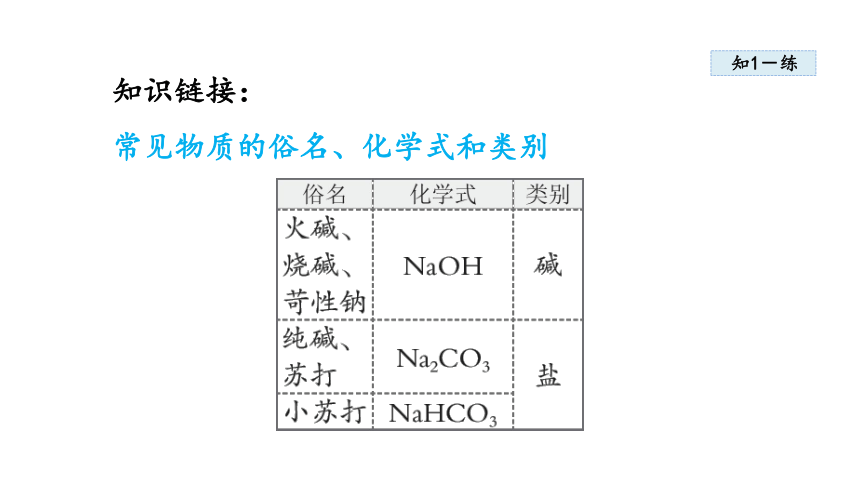
知识链接:
常见物质的俗名、化学式和类别
[中考·大连] 下列关于物质用途的说法,错误的是( )
A. 碳酸钙可用作补钙剂
B. 碳酸钠可用于制洗涤剂
C. 亚硝酸钠可用作调味品
D. 碳酸氢钠可用来治疗胃酸过多症
例2
知1-练
题型2 常见盐的用途
C
知1-练
解题秘方:物质的用途与其性质有关,可根据物质的性质来推断其用途,还需考虑物质的腐蚀性、毒性、价格等。
解:碳酸钙能与胃酸发生反应(CaCO3+2HCl ====CaCl2+H2O+CO2↑),补充钙元素,可用作补钙剂;碳酸钠溶液显碱性,可用于制洗涤剂;亚硝酸钠有毒,不能作调味品;碳酸氢钠能与胃酸反应,可用来治疗胃酸过多症。
知1-练
知识拓展:
胃酸的主要成分是盐酸,胃酸过多会造成胃溃疡等疾病。用于治疗胃酸过多的物质需具备以下条件:
1. 能与酸发生反应;
2. 无毒、无腐蚀性。当患者有严重胃溃疡时,不宜用NaHCO3,因为生成的气体会加重病情。
知识点
碳酸氢钠和碳酸钠的化学性质
2
知2-讲
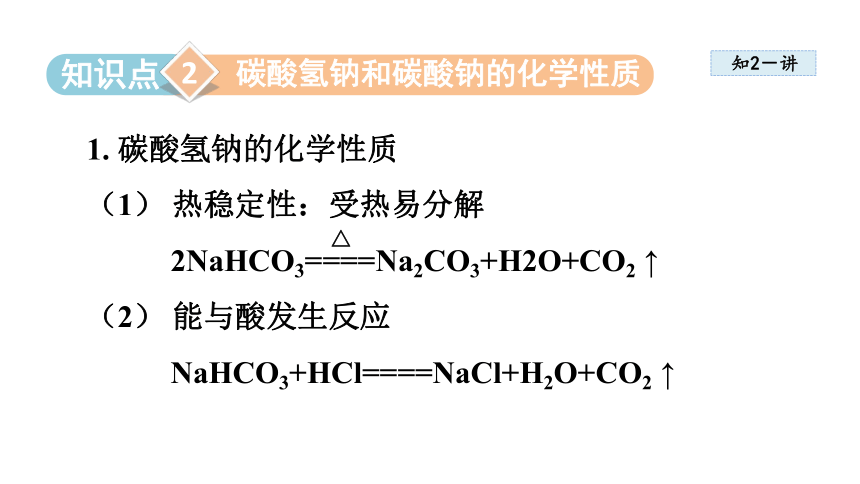
1. 碳酸氢钠的化学性质
(1) 热稳定性:受热易分解
2NaHCO3====Na2CO3+H2O+CO2 ↑
(2) 能与酸发生反应 NaHCO3+HCl====NaCl+H2O+CO2 ↑
△
知2-讲
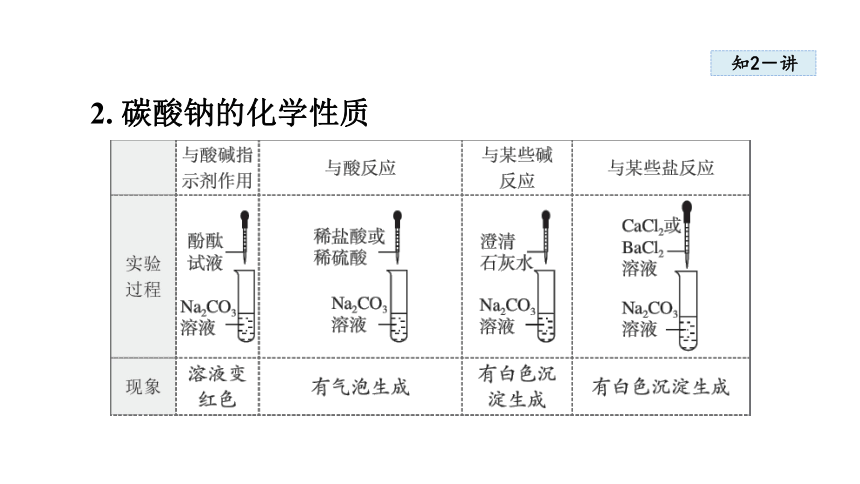
2. 碳酸钠的化学性质
知2-讲
知2-讲
3. 二级结论 CO32- 或HCO3-的检验方法
取少量待测样品装入试管中,加入盐酸,如果产生能使澄清石灰水变浑浊的气体,则说明原样品中含有CO32- 或HCO3-。
知2-讲
易错提示:
碳酸钠俗称纯碱,纯碱不是碱,而是一种盐,其水溶液呈碱性,能使无色酚酞试液变红。可见,盐类物质的水溶液不一定都呈中性。
知2-练
例3
[中考·邵阳] X是常见的碳酸盐,可发生如图1所示的变化,部分生成物省略。据图回答问题。
考向 碳酸氢钠、碳酸钠的化学性质
题型1 考查碳酸盐的化学性质
知2-练
(1)C的化学式是______________。
(2)写出图中①反应的化学方程式:
__________________________________,该反应的基本反应类型是______________ 。
CaCO3
Na2CO3+Ca(OH)2==CaCO3 ↓ +2NaOH
复分解反应
知2-练
解题秘方:根据Na2CO3的化学性质及反应的有关现象解答。
解:(1)气体A 能使澄清的石灰水即氢氧化钙溶液变浑浊,得到沉淀C,可判断气体A为二氧化碳,沉淀C为碳酸钙,从而推断物质X含有CO32- 或HCO3-,再结合物质X能与氢氧化钙溶液反应生成碳酸钙沉淀和氢氧化钠,推断物质X为碳酸钠,再经过各反应的检验证明推断正确,所以X是Na2CO3。
知2-练
(2)反应①是碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,该反应是由两种化合物互相交换成分,生成另外两种化合物,属于复分解反应。
知2-练
例4
下列检验及结论中一定正确的是( )
A. 某固体物质中加入稀盐酸,产生大量气泡,该物质一定是碳酸盐
B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则原溶液一定有硫酸盐
C. 分别含有Mg2+、Cu2+和Na+的三种盐酸盐溶液,用NaOH 溶液就能一次性鉴别开
D. 加入碳酸钠溶液产生白色沉淀,再加稀盐酸,白色沉淀消失,则原溶液中一定有Ba2+
题型2 综合考查CO32- 及其他物质的检验
C
知2-练
解题秘方:本题考查常见物质或离子的鉴别,可依据常见离子的检验方法及物质的性质差异分析解答。
知2-练
解:可以和盐酸反应产生气体的不一定是碳酸盐,也可能是活泼金属,A 错误;加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,原溶液不一定含有硫酸盐,也可能含硝酸银,B 错误;分别含有Mg2+、Cu2+和Na+的三种盐酸盐溶液,加入NaOH 溶液,能与镁离子产生白色沉淀,与铜离子产生蓝色沉淀,故能一次性鉴别开,C 正确;加入碳酸钠溶液产生白色沉淀,再加稀盐酸,白色沉淀消失,原溶液中不一定有Ba2+,也可能含Ca2+,D 错误。
知2-练
方法点拨:
碳酸盐(或碳酸氢盐)的简单检验方法:
取样——→气体——→变浑浊,则该物质中一定有CO32-或HCO3-,即需选用稀盐酸、澄清石灰水两种物质,注意能与稀盐酸反应产生气体的物质不一定是碳酸盐,若生成气体单质,则是活泼金属单质。
加稀盐酸
通入澄清石灰水
知识点
盐
3
知3-讲
1. 盐的判断
“金头酸尾”,盐即由金属阳离子(或NH4+)和酸根离子构成的化合物。如氯化钠(NaCl)、硫酸铜(CuSO4)、硫酸钠(Na2SO4)、
氯化铵(NH4Cl)等。
知3-讲
2. 盐的溶解性
不同种类的盐在水中的溶解性不同,钾盐、钠盐、铵盐和硝酸盐易溶于水,而碳酸盐大多不溶于水。盐的溶解性规律可简记如下:硝酸盐都能溶,钾、钠、铵盐也相同;盐酸盐中银不溶(指AgCl 不溶);硫酸盐中钡不溶(指BaSO4 不溶);碳酸盐中只溶钾、钠、铵。
知3-讲
规律总结:
(1)常见酸、碱的溶解性:酸中除硅酸难溶于水,其他的酸都易溶于水;碱中KOH、NaOH、Ba(OH)2 和NH3·H2O易溶于水,Ca(OH)2微溶于水,其他的碱一般难溶于水,可简记为酸类易溶除硅酸,溶碱钾、钠、钡和铵[Ca(OH)2 微溶]。
知3-讲
(2)常见沉淀的颜色:不溶于酸的白色沉淀:AgCl、BaSO4;溶于稀硝酸或盐酸的白色沉淀:CaCO3、BaCO3、Mg(OH)2、Al(OH)3、Zn(OH)2 等;红褐色沉淀:Fe(OH)3;蓝色沉淀:Cu(OH)2。
(3)特殊颜色的溶液:蓝色溶液:含Cu2+ 的盐溶液;黄色溶液:含Fe3+的盐溶液;浅绿色溶液:含Fe2+ 的盐溶液。
知3-讲
3. 盐的化学性质
知3-练
例5
[中考·郴州]下列各组常见的固体物质中,用水不能区分的是( )
A. NaOH 和NH4NO3 B. CuSO4 和Na2SO4
C. Na2CO3 和CaCO3 D. NaCl 和KCl
考向 盐的性质及应用
题型1 盐的溶解性及其应用
D
知3-练
解题秘方:根据固体物质的溶解性,溶于水后溶液的颜色,溶于水后的放热、吸热情况区分。
解:NaOH 溶于水放热,NH4NO3 溶于水吸热;CuSO4 溶液为蓝色,Na2SO4 溶液为无色;Na2CO3 能溶于水,CaCO3 难溶于水;NaCl 和KCl 都能溶于水得到无色溶液,用水无法区分。
知3-练
规律总结:
能用水区分的两种物质的情况有:
1.一种物质可溶于水,另一种物质难溶于水。
2.两种物质溶于水的热量变化不同。
3.两种物质溶于水后所得溶液的颜色不同。
知3-练
例6
及时归纳是学好化学的重要方法之一。利用如图2 所示的结构图归纳盐的四个方面的化学质(图中编号① ~ ④),请归纳有关知识。
题型2 盐的化学性质
知3-练
(1)在归纳性质②时,选取了硫酸铜和氢氧化钠两种物质,它们在溶液中相互反应时产生的现象是_____,反应的化学方程式为__________________________。
产生蓝色沉淀
CuSO4+2NaOH====Cu(OH)2 ↓ +Na2SO4
知3-练
(2)在性质③中,X 代表___________类物质。
(3)在归纳性质④时,从“某些盐”中选取了硝酸银,写出与硝酸银反应的物质的化学式 _____________________________(写一个)。
酸
NaCl( 合理即可)
知3-练
解题秘方:结合盐的组成及化学性质解答。
解:(1)在归纳性质②时,选取了硫酸铜和氢氧化钠两种物质,它们在溶液中相互反应时产生的现象是产生蓝色沉淀,是因为氢氧化钠和硫酸铜反应生成蓝色沉淀氢氧化铜和硫酸钠,化学方程式为CuSO4+2NaOH====Cu(OH)2 ↓ +Na2SO4。
知3-练
(2)在性质③中,X 代表酸类物质,即酸能和某些盐反应。
(3)氯化钠是盐,与硝酸银反应生成白色沉淀氯化银和硝酸钠,与硝酸银反应的物质的化学式是NaCl。
知3-练
方法点拨:
1. 盐的化学性质归纳如下:
(与金属的反应下一单元学习)
知3-练
2.盐能与某些单质、酸、碱、盐发生反应,但不是所有的盐都能与这四类物质反应,必须结合每种盐中的金属阳离子和酸根离子来分析。如氯化钠只能与硝酸银反应,不能与酸、碱、金属反应,CuSO4 可与NaOH、BaCl2、Ba(OH)2等反应。
知识点
复分解反应
4
知4-讲
1. 概念 发生在溶液中,由两种化合物互相交换成分,生成另外两种化合物的反应,这类反应叫作复分解反应。
2. 表达式 AB+CD → AD+CB。
3. 特征 双交换、价不变,即该反应是在两种化合物之间进行,且反应前后各元素的化合价不变。
知4-讲
知识拓展:
复分解反应前后各元素的化合价不变,因此复分解反应可记为“复分解,双交换 ,价不变”,由此可较容易地写出复分解反应的化学方程式。
知4-练
例7
列属于复分解反应的是( )
A. 2NaOH+CO2====Na2CO3+H2O
B. Ba(NO3)2+Na2CO3====BaCO3 ↓ +2NaNO3
C. H2O+3NO2====2HNO3+NO
D. CO+CuO====Cu+CO2
考向 复分解反应的判断
△
B
知4-练
解题秘方::根据复分解反应的定义来判断,即两种化合物互相交换成分,生成另外两种化合物的反应。
解:A 中是两种化合物反应生成另外两种化合物,但不是交换成分得到的,不是复分解反应;同理C 也不正确;D 中有单质生成,不是复分解反应。
知4-练
特别提醒:
有的反应形似复分解反应,如CO2+Ca(OH)2==== CaCO3↓+H2O,但没有交换成分,实质不是;
有的反应形不似,如Na2CO3+2HCl==== 2NaCl+H2O+CO2↑,生成物有三种,但该反应实质是两种化合物相互交换成分,属于复分解反应。
知识点
复分解反应的实质
5
知5-讲
1. 酸、碱、盐之间在水溶液中发生复分解反应的实质酸、碱、盐所解离出的离子相互结合,生成沉淀、气体或水的过程。
知5-讲
2. 复分解反应发生的条件
知5-讲
3. 四种基本反应类型的比较
(1)化合反应的生成物一定是化合物,反应物可能为单质或化合物;
(2)分解反应的反应物一定是化合物,生成物可能为单质或化合物;
(3)置换反应的反应物、生成物均为一种单质和一种化合物;
(4)复分解反应的反应物和生成物均为两种化合物。
知5-讲
规律总结:
复分解反应中的“二、三”:
1.二个特点:(1)双交换:复分解反应是酸、碱、盐之间在溶液中通过交换离子进行的;(2)价不变:反应前后各元素的化合价均保持不变。
知5-讲
2. 三个条件:酸、碱、盐在溶液中相互交换离子时,生成物中如有沉淀析出、有气体放出或有水生成,复分解反应即可发生。复分解反应进行的实质是使反应向溶液中离子浓度减小的方向进行。
知5-练
例8
[ 中考·株洲] 下列物质间不能发生复分解反应的是( )
A. 碳酸钠溶液和氯化钙溶液
B. 氢氧化钠溶液和氯化钾溶液
C. 碳酸钾溶液和盐酸
D. 硫酸铜溶液和氯化钡溶液
考向 复分解反应的条件与实质
题型1 复分解反应发生的条件
B
知5-练
解:碳酸钠溶液和氯化钙溶液相互交换成分生成碳酸钙沉淀和氯化钠,A 能发生复分解反应; 氢氧化钠溶液和氯化钾溶液相互交换成分没有沉淀、气体或水生成,B 不能发生复分解反应;碳酸钾溶液和盐酸相互交换成分生成氯化钾、水和二氧化碳,C 能发生复分解反应;硫酸铜溶液和氯化钡溶液相互交换成分生成硫酸钡沉淀和氯化铜,D 能发生复分解反应。
知5-练
方法点拨:
判断复分解反应能否发生的方法:
可先标出两种反应物中显正价和负价的元素或原子团,然后相互交换成分组成新物质。若生成的新物质中,有水、气体或难溶物中的至少一种,则该复分解反应能发生。
知5-练
例9
某兴趣小组利用“盐酸、硫酸铜、氢氧化钠、碳酸钠、硝酸钾”五种溶液对“复分解反应发生的条件”进行再探究。
【知识回顾】(1)回忆向滴有酚酞试剂的氢氧化钠溶液中滴加稀盐酸的实验;
题型2 结合微观示意图考查复分解反应的实质
知5-练
(2)观察两者反应的微观示意图(如图4 所示),该反应过程中没有变化的微粒是 _______________,两者反应的微观实质是溶液中的 _____________。
氯离子和钠离子
氢离子与氢氧根离子结合生成水分子
知5-练
【实质再探】(1)向氢氧化钠溶液中滴加硫酸铜溶液反应的化学方程式是 ___________________________,图5 是二者反应的微观示意图,两者反应的实质是溶液中的 __________________________________。
2NaOH+CuSO4==Na2SO4+Cu(OH)2 ↓
氢氧根离子与铜离子结合生成氢氧化铜沉淀
知5-练
(2)向碳酸钠溶液中滴加稀盐酸,产生大量气泡,实质是溶液中的 ___________________反应生成水和二氧化碳气体。
【归纳小结】复分解反应发生的微观实质是溶液中的
________________________。
氢离子和碳酸根离子
离子结合成沉淀、气体或水
知5-练
【拓展应用】(1)将碳酸钠溶液和硝酸钾溶液混合没有发生变化,分析两者不发生反应的原因是_______。
相互交换成分后没有气体或淀或水生成
知5-练
(2)图6 是硫酸氢钠在水中解离的微观示意图,溶液中存在的离子是 ___________________,滴加________(用化学式表示)溶液既能降低该溶液的酸性又能生成沉淀。
钠离子、氢离子和硫酸根离子
Ba(OH)2
知5-练
解题秘方:复分解反应的实质是反应物中的特殊阳离子与阴离子结合产生沉淀、气体或水。
解:【实质再探】(1)向氢氧化钠溶液中滴加硫酸铜溶液,反应生成硫酸钠和氢氧化铜蓝色沉淀,据此书写化学方程式;由微粒的变化可知,两者反应的实质是溶液中的氢氧根离子与铜离子结合生成氢氧化铜。(2)向碳酸钠溶液中滴加稀盐酸,产生大量气泡,实质是溶液中氢离子和碳酸根离子反应生成水和二氧化碳气体。
知5-练
【归纳小结】由反应前后微粒的变化可知,复分解反应发生的微观实质是溶液中的离子结合成沉淀、气体或水。【拓展应用】(1)将碳酸钠溶液和硝酸钾溶液混合没有发生变化,两者不发生反应的原因是互相交换成分后没有气体或沉淀或水生成。(2)硫酸氢钠在水中解离出钠离子、氢离子和硫酸根离子,滴加Ba(OH)2 溶液既能降低该溶液的酸性又能生成沉淀。
第八单元 海洋化学资源的利用
第三节
碳酸氢钠和碳酸钠
注:碳酸氢钠、碳酸钠主要是以食盐为原料制得的;我国化工专家侯德榜发明了联合制碱法(又称侯氏制碱法)。
知识点
碳酸氢钠与碳酸钠的物理性质及用途
1
知1-讲
知1-讲
知识拓展:
在蒸馒头时,发酵过程中会产生一些酸类物质,加入少量的Na2CO3或NaHCO3,可以将生成的酸反应掉,同时生成气体CO2,使馒头松软。
例1
[中考·淄博]下列物质的名称、俗名(或主要成分)与化学式对应完全正确的是( )
A. 氢氧化钙——熟石灰的主要成分——Ca(OH)2
B. 碳酸钙——石灰石——CaO
C. 氢氧化钠——纯碱——NaOH
D. 碳酸钠——小苏打——Na2CO3
A
知1-练
考向 常见盐的物理性质及用途
题型1 考查对物质名称、俗名及化学式的认知
知1-练
解题秘方:熟记常见碱、盐的俗名,学会根据组成来进行分类,注意纯碱不是碱。
解:碳酸钙的化学式为CaCO3;氢氧化钠的俗称是火碱、烧碱或苛性钠;碳酸钠的俗称是苏打或纯碱。故选A。
知1-练
知识链接:
常见物质的俗名、化学式和类别
[中考·大连] 下列关于物质用途的说法,错误的是( )
A. 碳酸钙可用作补钙剂
B. 碳酸钠可用于制洗涤剂
C. 亚硝酸钠可用作调味品
D. 碳酸氢钠可用来治疗胃酸过多症
例2
知1-练
题型2 常见盐的用途
C
知1-练
解题秘方:物质的用途与其性质有关,可根据物质的性质来推断其用途,还需考虑物质的腐蚀性、毒性、价格等。
解:碳酸钙能与胃酸发生反应(CaCO3+2HCl ====CaCl2+H2O+CO2↑),补充钙元素,可用作补钙剂;碳酸钠溶液显碱性,可用于制洗涤剂;亚硝酸钠有毒,不能作调味品;碳酸氢钠能与胃酸反应,可用来治疗胃酸过多症。
知1-练
知识拓展:
胃酸的主要成分是盐酸,胃酸过多会造成胃溃疡等疾病。用于治疗胃酸过多的物质需具备以下条件:
1. 能与酸发生反应;
2. 无毒、无腐蚀性。当患者有严重胃溃疡时,不宜用NaHCO3,因为生成的气体会加重病情。
知识点
碳酸氢钠和碳酸钠的化学性质
2
知2-讲
1. 碳酸氢钠的化学性质
(1) 热稳定性:受热易分解
2NaHCO3====Na2CO3+H2O+CO2 ↑
(2) 能与酸发生反应 NaHCO3+HCl====NaCl+H2O+CO2 ↑
△
知2-讲
2. 碳酸钠的化学性质
知2-讲
知2-讲
3. 二级结论 CO32- 或HCO3-的检验方法
取少量待测样品装入试管中,加入盐酸,如果产生能使澄清石灰水变浑浊的气体,则说明原样品中含有CO32- 或HCO3-。
知2-讲
易错提示:
碳酸钠俗称纯碱,纯碱不是碱,而是一种盐,其水溶液呈碱性,能使无色酚酞试液变红。可见,盐类物质的水溶液不一定都呈中性。
知2-练
例3
[中考·邵阳] X是常见的碳酸盐,可发生如图1所示的变化,部分生成物省略。据图回答问题。
考向 碳酸氢钠、碳酸钠的化学性质
题型1 考查碳酸盐的化学性质
知2-练
(1)C的化学式是______________。
(2)写出图中①反应的化学方程式:
__________________________________,该反应的基本反应类型是______________ 。
CaCO3
Na2CO3+Ca(OH)2==CaCO3 ↓ +2NaOH
复分解反应
知2-练
解题秘方:根据Na2CO3的化学性质及反应的有关现象解答。
解:(1)气体A 能使澄清的石灰水即氢氧化钙溶液变浑浊,得到沉淀C,可判断气体A为二氧化碳,沉淀C为碳酸钙,从而推断物质X含有CO32- 或HCO3-,再结合物质X能与氢氧化钙溶液反应生成碳酸钙沉淀和氢氧化钠,推断物质X为碳酸钠,再经过各反应的检验证明推断正确,所以X是Na2CO3。
知2-练
(2)反应①是碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,该反应是由两种化合物互相交换成分,生成另外两种化合物,属于复分解反应。
知2-练
例4
下列检验及结论中一定正确的是( )
A. 某固体物质中加入稀盐酸,产生大量气泡,该物质一定是碳酸盐
B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则原溶液一定有硫酸盐
C. 分别含有Mg2+、Cu2+和Na+的三种盐酸盐溶液,用NaOH 溶液就能一次性鉴别开
D. 加入碳酸钠溶液产生白色沉淀,再加稀盐酸,白色沉淀消失,则原溶液中一定有Ba2+
题型2 综合考查CO32- 及其他物质的检验
C
知2-练
解题秘方:本题考查常见物质或离子的鉴别,可依据常见离子的检验方法及物质的性质差异分析解答。
知2-练
解:可以和盐酸反应产生气体的不一定是碳酸盐,也可能是活泼金属,A 错误;加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,原溶液不一定含有硫酸盐,也可能含硝酸银,B 错误;分别含有Mg2+、Cu2+和Na+的三种盐酸盐溶液,加入NaOH 溶液,能与镁离子产生白色沉淀,与铜离子产生蓝色沉淀,故能一次性鉴别开,C 正确;加入碳酸钠溶液产生白色沉淀,再加稀盐酸,白色沉淀消失,原溶液中不一定有Ba2+,也可能含Ca2+,D 错误。
知2-练
方法点拨:
碳酸盐(或碳酸氢盐)的简单检验方法:
取样——→气体——→变浑浊,则该物质中一定有CO32-或HCO3-,即需选用稀盐酸、澄清石灰水两种物质,注意能与稀盐酸反应产生气体的物质不一定是碳酸盐,若生成气体单质,则是活泼金属单质。
加稀盐酸
通入澄清石灰水
知识点
盐
3
知3-讲
1. 盐的判断
“金头酸尾”,盐即由金属阳离子(或NH4+)和酸根离子构成的化合物。如氯化钠(NaCl)、硫酸铜(CuSO4)、硫酸钠(Na2SO4)、
氯化铵(NH4Cl)等。
知3-讲
2. 盐的溶解性
不同种类的盐在水中的溶解性不同,钾盐、钠盐、铵盐和硝酸盐易溶于水,而碳酸盐大多不溶于水。盐的溶解性规律可简记如下:硝酸盐都能溶,钾、钠、铵盐也相同;盐酸盐中银不溶(指AgCl 不溶);硫酸盐中钡不溶(指BaSO4 不溶);碳酸盐中只溶钾、钠、铵。
知3-讲
规律总结:
(1)常见酸、碱的溶解性:酸中除硅酸难溶于水,其他的酸都易溶于水;碱中KOH、NaOH、Ba(OH)2 和NH3·H2O易溶于水,Ca(OH)2微溶于水,其他的碱一般难溶于水,可简记为酸类易溶除硅酸,溶碱钾、钠、钡和铵[Ca(OH)2 微溶]。
知3-讲
(2)常见沉淀的颜色:不溶于酸的白色沉淀:AgCl、BaSO4;溶于稀硝酸或盐酸的白色沉淀:CaCO3、BaCO3、Mg(OH)2、Al(OH)3、Zn(OH)2 等;红褐色沉淀:Fe(OH)3;蓝色沉淀:Cu(OH)2。
(3)特殊颜色的溶液:蓝色溶液:含Cu2+ 的盐溶液;黄色溶液:含Fe3+的盐溶液;浅绿色溶液:含Fe2+ 的盐溶液。
知3-讲
3. 盐的化学性质
知3-练
例5
[中考·郴州]下列各组常见的固体物质中,用水不能区分的是( )
A. NaOH 和NH4NO3 B. CuSO4 和Na2SO4
C. Na2CO3 和CaCO3 D. NaCl 和KCl
考向 盐的性质及应用
题型1 盐的溶解性及其应用
D
知3-练
解题秘方:根据固体物质的溶解性,溶于水后溶液的颜色,溶于水后的放热、吸热情况区分。
解:NaOH 溶于水放热,NH4NO3 溶于水吸热;CuSO4 溶液为蓝色,Na2SO4 溶液为无色;Na2CO3 能溶于水,CaCO3 难溶于水;NaCl 和KCl 都能溶于水得到无色溶液,用水无法区分。
知3-练
规律总结:
能用水区分的两种物质的情况有:
1.一种物质可溶于水,另一种物质难溶于水。
2.两种物质溶于水的热量变化不同。
3.两种物质溶于水后所得溶液的颜色不同。
知3-练
例6
及时归纳是学好化学的重要方法之一。利用如图2 所示的结构图归纳盐的四个方面的化学质(图中编号① ~ ④),请归纳有关知识。
题型2 盐的化学性质
知3-练
(1)在归纳性质②时,选取了硫酸铜和氢氧化钠两种物质,它们在溶液中相互反应时产生的现象是_____,反应的化学方程式为__________________________。
产生蓝色沉淀
CuSO4+2NaOH====Cu(OH)2 ↓ +Na2SO4
知3-练
(2)在性质③中,X 代表___________类物质。
(3)在归纳性质④时,从“某些盐”中选取了硝酸银,写出与硝酸银反应的物质的化学式 _____________________________(写一个)。
酸
NaCl( 合理即可)
知3-练
解题秘方:结合盐的组成及化学性质解答。
解:(1)在归纳性质②时,选取了硫酸铜和氢氧化钠两种物质,它们在溶液中相互反应时产生的现象是产生蓝色沉淀,是因为氢氧化钠和硫酸铜反应生成蓝色沉淀氢氧化铜和硫酸钠,化学方程式为CuSO4+2NaOH====Cu(OH)2 ↓ +Na2SO4。
知3-练
(2)在性质③中,X 代表酸类物质,即酸能和某些盐反应。
(3)氯化钠是盐,与硝酸银反应生成白色沉淀氯化银和硝酸钠,与硝酸银反应的物质的化学式是NaCl。
知3-练
方法点拨:
1. 盐的化学性质归纳如下:
(与金属的反应下一单元学习)
知3-练
2.盐能与某些单质、酸、碱、盐发生反应,但不是所有的盐都能与这四类物质反应,必须结合每种盐中的金属阳离子和酸根离子来分析。如氯化钠只能与硝酸银反应,不能与酸、碱、金属反应,CuSO4 可与NaOH、BaCl2、Ba(OH)2等反应。
知识点
复分解反应
4
知4-讲
1. 概念 发生在溶液中,由两种化合物互相交换成分,生成另外两种化合物的反应,这类反应叫作复分解反应。
2. 表达式 AB+CD → AD+CB。
3. 特征 双交换、价不变,即该反应是在两种化合物之间进行,且反应前后各元素的化合价不变。
知4-讲
知识拓展:
复分解反应前后各元素的化合价不变,因此复分解反应可记为“复分解,双交换 ,价不变”,由此可较容易地写出复分解反应的化学方程式。
知4-练
例7
列属于复分解反应的是( )
A. 2NaOH+CO2====Na2CO3+H2O
B. Ba(NO3)2+Na2CO3====BaCO3 ↓ +2NaNO3
C. H2O+3NO2====2HNO3+NO
D. CO+CuO====Cu+CO2
考向 复分解反应的判断
△
B
知4-练
解题秘方::根据复分解反应的定义来判断,即两种化合物互相交换成分,生成另外两种化合物的反应。
解:A 中是两种化合物反应生成另外两种化合物,但不是交换成分得到的,不是复分解反应;同理C 也不正确;D 中有单质生成,不是复分解反应。
知4-练
特别提醒:
有的反应形似复分解反应,如CO2+Ca(OH)2==== CaCO3↓+H2O,但没有交换成分,实质不是;
有的反应形不似,如Na2CO3+2HCl==== 2NaCl+H2O+CO2↑,生成物有三种,但该反应实质是两种化合物相互交换成分,属于复分解反应。
知识点
复分解反应的实质
5
知5-讲
1. 酸、碱、盐之间在水溶液中发生复分解反应的实质酸、碱、盐所解离出的离子相互结合,生成沉淀、气体或水的过程。
知5-讲
2. 复分解反应发生的条件
知5-讲
3. 四种基本反应类型的比较
(1)化合反应的生成物一定是化合物,反应物可能为单质或化合物;
(2)分解反应的反应物一定是化合物,生成物可能为单质或化合物;
(3)置换反应的反应物、生成物均为一种单质和一种化合物;
(4)复分解反应的反应物和生成物均为两种化合物。
知5-讲
规律总结:
复分解反应中的“二、三”:
1.二个特点:(1)双交换:复分解反应是酸、碱、盐之间在溶液中通过交换离子进行的;(2)价不变:反应前后各元素的化合价均保持不变。
知5-讲
2. 三个条件:酸、碱、盐在溶液中相互交换离子时,生成物中如有沉淀析出、有气体放出或有水生成,复分解反应即可发生。复分解反应进行的实质是使反应向溶液中离子浓度减小的方向进行。
知5-练
例8
[ 中考·株洲] 下列物质间不能发生复分解反应的是( )
A. 碳酸钠溶液和氯化钙溶液
B. 氢氧化钠溶液和氯化钾溶液
C. 碳酸钾溶液和盐酸
D. 硫酸铜溶液和氯化钡溶液
考向 复分解反应的条件与实质
题型1 复分解反应发生的条件
B
知5-练
解:碳酸钠溶液和氯化钙溶液相互交换成分生成碳酸钙沉淀和氯化钠,A 能发生复分解反应; 氢氧化钠溶液和氯化钾溶液相互交换成分没有沉淀、气体或水生成,B 不能发生复分解反应;碳酸钾溶液和盐酸相互交换成分生成氯化钾、水和二氧化碳,C 能发生复分解反应;硫酸铜溶液和氯化钡溶液相互交换成分生成硫酸钡沉淀和氯化铜,D 能发生复分解反应。
知5-练
方法点拨:
判断复分解反应能否发生的方法:
可先标出两种反应物中显正价和负价的元素或原子团,然后相互交换成分组成新物质。若生成的新物质中,有水、气体或难溶物中的至少一种,则该复分解反应能发生。
知5-练
例9
某兴趣小组利用“盐酸、硫酸铜、氢氧化钠、碳酸钠、硝酸钾”五种溶液对“复分解反应发生的条件”进行再探究。
【知识回顾】(1)回忆向滴有酚酞试剂的氢氧化钠溶液中滴加稀盐酸的实验;
题型2 结合微观示意图考查复分解反应的实质
知5-练
(2)观察两者反应的微观示意图(如图4 所示),该反应过程中没有变化的微粒是 _______________,两者反应的微观实质是溶液中的 _____________。
氯离子和钠离子
氢离子与氢氧根离子结合生成水分子
知5-练
【实质再探】(1)向氢氧化钠溶液中滴加硫酸铜溶液反应的化学方程式是 ___________________________,图5 是二者反应的微观示意图,两者反应的实质是溶液中的 __________________________________。
2NaOH+CuSO4==Na2SO4+Cu(OH)2 ↓
氢氧根离子与铜离子结合生成氢氧化铜沉淀
知5-练
(2)向碳酸钠溶液中滴加稀盐酸,产生大量气泡,实质是溶液中的 ___________________反应生成水和二氧化碳气体。
【归纳小结】复分解反应发生的微观实质是溶液中的
________________________。
氢离子和碳酸根离子
离子结合成沉淀、气体或水
知5-练
【拓展应用】(1)将碳酸钠溶液和硝酸钾溶液混合没有发生变化,分析两者不发生反应的原因是_______。
相互交换成分后没有气体或淀或水生成
知5-练
(2)图6 是硫酸氢钠在水中解离的微观示意图,溶液中存在的离子是 ___________________,滴加________(用化学式表示)溶液既能降低该溶液的酸性又能生成沉淀。
钠离子、氢离子和硫酸根离子
Ba(OH)2
知5-练
解题秘方:复分解反应的实质是反应物中的特殊阳离子与阴离子结合产生沉淀、气体或水。
解:【实质再探】(1)向氢氧化钠溶液中滴加硫酸铜溶液,反应生成硫酸钠和氢氧化铜蓝色沉淀,据此书写化学方程式;由微粒的变化可知,两者反应的实质是溶液中的氢氧根离子与铜离子结合生成氢氧化铜。(2)向碳酸钠溶液中滴加稀盐酸,产生大量气泡,实质是溶液中氢离子和碳酸根离子反应生成水和二氧化碳气体。
知5-练
【归纳小结】由反应前后微粒的变化可知,复分解反应发生的微观实质是溶液中的离子结合成沉淀、气体或水。【拓展应用】(1)将碳酸钠溶液和硝酸钾溶液混合没有发生变化,两者不发生反应的原因是互相交换成分后没有气体或沉淀或水生成。(2)硫酸氢钠在水中解离出钠离子、氢离子和硫酸根离子,滴加Ba(OH)2 溶液既能降低该溶液的酸性又能生成沉淀。
同课章节目录
