第二节 碱及其性质 课件(共40张PPT)-鲁教版化学九年级下册
文档属性
| 名称 | 第二节 碱及其性质 课件(共40张PPT)-鲁教版化学九年级下册 |  | |
| 格式 | pptx | ||
| 文件大小 | 856.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-10 21:05:02 | ||
图片预览










文档简介
(共40张PPT)
第七单元 认识酸和碱
第二节 碱及其性质
介绍明代爱国将领于谦写的《石灰吟》
从化学角度看,你知道这首诗中包含了哪些化学反应吗
常见的碱
1. 碱的概念
在水溶液中解离出的阴离子全部是氢氧根离子(OH-),化学上把这类化合物称为碱。
2. 认识氢氧化钠和氢氧化钙
知识点
常见的碱
1
知1-讲
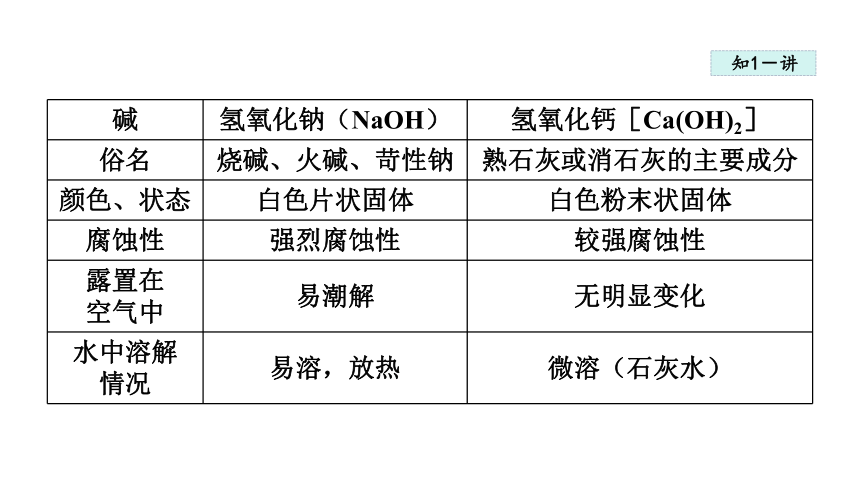
碱 氢氧化钠(NaOH) 氢氧化钙[Ca(OH)2]
俗名 烧碱、火碱、苛性钠 熟石灰或消石灰的主要成分
颜色、状态 白色片状固体 白色粉末状固体
腐蚀性 强烈腐蚀性 较强腐蚀性
露置在 空气中 易潮解 无明显变化
水中溶解 情况 易溶,放热 微溶(石灰水)
知1-讲
知1-讲
碱 氢氧化钠(NaOH) 氢氧化钙[Ca(OH)2]
溶解性 易溶于水,易潮解,溶解时放热 微溶于水,其水溶液俗称石灰水
主要用途 造纸,印染,炼油,生产化学纤维、橡胶等 生产农药和漂白剂、土木建筑、改良酸性土壤等
知1-讲
见多识广:
1.氢氧化钠易潮解(需密封保存),氧化钙能与水反应,因此这两种物质都可作干燥剂。氢氧化钠的腐蚀性较强,不能作食品干燥剂,一般用氧化钙作食品干燥剂。
2.氢氧化钠可作炉具清洁剂,用来除油污,是因为它能与油脂发生化学反应;洗涤剂除油污是利用洗涤剂的乳化作用;汽油能溶解油污,可用来除油污。
知1-讲
3. 氢氧化钠使用注意事项
氢氧化钠具有强烈的腐蚀性,使用时必须十分小心,要防止沾到眼睛、皮肤或衣服上。如果不慎将碱液沾到皮肤上,应立即用大量的水冲洗,然后涂上适量的硼酸溶液。
不能放在纸上称量,应放在玻璃器皿如烧杯或表面皿中称量,以防腐蚀托盘
知1-讲
4. 氢氧化钠的潮解
氢氧化钠暴露在空气中容易吸收水分,表面潮湿并逐渐溶解,这种现象叫作潮解,此过程是物理变化。
知1-讲
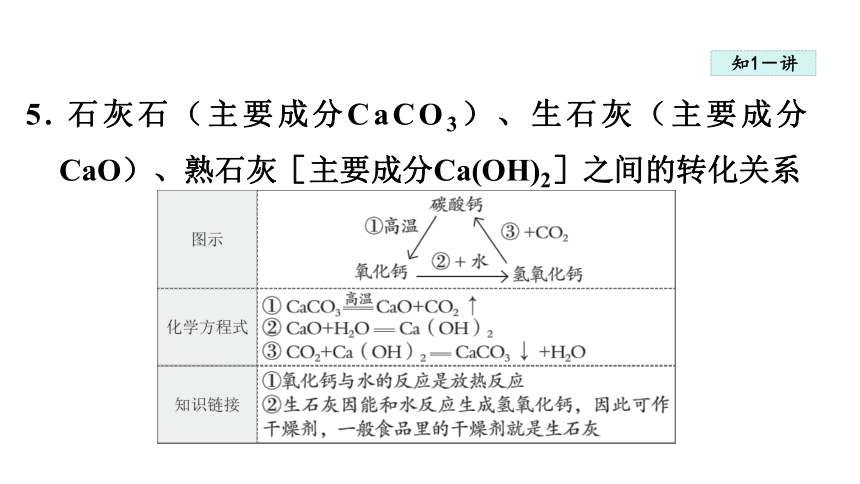
5. 石灰石(主要成分CaCO3)、生石灰(主要成分CaO)、熟石灰[主要成分Ca(OH)2]之间的转化关系
[中考·怀化] 下列物质俗名对应正确的是( )
A. NaOH—苛性钠
B. Ca(OH)2—生石灰
C. Na2CO3—烧碱
D. Ag—水银
A
知1-练
例1
考向 常见的碱
题型1 考查常见物质的俗名及化学式
知1-练
解题秘方:熟记常见物质的俗名及化学式,区分易混淆的物质,如银与水银、生石灰与熟石灰等。
解:氢氧化钠俗称火碱、烧碱、苛性钠,A 正确;熟石灰的主要成分是Ca(OH)2,B 错误;碳酸钠俗称纯碱、苏打,C 错误;汞俗称水银,D 错误。
知1-练
误区警示:
对于物质的认识不能望文生义,要认清实质:
如干冰不是冰(是固态CO2),水银不是银(是汞),金刚石不是钢(是非金属单质C),石灰生熟要分开,生(石灰)加水放热变熟(石灰)。
下列有关NaOH 和Ca(OH)2的说法不正确的是( )
A. 可用水来区分氢氧化钠和氢氧化钙
B. 都可作干燥剂
C. 氢氧化钠可作炉具清洁剂,氢氧化钙可用作建筑材料
D. 都具有腐蚀性
B
知1-练
例2
题型2 考查氢氧化钠、氢氧化钙的物理性质与用途
知1-练
解:氢氧化钠易溶于水且放热,溶液温度升高,氢氧化钙微溶于水,溶液温度无明显变化,因此可用水来鉴别这两种碱;氢氧化钠易潮解,可用作干燥剂,氢氧化钙不能作干燥剂,B 不正确;氢氧化钠能与油脂反应,可作炉具清洁剂,氢氧化钙是常用的建筑材料,这两种碱都有一定的腐蚀性。
知1-练
知识链接:
1.常用作干燥剂的物质:浓硫酸、氢氧化钠固体、氧化钙。
2.溶于水时放热的物质:浓硫酸、氢氧化钠、氧化钙。
3.可作建筑材料的物质:CaO、Ca(OH)2、CaCO3。
4.能用来除油污的物质:NaOH、汽油、洗涤剂。
初中常见含钙化合物的转化关系如图1 所示,请回答:
(1)Ca(OH)2是________________的主要成分。
(2)反应①的基本反应类型是________________ 。
(3)反应② (填“放出”或“吸收”)_______热量。
(4)反应③可用于检验CO2,反应的化学方程式是________________________________ 。
熟石灰
知1-练
例3
题型3 考查石灰石、生石灰、熟石灰之间的转化关系
分解反应
放出
CO2+Ca(OH)2====CaCO3↓ +H2O。
知1-练
解题秘方:在解此类题时,首先分析流程图中各步试剂的作用和反应物、生成物的成分,然后结合学过的知识进行分析,最终得出正确答案。
解题秘方::(1)Ca(OH)2是氢氧化钙的化学式, 氢氧化钙是熟石灰的主要成分。(2)①反应是碳酸钙在高温的条件下生成氧化钙和二氧化碳气体,是由一种物质生成两种新物质,符合“一变多”的特征,属于分解反应。
知1-练
(3)②反应是由氧化钙和水反应生成氢氧化钙,此反应过程中会放出大量的热。(4)二氧化碳与氢氧化钙反应生成碳酸钙白色沉淀和水,所以在实验室中用澄清的石灰水来检验二氧化碳气体,化学方程式为CO2+Ca(OH)2====CaCO3↓ +H2O。
知1-练
规律总结:
化学反应中常见的“三角关系”:
知识点
碱的化学性质
2
知2-讲
1. 与酸碱指示剂作用
将紫色石蕊试液、无色酚酞试液分别滴加到氢氧化钠溶液和氢氧化钙溶液中,现象如下:
加紫色石蕊溶液 加无色酚酞溶液
氢氧化钠溶液 变蓝色 变红色
氢氧化钙溶液 变蓝色 变红色
2. 与某些非金属氧化物反应
向两个盛满二氧化碳的矿泉水瓶中分别加入氢氧化钠溶液和氢氧化钙溶液,其现象及反应如下:
实验现象及化学方程式
加入氢氧化钠溶液 瓶子变瘪,
2NaOH +CO2 === Na2CO3 +H2O
加入氢氧化钙溶液 瓶子变瘪,澄清石灰水变浑浊,
Ca(OH)2 +CO2=== CaCO3↓+H2O
知2-讲
不是所有的非金属氧化物都能与碱溶液反应
知2-练
特别提醒:
1.只有可溶性碱形成的碱溶液才能与酸碱指示剂反应,难溶于水的碱,如:氢氧化铜、氢氧化铁、氢氧化镁等不能使指示剂变色。
2.氢氧化钠易吸收空气中的水和二氧化碳,因此应密封保存。
知2-练
3.二氧化碳能使澄清石灰水变浑浊,与氢氧化钠溶液反应无明显现象。因此实验室用澄清石灰水检验二氧化碳气体,氢氧化钠溶液用来吸收二氧化碳气体。
知2-讲
3. 与某些盐混合
将氢氧化钠溶液、氢氧化钙溶液分别加入碳酸钠溶液中,其现象及反应如下:
Na2CO3溶液
加入NaOH 溶液的现象及化学方程式 无明显现象
加入Ca(OH)2溶液的现象及化学方程式 有白色沉淀生成,
Ca(OH)2+Na2CO3====CaCO3↓+2NaOH(工业用此方法制NaOH)
实验是学习化学的重要途径,小亮在学习酸碱盐的化学性质时做了如下实验,请你和他一起完成实验活动。
知2-练
例4
考向 NaOH、Ca(OH)2的化学性质
(1)实验A 中1、3 孔的现象是 ________________,该实验的目的是 ________________________。
知2-练
石蕊试液变红
探究酸与指示剂的作用
(2)在实验B 的试管中,滴加少量的氢氧化钙溶液,看到的现象是 ________________,反应的化学方程式是 _____________________________________。
知2-练
有白色沉淀生成
Ca(OH)2+Na2CO3====CaCO3↓+2NaOH
(3)小张用实验C 验证二氧化碳与氢氧化钠溶液反应,看到的现象是 __________,写出反应的化学方程式:____________________________________。
知2-练
气球胀大
2NaOH + CO2 ===== Na2CO3 + H2O
知2-练
解题秘方:明确碱的化学性质及有关反应的现象,如酸碱指示剂遇碱的变色情况、碱与盐溶液反应产生沉淀的颜色,正确书写化学方程式是解答此类问题的关键。
解题秘方:(1)紫色石蕊遇酸变红色,遇碱变蓝色,所以实验A 中1、3 孔的现象是石蕊试液变红,该实验的目的是探究酸与指示剂的作用。(2)氢氧化钙和碳酸钠反应会生成碳酸钙沉淀,即有白色沉淀生成。(3)氢氧化钠能与二氧化碳反应,导致集气瓶内的气压减小,所以看到的现象是气球胀大。
知2-练
误区警示:
学习碱的化学性质要注意:
1.比较异同,如氢氧化钠和氢氧化钙的化学性质相似,但二者的性质也有不同之处。
2.关注一般规律与特殊情况,如碱能与非金属氧化物反应,但不是所有的非金属氧化物都能与碱反应。
知识点
碱的通性
3
知3-讲
1. 碱具有通性的原因
碱溶液中都含有OH-,所以它们具有相似的化学性质。
2. 碱的通性
碱的通性 一般规律 举例
与石蕊、酚酞作用 能使紫色石蕊试液变蓝,使无色酚酞试液变红
与非金属氧化物反应 碱+ 非金属氧化物→盐+ 水 Ca(OH)2+CO2===CaCO3↓+H2O
2NaOH +SO2 === Na2SO3 +H2O
知3-讲
碱的通性 一般规律 举例
与某些盐反应 碱+盐→新盐+新碱(条件:参加反应的碱与盐均须溶于水) Ca(OH)2+Na2CO3====CaCO3↓+2NaOH
与酸反应(第四节学习) 酸+ 碱→盐+ 水 NaOH +HCl === NaCl +H2O
知3-讲
知3-讲
特别提醒:
由于不同的碱溶于水时解离出的阳离子不同,所以其性质也存在差异。
例如,氢氧化钙溶液能与碳酸钠溶液反应生成白色的碳酸钙沉淀,而氢氧化钠却不能。
氢氧化铯(CsOH)是一种可溶性强碱,被称为“碱中之王”。氢氧化铯不仅具有碱的通性,其溶液还能与铝、锌等金属反应生成H2。下列有关说法正确的是( )
A. CsOH 可用于改良酸性土壤
B. CsOH 溶液不能使无色酚酞试液变色
C. CsOH 与硫酸反应生成盐的化学式为CsSO4
D. 能与锌和铝反应生成H2的溶液不一定能使紫色石蕊试液变红
知3-练
例5
D
考向 碱的通性
题型1 结合陌生新碱考查碱的通性
知3-练
解题秘方:本题运用信息迁移法和信息筛选法解答。氢氧化铯是一种可溶性碱,因此具有碱的通性。
解题秘方:氢氧化铯(CsOH)虽然是碱,可以和酸发生反应,但由于碱性太强,因此不适合用于改良酸性土壤,A 错误;氢氧化铯(CsOH)是一种可溶性强碱,其溶液中存在OH-,能够使无色酚酞试液变成红色,B 错误;硫酸铯的化学式为Cs2SO4,C 错误;氢氧化铯不是酸而是碱,能使紫色石蕊试液变成蓝色,D 正确。
归纳总结是学习化学的一种方法。莉莉整理的氢氧化钠的化学性质如图3 所示。
知3-练
例6
D
题型2 结合知识网络图考查碱的通性
结合此图回答下列问题:
(1)氢氧化钠能与某些非金属氧化物反应,暴露在空气中易变质,反应的化学方程式为_____________________, 所以要密封保存。实验室需密封保存的物质还有_______ ( 填一种)。
(2)写出能与氢氧化钙溶液反应的X中的一种物质____。
知3-练
2NaOH +CO2 === Na2CO3 +H2O
浓硫酸
碳酸钠
知3-练
解题秘方::结合图示记忆碱的相似化学性质(通性),并能熟记实验现象、正确书写化学方程式是解答此类问题的关键。
解题秘方:(1)氢氧化钠暴露在空气中易变质,是因为二氧化碳和氢氧化钠反应生成碳酸钠和水,所以要密封保存;实验室需密封保存的物质还有浓硫酸、氧化钙、浓盐酸等。(2)能与氢氧化钠溶液反应的X 中的一种物质可以是硫酸铜,这是因为硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠。
知3-练
方法点拨:
碱具有的相似化学性质
(通性)可结合图4记忆:
(说明:碱与酸的反应
第四节学习)
第七单元 认识酸和碱
第二节 碱及其性质
介绍明代爱国将领于谦写的《石灰吟》
从化学角度看,你知道这首诗中包含了哪些化学反应吗
常见的碱
1. 碱的概念
在水溶液中解离出的阴离子全部是氢氧根离子(OH-),化学上把这类化合物称为碱。
2. 认识氢氧化钠和氢氧化钙
知识点
常见的碱
1
知1-讲
碱 氢氧化钠(NaOH) 氢氧化钙[Ca(OH)2]
俗名 烧碱、火碱、苛性钠 熟石灰或消石灰的主要成分
颜色、状态 白色片状固体 白色粉末状固体
腐蚀性 强烈腐蚀性 较强腐蚀性
露置在 空气中 易潮解 无明显变化
水中溶解 情况 易溶,放热 微溶(石灰水)
知1-讲
知1-讲
碱 氢氧化钠(NaOH) 氢氧化钙[Ca(OH)2]
溶解性 易溶于水,易潮解,溶解时放热 微溶于水,其水溶液俗称石灰水
主要用途 造纸,印染,炼油,生产化学纤维、橡胶等 生产农药和漂白剂、土木建筑、改良酸性土壤等
知1-讲
见多识广:
1.氢氧化钠易潮解(需密封保存),氧化钙能与水反应,因此这两种物质都可作干燥剂。氢氧化钠的腐蚀性较强,不能作食品干燥剂,一般用氧化钙作食品干燥剂。
2.氢氧化钠可作炉具清洁剂,用来除油污,是因为它能与油脂发生化学反应;洗涤剂除油污是利用洗涤剂的乳化作用;汽油能溶解油污,可用来除油污。
知1-讲
3. 氢氧化钠使用注意事项
氢氧化钠具有强烈的腐蚀性,使用时必须十分小心,要防止沾到眼睛、皮肤或衣服上。如果不慎将碱液沾到皮肤上,应立即用大量的水冲洗,然后涂上适量的硼酸溶液。
不能放在纸上称量,应放在玻璃器皿如烧杯或表面皿中称量,以防腐蚀托盘
知1-讲
4. 氢氧化钠的潮解
氢氧化钠暴露在空气中容易吸收水分,表面潮湿并逐渐溶解,这种现象叫作潮解,此过程是物理变化。
知1-讲
5. 石灰石(主要成分CaCO3)、生石灰(主要成分CaO)、熟石灰[主要成分Ca(OH)2]之间的转化关系
[中考·怀化] 下列物质俗名对应正确的是( )
A. NaOH—苛性钠
B. Ca(OH)2—生石灰
C. Na2CO3—烧碱
D. Ag—水银
A
知1-练
例1
考向 常见的碱
题型1 考查常见物质的俗名及化学式
知1-练
解题秘方:熟记常见物质的俗名及化学式,区分易混淆的物质,如银与水银、生石灰与熟石灰等。
解:氢氧化钠俗称火碱、烧碱、苛性钠,A 正确;熟石灰的主要成分是Ca(OH)2,B 错误;碳酸钠俗称纯碱、苏打,C 错误;汞俗称水银,D 错误。
知1-练
误区警示:
对于物质的认识不能望文生义,要认清实质:
如干冰不是冰(是固态CO2),水银不是银(是汞),金刚石不是钢(是非金属单质C),石灰生熟要分开,生(石灰)加水放热变熟(石灰)。
下列有关NaOH 和Ca(OH)2的说法不正确的是( )
A. 可用水来区分氢氧化钠和氢氧化钙
B. 都可作干燥剂
C. 氢氧化钠可作炉具清洁剂,氢氧化钙可用作建筑材料
D. 都具有腐蚀性
B
知1-练
例2
题型2 考查氢氧化钠、氢氧化钙的物理性质与用途
知1-练
解:氢氧化钠易溶于水且放热,溶液温度升高,氢氧化钙微溶于水,溶液温度无明显变化,因此可用水来鉴别这两种碱;氢氧化钠易潮解,可用作干燥剂,氢氧化钙不能作干燥剂,B 不正确;氢氧化钠能与油脂反应,可作炉具清洁剂,氢氧化钙是常用的建筑材料,这两种碱都有一定的腐蚀性。
知1-练
知识链接:
1.常用作干燥剂的物质:浓硫酸、氢氧化钠固体、氧化钙。
2.溶于水时放热的物质:浓硫酸、氢氧化钠、氧化钙。
3.可作建筑材料的物质:CaO、Ca(OH)2、CaCO3。
4.能用来除油污的物质:NaOH、汽油、洗涤剂。
初中常见含钙化合物的转化关系如图1 所示,请回答:
(1)Ca(OH)2是________________的主要成分。
(2)反应①的基本反应类型是________________ 。
(3)反应② (填“放出”或“吸收”)_______热量。
(4)反应③可用于检验CO2,反应的化学方程式是________________________________ 。
熟石灰
知1-练
例3
题型3 考查石灰石、生石灰、熟石灰之间的转化关系
分解反应
放出
CO2+Ca(OH)2====CaCO3↓ +H2O。
知1-练
解题秘方:在解此类题时,首先分析流程图中各步试剂的作用和反应物、生成物的成分,然后结合学过的知识进行分析,最终得出正确答案。
解题秘方::(1)Ca(OH)2是氢氧化钙的化学式, 氢氧化钙是熟石灰的主要成分。(2)①反应是碳酸钙在高温的条件下生成氧化钙和二氧化碳气体,是由一种物质生成两种新物质,符合“一变多”的特征,属于分解反应。
知1-练
(3)②反应是由氧化钙和水反应生成氢氧化钙,此反应过程中会放出大量的热。(4)二氧化碳与氢氧化钙反应生成碳酸钙白色沉淀和水,所以在实验室中用澄清的石灰水来检验二氧化碳气体,化学方程式为CO2+Ca(OH)2====CaCO3↓ +H2O。
知1-练
规律总结:
化学反应中常见的“三角关系”:
知识点
碱的化学性质
2
知2-讲
1. 与酸碱指示剂作用
将紫色石蕊试液、无色酚酞试液分别滴加到氢氧化钠溶液和氢氧化钙溶液中,现象如下:
加紫色石蕊溶液 加无色酚酞溶液
氢氧化钠溶液 变蓝色 变红色
氢氧化钙溶液 变蓝色 变红色
2. 与某些非金属氧化物反应
向两个盛满二氧化碳的矿泉水瓶中分别加入氢氧化钠溶液和氢氧化钙溶液,其现象及反应如下:
实验现象及化学方程式
加入氢氧化钠溶液 瓶子变瘪,
2NaOH +CO2 === Na2CO3 +H2O
加入氢氧化钙溶液 瓶子变瘪,澄清石灰水变浑浊,
Ca(OH)2 +CO2=== CaCO3↓+H2O
知2-讲
不是所有的非金属氧化物都能与碱溶液反应
知2-练
特别提醒:
1.只有可溶性碱形成的碱溶液才能与酸碱指示剂反应,难溶于水的碱,如:氢氧化铜、氢氧化铁、氢氧化镁等不能使指示剂变色。
2.氢氧化钠易吸收空气中的水和二氧化碳,因此应密封保存。
知2-练
3.二氧化碳能使澄清石灰水变浑浊,与氢氧化钠溶液反应无明显现象。因此实验室用澄清石灰水检验二氧化碳气体,氢氧化钠溶液用来吸收二氧化碳气体。
知2-讲
3. 与某些盐混合
将氢氧化钠溶液、氢氧化钙溶液分别加入碳酸钠溶液中,其现象及反应如下:
Na2CO3溶液
加入NaOH 溶液的现象及化学方程式 无明显现象
加入Ca(OH)2溶液的现象及化学方程式 有白色沉淀生成,
Ca(OH)2+Na2CO3====CaCO3↓+2NaOH(工业用此方法制NaOH)
实验是学习化学的重要途径,小亮在学习酸碱盐的化学性质时做了如下实验,请你和他一起完成实验活动。
知2-练
例4
考向 NaOH、Ca(OH)2的化学性质
(1)实验A 中1、3 孔的现象是 ________________,该实验的目的是 ________________________。
知2-练
石蕊试液变红
探究酸与指示剂的作用
(2)在实验B 的试管中,滴加少量的氢氧化钙溶液,看到的现象是 ________________,反应的化学方程式是 _____________________________________。
知2-练
有白色沉淀生成
Ca(OH)2+Na2CO3====CaCO3↓+2NaOH
(3)小张用实验C 验证二氧化碳与氢氧化钠溶液反应,看到的现象是 __________,写出反应的化学方程式:____________________________________。
知2-练
气球胀大
2NaOH + CO2 ===== Na2CO3 + H2O
知2-练
解题秘方:明确碱的化学性质及有关反应的现象,如酸碱指示剂遇碱的变色情况、碱与盐溶液反应产生沉淀的颜色,正确书写化学方程式是解答此类问题的关键。
解题秘方:(1)紫色石蕊遇酸变红色,遇碱变蓝色,所以实验A 中1、3 孔的现象是石蕊试液变红,该实验的目的是探究酸与指示剂的作用。(2)氢氧化钙和碳酸钠反应会生成碳酸钙沉淀,即有白色沉淀生成。(3)氢氧化钠能与二氧化碳反应,导致集气瓶内的气压减小,所以看到的现象是气球胀大。
知2-练
误区警示:
学习碱的化学性质要注意:
1.比较异同,如氢氧化钠和氢氧化钙的化学性质相似,但二者的性质也有不同之处。
2.关注一般规律与特殊情况,如碱能与非金属氧化物反应,但不是所有的非金属氧化物都能与碱反应。
知识点
碱的通性
3
知3-讲
1. 碱具有通性的原因
碱溶液中都含有OH-,所以它们具有相似的化学性质。
2. 碱的通性
碱的通性 一般规律 举例
与石蕊、酚酞作用 能使紫色石蕊试液变蓝,使无色酚酞试液变红
与非金属氧化物反应 碱+ 非金属氧化物→盐+ 水 Ca(OH)2+CO2===CaCO3↓+H2O
2NaOH +SO2 === Na2SO3 +H2O
知3-讲
碱的通性 一般规律 举例
与某些盐反应 碱+盐→新盐+新碱(条件:参加反应的碱与盐均须溶于水) Ca(OH)2+Na2CO3====CaCO3↓+2NaOH
与酸反应(第四节学习) 酸+ 碱→盐+ 水 NaOH +HCl === NaCl +H2O
知3-讲
知3-讲
特别提醒:
由于不同的碱溶于水时解离出的阳离子不同,所以其性质也存在差异。
例如,氢氧化钙溶液能与碳酸钠溶液反应生成白色的碳酸钙沉淀,而氢氧化钠却不能。
氢氧化铯(CsOH)是一种可溶性强碱,被称为“碱中之王”。氢氧化铯不仅具有碱的通性,其溶液还能与铝、锌等金属反应生成H2。下列有关说法正确的是( )
A. CsOH 可用于改良酸性土壤
B. CsOH 溶液不能使无色酚酞试液变色
C. CsOH 与硫酸反应生成盐的化学式为CsSO4
D. 能与锌和铝反应生成H2的溶液不一定能使紫色石蕊试液变红
知3-练
例5
D
考向 碱的通性
题型1 结合陌生新碱考查碱的通性
知3-练
解题秘方:本题运用信息迁移法和信息筛选法解答。氢氧化铯是一种可溶性碱,因此具有碱的通性。
解题秘方:氢氧化铯(CsOH)虽然是碱,可以和酸发生反应,但由于碱性太强,因此不适合用于改良酸性土壤,A 错误;氢氧化铯(CsOH)是一种可溶性强碱,其溶液中存在OH-,能够使无色酚酞试液变成红色,B 错误;硫酸铯的化学式为Cs2SO4,C 错误;氢氧化铯不是酸而是碱,能使紫色石蕊试液变成蓝色,D 正确。
归纳总结是学习化学的一种方法。莉莉整理的氢氧化钠的化学性质如图3 所示。
知3-练
例6
D
题型2 结合知识网络图考查碱的通性
结合此图回答下列问题:
(1)氢氧化钠能与某些非金属氧化物反应,暴露在空气中易变质,反应的化学方程式为_____________________, 所以要密封保存。实验室需密封保存的物质还有_______ ( 填一种)。
(2)写出能与氢氧化钙溶液反应的X中的一种物质____。
知3-练
2NaOH +CO2 === Na2CO3 +H2O
浓硫酸
碳酸钠
知3-练
解题秘方::结合图示记忆碱的相似化学性质(通性),并能熟记实验现象、正确书写化学方程式是解答此类问题的关键。
解题秘方:(1)氢氧化钠暴露在空气中易变质,是因为二氧化碳和氢氧化钠反应生成碳酸钠和水,所以要密封保存;实验室需密封保存的物质还有浓硫酸、氧化钙、浓盐酸等。(2)能与氢氧化钠溶液反应的X 中的一种物质可以是硫酸铜,这是因为硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠。
知3-练
方法点拨:
碱具有的相似化学性质
(通性)可结合图4记忆:
(说明:碱与酸的反应
第四节学习)
同课章节目录
