第一节 酸及其性质 第二课时课件(共26张PPT内嵌视频)
文档属性
| 名称 | 第一节 酸及其性质 第二课时课件(共26张PPT内嵌视频) |  | |
| 格式 | pptx | ||
| 文件大小 | 139.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-11 21:41:32 | ||
图片预览







文档简介
(共26张PPT)
第一节 酸及其性质(2)
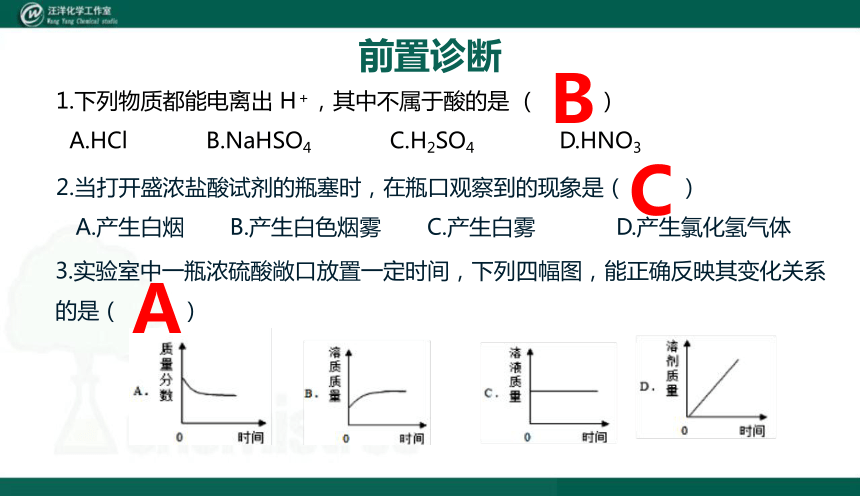
前置诊断
2.当打开盛浓盐酸试剂的瓶塞时,在瓶口观察到的现象是( )
A.产生白烟 B.产生白色烟雾 C.产生白雾 D.产生氯化氢气体
1.下列物质都能电离出 H+,其中不属于酸的是 ( )
A.HCl B.NaHSO4 C.H2SO4 D.HNO3
3.实验室中一瓶浓硫酸敞口放置一定时间,下列四幅图,能正确反映其变化关系的是( )
B
C
A
4.浓硫酸和浓盐酸敞口放置在空气中一段时间后,溶液中( )
A.溶液的质量都增大
B.溶质的质量分数都变小
C.溶质的质量分数前者变大,后者变小
D.溶质的质量分数都变大
5.如图所示实验操作中正确的是( )
B
C
学习目标
1.通过两种酸的实验探究,能正确说出稀盐酸、稀硫酸的化学性质。
2.通过合作探究,知道酸具有相似化学性质的原因。
3.通过具体反应原理分析归纳总结,能说出复分解反应和盐的概念。
学习任务一:酸的化学性质
实验探究活动一:酸+指示剂
向装有稀盐酸和稀硫酸的试管中分别加入紫色石蕊试液和无色酚酞试液,观察实验现象,填写相应的表格,并总结酸的化学性质。
加紫色石蕊溶液 加无色酚酞溶液
稀盐酸
稀硫酸
酸的化学性质1:
酸能使紫色石蕊试液变红色,无色酚酞不变色。
紫色变成红色
紫色变成红色
无色酚酞不变色
无色酚酞不变色
实验探究活动二:酸+金属氧化物
向盛有生锈铁钉、氧化铜的试管中加入少量稀盐酸和稀硫酸,观察实验现象,填写相应的表格,并总结酸的化学性质。
生锈的铁钉(Fe203红棕色) 氧化铜粉末(CuO黑色) 现象 反应方程式 现象 反应方程式
稀盐酸
稀硫酸
酸的化学性质2:
酸与金属氧化物生成盐和水。
铁锈消失
溶液变黄
铁锈消失
溶液变黄
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Fe2O3 +3H2SO4 = Fe2(SO4)3+ 3H2O
粉末消失
溶液变绿
粉末消失
溶液变蓝
CuO + 2HCl = CuCl2+ H2O
CuO + H2SO4= CuSO4+ H2O
含Fe3+的水溶液为黄色
含Cu2+的水溶液为蓝色
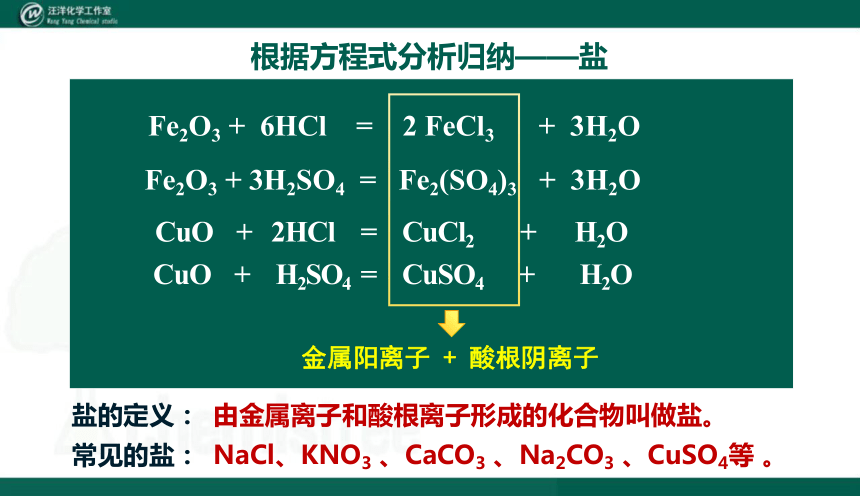
根据方程式分析归纳——盐
Fe2O3 + 6HCl = 2 FeCl3 + 3H2O
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
CuO + 2HCl = CuCl2 + H2O
CuO + H2SO4 = CuSO4 + H2O
金属阳离子 + 酸根阴离子
盐的定义:
由金属离子和酸根离子形成的化合物叫做盐。
常见的盐:
NaCl、KNO3 、CaCO3 、Na2CO3 、CuSO4等 。
根据方程式分析归纳——复分解反应
Fe2O3 + 6HCl = 2 FeCl3 + 3H2O
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
CuO + 2HCl = CuCl2 + H2O
CuO + H2SO4 = CuSO4 + H2O
复分解反应定义:
两种化合物互相交换成分生成另外两种化合物的反应
复分解反应特征:
双交换、价不变
复分解反应表示:
AB + CD → AD + CB
化合物
化合物
实验探究活动三:酸+某些金属
向盛有镁、锌、铁的试管中加入少量稀盐酸和稀硫酸,观察实验现象,填写相应的表格,并总结酸的化学性质。
稀盐酸 稀硫酸 现象 反应方程式 现象 反应方程式
Mg
Zn
Fe
酸的化学性质3:
酸与某些金属反应生成盐和氢气。
Mg+ 2HCl = MgCl2 + H2↑
Fe + H2SO4= FeSO4+ H2↑
Fe +2HCl = FeCl2+ H2↑
产生大
量气泡
产生大
量气泡
产生气泡
溶液变浅绿
产生大
量气泡
产生大
量气泡
产生气泡
溶液变浅绿
Zn+ 2HCl = ZnCl2 + H2↑
Mg+ H2SO4= MgSO4+ H2↑
Zn+ H2SO4= ZnSO4+ H2↑
含Fe2+的水溶液为浅绿色
学习任务二:酸的通性总结
小组合作总结归纳——酸的通性
通过实验可知,盐酸和硫酸具有一些相似的化学性质:
1.使紫色石蕊变红,酚酞不变色;
2.酸+金属→盐+氢气
3.酸+金属氧化物→盐+水
Fe +2HCl = FeCl2+ H2↑
Fe2O3+ 6HCl = 2 FeCl3 +3H2O
CaCO3+2HCl =CaCl2 +H2O+CO2 ↑
4.酸 +盐 → 新盐 + 新酸
H2CO3
为什么酸具有相似的化学性质呢?那是因为它们在溶于水时,都解离出了共同的阳离子——氢离子(H+ ),称作酸的通性。
HCl H+ + Cl-
H2SO4 2H+ + SO42-
总结归纳——酸的通性
探究升级——酸的个性
由于不同的酸溶于水时解离出的酸根阴离子不同,其性质也存在差异。
HCl H+ + Cl-
H2SO4 2H+ + SO42-
实验探究活动四:酸的个性探究
向盛有氯化钡的两只试管中加入少量稀盐酸和稀硫酸,观察实验现象,填写相应的表格。
氯化钡溶液 稀盐酸 稀硫酸 现象 反应方程式 现象 反应方程式
无
无现象
产生白
色沉淀
BaCl2+ H2SO4= BaSO4↓+ 2HCl
获得结论:盐酸不与氯化钡发生反应;硫酸能与氯化钡(BaCl2)反应,生成白色的硫酸钡(BaSO4)沉淀。
学习任务三:酸的用途
硫酸的用途
生产化肥;生产农药、炸药、医药、染料、冶金、石油化工、纺织。
盐酸的用途
制药、作除锈剂等
课堂总结:酸的化学性质
酸及其性质
酸的化学性质
使紫色石蕊试液变红
酸+活泼金属→盐+氢气酸+金属氧化物→盐+水
酸+盐→新酸+新盐
盐
金属阳离子+酸根阴离子
酸的用途
复分解反应
两种化合物互相交换成分生成另外两种化合物的反应
当堂达标检测
1.一定条件下,下列转化不能一步实现的是( )
A.CO2→CaCO3 B.HCl→CaCl2 C.Fe→FeSO4 D.Fe→Fe2(SO4)3
D
2.某固体中加入稀盐酸,产生了一种无色气体,则该固体不可能是 ( )
A.铁片 B.碳酸钠 C.碳酸钙 D.铜片
D
3.下列化学反应中,属于复分解反应的是( )
A. 4Al+3O2=2Al2O3 B.HCl+AgNO3=AgCl↓+HNO3
C. H2CO3=H2O+CO2↑ D.H2+CuO= Cu+H2O
B
4.学物质使世界变得绚丽多彩。如图是物质之间发生化学反应的颜色变化。
(1)请你在编号②③处各填入一种物质。②是 ;③是 ;
(2)根据图可以总结出稀硫酸的四点化学性质,与编号①的物质反应体现的稀硫酸的性质是 ;
(3)编号④的物质是盐,请你写出符合编号④的
一个化学方程式 ,
反应类型是 。
Fe
CuO
能使紫色石蕊变红色
BaCl2+ H2SO4= BaSO4↓+ 2HCl
复分解反应
课程结束了,祝学习进步哦!
稀盐酸、稀硫酸与金属氧化物的反应
稀盐酸、稀硫酸与某些金属的反应
第一节 酸及其性质(2)
前置诊断
2.当打开盛浓盐酸试剂的瓶塞时,在瓶口观察到的现象是( )
A.产生白烟 B.产生白色烟雾 C.产生白雾 D.产生氯化氢气体
1.下列物质都能电离出 H+,其中不属于酸的是 ( )
A.HCl B.NaHSO4 C.H2SO4 D.HNO3
3.实验室中一瓶浓硫酸敞口放置一定时间,下列四幅图,能正确反映其变化关系的是( )
B
C
A
4.浓硫酸和浓盐酸敞口放置在空气中一段时间后,溶液中( )
A.溶液的质量都增大
B.溶质的质量分数都变小
C.溶质的质量分数前者变大,后者变小
D.溶质的质量分数都变大
5.如图所示实验操作中正确的是( )
B
C
学习目标
1.通过两种酸的实验探究,能正确说出稀盐酸、稀硫酸的化学性质。
2.通过合作探究,知道酸具有相似化学性质的原因。
3.通过具体反应原理分析归纳总结,能说出复分解反应和盐的概念。
学习任务一:酸的化学性质
实验探究活动一:酸+指示剂
向装有稀盐酸和稀硫酸的试管中分别加入紫色石蕊试液和无色酚酞试液,观察实验现象,填写相应的表格,并总结酸的化学性质。
加紫色石蕊溶液 加无色酚酞溶液
稀盐酸
稀硫酸
酸的化学性质1:
酸能使紫色石蕊试液变红色,无色酚酞不变色。
紫色变成红色
紫色变成红色
无色酚酞不变色
无色酚酞不变色
实验探究活动二:酸+金属氧化物
向盛有生锈铁钉、氧化铜的试管中加入少量稀盐酸和稀硫酸,观察实验现象,填写相应的表格,并总结酸的化学性质。
生锈的铁钉(Fe203红棕色) 氧化铜粉末(CuO黑色) 现象 反应方程式 现象 反应方程式
稀盐酸
稀硫酸
酸的化学性质2:
酸与金属氧化物生成盐和水。
铁锈消失
溶液变黄
铁锈消失
溶液变黄
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Fe2O3 +3H2SO4 = Fe2(SO4)3+ 3H2O
粉末消失
溶液变绿
粉末消失
溶液变蓝
CuO + 2HCl = CuCl2+ H2O
CuO + H2SO4= CuSO4+ H2O
含Fe3+的水溶液为黄色
含Cu2+的水溶液为蓝色
根据方程式分析归纳——盐
Fe2O3 + 6HCl = 2 FeCl3 + 3H2O
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
CuO + 2HCl = CuCl2 + H2O
CuO + H2SO4 = CuSO4 + H2O
金属阳离子 + 酸根阴离子
盐的定义:
由金属离子和酸根离子形成的化合物叫做盐。
常见的盐:
NaCl、KNO3 、CaCO3 、Na2CO3 、CuSO4等 。
根据方程式分析归纳——复分解反应
Fe2O3 + 6HCl = 2 FeCl3 + 3H2O
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
CuO + 2HCl = CuCl2 + H2O
CuO + H2SO4 = CuSO4 + H2O
复分解反应定义:
两种化合物互相交换成分生成另外两种化合物的反应
复分解反应特征:
双交换、价不变
复分解反应表示:
AB + CD → AD + CB
化合物
化合物
实验探究活动三:酸+某些金属
向盛有镁、锌、铁的试管中加入少量稀盐酸和稀硫酸,观察实验现象,填写相应的表格,并总结酸的化学性质。
稀盐酸 稀硫酸 现象 反应方程式 现象 反应方程式
Mg
Zn
Fe
酸的化学性质3:
酸与某些金属反应生成盐和氢气。
Mg+ 2HCl = MgCl2 + H2↑
Fe + H2SO4= FeSO4+ H2↑
Fe +2HCl = FeCl2+ H2↑
产生大
量气泡
产生大
量气泡
产生气泡
溶液变浅绿
产生大
量气泡
产生大
量气泡
产生气泡
溶液变浅绿
Zn+ 2HCl = ZnCl2 + H2↑
Mg+ H2SO4= MgSO4+ H2↑
Zn+ H2SO4= ZnSO4+ H2↑
含Fe2+的水溶液为浅绿色
学习任务二:酸的通性总结
小组合作总结归纳——酸的通性
通过实验可知,盐酸和硫酸具有一些相似的化学性质:
1.使紫色石蕊变红,酚酞不变色;
2.酸+金属→盐+氢气
3.酸+金属氧化物→盐+水
Fe +2HCl = FeCl2+ H2↑
Fe2O3+ 6HCl = 2 FeCl3 +3H2O
CaCO3+2HCl =CaCl2 +H2O+CO2 ↑
4.酸 +盐 → 新盐 + 新酸
H2CO3
为什么酸具有相似的化学性质呢?那是因为它们在溶于水时,都解离出了共同的阳离子——氢离子(H+ ),称作酸的通性。
HCl H+ + Cl-
H2SO4 2H+ + SO42-
总结归纳——酸的通性
探究升级——酸的个性
由于不同的酸溶于水时解离出的酸根阴离子不同,其性质也存在差异。
HCl H+ + Cl-
H2SO4 2H+ + SO42-
实验探究活动四:酸的个性探究
向盛有氯化钡的两只试管中加入少量稀盐酸和稀硫酸,观察实验现象,填写相应的表格。
氯化钡溶液 稀盐酸 稀硫酸 现象 反应方程式 现象 反应方程式
无
无现象
产生白
色沉淀
BaCl2+ H2SO4= BaSO4↓+ 2HCl
获得结论:盐酸不与氯化钡发生反应;硫酸能与氯化钡(BaCl2)反应,生成白色的硫酸钡(BaSO4)沉淀。
学习任务三:酸的用途
硫酸的用途
生产化肥;生产农药、炸药、医药、染料、冶金、石油化工、纺织。
盐酸的用途
制药、作除锈剂等
课堂总结:酸的化学性质
酸及其性质
酸的化学性质
使紫色石蕊试液变红
酸+活泼金属→盐+氢气酸+金属氧化物→盐+水
酸+盐→新酸+新盐
盐
金属阳离子+酸根阴离子
酸的用途
复分解反应
两种化合物互相交换成分生成另外两种化合物的反应
当堂达标检测
1.一定条件下,下列转化不能一步实现的是( )
A.CO2→CaCO3 B.HCl→CaCl2 C.Fe→FeSO4 D.Fe→Fe2(SO4)3
D
2.某固体中加入稀盐酸,产生了一种无色气体,则该固体不可能是 ( )
A.铁片 B.碳酸钠 C.碳酸钙 D.铜片
D
3.下列化学反应中,属于复分解反应的是( )
A. 4Al+3O2=2Al2O3 B.HCl+AgNO3=AgCl↓+HNO3
C. H2CO3=H2O+CO2↑ D.H2+CuO= Cu+H2O
B
4.学物质使世界变得绚丽多彩。如图是物质之间发生化学反应的颜色变化。
(1)请你在编号②③处各填入一种物质。②是 ;③是 ;
(2)根据图可以总结出稀硫酸的四点化学性质,与编号①的物质反应体现的稀硫酸的性质是 ;
(3)编号④的物质是盐,请你写出符合编号④的
一个化学方程式 ,
反应类型是 。
Fe
CuO
能使紫色石蕊变红色
BaCl2+ H2SO4= BaSO4↓+ 2HCl
复分解反应
课程结束了,祝学习进步哦!
稀盐酸、稀硫酸与金属氧化物的反应
稀盐酸、稀硫酸与某些金属的反应
同课章节目录
