2025苏教版高中化学选择性必修第2强化练习题--题型整合练 晶胞的相关计算(含解析)
文档属性
| 名称 | 2025苏教版高中化学选择性必修第2强化练习题--题型整合练 晶胞的相关计算(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 579.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-13 12:41:12 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2025苏教版高中化学选择性必修第2
题型整合练 晶胞的相关计算
题型1 根据题给信息计算微粒间的距离
1.(2023湖北宜昌协作体期中联考)由Cu和O组成的某晶胞结构如图,其棱长为anm,下列有关该晶胞的说法错误的是( )
A.灰球表示的原子为Cu
B.晶体化学式为Cu2O
C.氧原子的配位数为4
D.Cu与O的最近距离为anm
2.(2023辽宁省实验中学月考)在C60的晶体空隙中插入金属离子可获得超导体。一种超导体的面心立方晶胞如图1所示,已知:晶胞参数为apm,各点的原子分数坐标分别为A(0,0,0),B(0,)。下列说法错误的是( )
图1 图2
A.沿图1虚线切割后得到的截面如图2所示
B.相邻两个K+的最短距离为apm
C.晶胞中C点原子分数坐标为()
D.该晶体的密度表达式为g·cm-3
题型2 根据题给信息计算晶体密度
3.(2023山东,16节选)(3)一定条件下,CuCl2、K和F2反应生成KCl和化合物X。已知X属于四方晶系,晶胞结构如图所示(晶胞参数a=b≠c,α=β=γ=90°),其中Cu化合价为+2。上述反应的化学方程式为 。若阿伏加德罗常数的值为NA,化合物X的密度ρ= g·cm-3(用含NA的代数式表示)。
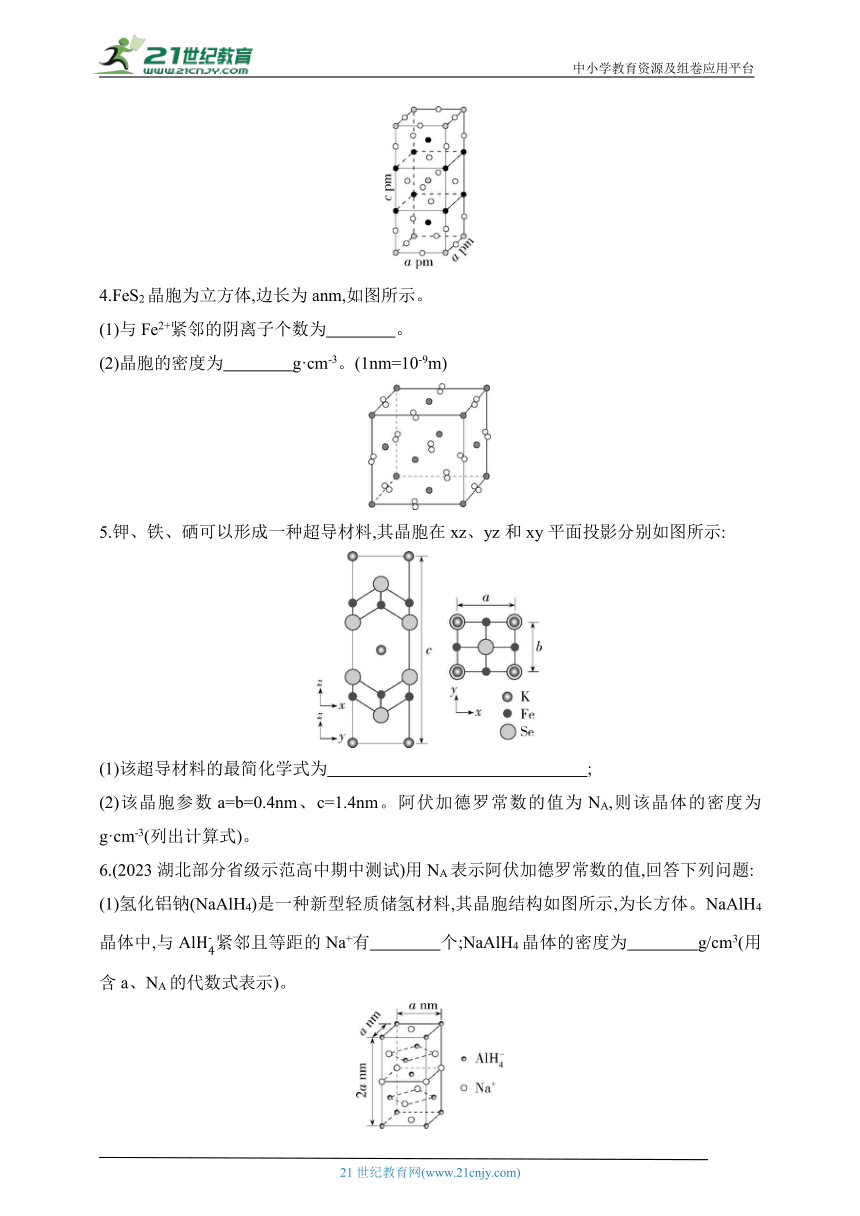
4.FeS2晶胞为立方体,边长为anm,如图所示。
(1)与Fe2+紧邻的阴离子个数为 。
(2)晶胞的密度为 g·cm-3。(1nm=10-9m)
5.钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:
(1)该超导材料的最简化学式为 ;
(2)该晶胞参数a=b=0.4nm、c=1.4nm。阿伏加德罗常数的值为NA,则该晶体的密度为 g·cm-3(列出计算式)。
6.(2023湖北部分省级示范高中期中测试)用NA表示阿伏加德罗常数的值,回答下列问题:
(1)氢化铝钠(NaAlH4)是一种新型轻质储氢材料,其晶胞结构如图所示,为长方体。NaAlH4晶体中,与Al紧邻且等距的Na+有 个;NaAlH4晶体的密度为 g/cm3(用含a、NA的代数式表示)。
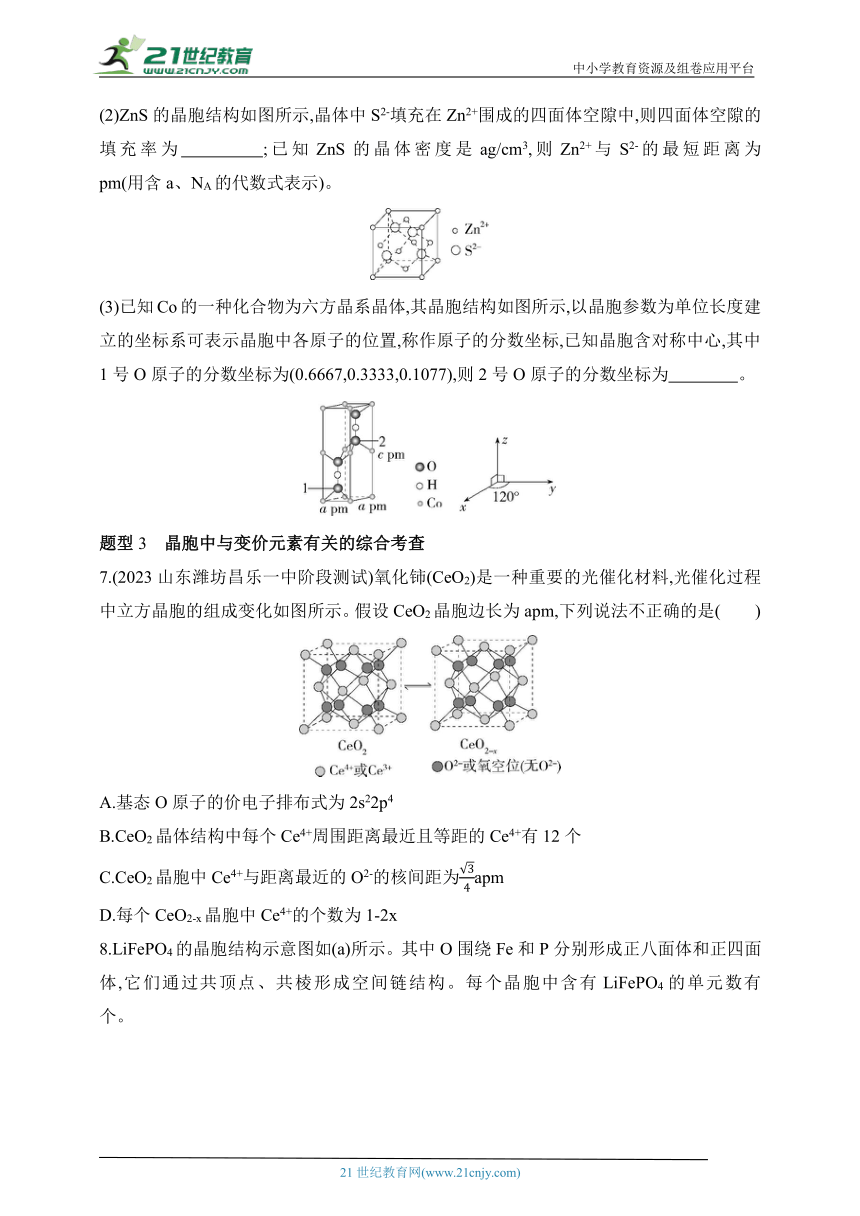
(2)ZnS的晶胞结构如图所示,晶体中S2-填充在Zn2+围成的四面体空隙中,则四面体空隙的填充率为 ;已知ZnS的晶体密度是ag/cm3,则Zn2+与S2-的最短距离为 pm(用含a、NA的代数式表示)。
(3)已知Co的一种化合物为六方晶系晶体,其晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可表示晶胞中各原子的位置,称作原子的分数坐标,已知晶胞含对称中心,其中1号O原子的分数坐标为(0.6667,0.3333,0.1077),则2号O原子的分数坐标为 。
题型3 晶胞中与变价元素有关的综合考查
7.(2023山东潍坊昌乐一中阶段测试)氧化铈(CeO2)是一种重要的光催化材料,光催化过程中立方晶胞的组成变化如图所示。假设CeO2晶胞边长为apm,下列说法不正确的是( )
A.基态O原子的价电子排布式为2s22p4
B.CeO2晶体结构中每个Ce4+周围距离最近且等距的Ce4+有12个
C.CeO2晶胞中Ce4+与距离最近的O2-的核间距为apm
D.每个CeO2-x晶胞中Ce4+的个数为1-2x
8.LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有 个。
电池充电时,LiFePO4脱出部分Li+,形成Li1-xFePO4,结构示意图如(b)所示,则x= ,n(Fe2+)∶n(Fe3+)= 。
答案与分层梯度式解析
题型整合练 晶胞的相关计算
1.D 在晶胞中含有灰球个数为4,含有白球个数为8×+1=2,灰球与白球个数比为4∶2=2∶1,这是Cu、O两种元素形成的化合物,结合二者常见化合物及元素化合价特点可知,灰球表示的原子为Cu,白球表示的原子为O,A正确;灰球表示Cu,白球表示O,灰球与白球个数比是2∶1,所以该晶体化学式为Cu2O,B正确;根据题图可知,在晶胞中与O原子距离相等且最近的Cu原子有4个,故氧原子的配位数为4,C正确;根据晶胞结构可知,在Cu2O晶胞中,Cu与O的最近距离是晶胞体对角线长的,已知晶胞棱长为anm,则其体对角线长为anm,所以Cu与O的最近距离为anm,D错误。
2.D C60位于顶点和面心,K+位于棱上、体心、体对角线,所以沿图1虚线切割后得到的截面如图2所示,故A正确;根据图示,相邻两个K+的最短距离为体对角线长的,为apm,故B正确;A点原子分数坐标为(0,0,0),A点是坐标原点,根据坐标系,晶胞中C点原子分数坐标为(),故C正确;根据均摊法,该晶胞中C60数目为8×=4、K+数目为12×+9=12,该晶体的密度表达式为g·cm-3,故D错误。
3.答案 (3)CuCl2+4K+2F22KCl+K2CuF4
解析 (3)CuCl2+K+F2KCl+X,化合物X中一定含有Cu和F,根据晶胞结构,利用均摊法可知,1个晶胞中白球(A)的个数为16×+2=8,灰球(B)的个数为8×+1=2,黑球(C)的个数为8×+2=4,其最简式为C2BA4,又因为Cu为+2价,K为+1价,F为-1价,故X为K2CuF4,则反应的化学方程式为CuCl2+4K+2F22KCl+K2CuF4。1个晶胞中含有4个K、2个Cu和8个F,则晶胞质量m=g,晶胞体积V=(a×10-10cm)2×c×10-10cm=a2c×10-30cm3,故化合物X的密度ρ=g·cm-3。
方法点津 该题中化学方程式书写的解题关键是根据晶胞结构,利用“均摊法”确定化合物X中各原子的比例关系,再结合各元素的化合价推测X的化学式。
4.答案 (1)6
(2)×1021
解析 (1)由晶胞结构可知,晶胞中位于顶点的亚铁离子与位于棱上的阴离子间的距离最近,则与Fe2+紧邻的阴离子个数为6;(2)由晶胞结构可知,晶胞中位于顶点和面心的亚铁离子个数为8×=4,位于棱上和体心的个数为12×+1=4,设晶体的密度为ρg/cm3,则=10-21a3ρ,解得ρ=×1021。
5.答案 (1)KFe2Se2 (2)
解析 (1)由投影可得晶胞的结构为:
利用“均摊法”,晶胞所含K原子个数为8×+1=2,所含Fe原子个数为8×=4,所含Se原子个数为8×+2=4,故该超导材料的最简化学式为KFe2Se2。
(2)1个晶胞中含有2个KFe2Se2,1molKFe2Se2的体积为×NA,1molKFe2Se2的质量为(39+56×2+79×2)g,故其密度为g·cm-3。
方法点津 晶体密度与晶胞参数的关系
注意单位换算:1pm=10-10cm=10-12m;1nm=10-7cm=10-9m。
6.答案 (1)8
(2)50% ×1010
(3)(0.3333,0.6667,0.6077)
解析 (1)观察体心的Al,可以看出与Al紧邻且等距的Na+有8个;在一个该晶胞中,Na+有6×=4个,Na+和Al个数相等,所以一个该晶胞的质量为g,晶胞的体积为a2×2anm3=2a3nm3=2a3×10-21cm3,所以NaAlH4晶体的密度为g/cm3。
(2)Zn2+位于立方体的顶点和面心,能够围成八个四面体空隙,S2-在晶胞内部只有4个,所以四面体空隙的填充率为50%;在一个晶胞中,Zn2+个数为8×=4,S2-个数为4,所以一个晶胞的质量为g,晶体密度为ag/cm3,则晶胞的体积为cm3,晶胞的边长为×1010pm,Zn2+与S2-的最短距离为晶胞体对角线长的四分之一,所以Zn2+与S2-的最短距离为×1010pm。
(3)由题图可知,该晶胞可以看做是由两个正三棱柱构成的,1号和2号氧原子分别位于两个正三棱柱里,晶胞含对称中心,1号氧原子的分数坐标为(0.6667,0.3333,0.1077),根据对称关系,对称位上氧原子的分数坐标为(0.3333,0.6667,0.8923),则2号氧原子的分数坐标为(0.3333,0.6667,0.6077)。
归纳提升 晶胞的相关计算考查点较多,常考查晶胞中微粒配位数的计算,晶胞中微粒数的计算,原子分数坐标的确定,晶胞的质量、密度及空间利用率的计算等。解答这类题目需要掌握晶体中微粒的计算方法及常见晶体结构,同时根据题目提供的晶胞结构结合信息进行分析、判断及计算。
7.D 基态O原子的价电子排布式为2s22p4,故A正确;由晶胞结构可知,以任一顶点的Ce4+为研究对象,距离其最近的Ce4+位于该顶点所在的三个面的面心,一个顶点被8个晶胞共用,则每个Ce4+周围距离最近且等距的Ce4+的个数为=12,故B正确;CeO2晶胞中Ce4+与距离最近的O2-的核间距为晶胞体对角线长度的,即apm,故C正确;假设CeO2-x中的Ce4+和Ce3+的个数分别为m、n,m+n=1,由化合物中元素正、负化合价代数和为0可得4m+3n=4-2x,解得m=1-2x,由晶胞结构可知,位于顶点和面心的Ce4+或Ce3+的个数为8×=4,所以每个晶胞中Ce4+的个数为4-8x,故D不正确。
8.答案 4 13∶3
解析 图(a)中每个晶胞含有Li+个数为8×=4,故每个晶胞中含有LiFePO4的单元数为4;图(b)中每个晶胞含有Li+个数为8×,则LiFePO4与Li1-xFePO4中Li+数目之比为1∶(1-x)=4∶;设Li1-xFePO4中Fe2+、Fe3+个数分别为a、b,则有,解得,故n(Fe2+)∶n(Fe3+)=a∶b=13∶3。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025苏教版高中化学选择性必修第2
题型整合练 晶胞的相关计算
题型1 根据题给信息计算微粒间的距离
1.(2023湖北宜昌协作体期中联考)由Cu和O组成的某晶胞结构如图,其棱长为anm,下列有关该晶胞的说法错误的是( )
A.灰球表示的原子为Cu
B.晶体化学式为Cu2O
C.氧原子的配位数为4
D.Cu与O的最近距离为anm
2.(2023辽宁省实验中学月考)在C60的晶体空隙中插入金属离子可获得超导体。一种超导体的面心立方晶胞如图1所示,已知:晶胞参数为apm,各点的原子分数坐标分别为A(0,0,0),B(0,)。下列说法错误的是( )
图1 图2
A.沿图1虚线切割后得到的截面如图2所示
B.相邻两个K+的最短距离为apm
C.晶胞中C点原子分数坐标为()
D.该晶体的密度表达式为g·cm-3
题型2 根据题给信息计算晶体密度
3.(2023山东,16节选)(3)一定条件下,CuCl2、K和F2反应生成KCl和化合物X。已知X属于四方晶系,晶胞结构如图所示(晶胞参数a=b≠c,α=β=γ=90°),其中Cu化合价为+2。上述反应的化学方程式为 。若阿伏加德罗常数的值为NA,化合物X的密度ρ= g·cm-3(用含NA的代数式表示)。
4.FeS2晶胞为立方体,边长为anm,如图所示。
(1)与Fe2+紧邻的阴离子个数为 。
(2)晶胞的密度为 g·cm-3。(1nm=10-9m)
5.钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:
(1)该超导材料的最简化学式为 ;
(2)该晶胞参数a=b=0.4nm、c=1.4nm。阿伏加德罗常数的值为NA,则该晶体的密度为 g·cm-3(列出计算式)。
6.(2023湖北部分省级示范高中期中测试)用NA表示阿伏加德罗常数的值,回答下列问题:
(1)氢化铝钠(NaAlH4)是一种新型轻质储氢材料,其晶胞结构如图所示,为长方体。NaAlH4晶体中,与Al紧邻且等距的Na+有 个;NaAlH4晶体的密度为 g/cm3(用含a、NA的代数式表示)。
(2)ZnS的晶胞结构如图所示,晶体中S2-填充在Zn2+围成的四面体空隙中,则四面体空隙的填充率为 ;已知ZnS的晶体密度是ag/cm3,则Zn2+与S2-的最短距离为 pm(用含a、NA的代数式表示)。
(3)已知Co的一种化合物为六方晶系晶体,其晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可表示晶胞中各原子的位置,称作原子的分数坐标,已知晶胞含对称中心,其中1号O原子的分数坐标为(0.6667,0.3333,0.1077),则2号O原子的分数坐标为 。
题型3 晶胞中与变价元素有关的综合考查
7.(2023山东潍坊昌乐一中阶段测试)氧化铈(CeO2)是一种重要的光催化材料,光催化过程中立方晶胞的组成变化如图所示。假设CeO2晶胞边长为apm,下列说法不正确的是( )
A.基态O原子的价电子排布式为2s22p4
B.CeO2晶体结构中每个Ce4+周围距离最近且等距的Ce4+有12个
C.CeO2晶胞中Ce4+与距离最近的O2-的核间距为apm
D.每个CeO2-x晶胞中Ce4+的个数为1-2x
8.LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有 个。
电池充电时,LiFePO4脱出部分Li+,形成Li1-xFePO4,结构示意图如(b)所示,则x= ,n(Fe2+)∶n(Fe3+)= 。
答案与分层梯度式解析
题型整合练 晶胞的相关计算
1.D 在晶胞中含有灰球个数为4,含有白球个数为8×+1=2,灰球与白球个数比为4∶2=2∶1,这是Cu、O两种元素形成的化合物,结合二者常见化合物及元素化合价特点可知,灰球表示的原子为Cu,白球表示的原子为O,A正确;灰球表示Cu,白球表示O,灰球与白球个数比是2∶1,所以该晶体化学式为Cu2O,B正确;根据题图可知,在晶胞中与O原子距离相等且最近的Cu原子有4个,故氧原子的配位数为4,C正确;根据晶胞结构可知,在Cu2O晶胞中,Cu与O的最近距离是晶胞体对角线长的,已知晶胞棱长为anm,则其体对角线长为anm,所以Cu与O的最近距离为anm,D错误。
2.D C60位于顶点和面心,K+位于棱上、体心、体对角线,所以沿图1虚线切割后得到的截面如图2所示,故A正确;根据图示,相邻两个K+的最短距离为体对角线长的,为apm,故B正确;A点原子分数坐标为(0,0,0),A点是坐标原点,根据坐标系,晶胞中C点原子分数坐标为(),故C正确;根据均摊法,该晶胞中C60数目为8×=4、K+数目为12×+9=12,该晶体的密度表达式为g·cm-3,故D错误。
3.答案 (3)CuCl2+4K+2F22KCl+K2CuF4
解析 (3)CuCl2+K+F2KCl+X,化合物X中一定含有Cu和F,根据晶胞结构,利用均摊法可知,1个晶胞中白球(A)的个数为16×+2=8,灰球(B)的个数为8×+1=2,黑球(C)的个数为8×+2=4,其最简式为C2BA4,又因为Cu为+2价,K为+1价,F为-1价,故X为K2CuF4,则反应的化学方程式为CuCl2+4K+2F22KCl+K2CuF4。1个晶胞中含有4个K、2个Cu和8个F,则晶胞质量m=g,晶胞体积V=(a×10-10cm)2×c×10-10cm=a2c×10-30cm3,故化合物X的密度ρ=g·cm-3。
方法点津 该题中化学方程式书写的解题关键是根据晶胞结构,利用“均摊法”确定化合物X中各原子的比例关系,再结合各元素的化合价推测X的化学式。
4.答案 (1)6
(2)×1021
解析 (1)由晶胞结构可知,晶胞中位于顶点的亚铁离子与位于棱上的阴离子间的距离最近,则与Fe2+紧邻的阴离子个数为6;(2)由晶胞结构可知,晶胞中位于顶点和面心的亚铁离子个数为8×=4,位于棱上和体心的个数为12×+1=4,设晶体的密度为ρg/cm3,则=10-21a3ρ,解得ρ=×1021。
5.答案 (1)KFe2Se2 (2)
解析 (1)由投影可得晶胞的结构为:
利用“均摊法”,晶胞所含K原子个数为8×+1=2,所含Fe原子个数为8×=4,所含Se原子个数为8×+2=4,故该超导材料的最简化学式为KFe2Se2。
(2)1个晶胞中含有2个KFe2Se2,1molKFe2Se2的体积为×NA,1molKFe2Se2的质量为(39+56×2+79×2)g,故其密度为g·cm-3。
方法点津 晶体密度与晶胞参数的关系
注意单位换算:1pm=10-10cm=10-12m;1nm=10-7cm=10-9m。
6.答案 (1)8
(2)50% ×1010
(3)(0.3333,0.6667,0.6077)
解析 (1)观察体心的Al,可以看出与Al紧邻且等距的Na+有8个;在一个该晶胞中,Na+有6×=4个,Na+和Al个数相等,所以一个该晶胞的质量为g,晶胞的体积为a2×2anm3=2a3nm3=2a3×10-21cm3,所以NaAlH4晶体的密度为g/cm3。
(2)Zn2+位于立方体的顶点和面心,能够围成八个四面体空隙,S2-在晶胞内部只有4个,所以四面体空隙的填充率为50%;在一个晶胞中,Zn2+个数为8×=4,S2-个数为4,所以一个晶胞的质量为g,晶体密度为ag/cm3,则晶胞的体积为cm3,晶胞的边长为×1010pm,Zn2+与S2-的最短距离为晶胞体对角线长的四分之一,所以Zn2+与S2-的最短距离为×1010pm。
(3)由题图可知,该晶胞可以看做是由两个正三棱柱构成的,1号和2号氧原子分别位于两个正三棱柱里,晶胞含对称中心,1号氧原子的分数坐标为(0.6667,0.3333,0.1077),根据对称关系,对称位上氧原子的分数坐标为(0.3333,0.6667,0.8923),则2号氧原子的分数坐标为(0.3333,0.6667,0.6077)。
归纳提升 晶胞的相关计算考查点较多,常考查晶胞中微粒配位数的计算,晶胞中微粒数的计算,原子分数坐标的确定,晶胞的质量、密度及空间利用率的计算等。解答这类题目需要掌握晶体中微粒的计算方法及常见晶体结构,同时根据题目提供的晶胞结构结合信息进行分析、判断及计算。
7.D 基态O原子的价电子排布式为2s22p4,故A正确;由晶胞结构可知,以任一顶点的Ce4+为研究对象,距离其最近的Ce4+位于该顶点所在的三个面的面心,一个顶点被8个晶胞共用,则每个Ce4+周围距离最近且等距的Ce4+的个数为=12,故B正确;CeO2晶胞中Ce4+与距离最近的O2-的核间距为晶胞体对角线长度的,即apm,故C正确;假设CeO2-x中的Ce4+和Ce3+的个数分别为m、n,m+n=1,由化合物中元素正、负化合价代数和为0可得4m+3n=4-2x,解得m=1-2x,由晶胞结构可知,位于顶点和面心的Ce4+或Ce3+的个数为8×=4,所以每个晶胞中Ce4+的个数为4-8x,故D不正确。
8.答案 4 13∶3
解析 图(a)中每个晶胞含有Li+个数为8×=4,故每个晶胞中含有LiFePO4的单元数为4;图(b)中每个晶胞含有Li+个数为8×,则LiFePO4与Li1-xFePO4中Li+数目之比为1∶(1-x)=4∶;设Li1-xFePO4中Fe2+、Fe3+个数分别为a、b,则有,解得,故n(Fe2+)∶n(Fe3+)=a∶b=13∶3。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
