【核心素养】7.2 物质溶解的量课件(共32张PPT)--科粤版(2024)九年级化学下册
文档属性
| 名称 | 【核心素养】7.2 物质溶解的量课件(共32张PPT)--科粤版(2024)九年级化学下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-12 23:05:53 | ||
图片预览











文档简介
(共32张PPT)
第七单元 溶液
物质溶解的量 第2课时
(科粤版)九年级
下
01
教学目标
内容总览
02
新知导入
03
探究新知
04
课堂练习
05
课堂总结
06
板书设计
教学目标
了解饱和溶液的含义;认识饱和溶液与不饱和溶液相互转化的方法;
01
02
了解固体溶解度的含义,初步学会绘制和查阅溶解度曲线;
03
知道气体溶解度的表示方法与影响因素。
新知导入
小明想要更快冲泡果汁,
请大家给他一些建议。
想一想
新知导入
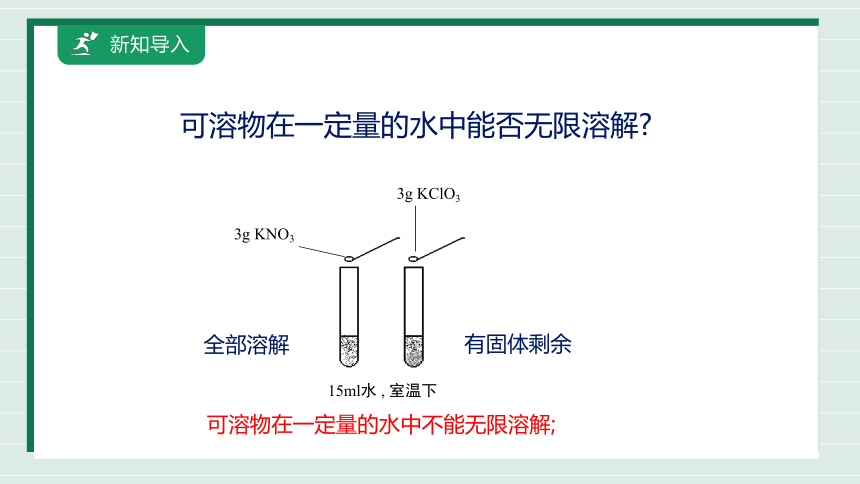
可溶物在一定量的水中能否无限溶解
15ml水 , 室温下
3g KNO3
3g KClO3
全部溶解
有固体剩余
可溶物在一定量的水中不能无限溶解;
探究新知
饱和溶液与不饱和溶液
我没吃饱
我刚好饱了
我吃饱了
我 是
不饱和溶液
我刚好是
饱和溶液
我 是
饱和溶液
在一定温度下,一定量的溶剂里
不能再溶解某种溶质的溶液, 叫做 该溶质的 饱和溶液;
还能继续溶解某种溶质的溶液,叫做该溶质的 不饱和溶液
探究新知
观察活动一:
往20 mL水中加入5 g硝酸钾,搅拌
现象:固体全部溶解
结论:硝酸钾可溶于水
往20 mL水中加入5 g氯酸钾,搅拌
现象:固体有剩余
结论:在常温下,20 mL水中溶解氯酸钾是有限的
探究新知
升高温度或再加5 mL水,搅拌
现象:固体继续溶解
结论:又能继续 溶解氯化钠
结论:
1、在一定量的溶剂里溶解溶质的量是有限的。
2、温度影响物质的溶解状况。
探究新知
观察活动二:
往20mL水中加入下列质量的硝酸钾
操 作 现 象
加入5g硝酸钾,搅拌
再加5g硝酸钾,搅拌
……
探究新知
固体溶解
固体溶解
有晶体析出
探究新知
1、饱和溶液和不饱和溶液的前提条件是什么?
一定温度、一定量的溶剂。
2.在上面的前提条件下,关键看什么?
溶质是否能继续溶解
3.为什么必须说明是“这种溶质”的饱和溶液?
说明:
1.硝酸钾的饱和溶液能继续溶解高锰酸钾;
2.此为硝酸钾饱和溶液,高锰酸钾不饱和溶液
加入少量
高锰酸钾
探究新知
饱和溶液 不饱和溶液
加溶剂
升温
加溶质;
蒸发溶剂
降温
注意:上述结论只适合于大多数随温度升高、
一定量溶剂中溶解量不断增多的固体物质
探究新知
固体物质的溶解度
任务二
1.定义:
一定温度
100克溶剂(一般指水)
饱和状态
条件:
标准:
溶液状态:
单位:
质量(克)
固体的溶解度的四要素:
例:蔗糖在20℃时的溶解度是203.9g。
在一定温度下,某固态物质的在100克溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
在20℃时,100g水中最多可溶解203.9g蔗糖。
在20℃时,100g水中溶解203.9g蔗糖,溶液达到饱和。
影响溶解度的因素:
内因:溶质和溶剂本身的性质
外因:温度
温度 溶质的质量 溶剂的质量 溶液的质量
探究新知
练习:
36
2.在0℃时,100g水中最多可溶解13.3g硝酸钾,则0℃时硝酸钾溶解度是____g。
13.3
3.20℃时硝酸钾的溶解度是31.6g,这句话的含义是什么?将其关系代入下表:
20℃
31.6g
100g
131.6g
1.在20℃时,100g水中溶解36g氯化钠溶液达到饱和,则20℃时氯化钠溶解度是____g。
溶解性
溶解度/g (20℃)
探究新知
2.溶解度与溶解性的关系
易溶
可溶
微溶
难(不)溶
难
>10g
>1g
<1g
<0.01g
A
练习: 1.不溶物就是绝对不溶于水的物质。此话是否正确? 2.20℃时碳酸钙的溶解度是0.0013g,所以碳酸钙是___溶物质。 3.20℃时氯化钠的溶解度是36g,则氯化钠属于( )
A.易溶 物质 B.可溶物质 C.微溶物质 D.难溶物质
.
.
.
0.01g
1g
10g
易溶
可溶
微溶
难溶
探究新知
硝酸钾在不同温度时的溶解度:
13.3
31.6
20.9
45.8
63.9
85.5
110
138
168
202
246
(2)列表法:
(1)语言直叙法:
3、溶解度的表示方法:
探究新知
溶解度曲线图法
溶解度曲线提供的信息:
1.曲线表示某物质在不同温度下的溶解度或溶解度随温度变化的情况。
2.曲线上的每一点表示该溶质在该温度下的溶解度,溶液为饱和溶液。
3.曲线的交点表示两物质在该温度下的溶解度相等。
4.在溶解度曲线下方的点,表示溶液是不饱和溶液。
探究新知
溶解度(克)
温度(t)
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
200
190
180
170
10
100
90
80
70
60
50
40
30
20
0
硝酸铵
硝酸钾
硝酸钠
氯化铵
氯化钠
硼酸
固体溶解度曲线
找一找50度各物质的溶解度
碳酸氢钠
1:曲线上的点表示物质在该点所示温度下的溶解度;两曲线上的交点表示两物质在该点所示温度下的溶解度相同
2:曲线表示同一种物质在不同温度下的溶解度或溶解度随温度变化的情况
3:曲线上面所表示的溶液为饱和溶液;曲线下面所表示的溶液为不饱和溶液
探究新知
硼酸
硝酸铵
硝酸钠
硝酸钾
氯化铵
氯化钾
氯化钠
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
200
50
10
20
30
40
0
90
60
70
80
碳酸氢钠
0.05
0.10
0.15
0.20
90
70
40
0
10
20
50
60
80
30
溶解度/
g
0.05
0.10
0.15
0.20
90
0
10
温度/℃
100
温度/℃
熟石灰的溶解度曲线:
讨论:固体物质溶解度受温度变化影响情况:
②少数固体物质溶解度受温度影响不大, 例如:食盐。
③极少数固体物质溶解度随温度升高反而减小,例如:熟石灰。
探究新知
三、气体物质的溶解度
在压强为101kPa和一定温度时,气体溶解在1体积水里达到饱和状态时溶解的气体体积。
气体溶解度的五要素:
1.压强101kPa
2.一定温度
3.1体积水
4.达到饱和状态
5.气体体积
探究新知
【分析比较】
气体溶解度的表达方式与固体溶解度的表达方式有什么不同点与相同点?
固体溶解度 气体溶解度
溶剂的量
条件不同
单位
100g
1体积
受温度影响
受温度、压强影响
体积
g
探究新知
影响气体溶解度的因素(外因)
压强:气体溶解度一般随压强增大而增大,减小而减小。
温度:气体溶解度一般随温度升高而减少,降低而增大。
【讨论】天气闷热时,鱼儿为什么总爱在水面上呼吸?
探究新知
思 考
【讨论】为什么拉开可口可乐易拉罐时,会有大量的气体泡沫喷出?
例题分析
知识点1:饱和溶液与不饱和溶液
将一定温度下的某物质的不饱和溶液转变为饱和溶
液,下列方法一定能成功的是( )
A.降温 B.升温
C.加入溶质 D.蒸发溶剂
知识点2:固体物质的溶解度
不能影响物质溶解度大小的因素是( )
A.温度高低 B.溶质、溶剂的量
C.溶剂种类 D.溶质种类
C
B
例题分析
知识点3:气体物质的溶解度
打开汽水瓶盖会有大量气泡冒出,产生这一现象的原因是二氧化碳的溶解度随( )
A.压强增大而减小
B.压强减小而减小
C.温度升高而升高
D.温度降低而减小
B
例题分析
例:甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是( )
①常温下,乙易溶于水
②甲溶液中溶质的质量分数比乙大
③从t2℃降至t1℃,甲溶液中有晶体析出
④甲的溶解度受温度的影响程度比乙大
A.①② B.③④ C.②③ D.①④
D
探究新知
解析:①0℃时,乙物质的溶解度为35.7g,由溶解度曲线可知,在20℃时,乙物质的溶解度大于35.7g,即大于10g,属于易溶于水的物质,故①正确;②甲、乙溶液的状态不能确定,所以溶液中溶质的质量分数不能确定,故②错误;③从t2℃降至t1℃,甲溶液的状态不能确定,所以溶液中不一定有晶体析出,故③错误;④甲物质的溶解度曲线较陡,所以甲物质溶解度受温度的影响程度比乙大,故④正确。
课堂总结
概念
溶解度
概念:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量
固体溶解度
气体溶解度
影响因素
概念:在压强为101 kPa和一定温度时,溶解在1体积水里达到饱和状态时的气体体积
影响因素
内因:溶质、溶剂本身的性质
外因:温度(温度越高,气体的溶解度越小)、压强(压强越大,气体
的溶解度越大)
不饱和溶液:在一定温度下,一定量溶剂里,还能继续溶解这种溶质的溶液
饱和溶液:在一定温度下,一定量溶剂里,不能继续溶解这种溶质的溶液
内因:溶质、溶剂本身的性质
外因:温度[多数固体物质溶解度随温度的升高而增大,但NaCl
(变化不大)、Ca(OH)2(降低)等除外]
板书设计
同种溶质在不同的溶 剂中的溶解能力不同
不同的溶质在同种溶 剂中的溶解能力不同
溶解性
物质的溶解度
定量描述
①一定温度
②100克溶剂
③溶液饱和
④单位是克
易溶 、可溶 、 微溶 、 难(不)溶
固体的溶解度
气体的溶解度
影响因素(温度)
影响因素 (温度、压强)
表示方法
表示方法
课堂练习
1.20℃时,A的溶解度是____
2.90℃时,ABC的溶解度大小顺序是__________。
3.随温度的升高溶解度下降的物质是_____。
4.P点表示的意义是:
_________________________
10g
A>B>C
C
40℃时,A和B的溶解度相同。
https://www.21cnjy.com/help/help_extract.php
让备课更有效
www.21cnjy.com
Thanks!
第七单元 溶液
物质溶解的量 第2课时
(科粤版)九年级
下
01
教学目标
内容总览
02
新知导入
03
探究新知
04
课堂练习
05
课堂总结
06
板书设计
教学目标
了解饱和溶液的含义;认识饱和溶液与不饱和溶液相互转化的方法;
01
02
了解固体溶解度的含义,初步学会绘制和查阅溶解度曲线;
03
知道气体溶解度的表示方法与影响因素。
新知导入
小明想要更快冲泡果汁,
请大家给他一些建议。
想一想
新知导入
可溶物在一定量的水中能否无限溶解
15ml水 , 室温下
3g KNO3
3g KClO3
全部溶解
有固体剩余
可溶物在一定量的水中不能无限溶解;
探究新知
饱和溶液与不饱和溶液
我没吃饱
我刚好饱了
我吃饱了
我 是
不饱和溶液
我刚好是
饱和溶液
我 是
饱和溶液
在一定温度下,一定量的溶剂里
不能再溶解某种溶质的溶液, 叫做 该溶质的 饱和溶液;
还能继续溶解某种溶质的溶液,叫做该溶质的 不饱和溶液
探究新知
观察活动一:
往20 mL水中加入5 g硝酸钾,搅拌
现象:固体全部溶解
结论:硝酸钾可溶于水
往20 mL水中加入5 g氯酸钾,搅拌
现象:固体有剩余
结论:在常温下,20 mL水中溶解氯酸钾是有限的
探究新知
升高温度或再加5 mL水,搅拌
现象:固体继续溶解
结论:又能继续 溶解氯化钠
结论:
1、在一定量的溶剂里溶解溶质的量是有限的。
2、温度影响物质的溶解状况。
探究新知
观察活动二:
往20mL水中加入下列质量的硝酸钾
操 作 现 象
加入5g硝酸钾,搅拌
再加5g硝酸钾,搅拌
……
探究新知
固体溶解
固体溶解
有晶体析出
探究新知
1、饱和溶液和不饱和溶液的前提条件是什么?
一定温度、一定量的溶剂。
2.在上面的前提条件下,关键看什么?
溶质是否能继续溶解
3.为什么必须说明是“这种溶质”的饱和溶液?
说明:
1.硝酸钾的饱和溶液能继续溶解高锰酸钾;
2.此为硝酸钾饱和溶液,高锰酸钾不饱和溶液
加入少量
高锰酸钾
探究新知
饱和溶液 不饱和溶液
加溶剂
升温
加溶质;
蒸发溶剂
降温
注意:上述结论只适合于大多数随温度升高、
一定量溶剂中溶解量不断增多的固体物质
探究新知
固体物质的溶解度
任务二
1.定义:
一定温度
100克溶剂(一般指水)
饱和状态
条件:
标准:
溶液状态:
单位:
质量(克)
固体的溶解度的四要素:
例:蔗糖在20℃时的溶解度是203.9g。
在一定温度下,某固态物质的在100克溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
在20℃时,100g水中最多可溶解203.9g蔗糖。
在20℃时,100g水中溶解203.9g蔗糖,溶液达到饱和。
影响溶解度的因素:
内因:溶质和溶剂本身的性质
外因:温度
温度 溶质的质量 溶剂的质量 溶液的质量
探究新知
练习:
36
2.在0℃时,100g水中最多可溶解13.3g硝酸钾,则0℃时硝酸钾溶解度是____g。
13.3
3.20℃时硝酸钾的溶解度是31.6g,这句话的含义是什么?将其关系代入下表:
20℃
31.6g
100g
131.6g
1.在20℃时,100g水中溶解36g氯化钠溶液达到饱和,则20℃时氯化钠溶解度是____g。
溶解性
溶解度/g (20℃)
探究新知
2.溶解度与溶解性的关系
易溶
可溶
微溶
难(不)溶
难
>10g
>1g
<1g
<0.01g
A
练习: 1.不溶物就是绝对不溶于水的物质。此话是否正确? 2.20℃时碳酸钙的溶解度是0.0013g,所以碳酸钙是___溶物质。 3.20℃时氯化钠的溶解度是36g,则氯化钠属于( )
A.易溶 物质 B.可溶物质 C.微溶物质 D.难溶物质
.
.
.
0.01g
1g
10g
易溶
可溶
微溶
难溶
探究新知
硝酸钾在不同温度时的溶解度:
13.3
31.6
20.9
45.8
63.9
85.5
110
138
168
202
246
(2)列表法:
(1)语言直叙法:
3、溶解度的表示方法:
探究新知
溶解度曲线图法
溶解度曲线提供的信息:
1.曲线表示某物质在不同温度下的溶解度或溶解度随温度变化的情况。
2.曲线上的每一点表示该溶质在该温度下的溶解度,溶液为饱和溶液。
3.曲线的交点表示两物质在该温度下的溶解度相等。
4.在溶解度曲线下方的点,表示溶液是不饱和溶液。
探究新知
溶解度(克)
温度(t)
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
200
190
180
170
10
100
90
80
70
60
50
40
30
20
0
硝酸铵
硝酸钾
硝酸钠
氯化铵
氯化钠
硼酸
固体溶解度曲线
找一找50度各物质的溶解度
碳酸氢钠
1:曲线上的点表示物质在该点所示温度下的溶解度;两曲线上的交点表示两物质在该点所示温度下的溶解度相同
2:曲线表示同一种物质在不同温度下的溶解度或溶解度随温度变化的情况
3:曲线上面所表示的溶液为饱和溶液;曲线下面所表示的溶液为不饱和溶液
探究新知
硼酸
硝酸铵
硝酸钠
硝酸钾
氯化铵
氯化钾
氯化钠
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
200
50
10
20
30
40
0
90
60
70
80
碳酸氢钠
0.05
0.10
0.15
0.20
90
70
40
0
10
20
50
60
80
30
溶解度/
g
0.05
0.10
0.15
0.20
90
0
10
温度/℃
100
温度/℃
熟石灰的溶解度曲线:
讨论:固体物质溶解度受温度变化影响情况:
②少数固体物质溶解度受温度影响不大, 例如:食盐。
③极少数固体物质溶解度随温度升高反而减小,例如:熟石灰。
探究新知
三、气体物质的溶解度
在压强为101kPa和一定温度时,气体溶解在1体积水里达到饱和状态时溶解的气体体积。
气体溶解度的五要素:
1.压强101kPa
2.一定温度
3.1体积水
4.达到饱和状态
5.气体体积
探究新知
【分析比较】
气体溶解度的表达方式与固体溶解度的表达方式有什么不同点与相同点?
固体溶解度 气体溶解度
溶剂的量
条件不同
单位
100g
1体积
受温度影响
受温度、压强影响
体积
g
探究新知
影响气体溶解度的因素(外因)
压强:气体溶解度一般随压强增大而增大,减小而减小。
温度:气体溶解度一般随温度升高而减少,降低而增大。
【讨论】天气闷热时,鱼儿为什么总爱在水面上呼吸?
探究新知
思 考
【讨论】为什么拉开可口可乐易拉罐时,会有大量的气体泡沫喷出?
例题分析
知识点1:饱和溶液与不饱和溶液
将一定温度下的某物质的不饱和溶液转变为饱和溶
液,下列方法一定能成功的是( )
A.降温 B.升温
C.加入溶质 D.蒸发溶剂
知识点2:固体物质的溶解度
不能影响物质溶解度大小的因素是( )
A.温度高低 B.溶质、溶剂的量
C.溶剂种类 D.溶质种类
C
B
例题分析
知识点3:气体物质的溶解度
打开汽水瓶盖会有大量气泡冒出,产生这一现象的原因是二氧化碳的溶解度随( )
A.压强增大而减小
B.压强减小而减小
C.温度升高而升高
D.温度降低而减小
B
例题分析
例:甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是( )
①常温下,乙易溶于水
②甲溶液中溶质的质量分数比乙大
③从t2℃降至t1℃,甲溶液中有晶体析出
④甲的溶解度受温度的影响程度比乙大
A.①② B.③④ C.②③ D.①④
D
探究新知
解析:①0℃时,乙物质的溶解度为35.7g,由溶解度曲线可知,在20℃时,乙物质的溶解度大于35.7g,即大于10g,属于易溶于水的物质,故①正确;②甲、乙溶液的状态不能确定,所以溶液中溶质的质量分数不能确定,故②错误;③从t2℃降至t1℃,甲溶液的状态不能确定,所以溶液中不一定有晶体析出,故③错误;④甲物质的溶解度曲线较陡,所以甲物质溶解度受温度的影响程度比乙大,故④正确。
课堂总结
概念
溶解度
概念:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量
固体溶解度
气体溶解度
影响因素
概念:在压强为101 kPa和一定温度时,溶解在1体积水里达到饱和状态时的气体体积
影响因素
内因:溶质、溶剂本身的性质
外因:温度(温度越高,气体的溶解度越小)、压强(压强越大,气体
的溶解度越大)
不饱和溶液:在一定温度下,一定量溶剂里,还能继续溶解这种溶质的溶液
饱和溶液:在一定温度下,一定量溶剂里,不能继续溶解这种溶质的溶液
内因:溶质、溶剂本身的性质
外因:温度[多数固体物质溶解度随温度的升高而增大,但NaCl
(变化不大)、Ca(OH)2(降低)等除外]
板书设计
同种溶质在不同的溶 剂中的溶解能力不同
不同的溶质在同种溶 剂中的溶解能力不同
溶解性
物质的溶解度
定量描述
①一定温度
②100克溶剂
③溶液饱和
④单位是克
易溶 、可溶 、 微溶 、 难(不)溶
固体的溶解度
气体的溶解度
影响因素(温度)
影响因素 (温度、压强)
表示方法
表示方法
课堂练习
1.20℃时,A的溶解度是____
2.90℃时,ABC的溶解度大小顺序是__________。
3.随温度的升高溶解度下降的物质是_____。
4.P点表示的意义是:
_________________________
10g
A>B>C
C
40℃时,A和B的溶解度相同。
https://www.21cnjy.com/help/help_extract.php
让备课更有效
www.21cnjy.com
Thanks!
