7.4 课时2 物质溶解性的定量表示 课件(共25张PPT) 2024-2025学年化学沪教版九年级下册
文档属性
| 名称 | 7.4 课时2 物质溶解性的定量表示 课件(共25张PPT) 2024-2025学年化学沪教版九年级下册 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-13 20:00:00 | ||
图片预览








文档简介
(共25张PPT)
课时2 物质溶解性的定量表示
1.能用溶解度对物质溶解性进行定量描述,
2.利用物质的溶解度曲线解决实际问题。
硝酸钾,是一种白色粉末
氯化钠,也叫“食盐”
谁的溶解能力更强?
氯化钠
100C
硝酸钾
400C
硝酸钾:“看,我达到饱和状态能溶解36.3g,你最多却只能溶解31.6g。我溶解得比你多,所以我溶解能力更强!
应该在同一温度下
不能比较
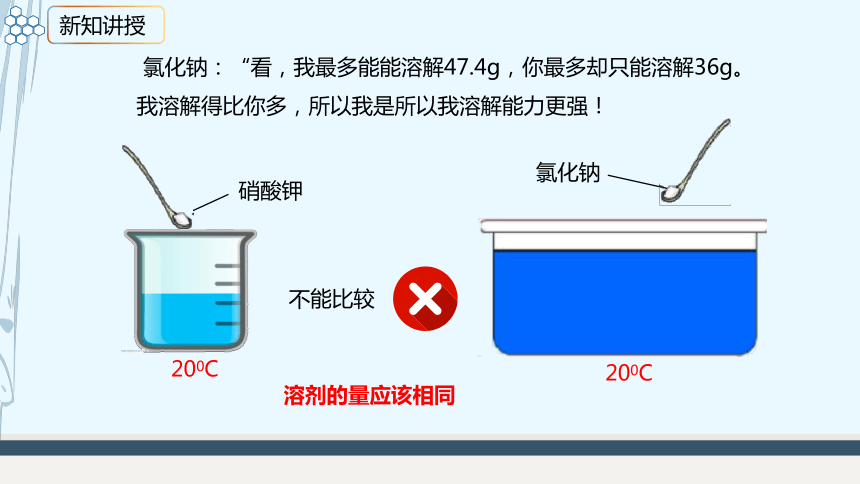
硝酸钾
200C
氯化钠
200C
氯化钠:“看,我最多能能溶解47.4g,你最多却只能溶解36g。我溶解得比你多,所以我是所以我溶解能力更强!
溶剂的量应该相同
不能比较
1g氯化钠
400C
1g硝酸钾
400C
硝酸钾说:“那我们都各取1g,都溶解在20g水中,结果都能溶解完。所以我们的溶解能力一样强。我们溶解能力一样强!
应该达到饱和状态
不能比较
比较不同物质的溶解能力,应该控制的条件有:
1.温度
2.一定量的溶剂
3.达到饱和状态
一、溶解度
人们常用溶解度来定量描述物质的溶解性强弱。
溶解度的四要素都有哪些?
固体物质的溶解度是指在一定温度下,该物质在100 g溶剂(通常溶剂为水)中达到饱和状态时所溶解的质量。
溶解度一般用符号s表示。
固体溶解度的四要素
·条件
·标准
·状态
·单位
在一定温度下
在 100 g溶剂里
(一般指水)
溶液达到饱和
溶解度单位为“克”
固体物质溶解度的影响因素主要是溶质和溶剂的性质以及温度。
20 ℃时,氯化钠的溶解度是36克的意义?
20 ℃时,100克水中最多能溶解氯化钠的质量为36克。
20 ℃时,100 克水中溶解了36克的氯化钠就达到饱和状态。
20 ℃时,食盐的饱和溶液中溶质、溶剂、溶液的质量比:=6g∶100g∶ 136g
20 ℃时几种固体物质在水中的溶解度
溶解性与溶解度的关系
1.用实验方法测定不同温度时硝酸钾在水中的溶解度,并将实验数据记录下来,如表7-10。
同一种物质在水中的溶解度随温度的变化关系,可以用物质的溶解度曲线表示。
2.以温度为横坐标,以物质的溶解度为纵坐标,在坐标纸(图7-16)上标出不同温度下相应溶解度的点,再用光滑的曲线将这些点连接起来,即为该物质的溶解度曲线
3.根据硝酸钾的溶解度曲线,你能得到哪些信息?
能否获得硝酸钾在50 ℃、70 ℃时的溶解度?
可以知道硝酸钾的溶解度随温度的升高而增大、
硝酸钾在某一温度下的溶解度等信息;
能获得硝酸钾在50 ℃、70℃时的溶解度。
溶解度曲线的意义
点
线
面
曲线上的点
两曲线上的交点
表示对应温度下该物质的溶解度
表示对应温度下两物质的溶解度相等
其饱和溶液的溶质质量分数也相等
表示该物质的溶解度随温度变化的趋势
曲线以下区域的点
曲线以上区域的点
表示对应温度下该物质的不饱和溶液
表示对应温度下该物质的饱和溶液
且溶液中有未溶固体
硝酸钾是溶解度随温度变化较大的物质,如何结合其溶解度曲线(如图7-19)分析其降温结晶过程中所经历的不同阶段
如图7-19,配制不饱和溶液①。随着温度下降,溶质的溶解度减小,至60℃时形成饱和溶液②。当温度继续下降时,溶解度也进一步减小,晶体不断析出,依次经历状态③和④
通过对溶解度曲线的分析,人们可以选择科学、合理的方法控制晶体的析 出。氯化钠的溶解度随温度变化不大,因此采用蒸发结晶的方法进行粗盐的提 纯。对于溶解能力受温度变化影响较大的固态物质(如硝酸钾),还可以用冷却 热的饱和溶液的方法,使溶质从溶液中结晶析出。
物质的分离与提纯
为了从混合物中获取所需的纯净物质,人们通常依据混合物中各组成物 质性质的差异,选用相应的操作方法,如可以利用物质溶解性的差异进行混合物的分离、提纯。生产实践中,要除去水中混有的泥沙颗粒,常采用过滤的 方法;为了从氯化钠溶液中提取氯化钠,可采用蒸发结晶的方法;在制药行业 中,降温结晶被广泛用于药物成分的提纯和分离
30 ℃时,在盛有100 g水的烧杯中,加入65 g硝酸钾晶体,用玻璃棒搅拌。下列说法中,不正确的是 ( )
A.所得溶液是不饱和溶液 B.硝酸钾晶体不能全部溶解
C.所得溶液是饱和溶液 D.在所得溶液中还可以溶解其他溶质
A
1. 经测定KNO3在不同温度时的溶解度数据如下表:
2. 在一个大萝卜中挖一个大孔,向其中注入一定量的饱和食盐水,过一段时间后将里面的食盐水倒出,再往倒出的食盐水中加入少量食盐晶体。则食盐水的质量会 ( )
A.不变,因为倒出的食盐水还是饱和的
B.增加,倒出的食盐水还是饱和的,但加入了食盐,故溶液的质量增加
C.增加,倒出的食盐水不饱和了,加入的食盐会溶解一部分
D.减少,因为有一部分食盐变成晶体析出
C
3. 25 ℃时向一定量不饱和KNO3溶液中逐渐加入KNO3固体,则下列图像中
能正确表示此过程溶质质量变化规律的是 ( )
C
4. 20 ℃时,将一瓶KNO3饱和溶液分成等质量的两份,向一份溶液中加入
该物质的晶体得到甲溶液,将另一份溶液加热至60 ℃得到乙溶液,下列
有关说法正确的是 ( )
A.甲乙两份溶液都仍是饱和溶液
B.乙溶液的质量减少
C.甲溶液是饱和溶液,乙溶液是不饱和溶液
D.甲溶液中溶质的质量增加
C
B
5.如图是甲、乙两种物质的溶解度曲线,下列叙述正确的是 ( )
A.20 ℃时,甲的溶解度大于乙的溶解度
B.40 ℃时,甲、乙两种物质的溶解度相等
C.采用降温的方法可以将乙的不饱
和溶液转化为饱和溶液
D.60 ℃时,在100 g水中加入100 g甲,
充分溶解后溶液质量为200 g
固体物质溶解性的定量表示
溶解度(四要素)
影响因素
一定温度下
100 g溶剂
饱和状态
单位(克)
溶质、溶剂本身的性质
温度:溶解度曲线随温度变化的规律
课时2 物质溶解性的定量表示
1.能用溶解度对物质溶解性进行定量描述,
2.利用物质的溶解度曲线解决实际问题。
硝酸钾,是一种白色粉末
氯化钠,也叫“食盐”
谁的溶解能力更强?
氯化钠
100C
硝酸钾
400C
硝酸钾:“看,我达到饱和状态能溶解36.3g,你最多却只能溶解31.6g。我溶解得比你多,所以我溶解能力更强!
应该在同一温度下
不能比较
硝酸钾
200C
氯化钠
200C
氯化钠:“看,我最多能能溶解47.4g,你最多却只能溶解36g。我溶解得比你多,所以我是所以我溶解能力更强!
溶剂的量应该相同
不能比较
1g氯化钠
400C
1g硝酸钾
400C
硝酸钾说:“那我们都各取1g,都溶解在20g水中,结果都能溶解完。所以我们的溶解能力一样强。我们溶解能力一样强!
应该达到饱和状态
不能比较
比较不同物质的溶解能力,应该控制的条件有:
1.温度
2.一定量的溶剂
3.达到饱和状态
一、溶解度
人们常用溶解度来定量描述物质的溶解性强弱。
溶解度的四要素都有哪些?
固体物质的溶解度是指在一定温度下,该物质在100 g溶剂(通常溶剂为水)中达到饱和状态时所溶解的质量。
溶解度一般用符号s表示。
固体溶解度的四要素
·条件
·标准
·状态
·单位
在一定温度下
在 100 g溶剂里
(一般指水)
溶液达到饱和
溶解度单位为“克”
固体物质溶解度的影响因素主要是溶质和溶剂的性质以及温度。
20 ℃时,氯化钠的溶解度是36克的意义?
20 ℃时,100克水中最多能溶解氯化钠的质量为36克。
20 ℃时,100 克水中溶解了36克的氯化钠就达到饱和状态。
20 ℃时,食盐的饱和溶液中溶质、溶剂、溶液的质量比:=6g∶100g∶ 136g
20 ℃时几种固体物质在水中的溶解度
溶解性与溶解度的关系
1.用实验方法测定不同温度时硝酸钾在水中的溶解度,并将实验数据记录下来,如表7-10。
同一种物质在水中的溶解度随温度的变化关系,可以用物质的溶解度曲线表示。
2.以温度为横坐标,以物质的溶解度为纵坐标,在坐标纸(图7-16)上标出不同温度下相应溶解度的点,再用光滑的曲线将这些点连接起来,即为该物质的溶解度曲线
3.根据硝酸钾的溶解度曲线,你能得到哪些信息?
能否获得硝酸钾在50 ℃、70 ℃时的溶解度?
可以知道硝酸钾的溶解度随温度的升高而增大、
硝酸钾在某一温度下的溶解度等信息;
能获得硝酸钾在50 ℃、70℃时的溶解度。
溶解度曲线的意义
点
线
面
曲线上的点
两曲线上的交点
表示对应温度下该物质的溶解度
表示对应温度下两物质的溶解度相等
其饱和溶液的溶质质量分数也相等
表示该物质的溶解度随温度变化的趋势
曲线以下区域的点
曲线以上区域的点
表示对应温度下该物质的不饱和溶液
表示对应温度下该物质的饱和溶液
且溶液中有未溶固体
硝酸钾是溶解度随温度变化较大的物质,如何结合其溶解度曲线(如图7-19)分析其降温结晶过程中所经历的不同阶段
如图7-19,配制不饱和溶液①。随着温度下降,溶质的溶解度减小,至60℃时形成饱和溶液②。当温度继续下降时,溶解度也进一步减小,晶体不断析出,依次经历状态③和④
通过对溶解度曲线的分析,人们可以选择科学、合理的方法控制晶体的析 出。氯化钠的溶解度随温度变化不大,因此采用蒸发结晶的方法进行粗盐的提 纯。对于溶解能力受温度变化影响较大的固态物质(如硝酸钾),还可以用冷却 热的饱和溶液的方法,使溶质从溶液中结晶析出。
物质的分离与提纯
为了从混合物中获取所需的纯净物质,人们通常依据混合物中各组成物 质性质的差异,选用相应的操作方法,如可以利用物质溶解性的差异进行混合物的分离、提纯。生产实践中,要除去水中混有的泥沙颗粒,常采用过滤的 方法;为了从氯化钠溶液中提取氯化钠,可采用蒸发结晶的方法;在制药行业 中,降温结晶被广泛用于药物成分的提纯和分离
30 ℃时,在盛有100 g水的烧杯中,加入65 g硝酸钾晶体,用玻璃棒搅拌。下列说法中,不正确的是 ( )
A.所得溶液是不饱和溶液 B.硝酸钾晶体不能全部溶解
C.所得溶液是饱和溶液 D.在所得溶液中还可以溶解其他溶质
A
1. 经测定KNO3在不同温度时的溶解度数据如下表:
2. 在一个大萝卜中挖一个大孔,向其中注入一定量的饱和食盐水,过一段时间后将里面的食盐水倒出,再往倒出的食盐水中加入少量食盐晶体。则食盐水的质量会 ( )
A.不变,因为倒出的食盐水还是饱和的
B.增加,倒出的食盐水还是饱和的,但加入了食盐,故溶液的质量增加
C.增加,倒出的食盐水不饱和了,加入的食盐会溶解一部分
D.减少,因为有一部分食盐变成晶体析出
C
3. 25 ℃时向一定量不饱和KNO3溶液中逐渐加入KNO3固体,则下列图像中
能正确表示此过程溶质质量变化规律的是 ( )
C
4. 20 ℃时,将一瓶KNO3饱和溶液分成等质量的两份,向一份溶液中加入
该物质的晶体得到甲溶液,将另一份溶液加热至60 ℃得到乙溶液,下列
有关说法正确的是 ( )
A.甲乙两份溶液都仍是饱和溶液
B.乙溶液的质量减少
C.甲溶液是饱和溶液,乙溶液是不饱和溶液
D.甲溶液中溶质的质量增加
C
B
5.如图是甲、乙两种物质的溶解度曲线,下列叙述正确的是 ( )
A.20 ℃时,甲的溶解度大于乙的溶解度
B.40 ℃时,甲、乙两种物质的溶解度相等
C.采用降温的方法可以将乙的不饱
和溶液转化为饱和溶液
D.60 ℃时,在100 g水中加入100 g甲,
充分溶解后溶液质量为200 g
固体物质溶解性的定量表示
溶解度(四要素)
影响因素
一定温度下
100 g溶剂
饱和状态
单位(克)
溶质、溶剂本身的性质
温度:溶解度曲线随温度变化的规律
同课章节目录
