5.2氮及其化合物第3课时 课件 (共52张ppt)2024-2025学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 5.2氮及其化合物第3课时 课件 (共52张ppt)2024-2025学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-13 20:55:01 | ||
图片预览










文档简介
(共52张PPT)
第二节 氮及其化合物
第3课时 硝酸 酸雨及防治
学习任务一 硝酸的性质及工业制备
学习任务二 酸雨及防治
学习任务一 硝酸的性质及工业制备
【新知自主预习】
一、硝酸的性质
1.物理性质
硝酸是____色、____挥发的液体,有刺激性气味。
无
易
2.化学性质
(1)酸性:硝酸溶液中含有 ,具有酸的化学通性。
(2)不稳定性
浓硝酸见光或受热会分解产生 ,化学方程式为
_ _________________________________。
[注意] 由于浓硝酸见光或受热分解,一般浓硝酸保存在带有玻璃
塞的棕色试剂瓶中,并放置在阴凉处。
(3)强氧化性
硝酸是一元强酸,具有酸的______,但硝酸与金属反应一般________
。硝酸无论浓、稀都有强氧化性,而且浓度越大氧化性越强。
①硝酸与铜的反应[教材实验
实验 操作 _______________________________________ 在橡胶塞侧面挖一个凹槽,并嵌入下端卷成
螺旋状的铜丝。向两支具支试管中分别加入
浓硝酸和稀硝酸,用橡胶塞塞住试管口,使铜丝
与硝酸接触,观察并比较实验现象。向上拉铜
丝,终止反应
通性
不产生
实验 现象 浓硝酸与铜反应时,试管内产生大量________气体,溶液逐
渐______,铜丝逐渐变细;稀硝酸与铜反应时,试管内开始产生
少量______气体,反应逐渐加快,气体在试管上部变为红棕色,
溶液逐渐______,铜丝逐渐变细
反应 原理 稀硝酸与铜反应:_____________________________________
______________________________________________________;
浓硝酸与铜反应:_________________________________________
________________________________________________________
红棕色
变绿
无色
变蓝
(稀)
续表
②硝酸与非金属反应
浓硝酸可与非金属单质(碳、硫、磷等)在加热条件下反应,非金
属单质被氧化,转化为最高价含氧酸(或酸性氧化物)。加热时,
浓硝酸与碳的反应:
。
[注意]①常温下,冷的浓硝酸能使铁、铝等______,属于化学反应,
表面生成致密氧化膜。
②王水是________和________的混合物,体积比为_____,能使不溶于
硝酸的金、铂等溶解。
钝化
浓盐酸
浓硝酸
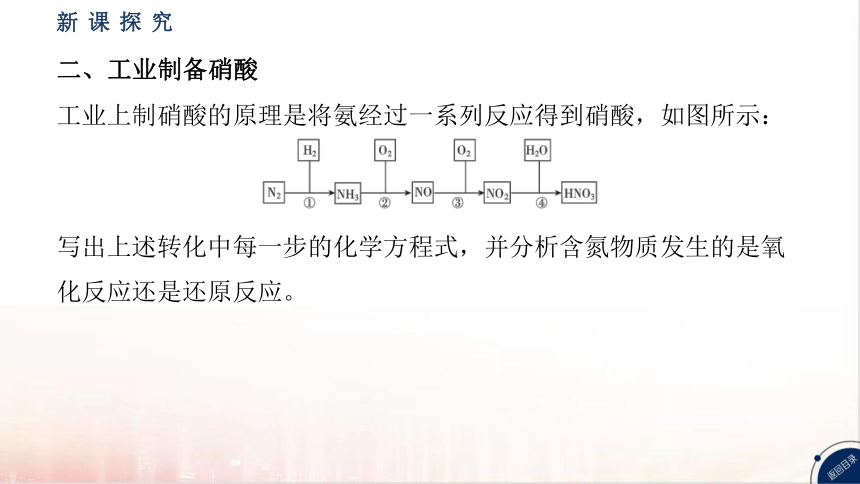
二、工业制备硝酸
工业上制硝酸的原理是将氨经过一系列反应得到硝酸,如图所示:
写出上述转化中每一步的化学方程式,并分析含氮物质发生的是氧
化反应还是还原反应。
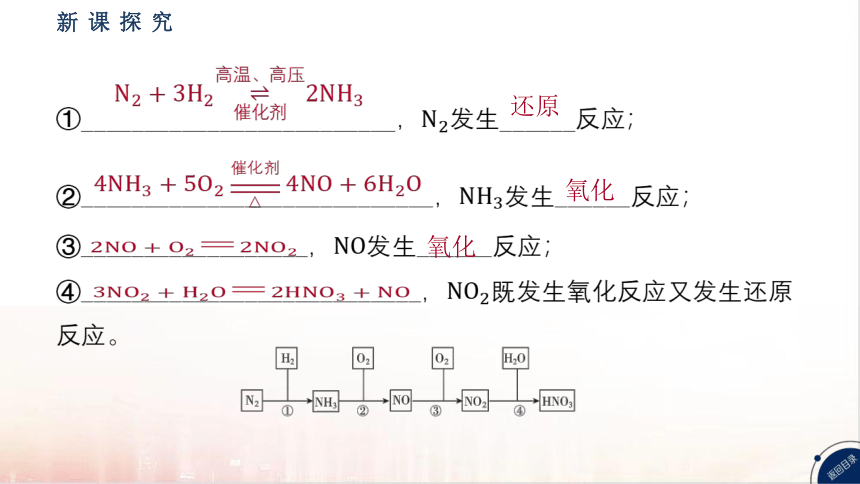
①_ ________________________, 发生______反应;
②_ ___________________________, 发生______反应;
③__________________, 发生______反应;
④___________________________, 既发生氧化反应又发生还原
反应。
还原
氧化
氧化
【核心知识讲解】
1.硝酸与金属反应的一般规律
(1)与、等不活泼金属反应时,浓硝酸的还原产物为 ,稀
硝酸的还原产物为 。反应过程中硝酸会变稀,因此与浓硝酸反应
往往得到和的混合气体。硝酸与金属反应时,一般没有 产生。
例如:
(稀)
(2)常温下,、 在浓硝酸中发生钝化,王水(浓硝酸与浓盐酸
体积比为)可溶解、 。
(3)硝酸与金属反应的计算
灵活运用原子守恒、得失电子守恒及溶液中的电荷守恒关系。例如
与 反应中有以下等量关系:
原子守恒:反应前所有的只存在于中,反应后含 的物质
有的还原产物(假设有、)和,若 过量,
则过量中也含 ,则有
。
②得失电子守恒:反应中失去电子的是参加反应的 ,
;得到电子的是被还原的 (假设还原产物为
、),、 。根据得失电子
守恒,则有 。
③电荷守恒:在任何溶液中,阴离子所带负电荷总数与阳离子所带
正电荷总数是相等的。在与反应后的溶液中,若 不过
量,阳离子只有,阴离子只有(此类计算不考虑 电离
出的极少量的、);若过量,溶液中的阳离子有
和,阴离子只有。则若不过量: ;
若过量: 。
2.硝酸与非金属的反应
(1)加热时,稀硝酸与非金属单质(如C等)不发生反应。
(2)加热时,浓硝酸与非金属单质(如C等)发生反应,生成 、
非金属的氧化物(或相应含氧酸)。
例如, 。
【知识迁移应用】
例1 [2024·浙江绍兴期中] 一定温度下,探究铜与稀HNO3反应,过程如图
所示,下列说法错误的是 ( )
A.过程Ⅰ中生成无色气体的离子方程式为
3Cu+2N+8H+ = 3Cu2++2NO↑+4H2O
B.过程Ⅱ中无色气体变为红棕色的反应为2NO+O2 = 2NO2
C.由实验推测,②振荡时可能发生反应:4NO2+O2+2H2O = 4HNO3
D.当活塞不再移动时,再抽入空气,铜不能再继续溶解
√
[解析] 过程Ⅰ中,铜和稀硝酸反应生成硝酸铜、NO和水,离子方程式为
3Cu+2N+8H+ = 3Cu2++2NO↑+4H2O,A正确;
过程Ⅱ抽入空气,无色气体变为红棕色,发生反应:2NO+O2 = 2NO2,
②振荡时,NO2、O2可与H2O反应:4NO2+O2+2H2O 4HNO3,B、C正确;
当活塞不再移动时,再抽入空气,NO与氧气、水反应生成硝酸,因此铜
可以继续溶解,D错误。
例2 [2024·江苏苏州期中] 将38.4 g铜与150 mL一定浓度的硝酸反应,
铜完全溶解,产生的NO和NO2混合气体折算为标准状况下的体积为
11.2 L,若铜与硝酸刚好反应完全,则原硝酸溶液中HNO3的物质的量
是 ( )
A.1.7 mol B.2.0 mol C.3.0 mol D.1.5 mol
√
[解析] 依次发生反应为Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O、
3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+4H2O;38.4 g Cu的物质的量为
=0.6 mol,混合气体的物质的量为=0.5 mol。
铜与硝酸刚好反应完全,生成硝酸铜、NO和NO2,由N原子守恒可知:
n(HNO3)=2n[Cu(NO3)2]+n(NO)+n(NO2)=2×0.6 mol+0.5 mol=1.7 mol。
[方法技巧] 硝酸与金属反应计算问题的思维模板
学习任务二 酸雨及防治
【新知自主预习】
1.酸雨
2.与 的主要来源、危害和防治
① :主要来源于__________和某些含硫金属矿物的燃烧或冶炼;
② :主要来自__________
煤、石油
汽车尾气
(1)来源
①调整能源结构,发展______能源;
②研究煤的脱硫技术、改进燃烧技术、减少二氧化硫和氮氧化物的排放;
③加强工厂废气的回收处理;
④改进汽车尾气的处理技术,控制尾气排放
清洁
(2)防治
【情境问题思考】
煤、石油和某些金属矿物中含有
硫,在燃烧或冶炼时常会产生 。
在机动车发动机中,燃料燃烧产生的
高温条件会使空气中的与 反应,
生成氮氧化物。它们会污染环境,危
害人体健康。
问题一: 排放到大气中的 是如何转化成硫酸型酸雨的?请结合
化学方程式描述其转化路径。
提示:排放到空气中的 在氧气和水蒸气的共同作用下形成酸雾,
随雨水降落成为硫酸型酸雨。
、 ;
、 。
问题二: 排放到大气中的氮氧化物是如何转化成硝酸型酸雨的?请
结合化学方程式描述其转化路径。
提示:排放到空气中的氮氧化物,与反应生成, 与空
气中的水蒸气反应生成 ,随雨水降落成为硝酸型酸雨。
、 。
【知识迁移应用】
例3 如图为某城市某日空气质量报告,下
列叙述与报告内容不相符的是 ( )
A.该日空气首要污染物是
B.该市空气质量等级属于重度污染
C.污染物 可能主要来源于机动车尾气
D.、 均可导致酸雨
√
[解析] 由图中信息可知,该日空气首要污染物是 ,A正确;
由图中信息可知,空气质量等级属于重度污染,B正确;
空气中的 和在机动车发动机内高温下反应生成,与反应
生成 ,C正确;
、均能导致酸雨, 不能引起酸雨,D错误。
[归纳总结]
(1)常见的污染类型
①光化学烟雾: 在紫外线作用下,与碳氢化合物发生一系列光化学
反应,产生的一种有毒的烟雾。
②酸雨:和排入大气中后,发生反应生成和 等,随雨
水降到地面。
③破坏臭氧层: 等可使平流层中的臭氧减少,导致地面紫外线辐射
量增加。
(2)常见的 尾气处理方法
①碱液吸收法
、 的混合气体能被足量烧碱溶液完全吸收的条件是
。一般适合工业尾气中 的处理。
②催化转化:在催化剂、加热条件下,氨可将氮氧化物转化为无毒气
体或与在一定温度下催化转化为无毒气体和 ,一
般适用于汽车尾气的处理。
1.[2024·浙江宁波十校联考]酸雨对环境危害巨大,下列关于酸雨及防
治的说法正确的是( )
A.酸雨的 等于5.6
B.酸雨能直接损伤农作物,使土壤酸化,加速建筑腐蚀
C. 是形成酸雨的主要原因
D.将含硫的煤和石灰石混合后燃烧,可以减少酸雨的形成以及温室
气体的排放
√
[解析] 正常雨水由于溶解二氧化碳,约为,酸雨是指
的雨水,A错误;
酸雨能直接损伤农作物,破坏森林,使土壤酸化,
加速建筑物的腐蚀,B正确;
二氧化硫和氮氧化物是形成酸雨的主要原因,C错误;
将含硫的煤和石灰石混合后燃烧生成难分解的硫酸钙,
可以减少酸雨的形成,但不能减少温室气体的排放,D错误。
2.下列反应中,硝酸既表现酸性,又表现氧化性的是( )
A.跟稀硝酸反应 B. 跟稀硝酸反应
C.跟稀硝酸反应 D. 跟稀硝酸反应
[解析] 、与稀硝酸发生复分解反应,A、C错误;
跟稀硝酸发生中和反应,属于非氧化还原反应,D错误;
具有较强还原性,与稀硝酸发生氧化还原反应,生成
、 和,体现 的酸性和氧化性,B正确。
√
3.下列有关硝酸化学性质的叙述正确的是( )
A.稀硝酸使红色石蕊试纸变蓝
B.硝酸能与反应,但不生成
C.硝酸可与反应制得 气体
D.浓硝酸因分解放出的 又溶解于硝酸而呈黄色
[解析] 稀硝酸显酸性,不可能使红色石蕊试纸变蓝,故A错误;
发生复分解反应,可以生成,故B错误;
有强氧化性,可以氧化气体,不能用于制取,故C错误;
呈红棕色,浓硝酸因分解放出的 又溶解于硝酸而呈黄色,故D
正确。
√
4.下列关于硝酸的说法正确的是 ( )
A.NO2溶于水生成硝酸,所以NO2是酸性氧化物
B.冷的稀硝酸可以保存在铝、铁的容器中
C.浓硝酸久置溶液会变黄是因为硝酸分解产生NO2
D.硝酸与铜的反应中,硝酸只表现氧化性
√
[解析] 二氧化氮与水反应生成硝酸和一氧化氮,但二氧化氮和硝酸中氮
元素的化合价不相等,故二氧化氮不是酸性氧化物,A错误;
稀硝酸具有强氧化性,能与活泼金属铝、铁反应,所以冷的稀硝酸不能
保存在铝、铁的容器中,B错误;
浓硝酸具有不稳定性,受热或见光易分解生成二氧化氮、氧气和水,分
解生成的二氧化氮溶于浓硝酸会使溶液变为黄色,C正确;
铜与硝酸反应时,氮元素的化合价部分未变生成硝酸铜,部分降低被还
原,硝酸表现酸性和强氧化性,D错误。
5.如图甲是验证铜和浓硝酸反应的装置,乙、丙是师生对实验改进后
的装置:
(1)写出甲、乙、丙三个装置中都发生的反应的化学方程式:
_____________________________________________。
(2)和甲装置相比,乙装置的优点:
①________________________;
②________________________。
可控制反应的发生和停止
可吸收,防止污染环境
(3)为了进一步验证 和水的反应,某学生设计了丙装置。实验
时先关闭止水夹__,再打开止水夹______,才能使 气体充满B试
管;当气体充满B试管后,将铜丝提起与溶液脱离。欲使烧杯中的水
进入B试管,应如何操作?____________________________________
____。
、
先关闭,再关闭,然后打开,用手捂住试管B
[解析] 利用对比的方法,找出装置的优缺点,应注意 有毒,要进行尾
气吸收。丙中要使气体充满试管B,应先关闭止水夹,再打开、 ,
充满试管B后,把铜丝拉起,然后关闭,再关闭后打开 ,用手捂住
试管B,使气体受热膨胀,与水接触, 极易与水反应,使系统内压强减
小,烧杯中的水便进入试管B。
1.常温下,下列溶液可用铁质容器盛装的是( )
A.稀硝酸 B.稀硫酸 C.浓硝酸 D.浓盐酸
[解析] 常温下,稀硝酸、稀硫酸、浓盐酸均与铁发生反应,故不能
用铁质容器盛装,A、B、D均错误;
常温下,浓硝酸能使铁钝化,表面生成致密氧化膜,保护内层铁不
被腐蚀,因此能用铁质容器盛装,C正确。
√
2.[2024·安徽蚌埠期末]足量铜与一定量浓硝酸反应,得到硝酸铜溶
液和、、的混合气体,将这些气体与
(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。
若向所得硝酸铜溶液中加入溶液至 恰好完全沉
淀,则消耗 溶液的体积是( )
A. B. C. D.
√
[解析] 标准状况 的物质的量
,混合气体与 、水反应又得到
,根据得失电子守恒,原子失去的电子等于 获得的电子,
所得硝酸铜溶液中加入溶液至恰好完全沉淀生成 ,
由电荷守恒,
,由于
溶液的浓度是,故需该 溶液的体积
。
3.某研究性学习小组的同学通过查阅资料知, 可与炽热的铜粉发
生反应,他们设计如下装置(夹持装置略去)进行实验验证。
已知:能被酸性高锰酸钾溶液氧化生成 。
请回答下列问题:
(1)实验开始前,检查装置气密性的方法是关闭、 ,将导管末
端置于盛水的水槽中,_______________________________________
___________________________________________________________
____,则表明装置气密性良好;装置A中发生反应的离子方程式为
_________________________________________。
用酒精灯微热三颈烧瓶,水槽中有气泡产生,撤去酒精灯后导管中有一段倒吸的水柱,且一段时间内水柱高度不变
[解析] 检查装置气密性,关闭、 ,将导管末端置于盛水的水槽
中,用酒精灯微热三颈烧瓶,水槽中有气泡产生,撤去酒精灯后导
管中有一段倒吸的水柱,且一段时间内水柱高度不变,证明装置气
密性良好;装置A中 与浓硝酸发生反应的离子方程式为
。
(2)装置B的作用是________________。
将转化为
[解析] 实验的目的是探究与 发生反应,即装置B发生的反应是
,装置B的作用是将转化成 。
(3)装置A中反应开始前,需要先打开 ,向装置中通入一段时间
的或 ,其目的是_______________________________________
___________。
排尽装置内的空气,防止及被空气中的氧气氧化
[解析] 因为能与发生反应生成,加热状态下与 反应生
成,因此反应开始前通入一段时间的或 ,目的是排尽装置
中的空气,防止与、 发生反应。
(4)实验过程中,装置D中铜粉变黑,装置 中溶液颜色变浅,则
装置 中发生反应的离子方程式为
____________________________________________。
请设计一种简单的实验方案,证明该离子反应中的氧化产物为
_____________________________________________________
_________________________________________________________
(写出主要的操作过程、现象、结论)。
取适量中溶液于试管中,加入稀硫酸后再加入铜片,若试管口有红棕色气体生成,则说明有生成,否则没有生成
[解析] D中铜粉变黑,说明铜与发生反应,生成和 ,根据
信息能与酸性高锰酸钾溶液发生反应,即装置 的目的是除去未
反应的 ,则离子方程式为
。 在酸性条件
下具有强氧化性,证明存在的方法是取适量 中溶液于试管中,
加入稀硫酸后再加入铜片,若试管口有红棕色气体生成,则说明有
生成,否则没
有 生成。
(5)从绿色化学角度考虑,实验结束后,拆卸装置前,还应进行的
一项操作是____________________________________。
打开,向装置内通入一段时间的氮气
[解析] 反应停止后,装置中还有未反应的, 有毒,必须除去,
实验结束后,拆卸装置前,应打开 ,向装置内通入一段时间的氮
气,让 全部被酸性高锰酸钾溶液吸收。
第二节 氮及其化合物
第3课时 硝酸 酸雨及防治
学习任务一 硝酸的性质及工业制备
学习任务二 酸雨及防治
学习任务一 硝酸的性质及工业制备
【新知自主预习】
一、硝酸的性质
1.物理性质
硝酸是____色、____挥发的液体,有刺激性气味。
无
易
2.化学性质
(1)酸性:硝酸溶液中含有 ,具有酸的化学通性。
(2)不稳定性
浓硝酸见光或受热会分解产生 ,化学方程式为
_ _________________________________。
[注意] 由于浓硝酸见光或受热分解,一般浓硝酸保存在带有玻璃
塞的棕色试剂瓶中,并放置在阴凉处。
(3)强氧化性
硝酸是一元强酸,具有酸的______,但硝酸与金属反应一般________
。硝酸无论浓、稀都有强氧化性,而且浓度越大氧化性越强。
①硝酸与铜的反应[教材实验
实验 操作 _______________________________________ 在橡胶塞侧面挖一个凹槽,并嵌入下端卷成
螺旋状的铜丝。向两支具支试管中分别加入
浓硝酸和稀硝酸,用橡胶塞塞住试管口,使铜丝
与硝酸接触,观察并比较实验现象。向上拉铜
丝,终止反应
通性
不产生
实验 现象 浓硝酸与铜反应时,试管内产生大量________气体,溶液逐
渐______,铜丝逐渐变细;稀硝酸与铜反应时,试管内开始产生
少量______气体,反应逐渐加快,气体在试管上部变为红棕色,
溶液逐渐______,铜丝逐渐变细
反应 原理 稀硝酸与铜反应:_____________________________________
______________________________________________________;
浓硝酸与铜反应:_________________________________________
________________________________________________________
红棕色
变绿
无色
变蓝
(稀)
续表
②硝酸与非金属反应
浓硝酸可与非金属单质(碳、硫、磷等)在加热条件下反应,非金
属单质被氧化,转化为最高价含氧酸(或酸性氧化物)。加热时,
浓硝酸与碳的反应:
。
[注意]①常温下,冷的浓硝酸能使铁、铝等______,属于化学反应,
表面生成致密氧化膜。
②王水是________和________的混合物,体积比为_____,能使不溶于
硝酸的金、铂等溶解。
钝化
浓盐酸
浓硝酸
二、工业制备硝酸
工业上制硝酸的原理是将氨经过一系列反应得到硝酸,如图所示:
写出上述转化中每一步的化学方程式,并分析含氮物质发生的是氧
化反应还是还原反应。
①_ ________________________, 发生______反应;
②_ ___________________________, 发生______反应;
③__________________, 发生______反应;
④___________________________, 既发生氧化反应又发生还原
反应。
还原
氧化
氧化
【核心知识讲解】
1.硝酸与金属反应的一般规律
(1)与、等不活泼金属反应时,浓硝酸的还原产物为 ,稀
硝酸的还原产物为 。反应过程中硝酸会变稀,因此与浓硝酸反应
往往得到和的混合气体。硝酸与金属反应时,一般没有 产生。
例如:
(稀)
(2)常温下,、 在浓硝酸中发生钝化,王水(浓硝酸与浓盐酸
体积比为)可溶解、 。
(3)硝酸与金属反应的计算
灵活运用原子守恒、得失电子守恒及溶液中的电荷守恒关系。例如
与 反应中有以下等量关系:
原子守恒:反应前所有的只存在于中,反应后含 的物质
有的还原产物(假设有、)和,若 过量,
则过量中也含 ,则有
。
②得失电子守恒:反应中失去电子的是参加反应的 ,
;得到电子的是被还原的 (假设还原产物为
、),、 。根据得失电子
守恒,则有 。
③电荷守恒:在任何溶液中,阴离子所带负电荷总数与阳离子所带
正电荷总数是相等的。在与反应后的溶液中,若 不过
量,阳离子只有,阴离子只有(此类计算不考虑 电离
出的极少量的、);若过量,溶液中的阳离子有
和,阴离子只有。则若不过量: ;
若过量: 。
2.硝酸与非金属的反应
(1)加热时,稀硝酸与非金属单质(如C等)不发生反应。
(2)加热时,浓硝酸与非金属单质(如C等)发生反应,生成 、
非金属的氧化物(或相应含氧酸)。
例如, 。
【知识迁移应用】
例1 [2024·浙江绍兴期中] 一定温度下,探究铜与稀HNO3反应,过程如图
所示,下列说法错误的是 ( )
A.过程Ⅰ中生成无色气体的离子方程式为
3Cu+2N+8H+ = 3Cu2++2NO↑+4H2O
B.过程Ⅱ中无色气体变为红棕色的反应为2NO+O2 = 2NO2
C.由实验推测,②振荡时可能发生反应:4NO2+O2+2H2O = 4HNO3
D.当活塞不再移动时,再抽入空气,铜不能再继续溶解
√
[解析] 过程Ⅰ中,铜和稀硝酸反应生成硝酸铜、NO和水,离子方程式为
3Cu+2N+8H+ = 3Cu2++2NO↑+4H2O,A正确;
过程Ⅱ抽入空气,无色气体变为红棕色,发生反应:2NO+O2 = 2NO2,
②振荡时,NO2、O2可与H2O反应:4NO2+O2+2H2O 4HNO3,B、C正确;
当活塞不再移动时,再抽入空气,NO与氧气、水反应生成硝酸,因此铜
可以继续溶解,D错误。
例2 [2024·江苏苏州期中] 将38.4 g铜与150 mL一定浓度的硝酸反应,
铜完全溶解,产生的NO和NO2混合气体折算为标准状况下的体积为
11.2 L,若铜与硝酸刚好反应完全,则原硝酸溶液中HNO3的物质的量
是 ( )
A.1.7 mol B.2.0 mol C.3.0 mol D.1.5 mol
√
[解析] 依次发生反应为Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O、
3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+4H2O;38.4 g Cu的物质的量为
=0.6 mol,混合气体的物质的量为=0.5 mol。
铜与硝酸刚好反应完全,生成硝酸铜、NO和NO2,由N原子守恒可知:
n(HNO3)=2n[Cu(NO3)2]+n(NO)+n(NO2)=2×0.6 mol+0.5 mol=1.7 mol。
[方法技巧] 硝酸与金属反应计算问题的思维模板
学习任务二 酸雨及防治
【新知自主预习】
1.酸雨
2.与 的主要来源、危害和防治
① :主要来源于__________和某些含硫金属矿物的燃烧或冶炼;
② :主要来自__________
煤、石油
汽车尾气
(1)来源
①调整能源结构,发展______能源;
②研究煤的脱硫技术、改进燃烧技术、减少二氧化硫和氮氧化物的排放;
③加强工厂废气的回收处理;
④改进汽车尾气的处理技术,控制尾气排放
清洁
(2)防治
【情境问题思考】
煤、石油和某些金属矿物中含有
硫,在燃烧或冶炼时常会产生 。
在机动车发动机中,燃料燃烧产生的
高温条件会使空气中的与 反应,
生成氮氧化物。它们会污染环境,危
害人体健康。
问题一: 排放到大气中的 是如何转化成硫酸型酸雨的?请结合
化学方程式描述其转化路径。
提示:排放到空气中的 在氧气和水蒸气的共同作用下形成酸雾,
随雨水降落成为硫酸型酸雨。
、 ;
、 。
问题二: 排放到大气中的氮氧化物是如何转化成硝酸型酸雨的?请
结合化学方程式描述其转化路径。
提示:排放到空气中的氮氧化物,与反应生成, 与空
气中的水蒸气反应生成 ,随雨水降落成为硝酸型酸雨。
、 。
【知识迁移应用】
例3 如图为某城市某日空气质量报告,下
列叙述与报告内容不相符的是 ( )
A.该日空气首要污染物是
B.该市空气质量等级属于重度污染
C.污染物 可能主要来源于机动车尾气
D.、 均可导致酸雨
√
[解析] 由图中信息可知,该日空气首要污染物是 ,A正确;
由图中信息可知,空气质量等级属于重度污染,B正确;
空气中的 和在机动车发动机内高温下反应生成,与反应
生成 ,C正确;
、均能导致酸雨, 不能引起酸雨,D错误。
[归纳总结]
(1)常见的污染类型
①光化学烟雾: 在紫外线作用下,与碳氢化合物发生一系列光化学
反应,产生的一种有毒的烟雾。
②酸雨:和排入大气中后,发生反应生成和 等,随雨
水降到地面。
③破坏臭氧层: 等可使平流层中的臭氧减少,导致地面紫外线辐射
量增加。
(2)常见的 尾气处理方法
①碱液吸收法
、 的混合气体能被足量烧碱溶液完全吸收的条件是
。一般适合工业尾气中 的处理。
②催化转化:在催化剂、加热条件下,氨可将氮氧化物转化为无毒气
体或与在一定温度下催化转化为无毒气体和 ,一
般适用于汽车尾气的处理。
1.[2024·浙江宁波十校联考]酸雨对环境危害巨大,下列关于酸雨及防
治的说法正确的是( )
A.酸雨的 等于5.6
B.酸雨能直接损伤农作物,使土壤酸化,加速建筑腐蚀
C. 是形成酸雨的主要原因
D.将含硫的煤和石灰石混合后燃烧,可以减少酸雨的形成以及温室
气体的排放
√
[解析] 正常雨水由于溶解二氧化碳,约为,酸雨是指
的雨水,A错误;
酸雨能直接损伤农作物,破坏森林,使土壤酸化,
加速建筑物的腐蚀,B正确;
二氧化硫和氮氧化物是形成酸雨的主要原因,C错误;
将含硫的煤和石灰石混合后燃烧生成难分解的硫酸钙,
可以减少酸雨的形成,但不能减少温室气体的排放,D错误。
2.下列反应中,硝酸既表现酸性,又表现氧化性的是( )
A.跟稀硝酸反应 B. 跟稀硝酸反应
C.跟稀硝酸反应 D. 跟稀硝酸反应
[解析] 、与稀硝酸发生复分解反应,A、C错误;
跟稀硝酸发生中和反应,属于非氧化还原反应,D错误;
具有较强还原性,与稀硝酸发生氧化还原反应,生成
、 和,体现 的酸性和氧化性,B正确。
√
3.下列有关硝酸化学性质的叙述正确的是( )
A.稀硝酸使红色石蕊试纸变蓝
B.硝酸能与反应,但不生成
C.硝酸可与反应制得 气体
D.浓硝酸因分解放出的 又溶解于硝酸而呈黄色
[解析] 稀硝酸显酸性,不可能使红色石蕊试纸变蓝,故A错误;
发生复分解反应,可以生成,故B错误;
有强氧化性,可以氧化气体,不能用于制取,故C错误;
呈红棕色,浓硝酸因分解放出的 又溶解于硝酸而呈黄色,故D
正确。
√
4.下列关于硝酸的说法正确的是 ( )
A.NO2溶于水生成硝酸,所以NO2是酸性氧化物
B.冷的稀硝酸可以保存在铝、铁的容器中
C.浓硝酸久置溶液会变黄是因为硝酸分解产生NO2
D.硝酸与铜的反应中,硝酸只表现氧化性
√
[解析] 二氧化氮与水反应生成硝酸和一氧化氮,但二氧化氮和硝酸中氮
元素的化合价不相等,故二氧化氮不是酸性氧化物,A错误;
稀硝酸具有强氧化性,能与活泼金属铝、铁反应,所以冷的稀硝酸不能
保存在铝、铁的容器中,B错误;
浓硝酸具有不稳定性,受热或见光易分解生成二氧化氮、氧气和水,分
解生成的二氧化氮溶于浓硝酸会使溶液变为黄色,C正确;
铜与硝酸反应时,氮元素的化合价部分未变生成硝酸铜,部分降低被还
原,硝酸表现酸性和强氧化性,D错误。
5.如图甲是验证铜和浓硝酸反应的装置,乙、丙是师生对实验改进后
的装置:
(1)写出甲、乙、丙三个装置中都发生的反应的化学方程式:
_____________________________________________。
(2)和甲装置相比,乙装置的优点:
①________________________;
②________________________。
可控制反应的发生和停止
可吸收,防止污染环境
(3)为了进一步验证 和水的反应,某学生设计了丙装置。实验
时先关闭止水夹__,再打开止水夹______,才能使 气体充满B试
管;当气体充满B试管后,将铜丝提起与溶液脱离。欲使烧杯中的水
进入B试管,应如何操作?____________________________________
____。
、
先关闭,再关闭,然后打开,用手捂住试管B
[解析] 利用对比的方法,找出装置的优缺点,应注意 有毒,要进行尾
气吸收。丙中要使气体充满试管B,应先关闭止水夹,再打开、 ,
充满试管B后,把铜丝拉起,然后关闭,再关闭后打开 ,用手捂住
试管B,使气体受热膨胀,与水接触, 极易与水反应,使系统内压强减
小,烧杯中的水便进入试管B。
1.常温下,下列溶液可用铁质容器盛装的是( )
A.稀硝酸 B.稀硫酸 C.浓硝酸 D.浓盐酸
[解析] 常温下,稀硝酸、稀硫酸、浓盐酸均与铁发生反应,故不能
用铁质容器盛装,A、B、D均错误;
常温下,浓硝酸能使铁钝化,表面生成致密氧化膜,保护内层铁不
被腐蚀,因此能用铁质容器盛装,C正确。
√
2.[2024·安徽蚌埠期末]足量铜与一定量浓硝酸反应,得到硝酸铜溶
液和、、的混合气体,将这些气体与
(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。
若向所得硝酸铜溶液中加入溶液至 恰好完全沉
淀,则消耗 溶液的体积是( )
A. B. C. D.
√
[解析] 标准状况 的物质的量
,混合气体与 、水反应又得到
,根据得失电子守恒,原子失去的电子等于 获得的电子,
所得硝酸铜溶液中加入溶液至恰好完全沉淀生成 ,
由电荷守恒,
,由于
溶液的浓度是,故需该 溶液的体积
。
3.某研究性学习小组的同学通过查阅资料知, 可与炽热的铜粉发
生反应,他们设计如下装置(夹持装置略去)进行实验验证。
已知:能被酸性高锰酸钾溶液氧化生成 。
请回答下列问题:
(1)实验开始前,检查装置气密性的方法是关闭、 ,将导管末
端置于盛水的水槽中,_______________________________________
___________________________________________________________
____,则表明装置气密性良好;装置A中发生反应的离子方程式为
_________________________________________。
用酒精灯微热三颈烧瓶,水槽中有气泡产生,撤去酒精灯后导管中有一段倒吸的水柱,且一段时间内水柱高度不变
[解析] 检查装置气密性,关闭、 ,将导管末端置于盛水的水槽
中,用酒精灯微热三颈烧瓶,水槽中有气泡产生,撤去酒精灯后导
管中有一段倒吸的水柱,且一段时间内水柱高度不变,证明装置气
密性良好;装置A中 与浓硝酸发生反应的离子方程式为
。
(2)装置B的作用是________________。
将转化为
[解析] 实验的目的是探究与 发生反应,即装置B发生的反应是
,装置B的作用是将转化成 。
(3)装置A中反应开始前,需要先打开 ,向装置中通入一段时间
的或 ,其目的是_______________________________________
___________。
排尽装置内的空气,防止及被空气中的氧气氧化
[解析] 因为能与发生反应生成,加热状态下与 反应生
成,因此反应开始前通入一段时间的或 ,目的是排尽装置
中的空气,防止与、 发生反应。
(4)实验过程中,装置D中铜粉变黑,装置 中溶液颜色变浅,则
装置 中发生反应的离子方程式为
____________________________________________。
请设计一种简单的实验方案,证明该离子反应中的氧化产物为
_____________________________________________________
_________________________________________________________
(写出主要的操作过程、现象、结论)。
取适量中溶液于试管中,加入稀硫酸后再加入铜片,若试管口有红棕色气体生成,则说明有生成,否则没有生成
[解析] D中铜粉变黑,说明铜与发生反应,生成和 ,根据
信息能与酸性高锰酸钾溶液发生反应,即装置 的目的是除去未
反应的 ,则离子方程式为
。 在酸性条件
下具有强氧化性,证明存在的方法是取适量 中溶液于试管中,
加入稀硫酸后再加入铜片,若试管口有红棕色气体生成,则说明有
生成,否则没
有 生成。
(5)从绿色化学角度考虑,实验结束后,拆卸装置前,还应进行的
一项操作是____________________________________。
打开,向装置内通入一段时间的氮气
[解析] 反应停止后,装置中还有未反应的, 有毒,必须除去,
实验结束后,拆卸装置前,应打开 ,向装置内通入一段时间的氮
气,让 全部被酸性高锰酸钾溶液吸收。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
