广西壮族自治区柳州2024-2025学年高二上学期12月月考 化学试题(含答案)
文档属性
| 名称 | 广西壮族自治区柳州2024-2025学年高二上学期12月月考 化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-15 16:54:45 | ||
图片预览



文档简介
柳州2024-2025学年第一学期高二年级12月月考
化学科试卷
可能用到的相对原子质量:H-1C-12N-14O-16Mg-24S-32Cl-35.5
考试时间:75分钟满分:100分
第I卷(选择题,共42分)
一、单项选择题(本大题共14小题,每小题3分,共42分)
1.代表阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,含有的原子数为
B.中含有非极性共价键的数目为
C.的溶液中,的数目小于
D.加热条件下,与足量的充分反应,转移的电子数目为
2.下列离子方程式书写正确的是( )
A.硝酸铁溶液中加入少量氢碘酸:
B.向溶液中加入过量氨水:
C.的水溶液显碱性:
D.向溶液中加入过量溶液:
3.下列说法正确的是( )
A.已知甲烷的燃烧热,则
B.已知(石墨,s)(金刚石,s),则金刚石比石墨稳定
C.已知、下,,则将和在此条件下充分反应,放出热量
D.已知稀溶液中,,相同条件下稀醋酸和稀氢氧化钠溶液反应生成液态水时的反应热为,则
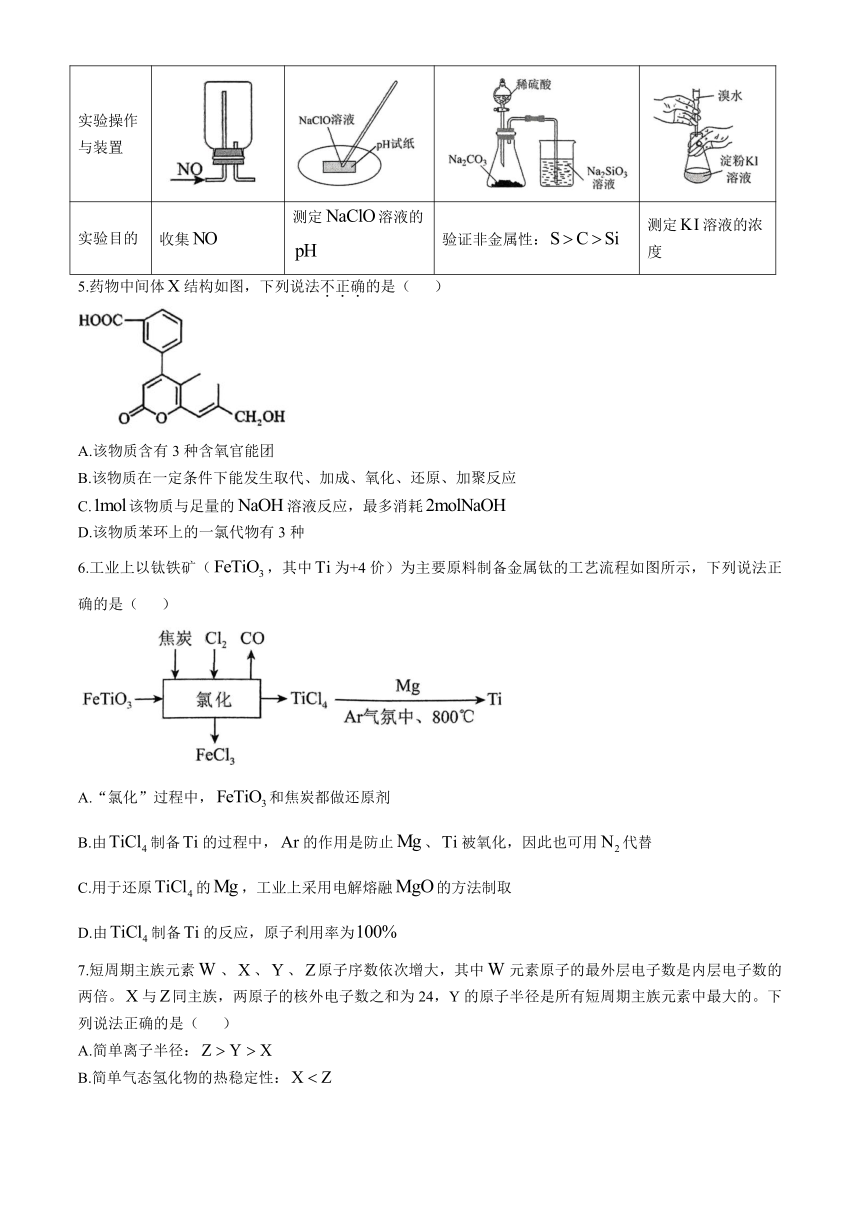
4.下列实验操作或装置能达到实验目的的是( )
A B C D
实验操作与装置
实验目的 收集 测定溶液的 验证非金属性: 测定溶液的浓度
5.药物中间体结构如图,下列说法不正确的是( )
A.该物质含有3种含氧官能团
B.该物质在一定条件下能发生取代、加成、氧化、还原、加聚反应
C.该物质与足量的溶液反应,最多消耗
D.该物质苯环上的一氯代物有3种
6.工业上以钛铁矿(,其中为+4价)为主要原料制备金属钛的工艺流程如图所示,下列说法正确的是( )
A.“氯化”过程中,和焦炭都做还原剂
B.由制备的过程中,的作用是防止、被氧化,因此也可用代替
C.用于还原的,工业上采用电解熔融的方法制取
D.由制备的反应,原子利用率为
7.短周期主族元素、、、原子序数依次增大,其中元素原子的最外层电子数是内层电子数的两倍。与同主族,两原子的核外电子数之和为24,Y的原子半径是所有短周期主族元素中最大的。下列说法正确的是( )
A.简单离子半径:
B.简单气态氢化物的热稳定性:
C.分子的空间结构为直线形
D.和中阴、阳离子的个数比相同,化学键类型完全相同
8.下列叙述正确的是( )
A.将水加热到时,变大,变大B
.某温度下,氨水加水稀释过程中,减小
C.向醋酸溶液中加醋酸钠固体,抑制醋酸电离,减小,导电能力增强
D.均为4的盐酸和两种溶液中,水的电离程度相同
9.下列实验方案可以达到实验目的的是( )
实验目的 实验方案
A 比较稀硝酸与浓硝酸氧化性的强弱 常温下将两块相同的铁片分别插入稀硝酸和浓硝酸中
B 检验丙烯醛中的碳碳双键 向丙烯醛中加入溴水
C 比较和的水解能力大小 相同温度下,分别测定溶液、溶液的
D 检验样品是否氧化变质 将样品溶于蒸馏水,滴加足量稀盐酸,再加入足量溶液
10.是医药工业和香料工业的重要中间体,合成路线如图所示。下列说法正确的是( )
A.X中所有原子不一定都共平面
B.属于取代反应,属于氧化反应
C.等物质的量的和,分别与足量的反应,消耗的物质的量相同
D.与完全加成后所得分子中存在手性碳原子
11.氨燃料电池是当前科研的一个热点,其工作原理如图所示(a、b均为惰性电极)。下列说法正确的是( )
A.电子由b极经导线流向a极
B.极的电极反应为
C.标准状况下,当有生成时,消耗
D.移向极,且极附近溶液碱性减弱
12.向某恒容密闭容器中充入和,发生反应,温度和压强对的平衡转化率的影响如图所示。下列说法正确的是( )
A.横坐标代表温度 B.平衡常数:
C.平均相对分子质量: D.该反应在任意温度下均可自发进行
13.下列说法正确的是( )
A.常温下,的硫酸和的溶液等体积混合后,得到的溶液呈中性
B.常温下,某溶液中由水电离出的,则该溶液的可能为12
C.常温下,相同的、、三种溶液中,溶质的物质的量浓度最大的是
D.酸碱滴定实验中,盛放标准液的滴定管水洗后未润洗,则待测液浓度测定结果偏低
14.水中氨氮含量超标会造成水体富营养化,可利用漂白粉的有效成分次氯酸钙除去氨氮,原理如图所示。下列说法不正确的是( )
A.每生成,转移电子
B.反应②中氧化剂与还原剂的物质的量之比为2:3
C.工业上用氯气与石灰乳制备漂白粉
D.除去氨氮的总反应方程式为
第II卷(非选择题,共58分)
二、填空题
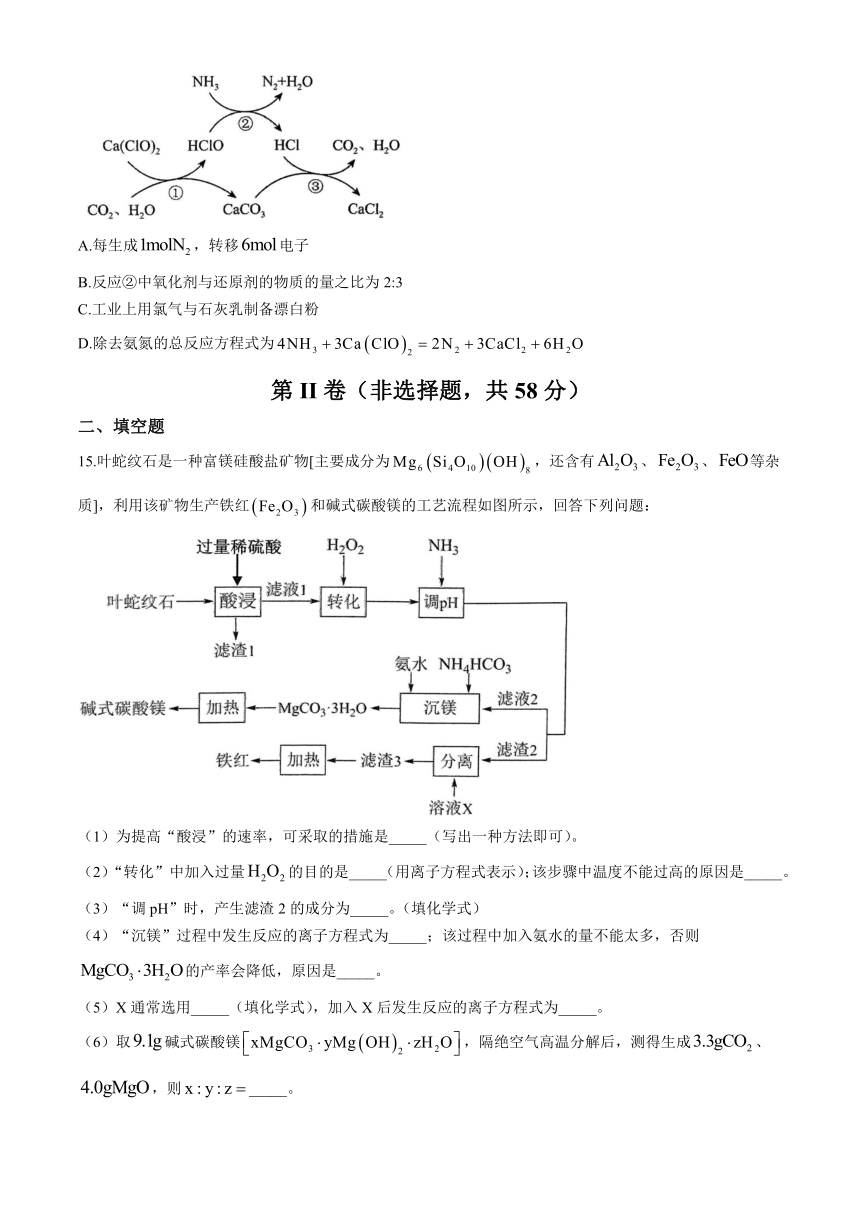
15.叶蛇纹石是一种富镁硅酸盐矿物[主要成分为,还含有、、等杂质],利用该矿物生产铁红和碱式碳酸镁的工艺流程如图所示,回答下列问题:
(1)为提高“酸浸”的速率,可采取的措施是_____(写出一种方法即可)。
(2)“转化”中加入过量的目的是_____(用离子方程式表示);该步骤中温度不能过高的原因是_____。
(3)“调pH”时,产生滤渣2的成分为_____。(填化学式)
(4)“沉镁”过程中发生反应的离子方程式为_____;该过程中加入氨水的量不能太多,否则的产率会降低,原因是_____。
(5)X通常选用_____(填化学式),加入X后发生反应的离子方程式为_____。
(6)取碱式碳酸镁,隔绝空气高温分解后,测得生成、,则_____。
16.无水在以上升华,遇潮湿空气极易潮解。实验室利用纯净干燥的氯气制备无水需要用到的实验仪器如下(装置不重复使用):
(1)仪器的连接顺序为_________________________。
(2)圆底烧瓶中发生反应的离子方程式为_____。
(3)与分液漏斗相连通的橡胶管的作用是_____。
(4)装置B中碱石灰的作用是_____。
(5)装置D与装置E之间通过粗玻璃导管而不是普通的细玻璃导管连接,其目的是_____。
(6)对反应后的固体产物进行探究
小明同学设计如下实验检验产物中的金属阳离子:取少量中的固体加入足量的蒸馏水溶解,取上层清液分别装入甲、乙两支试管中。请完成以下实验报告:
序号 实验操作 实验现象 实验结论
① 向甲试管中滴加少量的_____(填试剂名称) _____ 溶液中一定含有
② 向乙试管中滴加少量的酸性溶液 溶液紫红色褪去 溶液中一定含有
有关上述实验说法正确的是_____
A.固体产物一定含有
B.固体产物可能含有
C.实验②所得结论不正确
D.可用溶液代替酸性溶液检验溶液中是否存在
17.将转化为等燃料,可以有效的缓解能源危机,同时可以减少温室气体,实现“双碳目标”。
(1)由制备甲醇过程涉及反应如下:
反应I:
反应II:
反应III:
则_____(用、表示)。
(2)保持温度不变,在恒容密闭容器中充入和,只发生反应:。
测得和的浓度随时间变化如下图所示:
①从反应开始到平衡,用浓度变化表示化学反应速率为_____。
②达到平衡时,的体积分数为_____,容器内反应平衡与开始时的压强之比为_____。
③反应达到平衡后,往平衡体系中再加入、并达到新的平衡,与原平衡相比,的转化率_____(填“增大”“不变”或“减小”)。
④能判断该反应达到化学平衡状态的依据是_____。
A.容器压强不变 B.混合气体的密度不变
C. D.单位时间内消耗,同时消耗
⑤下列措施中能使平衡体系中增大且降低化学反应速率的是_____。
A.再充入 B.降低温度
C.将从体系中分离出去 D.充入,使体系压强增大
(3)不同压强下,按照投料,只发生反应III:。实验测定的平衡产率随温度的变化关系如图所示:
已知:的平衡产率
①压强、、由大到小的顺序为_____;
②一定压强下,的平衡产率随温度升高而下降的原因是_____。
18.化合物是一种香料,以烷烃和芳香族化合物为原料制备的一种合成路线如图所示:
已知:I.;
II.B的核磁共振氢谱只有一组峰
回答下列问题:
(1)A的结构简式为_____,F中所含官能团的名称为_____,用系统命名法对D命名_____。
(2)试剂为_____,由的反应类型为_____。
(3)反应的化学方程式为_____。
(4)写出一种同时满足下列条件的W的同分异构体的结构简式:_____。
①能发生水解反应,且水解产物之一能与溶液发生显色反应
②核磁共振氢谱中有4组峰,且峰面积之比为1:2:2:9
(5)参照上述合成路线和信息,以丙烯和甲醇为原料(无机试剂任选),设计制备丙酸甲酯的合成路线__________。
柳州2024-2025学年第一学期高二年级12月月考答案
1 2 3 4 5 6 7
B D D C D A C
8 9 10 11 12 13 14
C D A C C B B
15.(14分)(除特别标注外,其余每空2分)
(1)粉碎固体、适当增大稀硫酸浓度、适当加热、搅拌(1分)
(2)防止温度过高,易分解(1分)
(3)、
(4)会生成氢氧化镁沉淀,降低产率(1分)
(5)(1分)
(6)3:1:3
16.(14分)(除特别标注外,其余每空2分)
(1)j k d e h b c
(2)
(3)平衡气压,使浓盐酸顺利流下
(4)防止空气中的水蒸气进入中,影响的收集;吸收未反应的,防止污染环境
(5)防止凝华后堵塞导管
(6)硫氰化钾(溶液)(1分)溶液变红色(1分)BC
17.(15分)(除特别标注外,其余每空2分)
(1)(1分)
(2)① ②305:8 ③增大(1分) ④AD ⑤BC
(3)(1分)
该反应为放热反应,温度升高,平衡向吸热反应方向移动,即逆向移动,的平衡产率下降
18.(15分)(除特别标注外,其余每空2分)
(1)醛基(1分)2-甲基-1-丙烯
(2)的醇溶液(1分)消去反应(1分)
(3)
(4)或
(5)(4分,其他合理答案也给分)
化学科试卷
可能用到的相对原子质量:H-1C-12N-14O-16Mg-24S-32Cl-35.5
考试时间:75分钟满分:100分
第I卷(选择题,共42分)
一、单项选择题(本大题共14小题,每小题3分,共42分)
1.代表阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,含有的原子数为
B.中含有非极性共价键的数目为
C.的溶液中,的数目小于
D.加热条件下,与足量的充分反应,转移的电子数目为
2.下列离子方程式书写正确的是( )
A.硝酸铁溶液中加入少量氢碘酸:
B.向溶液中加入过量氨水:
C.的水溶液显碱性:
D.向溶液中加入过量溶液:
3.下列说法正确的是( )
A.已知甲烷的燃烧热,则
B.已知(石墨,s)(金刚石,s),则金刚石比石墨稳定
C.已知、下,,则将和在此条件下充分反应,放出热量
D.已知稀溶液中,,相同条件下稀醋酸和稀氢氧化钠溶液反应生成液态水时的反应热为,则
4.下列实验操作或装置能达到实验目的的是( )
A B C D
实验操作与装置
实验目的 收集 测定溶液的 验证非金属性: 测定溶液的浓度
5.药物中间体结构如图,下列说法不正确的是( )
A.该物质含有3种含氧官能团
B.该物质在一定条件下能发生取代、加成、氧化、还原、加聚反应
C.该物质与足量的溶液反应,最多消耗
D.该物质苯环上的一氯代物有3种
6.工业上以钛铁矿(,其中为+4价)为主要原料制备金属钛的工艺流程如图所示,下列说法正确的是( )
A.“氯化”过程中,和焦炭都做还原剂
B.由制备的过程中,的作用是防止、被氧化,因此也可用代替
C.用于还原的,工业上采用电解熔融的方法制取
D.由制备的反应,原子利用率为
7.短周期主族元素、、、原子序数依次增大,其中元素原子的最外层电子数是内层电子数的两倍。与同主族,两原子的核外电子数之和为24,Y的原子半径是所有短周期主族元素中最大的。下列说法正确的是( )
A.简单离子半径:
B.简单气态氢化物的热稳定性:
C.分子的空间结构为直线形
D.和中阴、阳离子的个数比相同,化学键类型完全相同
8.下列叙述正确的是( )
A.将水加热到时,变大,变大B
.某温度下,氨水加水稀释过程中,减小
C.向醋酸溶液中加醋酸钠固体,抑制醋酸电离,减小,导电能力增强
D.均为4的盐酸和两种溶液中,水的电离程度相同
9.下列实验方案可以达到实验目的的是( )
实验目的 实验方案
A 比较稀硝酸与浓硝酸氧化性的强弱 常温下将两块相同的铁片分别插入稀硝酸和浓硝酸中
B 检验丙烯醛中的碳碳双键 向丙烯醛中加入溴水
C 比较和的水解能力大小 相同温度下,分别测定溶液、溶液的
D 检验样品是否氧化变质 将样品溶于蒸馏水,滴加足量稀盐酸,再加入足量溶液
10.是医药工业和香料工业的重要中间体,合成路线如图所示。下列说法正确的是( )
A.X中所有原子不一定都共平面
B.属于取代反应,属于氧化反应
C.等物质的量的和,分别与足量的反应,消耗的物质的量相同
D.与完全加成后所得分子中存在手性碳原子
11.氨燃料电池是当前科研的一个热点,其工作原理如图所示(a、b均为惰性电极)。下列说法正确的是( )
A.电子由b极经导线流向a极
B.极的电极反应为
C.标准状况下,当有生成时,消耗
D.移向极,且极附近溶液碱性减弱
12.向某恒容密闭容器中充入和,发生反应,温度和压强对的平衡转化率的影响如图所示。下列说法正确的是( )
A.横坐标代表温度 B.平衡常数:
C.平均相对分子质量: D.该反应在任意温度下均可自发进行
13.下列说法正确的是( )
A.常温下,的硫酸和的溶液等体积混合后,得到的溶液呈中性
B.常温下,某溶液中由水电离出的,则该溶液的可能为12
C.常温下,相同的、、三种溶液中,溶质的物质的量浓度最大的是
D.酸碱滴定实验中,盛放标准液的滴定管水洗后未润洗,则待测液浓度测定结果偏低
14.水中氨氮含量超标会造成水体富营养化,可利用漂白粉的有效成分次氯酸钙除去氨氮,原理如图所示。下列说法不正确的是( )
A.每生成,转移电子
B.反应②中氧化剂与还原剂的物质的量之比为2:3
C.工业上用氯气与石灰乳制备漂白粉
D.除去氨氮的总反应方程式为
第II卷(非选择题,共58分)
二、填空题
15.叶蛇纹石是一种富镁硅酸盐矿物[主要成分为,还含有、、等杂质],利用该矿物生产铁红和碱式碳酸镁的工艺流程如图所示,回答下列问题:
(1)为提高“酸浸”的速率,可采取的措施是_____(写出一种方法即可)。
(2)“转化”中加入过量的目的是_____(用离子方程式表示);该步骤中温度不能过高的原因是_____。
(3)“调pH”时,产生滤渣2的成分为_____。(填化学式)
(4)“沉镁”过程中发生反应的离子方程式为_____;该过程中加入氨水的量不能太多,否则的产率会降低,原因是_____。
(5)X通常选用_____(填化学式),加入X后发生反应的离子方程式为_____。
(6)取碱式碳酸镁,隔绝空气高温分解后,测得生成、,则_____。
16.无水在以上升华,遇潮湿空气极易潮解。实验室利用纯净干燥的氯气制备无水需要用到的实验仪器如下(装置不重复使用):
(1)仪器的连接顺序为_________________________。
(2)圆底烧瓶中发生反应的离子方程式为_____。
(3)与分液漏斗相连通的橡胶管的作用是_____。
(4)装置B中碱石灰的作用是_____。
(5)装置D与装置E之间通过粗玻璃导管而不是普通的细玻璃导管连接,其目的是_____。
(6)对反应后的固体产物进行探究
小明同学设计如下实验检验产物中的金属阳离子:取少量中的固体加入足量的蒸馏水溶解,取上层清液分别装入甲、乙两支试管中。请完成以下实验报告:
序号 实验操作 实验现象 实验结论
① 向甲试管中滴加少量的_____(填试剂名称) _____ 溶液中一定含有
② 向乙试管中滴加少量的酸性溶液 溶液紫红色褪去 溶液中一定含有
有关上述实验说法正确的是_____
A.固体产物一定含有
B.固体产物可能含有
C.实验②所得结论不正确
D.可用溶液代替酸性溶液检验溶液中是否存在
17.将转化为等燃料,可以有效的缓解能源危机,同时可以减少温室气体,实现“双碳目标”。
(1)由制备甲醇过程涉及反应如下:
反应I:
反应II:
反应III:
则_____(用、表示)。
(2)保持温度不变,在恒容密闭容器中充入和,只发生反应:。
测得和的浓度随时间变化如下图所示:
①从反应开始到平衡,用浓度变化表示化学反应速率为_____。
②达到平衡时,的体积分数为_____,容器内反应平衡与开始时的压强之比为_____。
③反应达到平衡后,往平衡体系中再加入、并达到新的平衡,与原平衡相比,的转化率_____(填“增大”“不变”或“减小”)。
④能判断该反应达到化学平衡状态的依据是_____。
A.容器压强不变 B.混合气体的密度不变
C. D.单位时间内消耗,同时消耗
⑤下列措施中能使平衡体系中增大且降低化学反应速率的是_____。
A.再充入 B.降低温度
C.将从体系中分离出去 D.充入,使体系压强增大
(3)不同压强下,按照投料,只发生反应III:。实验测定的平衡产率随温度的变化关系如图所示:
已知:的平衡产率
①压强、、由大到小的顺序为_____;
②一定压强下,的平衡产率随温度升高而下降的原因是_____。
18.化合物是一种香料,以烷烃和芳香族化合物为原料制备的一种合成路线如图所示:
已知:I.;
II.B的核磁共振氢谱只有一组峰
回答下列问题:
(1)A的结构简式为_____,F中所含官能团的名称为_____,用系统命名法对D命名_____。
(2)试剂为_____,由的反应类型为_____。
(3)反应的化学方程式为_____。
(4)写出一种同时满足下列条件的W的同分异构体的结构简式:_____。
①能发生水解反应,且水解产物之一能与溶液发生显色反应
②核磁共振氢谱中有4组峰,且峰面积之比为1:2:2:9
(5)参照上述合成路线和信息,以丙烯和甲醇为原料(无机试剂任选),设计制备丙酸甲酯的合成路线__________。
柳州2024-2025学年第一学期高二年级12月月考答案
1 2 3 4 5 6 7
B D D C D A C
8 9 10 11 12 13 14
C D A C C B B
15.(14分)(除特别标注外,其余每空2分)
(1)粉碎固体、适当增大稀硫酸浓度、适当加热、搅拌(1分)
(2)防止温度过高,易分解(1分)
(3)、
(4)会生成氢氧化镁沉淀,降低产率(1分)
(5)(1分)
(6)3:1:3
16.(14分)(除特别标注外,其余每空2分)
(1)j k d e h b c
(2)
(3)平衡气压,使浓盐酸顺利流下
(4)防止空气中的水蒸气进入中,影响的收集;吸收未反应的,防止污染环境
(5)防止凝华后堵塞导管
(6)硫氰化钾(溶液)(1分)溶液变红色(1分)BC
17.(15分)(除特别标注外,其余每空2分)
(1)(1分)
(2)① ②305:8 ③增大(1分) ④AD ⑤BC
(3)(1分)
该反应为放热反应,温度升高,平衡向吸热反应方向移动,即逆向移动,的平衡产率下降
18.(15分)(除特别标注外,其余每空2分)
(1)醛基(1分)2-甲基-1-丙烯
(2)的醇溶液(1分)消去反应(1分)
(3)
(4)或
(5)(4分,其他合理答案也给分)
同课章节目录
