2024-2025学年高一化学苏教版(2019)上学期期末教学质量模拟检测(三)(含解析)
文档属性
| 名称 | 2024-2025学年高一化学苏教版(2019)上学期期末教学质量模拟检测(三)(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-15 18:48:18 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2024-2025学年高一化学苏教版(2019)上学期期末教学质量模拟检测(三)(含解析)
注意事项:
1.答题前,考生先将自己的姓名准考证号码填写清楚,将条形码准确粘贴在考生信息条形码粘贴区。
2.选择题必须使用2B铅笔填涂;非选择题必须使用0.5毫米黑色字迹的签字笔书写,字体工整、笔迹清楚。
3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试卷上答题无效。
4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。
5.保持卡面清洁,不要折叠,不要弄破、异皱,不准使用涂改液、修正带、刮纸刀。
可能用到的相对原子质量:
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项符合题目要求。
1.下列属于含非极性键的非极性分子的是( )
A. B. C. D.
2.短周期主族元素W、X、Y、Z、Q原子序数依次增大,形成的化合物是一种重要的食品添加剂,结构如下图。Z核外最外层电子数与X核外电子总数相等。W的原子半径在周期表中最小。下列有关叙述正确的是( )
A.原子半径大小:Y>Z>Q
B.该化合物中Y原子不满足8电子稳定结构
C.该化合物中,W、X、Y、Z、Q之间均为共价键
D.Q元素对应的单质能与水反应,也能与甲醇反应
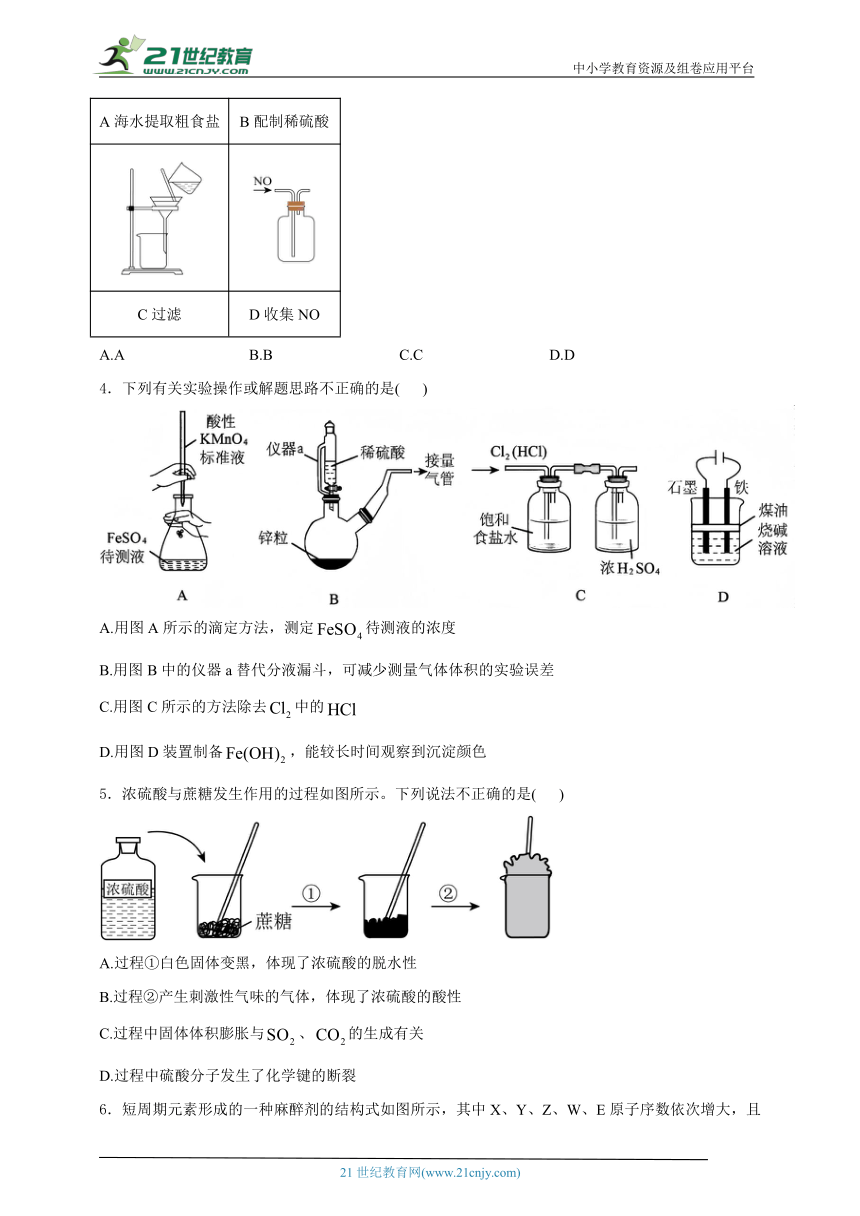
3.下列实验中,实验仪器使用正确且操作规范的是( )
A海水提取粗食盐 B配制稀硫酸
C过滤 D收集NO
A.A B.B C.C D.D
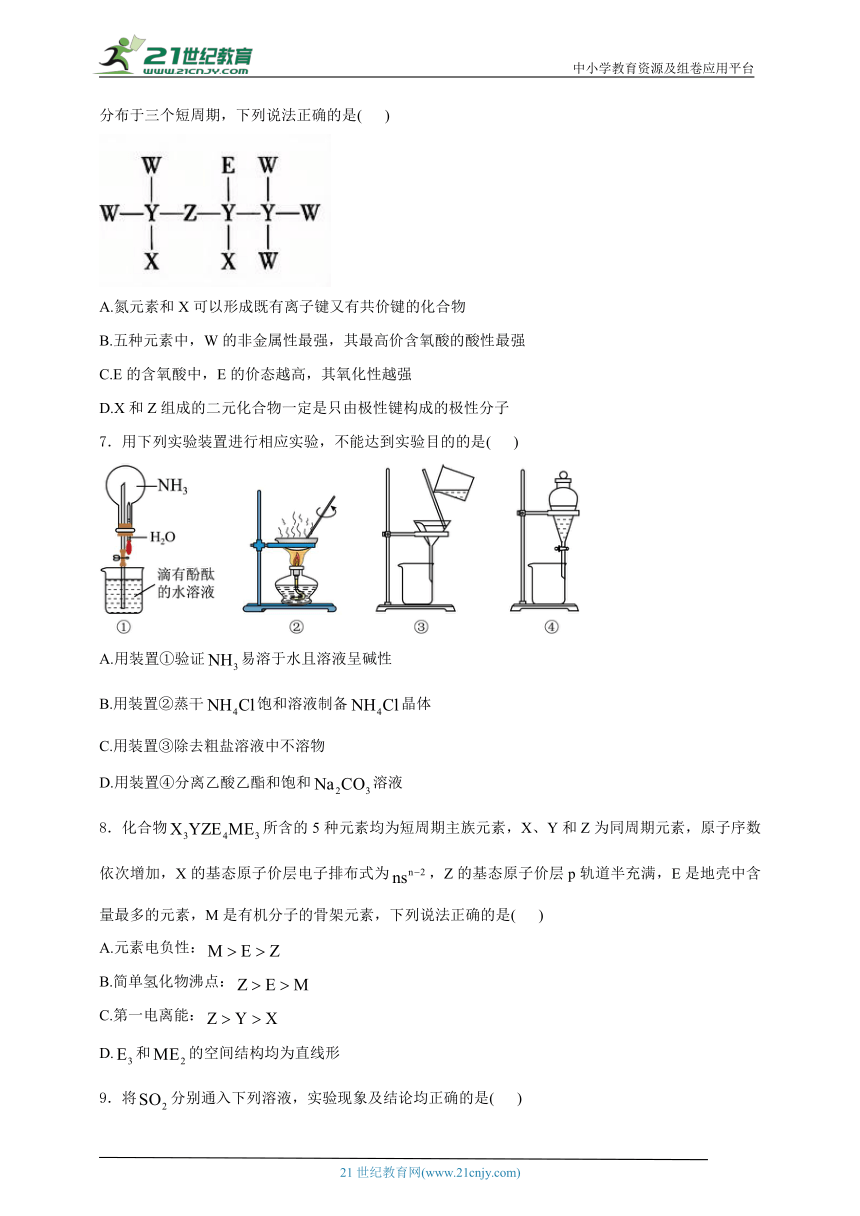
4.下列有关实验操作或解题思路不正确的是( )
A.用图A所示的滴定方法,测定待测液的浓度
B.用图B中的仪器a替代分液漏斗,可减少测量气体体积的实验误差
C.用图C所示的方法除去中的
D.用图D装置制备,能较长时间观察到沉淀颜色
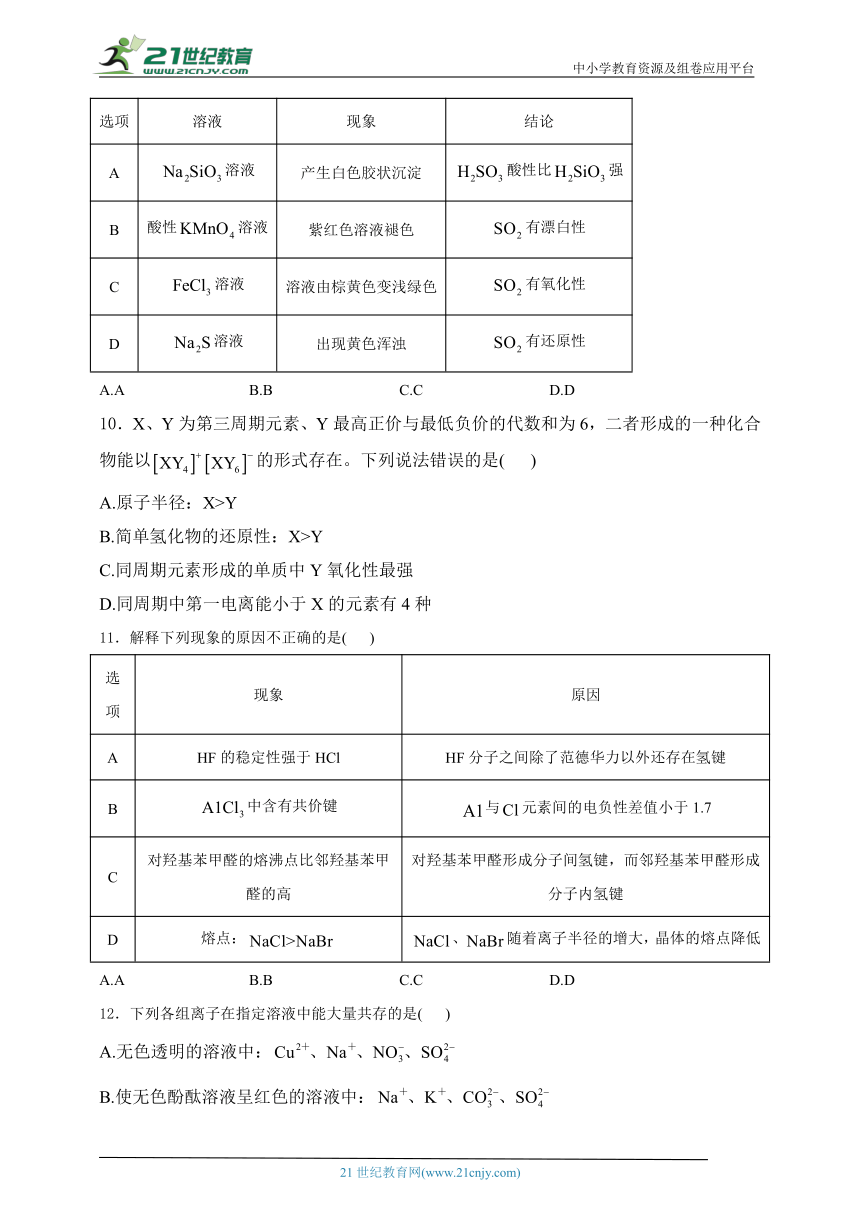
5.浓硫酸与蔗糖发生作用的过程如图所示。下列说法不正确的是( )
A.过程①白色固体变黑,体现了浓硫酸的脱水性
B.过程②产生刺激性气味的气体,体现了浓硫酸的酸性
C.过程中固体体积膨胀与、的生成有关
D.过程中硫酸分子发生了化学键的断裂
6.短周期元素形成的一种麻醉剂的结构式如图所示,其中X、Y、Z、W、E原子序数依次增大,且分布于三个短周期,下列说法正确的是( )
A.氮元素和X可以形成既有离子键又有共价键的化合物
B.五种元素中,W的非金属性最强,其最高价含氧酸的酸性最强
C.E的含氧酸中,E的价态越高,其氧化性越强
D.X和Z组成的二元化合物一定是只由极性键构成的极性分子
7.用下列实验装置进行相应实验,不能达到实验目的的是( )
A.用装置①验证易溶于水且溶液呈碱性
B.用装置②蒸干饱和溶液制备晶体
C.用装置③除去粗盐溶液中不溶物
D.用装置④分离乙酸乙酯和饱和溶液
8.化合物所含的5种元素均为短周期主族元素,X、Y和Z为同周期元素,原子序数依次增加,X的基态原子价层电子排布式为,Z的基态原子价层p轨道半充满,E是地壳中含量最多的元素,M是有机分子的骨架元素,下列说法正确的是( )
A.元素电负性:
B.简单氢化物沸点:
C.第一电离能:
D.和的空间结构均为直线形
9.将分别通入下列溶液,实验现象及结论均正确的是( )
选项 溶液 现象 结论
A 溶液 产生白色胶状沉淀 酸性比强
B 酸性溶液 紫红色溶液褪色 有漂白性
C 溶液 溶液由棕黄色变浅绿色 有氧化性
D 溶液 出现黄色浑浊 有还原性
A.A B.B C.C D.D
10.X、Y为第三周期元素、Y最高正价与最低负价的代数和为6,二者形成的一种化合物能以的形式存在。下列说法错误的是( )
A.原子半径:X>Y
B.简单氢化物的还原性:X>Y
C.同周期元素形成的单质中Y氧化性最强
D.同周期中第一电离能小于X的元素有4种
11.解释下列现象的原因不正确的是( )
选项 现象 原因
A HF的稳定性强于HCl HF分子之间除了范德华力以外还存在氢键
B 中含有共价键 与元素间的电负性差值小于1.7
C 对羟基苯甲醛的熔沸点比邻羟基苯甲醛的高 对羟基苯甲醛形成分子间氢键,而邻羟基苯甲醛形成分子内氢键
D 熔点: 、随着离子半径的增大,晶体的熔点降低
A.A B.B C.C D.D
12.下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:
B.使无色酚酞溶液呈红色的溶液中:
C.使紫色石蕊溶液呈红色的溶液中:
D.含有大量的溶液中:
13.某短周期元素的价—类二维图如图所示,下列说法正确的是( )
A.a可以用g的浓溶液干燥 B.c可以使石蕊溶液先变红后褪色
C.b易溶于 D.e、h一定均能促进水的电离
14.下列各组离子中,在给定的环境中一定能大量共存的是( )
A.能使甲基橙变红的溶液:
B.常温下,由水电离的的溶液中:
C.在水溶液中:
D.在漂白液中:
二、非选择题:本题共4小题,共58分。
15.配制240mL0.50mol/L的NaOH溶液,回答下列问题:
(1)选择仪器:完成本实验所必需的仪器有托盘天平、药匙、量筒、烧杯、玻璃棒、_______、_______。
(2)计算、称量:需称量NaOH固体的质量为_______g。
(3)配制时,正确的操作顺序是_______(字母表示,每个操作只用一次)。
A.用少量水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(4)该实验中玻璃棒起到_______和引流作用。
(5)在配制过程中,下列操作会对溶液物质的量浓度造成怎样的影响?(选填“偏高”、“偏低”、“无影响”)
①定容时,加蒸馏水超过刻度线,又用胶头滴管吸出多余液体_______;
②配制前,容量瓶中含有少量蒸馏水_______;
③定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线_______;
④定容时,俯视刻度线_______。
16.钠是一种非常活泼、具有广泛应用的金属。回答下列问题:
(1)钠原子的结构示意图为___________,在化学反应中容易___________(填“得到”或“失去”)电子。
(2)钠的一种常见淡黄色氧化物,常用作呼吸面具的供氧剂。该物质与反应的化学反应方程式为___________。
(3)观察法也是学习化学的重要方法,金属钠放置在空气中观察到下列现象。
银白色固体变灰暗变白色出现液滴白色晶体
①反应Ⅰ后固体变灰暗,该固体的化学式为___________,将少量灰暗色固体投入溶液中,观察到的实验现象为___________。
②反应Ⅱ后得到的固体为NaOH,NaOH在水中的电离方程式为___________。
③反应Ⅳ,主要是液滴与空气中的___________(填名称)发生反应,下列属于白色晶体用途的是___________(填字母)。
A.制肥皂
B.造纸
C.烘焙蛋糕
D.用于治疗胃酸过多症
17.从化学键的角度解释石墨的熔点高于金刚石的原因__________。
18.亚氯酸钠()是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊法制备亚氯酸钠的流程如图:
(1)反应①的化学方程式为:,该反应的还原产物是___________(写化学式)。
(2)在□补充反应②另一种产物,并配平此离子方程式,然后用单线桥法解题思路此化学反应。___________
________ +_________+_________=________+________+________□
(3)中Cl的化合价为___________,在反应②中___________(填字母)。
A.只能作氧化剂
B.只能作还原剂
C.既能作氧化剂也能作还原剂
(4)实验室采用马蒂逊法制备的实验装置如图甲所示:
已知:①的熔点为-59℃,沸点为11℃,的沸点为150℃。
②当温度低于38℃时,饱和溶液中析出的晶体是;当温度在38~60℃时,析出;温度高于60℃时,分解。
C中将装置浸入冰水浴中的目的是___________。
参考答案
1.答案:A
解析:A.乙炔分子是含有碳碳非极性键的非极性分子,故A符合题意;
B.过氧化氢是含有极性键和非极性键的极性分子,故B不符合题意;
C.联氨是含有极性键和非极性键的极性分子,故C不符合题意;
D.三氧化硫是只含有极性键的非极性分子,故D不符合题意;
故选A。
2.答案:D
A.Y W为H、X为C、Y为N、Z为O、Q为Na,A.Y为N,Z为O,Q为Na,原子核外电子层数越多,原子半径越大,同周期元素从左到右原子半径减小,则原子半径:Q>Y>Z,故A错误;
B.该化合物中Y原子得到3个电子形成8电子稳定结构,故B错误;
C.该化合物中存在离子键和共价键,故C错误;
D.Q为Na,能与水、甲醇反应生成氢气,故D正确;
故选:D。
3.答案:C
解析:A.用蒸发结晶的方法将海水中的NaCl提取出来,应选用蒸发皿,不能用坩埚,A项错误;
B.配制稀硫酸时应该先将浓硫酸稀释再转移到容量瓶中定容,不能直接将浓硫酸倒入盛有水的容量瓶中,B项错误;
C.通过过滤操作可以分离固液混合物,过滤时遵循“一贴、二低、三靠”原则,C项正确;
D.NO难溶于水,易与空气中的氧气反应,所以不适用排空气法收集,应用排水法收集,D项错误;
答案选C。
4.答案:D
解析:A.高锰酸钾装在酸式滴定管中,装在锥形瓶中,用图A所示的滴定方法,测定待测液的浓度,故A正确;
B.用图B中的仪器a替代分液漏斗,避免溶液减少将空气的体积排出,因此可减少测量气体体积的实验误差,故B正确;
C.饱和食盐水吸收氯气中的氯化氢气体,再用浓硫酸干燥,因此用图C所示的方法除去中的,故C正确;
D.用图D装置制备,铁应该连接电源的正极,作阳极,故D错误。
综上所述,答案为D。
5.答案:B
解析:A.浓硫酸具有脱水性,能将有机物中的H原子和O原子按2:1的比例脱除,蔗糖中加入浓硫酸,白色固体变黑,体现浓硫酸的脱水性,A项正确;
B.浓硫酸作用下蔗糖脱水过程中释放大量热,此时发生反应,产生大量气体,使固体体积膨胀,该过程体现了浓硫酸的氧化性,B项错误;
C.蔗糖水过程中释放大量热,此时发生反应,过程中固体体积膨胀与、的生成有关,C项正确;
D.该过程中,硫酸分子发生化学反应,发生了化学键的断裂,D项正确;
故选B。
6.答案:A
解析:X、Y、Z、W、E原子序数依次增大,且分布于三个短周期,由题图可知,X、W、E形成1个共价键,Y形成4个共价键,Z形成2个共价键,则X、Y、Z、W、E分别为H、。氮元素和氢元素可形成,既含有离子键,又含有共价键,A项正确;W为F元素,F元素无对应含氧酸,B项错误;E为Cl元素,其含氧酸中氧化性最强的是HClO,C项错误;X和Z分别为H和O元素,可以形成和,是含有极性键和非极性键的极性分子,D项错误。
7.答案:B
解析:A.氨气极易溶于水,能与滴有酚酞的水溶液形成红色喷泉证明氨水呈碱性,则装置①能达到实验目的,故A不符合题意;
B.氯化铵固体受热分解生成氨气和氯化氢,则蒸干氯化铵饱和溶液不能制备氯化铵晶体,则装置②无法达到实验目的,故B符合题意;
C.用过滤的方法能除去粗盐溶液中不溶物,则装置③能达到实验目的,故C不符合题意;
D.乙酸乙酯不溶于水,用分液的方法能分离乙酸乙酯和饱和碳酸钠溶液,则装置④能达到实验目的,故D不符合题意;
故选B。
8.答案:C
解析:A.元素的非金属性越强,电负性越大,氧元素的非金属性强于碳元素,则氧元素的电负性大于碳元素,故A错误;
B.水分子能形成分子间氢键,磷化氢不能形成分子间氢键,则水分子的分子间作用力大于磷化氢,沸点高于磷化氢,故B错误;
C.同周期元素,从左到右第一电离能呈增大趋势,镁原子的3s轨道为稳定的全充满结构,元素的第一电离能大于相邻元素,则第一电离能由大到小的顺序为P>Mg>Na,故C正确;
D.二氧化硫分子中硫原子的价层电子对数为3、孤对电子对数为1,分子空间构型为V形,臭氧和二氧化硫的原子个数都为3、价电子数都为18,互为等电子体,等电子体具有相似的空间构型,所以臭氧分子的空间构型为V形,CO2为直线形,故D错误;
故选C。
9.答案:A
解析:A.溶液中通入,产生白色胶状沉淀是生成了,说明酸性比强,A正确;
B.酸性溶液能够氧化,导致溶液紫红色褪去,表现还原性,B错误;
C.使溶液由棕黄色变浅绿色是生成,表现氧化性,表现还原性,C错误;
D.溶液中通入,出现黄色浑浊是生成了,该反应中中硫元素由+4价降低为0价,被还原,表现氧化性,D错误;
答案选A。
10.答案:D
A.PA.P与Cl在同一周期,则P半径大,即X>Y,A项不符合题意;
B.两者对应的简单氢化物分别是和HCl,半径是,所以的失电子能力强,还原性强,即X>Y,B项不符合题意;
C.同周期元素从左往右,金属性减弱,非金属性增强,各元素对应的金属单质还原性减弱,非金属单质的氧化性增强,所以的氧化性最强,C项不符合题意;
D.同一周期,从左到右,第一电离能呈现增大的趋势,第VA族元素的第一电离能大于相邻元素的第一电离能;所以第三周期第一电离能从小到大依次为Na、Al、Mg、Si、S、P、Cl,所以有5种,D项符合题意;
故选D。
11.答案:A
解析:A.HF的稳定性强于HCl是因为F的非金属性大于Cl,故A项错误;
B.Al与C元素间的电负性差值小于1.7,故中含有共价键,故B项正确;
C.对羟基苯甲醛形成分子间氢键,而邻羟基苯甲醛形成分子内氢键,故对羟基苯甲醛的熔沸点比邻羟基苯甲醛的高,故C项正确;
D.NaCl、NaBr均为离子晶体,熔化时破坏的是离子键,离子半径的增大,晶体的熔点降低,则有:熔点:NaCl>NaBr,故D项正确。
故答案选A。
12.答案:B
解析:含有铜离子的溶液显蓝色,不能在无色溶液中大量存在,故A不符合题意;
使无色酚酞溶液呈红色的溶液显碱性,四种离子相互不反应,且不与氢氧根离子反应,可以大量共存,故B符合题意;
使紫色石蕊溶液呈红色的溶液显酸性,酸性溶液中碳酸氢根离子不能大量存在,故C不符合题意;
具有氧化性,具有还原性,能氧化,二者不能大量共存,故D不符合题意。
13.答案:C
解析:a为,g为,浓硫酸可以氧化,不能干燥,A错误;c为,溶于水生成亚硫酸,可以使石蕊溶液变红,但不能漂白石蕊溶液,B错误;b为S单质,属于非极性分子,易溶于非极性溶剂,C正确;h为硫酸盐,当h为正盐时,硫酸根离子不水解,h不一定能促进水的电离,当h为酸式盐时,电离抑制水的电离,D错误。
14.答案:D
解析:能使甲基橙变红的溶液中含有大量,不能与大量共存,A错误;常温下,由水电离的的溶液呈酸性或碱性,与不能大量共存,B错误;能发生反应:再与生成沉淀,题给离子无法大量共存,C错误;漂白液中含有,能和题给离子大量共存,D正确。
15.答案:(1)250mL容量瓶;胶头滴管
(2)5.0
(3)BCAFED
(4)搅拌、加速溶解
(5)偏低;无影响;偏低;偏高
解析:(1)完成配制的NaOH溶液实验所必需的仪器有托盘天平、药匙、量筒、烧杯、玻璃棒、250mL容量瓶、胶头滴管,故答案为:250mL容量瓶;胶头滴管;
(2)需称量NaOH固体的质量为:,故答案为:5.0;
(3)根据用固体配制一定物质的量浓度的溶液先后步骤可知,配制时,正确的操作顺序是:B.在盛有NaOH固体的烧杯中加入适量水溶解即溶解,C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中即转移,A.用少量水洗涤烧杯次,洗涤液均注入容量瓶,振荡即洗涤,F.继续往容量瓶内小心加水,直到液面接近刻度处,E.改用胶头滴管加水,使溶液凹面恰好与刻度相切即定容,D.将容量瓶盖紧,反复上下颠倒,摇匀,故答案为:BCAFED;
(4)该实验中玻璃棒起到有:溶解步骤中的加速溶解和转移、定容步骤中的引流的作用,故答案为:搅拌、加速溶解;
(5)①定容时,加蒸馏水超过刻度线,又用胶头滴管吸出多余液体,导致溶质的物质的量偏小,所配溶液浓度偏低,故答案为:偏低;
②由于洗涤、定容步骤中还需向容量瓶中加入蒸馏水,故配制前,容量瓶中含有少量蒸馏水对实验无影响,故答案为:无影响;
③定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线,将导致所配溶液体积偏大,所配溶液浓度偏低,故答案为:偏低;
④定容时,俯视刻度线导致所配溶液体积偏小,所配溶液浓度偏高,故答案为:偏高。
16.答案:(1);失去
(2)
(3);灰暗色固体溶解,溶液中有蓝色沉淀生成;;二氧化碳;AB
解析:(1)钠原子为11号元素原子,结构示意图为,最外层有1个电子,在化学反应中容易失去电子;
(2)钠的一种常见淡黄色氧化物,常用作呼吸面具的供氧剂,为过氧化钠,过氧化钠和二氧化碳生成碳酸钠和氧气,;
(3)①由解题思路可知,反应Ⅰ后固体变灰暗生成氧化钠,该固体的化学式为,将少量灰暗色固体投入溶液中,氧化钠和水生成氢氧化钠,氢氧化钠和硫酸铜生成氢氧化铜蓝色沉淀,观察到的实验现象为灰暗色固体溶解,溶液中有蓝色沉淀生成。
②反应Ⅱ后得到的固体为NaOH,NaOH在水中完全电离,电离方程式为。
③反应Ⅳ,主要是氢氧化钠与空气中的二氧化碳发生反应生成碳酸钠,碳酸钠可以用于A.制肥皂、B.造纸,用于烘焙糕点、治疗胃酸的碳酸氢钠;故选AB。
17.答案:石墨中碳原子均为杂化,未参与杂化的p轨道形成π键,使石墨中碳碳共价键比金刚石中碳碳共价键键长更短、键能更大
解析:石墨晶体中C原子采取sp2杂化,金刚石中碳原子采取sp3化,由图可知,石墨晶体中C—C键长比金刚石中C—C键长短,电子云之间重叠程度比金刚石中更大,键能大,熔点高。
18.答案:(1)
(2)
(3) +3;C
(4)增大的溶解度使其充分反应,防止温度过高使分解
解析:(1)反应①的化学方程式为:,是氧化剂,是还原剂,则该反应的还原产物是。
(2)由解题思路可知,反应在生成的同时,还有生成,则□对应的产物为,依据得失电子守恒的原则,的化学计量数分别为2、1,、的化学计量数分别为2、1,再利用质量守恒,便可配平的化学计量数。在反应中,中的O元素失电子,转移给中的Cl元素,转化电子数为。从而得出配平的离子方程式,然后用单线桥法解题思路此化学反应为:。
(3)中,Na显+1价,O显-2价,则Cl的化合价为+3,中O显-1价,反应②中既能作氧化剂也能作还原剂,故选C。
(4)实验室采用马蒂逊法制备,装置A用于制取,装置B用于收集,装置C中发生反应制取。
由于的热稳定性差,则C中将装置浸入冰水浴中的目的是:增大的溶解度使其充分反应,防止温度过高使分解。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
2024-2025学年高一化学苏教版(2019)上学期期末教学质量模拟检测(三)(含解析)
注意事项:
1.答题前,考生先将自己的姓名准考证号码填写清楚,将条形码准确粘贴在考生信息条形码粘贴区。
2.选择题必须使用2B铅笔填涂;非选择题必须使用0.5毫米黑色字迹的签字笔书写,字体工整、笔迹清楚。
3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试卷上答题无效。
4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。
5.保持卡面清洁,不要折叠,不要弄破、异皱,不准使用涂改液、修正带、刮纸刀。
可能用到的相对原子质量:
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项符合题目要求。
1.下列属于含非极性键的非极性分子的是( )
A. B. C. D.
2.短周期主族元素W、X、Y、Z、Q原子序数依次增大,形成的化合物是一种重要的食品添加剂,结构如下图。Z核外最外层电子数与X核外电子总数相等。W的原子半径在周期表中最小。下列有关叙述正确的是( )
A.原子半径大小:Y>Z>Q
B.该化合物中Y原子不满足8电子稳定结构
C.该化合物中,W、X、Y、Z、Q之间均为共价键
D.Q元素对应的单质能与水反应,也能与甲醇反应
3.下列实验中,实验仪器使用正确且操作规范的是( )
A海水提取粗食盐 B配制稀硫酸
C过滤 D收集NO
A.A B.B C.C D.D
4.下列有关实验操作或解题思路不正确的是( )
A.用图A所示的滴定方法,测定待测液的浓度
B.用图B中的仪器a替代分液漏斗,可减少测量气体体积的实验误差
C.用图C所示的方法除去中的
D.用图D装置制备,能较长时间观察到沉淀颜色
5.浓硫酸与蔗糖发生作用的过程如图所示。下列说法不正确的是( )
A.过程①白色固体变黑,体现了浓硫酸的脱水性
B.过程②产生刺激性气味的气体,体现了浓硫酸的酸性
C.过程中固体体积膨胀与、的生成有关
D.过程中硫酸分子发生了化学键的断裂
6.短周期元素形成的一种麻醉剂的结构式如图所示,其中X、Y、Z、W、E原子序数依次增大,且分布于三个短周期,下列说法正确的是( )
A.氮元素和X可以形成既有离子键又有共价键的化合物
B.五种元素中,W的非金属性最强,其最高价含氧酸的酸性最强
C.E的含氧酸中,E的价态越高,其氧化性越强
D.X和Z组成的二元化合物一定是只由极性键构成的极性分子
7.用下列实验装置进行相应实验,不能达到实验目的的是( )
A.用装置①验证易溶于水且溶液呈碱性
B.用装置②蒸干饱和溶液制备晶体
C.用装置③除去粗盐溶液中不溶物
D.用装置④分离乙酸乙酯和饱和溶液
8.化合物所含的5种元素均为短周期主族元素,X、Y和Z为同周期元素,原子序数依次增加,X的基态原子价层电子排布式为,Z的基态原子价层p轨道半充满,E是地壳中含量最多的元素,M是有机分子的骨架元素,下列说法正确的是( )
A.元素电负性:
B.简单氢化物沸点:
C.第一电离能:
D.和的空间结构均为直线形
9.将分别通入下列溶液,实验现象及结论均正确的是( )
选项 溶液 现象 结论
A 溶液 产生白色胶状沉淀 酸性比强
B 酸性溶液 紫红色溶液褪色 有漂白性
C 溶液 溶液由棕黄色变浅绿色 有氧化性
D 溶液 出现黄色浑浊 有还原性
A.A B.B C.C D.D
10.X、Y为第三周期元素、Y最高正价与最低负价的代数和为6,二者形成的一种化合物能以的形式存在。下列说法错误的是( )
A.原子半径:X>Y
B.简单氢化物的还原性:X>Y
C.同周期元素形成的单质中Y氧化性最强
D.同周期中第一电离能小于X的元素有4种
11.解释下列现象的原因不正确的是( )
选项 现象 原因
A HF的稳定性强于HCl HF分子之间除了范德华力以外还存在氢键
B 中含有共价键 与元素间的电负性差值小于1.7
C 对羟基苯甲醛的熔沸点比邻羟基苯甲醛的高 对羟基苯甲醛形成分子间氢键,而邻羟基苯甲醛形成分子内氢键
D 熔点: 、随着离子半径的增大,晶体的熔点降低
A.A B.B C.C D.D
12.下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:
B.使无色酚酞溶液呈红色的溶液中:
C.使紫色石蕊溶液呈红色的溶液中:
D.含有大量的溶液中:
13.某短周期元素的价—类二维图如图所示,下列说法正确的是( )
A.a可以用g的浓溶液干燥 B.c可以使石蕊溶液先变红后褪色
C.b易溶于 D.e、h一定均能促进水的电离
14.下列各组离子中,在给定的环境中一定能大量共存的是( )
A.能使甲基橙变红的溶液:
B.常温下,由水电离的的溶液中:
C.在水溶液中:
D.在漂白液中:
二、非选择题:本题共4小题,共58分。
15.配制240mL0.50mol/L的NaOH溶液,回答下列问题:
(1)选择仪器:完成本实验所必需的仪器有托盘天平、药匙、量筒、烧杯、玻璃棒、_______、_______。
(2)计算、称量:需称量NaOH固体的质量为_______g。
(3)配制时,正确的操作顺序是_______(字母表示,每个操作只用一次)。
A.用少量水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(4)该实验中玻璃棒起到_______和引流作用。
(5)在配制过程中,下列操作会对溶液物质的量浓度造成怎样的影响?(选填“偏高”、“偏低”、“无影响”)
①定容时,加蒸馏水超过刻度线,又用胶头滴管吸出多余液体_______;
②配制前,容量瓶中含有少量蒸馏水_______;
③定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线_______;
④定容时,俯视刻度线_______。
16.钠是一种非常活泼、具有广泛应用的金属。回答下列问题:
(1)钠原子的结构示意图为___________,在化学反应中容易___________(填“得到”或“失去”)电子。
(2)钠的一种常见淡黄色氧化物,常用作呼吸面具的供氧剂。该物质与反应的化学反应方程式为___________。
(3)观察法也是学习化学的重要方法,金属钠放置在空气中观察到下列现象。
银白色固体变灰暗变白色出现液滴白色晶体
①反应Ⅰ后固体变灰暗,该固体的化学式为___________,将少量灰暗色固体投入溶液中,观察到的实验现象为___________。
②反应Ⅱ后得到的固体为NaOH,NaOH在水中的电离方程式为___________。
③反应Ⅳ,主要是液滴与空气中的___________(填名称)发生反应,下列属于白色晶体用途的是___________(填字母)。
A.制肥皂
B.造纸
C.烘焙蛋糕
D.用于治疗胃酸过多症
17.从化学键的角度解释石墨的熔点高于金刚石的原因__________。
18.亚氯酸钠()是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊法制备亚氯酸钠的流程如图:
(1)反应①的化学方程式为:,该反应的还原产物是___________(写化学式)。
(2)在□补充反应②另一种产物,并配平此离子方程式,然后用单线桥法解题思路此化学反应。___________
________ +_________+_________=________+________+________□
(3)中Cl的化合价为___________,在反应②中___________(填字母)。
A.只能作氧化剂
B.只能作还原剂
C.既能作氧化剂也能作还原剂
(4)实验室采用马蒂逊法制备的实验装置如图甲所示:
已知:①的熔点为-59℃,沸点为11℃,的沸点为150℃。
②当温度低于38℃时,饱和溶液中析出的晶体是;当温度在38~60℃时,析出;温度高于60℃时,分解。
C中将装置浸入冰水浴中的目的是___________。
参考答案
1.答案:A
解析:A.乙炔分子是含有碳碳非极性键的非极性分子,故A符合题意;
B.过氧化氢是含有极性键和非极性键的极性分子,故B不符合题意;
C.联氨是含有极性键和非极性键的极性分子,故C不符合题意;
D.三氧化硫是只含有极性键的非极性分子,故D不符合题意;
故选A。
2.答案:D
A.Y W为H、X为C、Y为N、Z为O、Q为Na,A.Y为N,Z为O,Q为Na,原子核外电子层数越多,原子半径越大,同周期元素从左到右原子半径减小,则原子半径:Q>Y>Z,故A错误;
B.该化合物中Y原子得到3个电子形成8电子稳定结构,故B错误;
C.该化合物中存在离子键和共价键,故C错误;
D.Q为Na,能与水、甲醇反应生成氢气,故D正确;
故选:D。
3.答案:C
解析:A.用蒸发结晶的方法将海水中的NaCl提取出来,应选用蒸发皿,不能用坩埚,A项错误;
B.配制稀硫酸时应该先将浓硫酸稀释再转移到容量瓶中定容,不能直接将浓硫酸倒入盛有水的容量瓶中,B项错误;
C.通过过滤操作可以分离固液混合物,过滤时遵循“一贴、二低、三靠”原则,C项正确;
D.NO难溶于水,易与空气中的氧气反应,所以不适用排空气法收集,应用排水法收集,D项错误;
答案选C。
4.答案:D
解析:A.高锰酸钾装在酸式滴定管中,装在锥形瓶中,用图A所示的滴定方法,测定待测液的浓度,故A正确;
B.用图B中的仪器a替代分液漏斗,避免溶液减少将空气的体积排出,因此可减少测量气体体积的实验误差,故B正确;
C.饱和食盐水吸收氯气中的氯化氢气体,再用浓硫酸干燥,因此用图C所示的方法除去中的,故C正确;
D.用图D装置制备,铁应该连接电源的正极,作阳极,故D错误。
综上所述,答案为D。
5.答案:B
解析:A.浓硫酸具有脱水性,能将有机物中的H原子和O原子按2:1的比例脱除,蔗糖中加入浓硫酸,白色固体变黑,体现浓硫酸的脱水性,A项正确;
B.浓硫酸作用下蔗糖脱水过程中释放大量热,此时发生反应,产生大量气体,使固体体积膨胀,该过程体现了浓硫酸的氧化性,B项错误;
C.蔗糖水过程中释放大量热,此时发生反应,过程中固体体积膨胀与、的生成有关,C项正确;
D.该过程中,硫酸分子发生化学反应,发生了化学键的断裂,D项正确;
故选B。
6.答案:A
解析:X、Y、Z、W、E原子序数依次增大,且分布于三个短周期,由题图可知,X、W、E形成1个共价键,Y形成4个共价键,Z形成2个共价键,则X、Y、Z、W、E分别为H、。氮元素和氢元素可形成,既含有离子键,又含有共价键,A项正确;W为F元素,F元素无对应含氧酸,B项错误;E为Cl元素,其含氧酸中氧化性最强的是HClO,C项错误;X和Z分别为H和O元素,可以形成和,是含有极性键和非极性键的极性分子,D项错误。
7.答案:B
解析:A.氨气极易溶于水,能与滴有酚酞的水溶液形成红色喷泉证明氨水呈碱性,则装置①能达到实验目的,故A不符合题意;
B.氯化铵固体受热分解生成氨气和氯化氢,则蒸干氯化铵饱和溶液不能制备氯化铵晶体,则装置②无法达到实验目的,故B符合题意;
C.用过滤的方法能除去粗盐溶液中不溶物,则装置③能达到实验目的,故C不符合题意;
D.乙酸乙酯不溶于水,用分液的方法能分离乙酸乙酯和饱和碳酸钠溶液,则装置④能达到实验目的,故D不符合题意;
故选B。
8.答案:C
解析:A.元素的非金属性越强,电负性越大,氧元素的非金属性强于碳元素,则氧元素的电负性大于碳元素,故A错误;
B.水分子能形成分子间氢键,磷化氢不能形成分子间氢键,则水分子的分子间作用力大于磷化氢,沸点高于磷化氢,故B错误;
C.同周期元素,从左到右第一电离能呈增大趋势,镁原子的3s轨道为稳定的全充满结构,元素的第一电离能大于相邻元素,则第一电离能由大到小的顺序为P>Mg>Na,故C正确;
D.二氧化硫分子中硫原子的价层电子对数为3、孤对电子对数为1,分子空间构型为V形,臭氧和二氧化硫的原子个数都为3、价电子数都为18,互为等电子体,等电子体具有相似的空间构型,所以臭氧分子的空间构型为V形,CO2为直线形,故D错误;
故选C。
9.答案:A
解析:A.溶液中通入,产生白色胶状沉淀是生成了,说明酸性比强,A正确;
B.酸性溶液能够氧化,导致溶液紫红色褪去,表现还原性,B错误;
C.使溶液由棕黄色变浅绿色是生成,表现氧化性,表现还原性,C错误;
D.溶液中通入,出现黄色浑浊是生成了,该反应中中硫元素由+4价降低为0价,被还原,表现氧化性,D错误;
答案选A。
10.答案:D
A.PA.P与Cl在同一周期,则P半径大,即X>Y,A项不符合题意;
B.两者对应的简单氢化物分别是和HCl,半径是,所以的失电子能力强,还原性强,即X>Y,B项不符合题意;
C.同周期元素从左往右,金属性减弱,非金属性增强,各元素对应的金属单质还原性减弱,非金属单质的氧化性增强,所以的氧化性最强,C项不符合题意;
D.同一周期,从左到右,第一电离能呈现增大的趋势,第VA族元素的第一电离能大于相邻元素的第一电离能;所以第三周期第一电离能从小到大依次为Na、Al、Mg、Si、S、P、Cl,所以有5种,D项符合题意;
故选D。
11.答案:A
解析:A.HF的稳定性强于HCl是因为F的非金属性大于Cl,故A项错误;
B.Al与C元素间的电负性差值小于1.7,故中含有共价键,故B项正确;
C.对羟基苯甲醛形成分子间氢键,而邻羟基苯甲醛形成分子内氢键,故对羟基苯甲醛的熔沸点比邻羟基苯甲醛的高,故C项正确;
D.NaCl、NaBr均为离子晶体,熔化时破坏的是离子键,离子半径的增大,晶体的熔点降低,则有:熔点:NaCl>NaBr,故D项正确。
故答案选A。
12.答案:B
解析:含有铜离子的溶液显蓝色,不能在无色溶液中大量存在,故A不符合题意;
使无色酚酞溶液呈红色的溶液显碱性,四种离子相互不反应,且不与氢氧根离子反应,可以大量共存,故B符合题意;
使紫色石蕊溶液呈红色的溶液显酸性,酸性溶液中碳酸氢根离子不能大量存在,故C不符合题意;
具有氧化性,具有还原性,能氧化,二者不能大量共存,故D不符合题意。
13.答案:C
解析:a为,g为,浓硫酸可以氧化,不能干燥,A错误;c为,溶于水生成亚硫酸,可以使石蕊溶液变红,但不能漂白石蕊溶液,B错误;b为S单质,属于非极性分子,易溶于非极性溶剂,C正确;h为硫酸盐,当h为正盐时,硫酸根离子不水解,h不一定能促进水的电离,当h为酸式盐时,电离抑制水的电离,D错误。
14.答案:D
解析:能使甲基橙变红的溶液中含有大量,不能与大量共存,A错误;常温下,由水电离的的溶液呈酸性或碱性,与不能大量共存,B错误;能发生反应:再与生成沉淀,题给离子无法大量共存,C错误;漂白液中含有,能和题给离子大量共存,D正确。
15.答案:(1)250mL容量瓶;胶头滴管
(2)5.0
(3)BCAFED
(4)搅拌、加速溶解
(5)偏低;无影响;偏低;偏高
解析:(1)完成配制的NaOH溶液实验所必需的仪器有托盘天平、药匙、量筒、烧杯、玻璃棒、250mL容量瓶、胶头滴管,故答案为:250mL容量瓶;胶头滴管;
(2)需称量NaOH固体的质量为:,故答案为:5.0;
(3)根据用固体配制一定物质的量浓度的溶液先后步骤可知,配制时,正确的操作顺序是:B.在盛有NaOH固体的烧杯中加入适量水溶解即溶解,C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中即转移,A.用少量水洗涤烧杯次,洗涤液均注入容量瓶,振荡即洗涤,F.继续往容量瓶内小心加水,直到液面接近刻度处,E.改用胶头滴管加水,使溶液凹面恰好与刻度相切即定容,D.将容量瓶盖紧,反复上下颠倒,摇匀,故答案为:BCAFED;
(4)该实验中玻璃棒起到有:溶解步骤中的加速溶解和转移、定容步骤中的引流的作用,故答案为:搅拌、加速溶解;
(5)①定容时,加蒸馏水超过刻度线,又用胶头滴管吸出多余液体,导致溶质的物质的量偏小,所配溶液浓度偏低,故答案为:偏低;
②由于洗涤、定容步骤中还需向容量瓶中加入蒸馏水,故配制前,容量瓶中含有少量蒸馏水对实验无影响,故答案为:无影响;
③定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线,将导致所配溶液体积偏大,所配溶液浓度偏低,故答案为:偏低;
④定容时,俯视刻度线导致所配溶液体积偏小,所配溶液浓度偏高,故答案为:偏高。
16.答案:(1);失去
(2)
(3);灰暗色固体溶解,溶液中有蓝色沉淀生成;;二氧化碳;AB
解析:(1)钠原子为11号元素原子,结构示意图为,最外层有1个电子,在化学反应中容易失去电子;
(2)钠的一种常见淡黄色氧化物,常用作呼吸面具的供氧剂,为过氧化钠,过氧化钠和二氧化碳生成碳酸钠和氧气,;
(3)①由解题思路可知,反应Ⅰ后固体变灰暗生成氧化钠,该固体的化学式为,将少量灰暗色固体投入溶液中,氧化钠和水生成氢氧化钠,氢氧化钠和硫酸铜生成氢氧化铜蓝色沉淀,观察到的实验现象为灰暗色固体溶解,溶液中有蓝色沉淀生成。
②反应Ⅱ后得到的固体为NaOH,NaOH在水中完全电离,电离方程式为。
③反应Ⅳ,主要是氢氧化钠与空气中的二氧化碳发生反应生成碳酸钠,碳酸钠可以用于A.制肥皂、B.造纸,用于烘焙糕点、治疗胃酸的碳酸氢钠;故选AB。
17.答案:石墨中碳原子均为杂化,未参与杂化的p轨道形成π键,使石墨中碳碳共价键比金刚石中碳碳共价键键长更短、键能更大
解析:石墨晶体中C原子采取sp2杂化,金刚石中碳原子采取sp3化,由图可知,石墨晶体中C—C键长比金刚石中C—C键长短,电子云之间重叠程度比金刚石中更大,键能大,熔点高。
18.答案:(1)
(2)
(3) +3;C
(4)增大的溶解度使其充分反应,防止温度过高使分解
解析:(1)反应①的化学方程式为:,是氧化剂,是还原剂,则该反应的还原产物是。
(2)由解题思路可知,反应在生成的同时,还有生成,则□对应的产物为,依据得失电子守恒的原则,的化学计量数分别为2、1,、的化学计量数分别为2、1,再利用质量守恒,便可配平的化学计量数。在反应中,中的O元素失电子,转移给中的Cl元素,转化电子数为。从而得出配平的离子方程式,然后用单线桥法解题思路此化学反应为:。
(3)中,Na显+1价,O显-2价,则Cl的化合价为+3,中O显-1价,反应②中既能作氧化剂也能作还原剂,故选C。
(4)实验室采用马蒂逊法制备,装置A用于制取,装置B用于收集,装置C中发生反应制取。
由于的热稳定性差,则C中将装置浸入冰水浴中的目的是:增大的溶解度使其充分反应,防止温度过高使分解。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
