2024-2025学年高一化学苏教版(2019)上学期期末教学质量模拟检测(一)(含解析)
文档属性
| 名称 | 2024-2025学年高一化学苏教版(2019)上学期期末教学质量模拟检测(一)(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-15 18:48:40 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2024-2025学年高一化学苏教版(2019)上学期期末教学质量模拟检测(一)(含解析)
注意事项:
1.答题前,考生先将自己的姓名准考证号码填写清楚,将条形码准确粘贴在考生信息条形码粘贴区。
2.选择题必须使用2B铅笔填涂;非选择题必须使用0.5毫米黑色字迹的签字笔书写,字体工整、笔迹清楚。
3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试卷上答题无效。
4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。
5.保持卡面清洁,不要折叠,不要弄破、异皱,不准使用涂改液、修正带、刮纸刀。
可能用到的相对原子质量:
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项符合题目要求。
1.非物质文化遗产是古代劳动人民的智慧结晶。下列说法正确的是( )
A.蒸馏酒传统酿造技艺:利用乙醇和水的密度不同,蒸馏提高酒精度
B.斑铜制作技艺:在铜中掺杂金、银等金属,斑铜的熔点比纯铜高
C.桑 丝织技艺:忝丝的主要成分属于高分子化合物
D.桐油纸伞制作技艺:桐油(由桐树的果实压榨而得)的主要成分是烃
2.短周期主族元素W、X、Y、Z、Q原子序数依次增大,形成的化合物是一种重要的食品添加剂,结构如下图。Z核外最外层电子数与X核外电子总数相等。W的原子半径在周期表中最小。下列有关叙述正确的是( )
A.原子半径大小:Y>Z>Q
B.该化合物中Y原子不满足8电子稳定结构
C.该化合物中,W、X、Y、Z、Q之间均为共价键
D.Q元素对应的单质能与水反应,也能与甲醇反应
3.下列实验方案合理的是( )
A制取并收集乙酸乙酯 B制取并验证乙炔的性质 C利用氯气制备漂白液和氯酸钠,可在中间试管得到漂白液 D利用硫酸的酸性制备氯化氢,分液漏斗中溶液不能换成磷酸
A.A B.B C.C D.D
4.下列所用仪器或试剂,在涉及操作中的作用或性质前后相同的是( )
A.玻璃棒的作用:过滤;溶解
B.温度计的位置:乙醇浓硫酸共热制乙烯;分离乙醇和水的混合液
C.水体现的性质:分别与Na和反应生成气体
D.的性质:分别使溴水和高锰酸钾溶液褪色
5.下列各组离子在给定条件下能大量共存的是( )
A.澄清透明溶液中:
B.有存在的溶液中:
C.使石蕊变红的溶液中:
D.使酚酞溶液变红的溶液中:
6.元素周期表是指导化学学习的工具,下列说法正确的是( )
A.ⅠA族元素全部金属元素,称为碱金属元素
B.元素周期表纵向看,由16个纵列构成,共16个族
C.元素周期表中元素种类最多的族是第ⅢB族
D.原子最外层有2个电子的元素都在ⅡA族
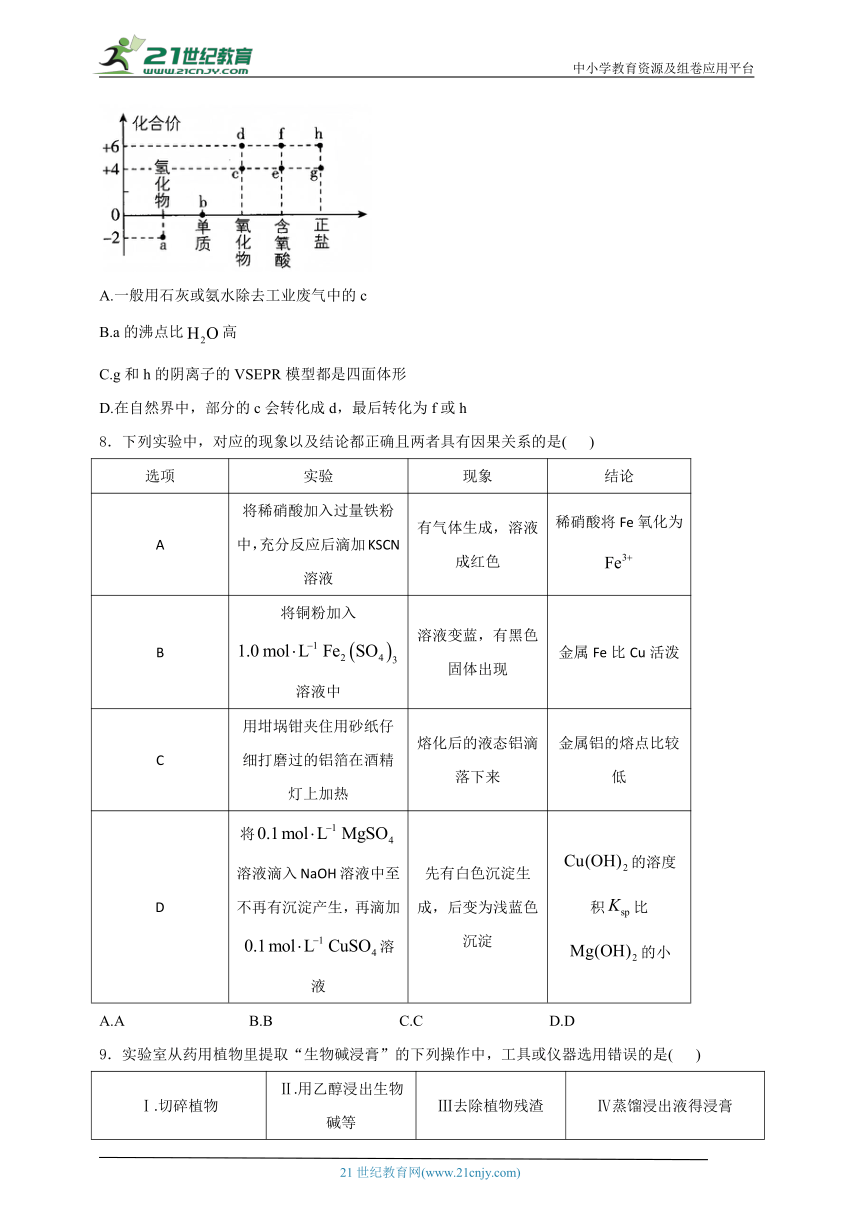
7.核心元素的化合价及类别是研究物质性质的两个重要视角。硫及其化合物的分类与相应硫元素的化合价关系如图所示。下列说法错误的是( )
A.一般用石灰或氨水除去工业废气中的c
B.a的沸点比高
C.g和h的阴离子的VSEPR模型都是四面体形
D.在自然界中,部分的c会转化成d,最后转化为f或h
8.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 实验 现象 结论
A 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 有气体生成,溶液成红色 稀硝酸将Fe氧化为
B 将铜粉加入溶液中 溶液变蓝,有黑色固体出现 金属Fe比Cu活泼
C 用坩埚钳夹住用砂纸仔细打磨过的铝箔在酒精灯上加热 熔化后的液态铝滴落下来 金属铝的熔点比较低
D 将溶液滴入NaOH溶液中至不再有沉淀产生,再滴加溶液 先有白色沉淀生成,后变为浅蓝色沉淀 的溶度积比的小
A.A B.B C.C D.D
9.实验室从药用植物里提取“生物碱浸膏”的下列操作中,工具或仪器选用错误的是( )
Ⅰ.切碎植物 Ⅱ.用乙醇浸出生物碱等 Ⅲ去除植物残渣 Ⅳ蒸馏浸出液得浸膏
A铡刀 B广口瓶 C分液漏斗 D蒸馏装置
A.A B.B C.C D.D
10.短周期元素X、Y、Z、W的原子序数依次增大。X的原子核外有1个电子,Y是地壳中含量最多的元素,Z位确于元素周期表第ⅢA族,W单质可广泛用于生产芯片。下列说法正确的是( )
A.原子半径:YB.元素电负性:XC.W的简单氢化物比Y的稳定
D.Z单质制成的容器可盛放冷浓硫酸
11.反应常被用于除去水中残余氯。为阿伏加德罗常数的值,下列说法正确的是( )
A.溶液中含有的键数目为
B.时,中氯原子的数目为
C.含有质子的数目为
D.通过上述反应除去,电子转移的数目为
12.用表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,中含有的氢原子数为
B.常温常压下,中含有的共用电子对的数目为
C.标准状况下,5.6L由与组成的混合气体中,原子总数为
D.的NaCl溶液中含有的离子总数为
13.一定温度下,两个容积相同的带活塞的容器,分别盛有一定质量的和,都为一样的红棕色,同时压缩到原容积的一半(如图),假设气体不液化,则下列说法正确的是( )
A.过程中,颜色突然加深,然后逐渐变浅,最终颜色比原来的深
B.的颜色一样深
C.的压强分别为a、b的压强的2倍
D.中的可能比中的大
14.某无色溶液可能是强酸性也可能是强碱性,在该溶液中一定能大量共存的离子是( )
A.、、、 B.、、、
C.、、、 D.、、、
二、非选择题:本题共4小题,共58分。
15.亚氯酸钠()是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊法制备亚氯酸钠的流程如图:
(1)反应①的化学方程式为:,该反应的还原产物是___________(写化学式)。
(2)在□补充反应②另一种产物,并配平此离子方程式,然后用单线桥法解题思路此化学反应。___________
________ +_________+_________=________+________+________□
(3)中Cl的化合价为___________,在反应②中___________(填字母)。
A.只能作氧化剂
B.只能作还原剂
C.既能作氧化剂也能作还原剂
(4)实验室采用马蒂逊法制备的实验装置如图甲所示:
已知:①的熔点为-59℃,沸点为11℃,的沸点为150℃。
②当温度低于38℃时,饱和溶液中析出的晶体是;当温度在38~60℃时,析出;温度高于60℃时,分解。
C中将装置浸入冰水浴中的目的是___________。
16.、、、等都是重要的氧化剂,其中、、还是常见的水处理剂,这些物质之间存在如图所示的转化关系。
回答下列问题:
(1)已知电解质在水溶液里或熔融状态时通电会发生氧化还原反应,其中阳极发生失电子的反应,阴极发生得电子的反应,则反应②中单质Na在________(填“阴”或“阳”)极产生。
(2)反应④体现了金属Na的________性(填“氧化”或“还原”)。
(3)反应⑤在碱性条件下进行,生成物中Fe元素的化合价为________。
(4)反应⑥的化学方程式为,该反应的氧化剂为________(填化学式,下同),氧化产物为________。
(5)反应⑦是在饱和溶液中加入KOH,可得沉淀,该反应的反应类型是________(填四大基本反应类型)。
17.雾霾严重影响人们的生活与健康.某地区的雾霾中可能含有、、、、、、等离子。某同学收集雾霾样品,经必要的预处理配成无色试样溶液,设计如下实验探究其中含有的离子。
回答下列问题:
(1)不需要经过实验就可判断试样溶液中没有,理由是_______________;白色沉淀1的化学式是______________。
(2)生成白色沉淀2的离子方程式是______________。
(3)试样溶液中一定存在的离子是_____________(填写离子符号,下同),可能含有的离子是___________。一定没有的离子除了外,还有________________。
(4)检验试样溶液中可能含有的阴离子的方法是________________________。
18.现有四种物质、、、,它们之间的反应关系如图所示。a、b、c、d代表这四种物质的溶液,e和f为沉淀,其中f为白色沉淀,g为气体。回答下列问题:
(1)b代表的物质为________(填化学式,下同),d代表的物质为________。
(2)c中溶质的电离方程式为________。
(3)将a的饱和溶液分别滴入下列物质中加热,能形成胶体的是________。(填标号)。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(4)c与d反应的离子方程式为________。
(5)呼吸面具中常用的供氧剂是一种________色固体,g与其反应的化学方程式为________。
(6)向一定体积的b中逐滴加入稀硫酸至过量,混合溶液的导电能力随稀硫酸加入量的变化趋势为________。
参考答案
1.答案:C
解析:蒸馏是利用乙醇和水的沸点不同,A错误;斑铜为铜的一种合金,熔点低于纯铜,B错误;蚕丝的主要成分是蛋白质,蛋白质是天然高分子化合物,C正确;桐油是一种植物油,其主要成分是高级脂肪酸甘油酯,D错误。
2.答案:D
A.Y W为H、X为C、Y为N、Z为O、Q为Na,A.Y为N,Z为O,Q为Na,原子核外电子层数越多,原子半径越大,同周期元素从左到右原子半径减小,则原子半径:Q>Y>Z,故A错误;
B.该化合物中Y原子得到3个电子形成8电子稳定结构,故B错误;
C.该化合物中存在离子键和共价键,故C错误;
D.Q为Na,能与水、甲醇反应生成氢气,故D正确;
故选:D。
3.答案:B
解析:乙酸乙酯制取实验中导管不能伸入饱和碳酸钠溶液液面下,易产生倒吸现象,A错误;缓慢滴加饱和食盐水,与电石反应制取乙炔气体,用溶液除去等杂质气体,用酸性高锰酸钾溶液验证乙炔具有还原性,可被酸性高锰酸钾溶液氧化,B正确;与NaOH溶液在加热条件下反应生成和NaCl,在冰水条件下生成NaClO和NaCl,中间试管得到氯酸钠,右侧试管得到漂白液,且用于平衡气压的长玻璃管应伸入液面以下,C错误;硫酸和氯化钠共热制取HCl气体,利用的是硫酸的高沸点性质,磷酸也是高沸点酸,也可以用于制取,D错误。
4.答案:D
解析:玻璃棒在过滤操作中的作用是引流,在溶解操作中的作用是搅拌,A错误;温度计水银球在制乙烯实验中是位于反应溶液中,用于测量反应温度,蒸馏操作中是位于蒸馏烧瓶支管口处,用于测量蒸气温度,B错误;水与Na反应生成,水体现氧化性,水与反应生成,水既不体现氧化性,也不体现还原性,C错误;使溴水和高锰酸钾溶液褪色都是体现的还原性,D正确。
5.答案:A
解析:A.该组离子之间不反应,可大量共存,A符合题意;
B.和结合生成沉淀,不能大量共存,B不符合题意;
C.使石蕊变红的溶液显酸性,不能大量存在,C不符合题意;
D.酚酞溶液变红说明溶液显碱性,与反应,不能大量能共存,D不符合题意;
故答案选A。
6.答案:C
解析:A.ⅠA族元素中H是非金属元素,A错误;
B.元素周期表纵向看,由18个纵列构成,共16个族,B错误;
C.元素周期表中元素种类最多的族是第ⅢB族,包含镧系和锕系,C正确;
D.原子最外层有2个电子的元素不一定在ⅡA族,如He是0族元素,D错误;
故选C。
7.答案:B
解析:c为,是酸性氧化物,可以和石灰或氨水反应从而被除去,A正确;a为,分子间存在氢键,沸点:,B错误;中心原子S的价层电子对数为,中心原子S的价层电子对数为,二者VSEPR模型都是四面体形,酸或硫酸盐,D正确。
8.答案:D
解析:因为铁粉过量,反应生成,加入KSCN溶液,溶液不变红,A错误;,生成,溶液变蓝,没有黑色固体出现,B错误;加热时铝表面产生氧化铝,氧化铝的熔点比铝的高,因此内部铝熔化被氧化铝包裏而不滴落,C错误;溶液加入NaOH溶液中,生成,待NaOH被完全反应后,再加入溶液,出现蓝色沉淀,即发生反应,,发生了沉淀的转化,说明的溶度积小于,D正确。
9.答案:C
解析:去除植物残渣是过滤操作,应使用普通漏斗,C错误。
10.答案:D
解析:同主族周期元素,从左至右,原子半径逐渐减小,则Z、W原子半径大小为,A错误;电负性:(同周期主族元素的电负性从左至右递增)(同主族元素的电负性从上至下递减),综合可知电负性:,B错误;由电负性可知非金属性:,所以稳定性:,C错误;常温下浓硫酸可以使Al钝化,Al表面易被氧化成致密的氧化膜,所以可用铝制容器盛放冷浓硫酸,D正确。
11.答案:D
解析:溶液中和分子中都含有键,所以题给溶液中含有的键数目大于,A错误;标准状况下,中氯原子的数目为,但题中的温度不符合标准状况,B错误;0的质子数是8,所以中含有1.6 mol质子,数目为,C错误;该反应中Cl元素化合价由0价降为-1价,且无其他化合价降低的元素,所以每消耗将转移1 mol电子,数目为,D正确。
12.答案:C
解析:
A.标准状况下,水为液态不是气体,故A选项错误;
B.为0.1mol,1个分子中有4对共用电子对,因此4.4g中含有的共用电了对的数日为,故B选项错误;
C.标准状况下,56L气体为0.25mol,一个与,分子分别有3个原子,则混合气体中原子为0.75mol,因此组成的混合气体中原子总数为,故C选项正确;
D.溶液体积未知不能计算,故D选项错误;
故选C选项。
13.答案:D
解析:
14.答案:C
解析:A. 在强碱性溶液中不能大量存在、且为紫红色,故A错误;
B.与、不共存,故B错误;
C.酸或碱溶液中、、、这四种离子均不反应,且离子均为无色,大量共存,故C正确;
D.在酸性和强碱性溶液中都不能大量存在,故D错误;
故答案选C。
15.答案:(1)
(2)
(3) +3;C
(4)增大的溶解度使其充分反应,防止温度过高使分解
解析:(1)反应①的化学方程式为:,是氧化剂,是还原剂,则该反应的还原产物是。
(2)由解题思路可知,反应在生成的同时,还有生成,则□对应的产物为,依据得失电子守恒的原则,的化学计量数分别为2、1,、的化学计量数分别为2、1,再利用质量守恒,便可配平的化学计量数。在反应中,中的O元素失电子,转移给中的Cl元素,转化电子数为。从而得出配平的离子方程式,然后用单线桥法解题思路此化学反应为:。
(3)中,Na显+1价,O显-2价,则Cl的化合价为+3,中O显-1价,反应②中既能作氧化剂也能作还原剂,故选C。
(4)实验室采用马蒂逊法制备,装置A用于制取,装置B用于收集,装置C中发生反应制取。
由于的热稳定性差,则C中将装置浸入冰水浴中的目的是:增大的溶解度使其充分反应,防止温度过高使分解。
16.答案:(1)阴
(2)还原
(3)
(4);、
(5)复分解反应
解析:电解溶液生成、氢气和氯气,电解熔融得到和氯气,氯气和溶液反应生成,次氯酸钠与氯化铁反应生成,加入KOH转化为,钠和氧气加热反应生成过氧化钠。
(1)电解熔融得到和氯气,钠元素化合价降低,发生得电子反应,则反应②中单质在阴极产生;
(2)反应④中金属与氧气反应生成过氧化钠钠做还原剂,体现还原性;
(3)中为+1价,0为-2价,根据化合价规则元素的化合价为+6;
(4)反应⑥中铁元素化合价从+2升高+6价,为还原剂,中氧元素为-1价,氧元素从-1降低至-2价过程中,做氧化剂,生成氧气过程中氧元素由-1价0价化合价升高,是氧化产物,铁元素化合价从+2+6价化合价升高,也是氧化产物;
(5)反应⑦是在饱和溶液中加入KOH溶液,能够得到固体,同时生成,是两种化合物成分互换,反应类型是复分解反应,该反应能发生的主要原因是: 相同温度下,的溶解度小于。
17.答案:(1)有颜色;
(2)
(3)、;、;、
(4)取少许试样溶液于试管中,加入足量,静置后向上层清液中加入溶液,有白色沉淀,证明有
解析:(1)有颜色,不用实验就能根据无色判断;白色沉淀为;
(2)生成白色沉淀2的离子反应为;
(3)由题意,溶液中一定存在、,可能有、,一定没有、、;
(4)先取试样溶液少许,在加入足量溶液,再加入溶液,若有白色沉淀,证明有。
18.答案:(1);HCl
(2)
(3)B
(4)
(5)淡黄;
(6)先逐渐减小至接近于零,后又逐渐增大
解析:(1)根据离子组成和a、b、c、d四种溶液之间反应的产物,判断出a是、b是、c是、d是HCl。
(2)在水中的电离方程式为。
(3)氢氧化铁胶体的制备方法是将少量饱和溶液滴入沸水中,煮沸至液体呈红褐色
(4)与HCl反应的离子方程式为。
(5)为淡黄色固体,与反应的化学方程式为,可作供氧剂
(6)向溶液中逐滴加入稀硫酸,发生反应:,溶液中的离子浓度减小,溶液的导电能力减弱至接近于零,稀硫酸过量时,溶液中的离子浓度增大,溶液的导电能力增强
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
2024-2025学年高一化学苏教版(2019)上学期期末教学质量模拟检测(一)(含解析)
注意事项:
1.答题前,考生先将自己的姓名准考证号码填写清楚,将条形码准确粘贴在考生信息条形码粘贴区。
2.选择题必须使用2B铅笔填涂;非选择题必须使用0.5毫米黑色字迹的签字笔书写,字体工整、笔迹清楚。
3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试卷上答题无效。
4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。
5.保持卡面清洁,不要折叠,不要弄破、异皱,不准使用涂改液、修正带、刮纸刀。
可能用到的相对原子质量:
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项符合题目要求。
1.非物质文化遗产是古代劳动人民的智慧结晶。下列说法正确的是( )
A.蒸馏酒传统酿造技艺:利用乙醇和水的密度不同,蒸馏提高酒精度
B.斑铜制作技艺:在铜中掺杂金、银等金属,斑铜的熔点比纯铜高
C.桑 丝织技艺:忝丝的主要成分属于高分子化合物
D.桐油纸伞制作技艺:桐油(由桐树的果实压榨而得)的主要成分是烃
2.短周期主族元素W、X、Y、Z、Q原子序数依次增大,形成的化合物是一种重要的食品添加剂,结构如下图。Z核外最外层电子数与X核外电子总数相等。W的原子半径在周期表中最小。下列有关叙述正确的是( )
A.原子半径大小:Y>Z>Q
B.该化合物中Y原子不满足8电子稳定结构
C.该化合物中,W、X、Y、Z、Q之间均为共价键
D.Q元素对应的单质能与水反应,也能与甲醇反应
3.下列实验方案合理的是( )
A制取并收集乙酸乙酯 B制取并验证乙炔的性质 C利用氯气制备漂白液和氯酸钠,可在中间试管得到漂白液 D利用硫酸的酸性制备氯化氢,分液漏斗中溶液不能换成磷酸
A.A B.B C.C D.D
4.下列所用仪器或试剂,在涉及操作中的作用或性质前后相同的是( )
A.玻璃棒的作用:过滤;溶解
B.温度计的位置:乙醇浓硫酸共热制乙烯;分离乙醇和水的混合液
C.水体现的性质:分别与Na和反应生成气体
D.的性质:分别使溴水和高锰酸钾溶液褪色
5.下列各组离子在给定条件下能大量共存的是( )
A.澄清透明溶液中:
B.有存在的溶液中:
C.使石蕊变红的溶液中:
D.使酚酞溶液变红的溶液中:
6.元素周期表是指导化学学习的工具,下列说法正确的是( )
A.ⅠA族元素全部金属元素,称为碱金属元素
B.元素周期表纵向看,由16个纵列构成,共16个族
C.元素周期表中元素种类最多的族是第ⅢB族
D.原子最外层有2个电子的元素都在ⅡA族
7.核心元素的化合价及类别是研究物质性质的两个重要视角。硫及其化合物的分类与相应硫元素的化合价关系如图所示。下列说法错误的是( )
A.一般用石灰或氨水除去工业废气中的c
B.a的沸点比高
C.g和h的阴离子的VSEPR模型都是四面体形
D.在自然界中,部分的c会转化成d,最后转化为f或h
8.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 实验 现象 结论
A 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 有气体生成,溶液成红色 稀硝酸将Fe氧化为
B 将铜粉加入溶液中 溶液变蓝,有黑色固体出现 金属Fe比Cu活泼
C 用坩埚钳夹住用砂纸仔细打磨过的铝箔在酒精灯上加热 熔化后的液态铝滴落下来 金属铝的熔点比较低
D 将溶液滴入NaOH溶液中至不再有沉淀产生,再滴加溶液 先有白色沉淀生成,后变为浅蓝色沉淀 的溶度积比的小
A.A B.B C.C D.D
9.实验室从药用植物里提取“生物碱浸膏”的下列操作中,工具或仪器选用错误的是( )
Ⅰ.切碎植物 Ⅱ.用乙醇浸出生物碱等 Ⅲ去除植物残渣 Ⅳ蒸馏浸出液得浸膏
A铡刀 B广口瓶 C分液漏斗 D蒸馏装置
A.A B.B C.C D.D
10.短周期元素X、Y、Z、W的原子序数依次增大。X的原子核外有1个电子,Y是地壳中含量最多的元素,Z位确于元素周期表第ⅢA族,W单质可广泛用于生产芯片。下列说法正确的是( )
A.原子半径:Y
D.Z单质制成的容器可盛放冷浓硫酸
11.反应常被用于除去水中残余氯。为阿伏加德罗常数的值,下列说法正确的是( )
A.溶液中含有的键数目为
B.时,中氯原子的数目为
C.含有质子的数目为
D.通过上述反应除去,电子转移的数目为
12.用表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,中含有的氢原子数为
B.常温常压下,中含有的共用电子对的数目为
C.标准状况下,5.6L由与组成的混合气体中,原子总数为
D.的NaCl溶液中含有的离子总数为
13.一定温度下,两个容积相同的带活塞的容器,分别盛有一定质量的和,都为一样的红棕色,同时压缩到原容积的一半(如图),假设气体不液化,则下列说法正确的是( )
A.过程中,颜色突然加深,然后逐渐变浅,最终颜色比原来的深
B.的颜色一样深
C.的压强分别为a、b的压强的2倍
D.中的可能比中的大
14.某无色溶液可能是强酸性也可能是强碱性,在该溶液中一定能大量共存的离子是( )
A.、、、 B.、、、
C.、、、 D.、、、
二、非选择题:本题共4小题,共58分。
15.亚氯酸钠()是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊法制备亚氯酸钠的流程如图:
(1)反应①的化学方程式为:,该反应的还原产物是___________(写化学式)。
(2)在□补充反应②另一种产物,并配平此离子方程式,然后用单线桥法解题思路此化学反应。___________
________ +_________+_________=________+________+________□
(3)中Cl的化合价为___________,在反应②中___________(填字母)。
A.只能作氧化剂
B.只能作还原剂
C.既能作氧化剂也能作还原剂
(4)实验室采用马蒂逊法制备的实验装置如图甲所示:
已知:①的熔点为-59℃,沸点为11℃,的沸点为150℃。
②当温度低于38℃时,饱和溶液中析出的晶体是;当温度在38~60℃时,析出;温度高于60℃时,分解。
C中将装置浸入冰水浴中的目的是___________。
16.、、、等都是重要的氧化剂,其中、、还是常见的水处理剂,这些物质之间存在如图所示的转化关系。
回答下列问题:
(1)已知电解质在水溶液里或熔融状态时通电会发生氧化还原反应,其中阳极发生失电子的反应,阴极发生得电子的反应,则反应②中单质Na在________(填“阴”或“阳”)极产生。
(2)反应④体现了金属Na的________性(填“氧化”或“还原”)。
(3)反应⑤在碱性条件下进行,生成物中Fe元素的化合价为________。
(4)反应⑥的化学方程式为,该反应的氧化剂为________(填化学式,下同),氧化产物为________。
(5)反应⑦是在饱和溶液中加入KOH,可得沉淀,该反应的反应类型是________(填四大基本反应类型)。
17.雾霾严重影响人们的生活与健康.某地区的雾霾中可能含有、、、、、、等离子。某同学收集雾霾样品,经必要的预处理配成无色试样溶液,设计如下实验探究其中含有的离子。
回答下列问题:
(1)不需要经过实验就可判断试样溶液中没有,理由是_______________;白色沉淀1的化学式是______________。
(2)生成白色沉淀2的离子方程式是______________。
(3)试样溶液中一定存在的离子是_____________(填写离子符号,下同),可能含有的离子是___________。一定没有的离子除了外,还有________________。
(4)检验试样溶液中可能含有的阴离子的方法是________________________。
18.现有四种物质、、、,它们之间的反应关系如图所示。a、b、c、d代表这四种物质的溶液,e和f为沉淀,其中f为白色沉淀,g为气体。回答下列问题:
(1)b代表的物质为________(填化学式,下同),d代表的物质为________。
(2)c中溶质的电离方程式为________。
(3)将a的饱和溶液分别滴入下列物质中加热,能形成胶体的是________。(填标号)。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(4)c与d反应的离子方程式为________。
(5)呼吸面具中常用的供氧剂是一种________色固体,g与其反应的化学方程式为________。
(6)向一定体积的b中逐滴加入稀硫酸至过量,混合溶液的导电能力随稀硫酸加入量的变化趋势为________。
参考答案
1.答案:C
解析:蒸馏是利用乙醇和水的沸点不同,A错误;斑铜为铜的一种合金,熔点低于纯铜,B错误;蚕丝的主要成分是蛋白质,蛋白质是天然高分子化合物,C正确;桐油是一种植物油,其主要成分是高级脂肪酸甘油酯,D错误。
2.答案:D
A.Y W为H、X为C、Y为N、Z为O、Q为Na,A.Y为N,Z为O,Q为Na,原子核外电子层数越多,原子半径越大,同周期元素从左到右原子半径减小,则原子半径:Q>Y>Z,故A错误;
B.该化合物中Y原子得到3个电子形成8电子稳定结构,故B错误;
C.该化合物中存在离子键和共价键,故C错误;
D.Q为Na,能与水、甲醇反应生成氢气,故D正确;
故选:D。
3.答案:B
解析:乙酸乙酯制取实验中导管不能伸入饱和碳酸钠溶液液面下,易产生倒吸现象,A错误;缓慢滴加饱和食盐水,与电石反应制取乙炔气体,用溶液除去等杂质气体,用酸性高锰酸钾溶液验证乙炔具有还原性,可被酸性高锰酸钾溶液氧化,B正确;与NaOH溶液在加热条件下反应生成和NaCl,在冰水条件下生成NaClO和NaCl,中间试管得到氯酸钠,右侧试管得到漂白液,且用于平衡气压的长玻璃管应伸入液面以下,C错误;硫酸和氯化钠共热制取HCl气体,利用的是硫酸的高沸点性质,磷酸也是高沸点酸,也可以用于制取,D错误。
4.答案:D
解析:玻璃棒在过滤操作中的作用是引流,在溶解操作中的作用是搅拌,A错误;温度计水银球在制乙烯实验中是位于反应溶液中,用于测量反应温度,蒸馏操作中是位于蒸馏烧瓶支管口处,用于测量蒸气温度,B错误;水与Na反应生成,水体现氧化性,水与反应生成,水既不体现氧化性,也不体现还原性,C错误;使溴水和高锰酸钾溶液褪色都是体现的还原性,D正确。
5.答案:A
解析:A.该组离子之间不反应,可大量共存,A符合题意;
B.和结合生成沉淀,不能大量共存,B不符合题意;
C.使石蕊变红的溶液显酸性,不能大量存在,C不符合题意;
D.酚酞溶液变红说明溶液显碱性,与反应,不能大量能共存,D不符合题意;
故答案选A。
6.答案:C
解析:A.ⅠA族元素中H是非金属元素,A错误;
B.元素周期表纵向看,由18个纵列构成,共16个族,B错误;
C.元素周期表中元素种类最多的族是第ⅢB族,包含镧系和锕系,C正确;
D.原子最外层有2个电子的元素不一定在ⅡA族,如He是0族元素,D错误;
故选C。
7.答案:B
解析:c为,是酸性氧化物,可以和石灰或氨水反应从而被除去,A正确;a为,分子间存在氢键,沸点:,B错误;中心原子S的价层电子对数为,中心原子S的价层电子对数为,二者VSEPR模型都是四面体形,酸或硫酸盐,D正确。
8.答案:D
解析:因为铁粉过量,反应生成,加入KSCN溶液,溶液不变红,A错误;,生成,溶液变蓝,没有黑色固体出现,B错误;加热时铝表面产生氧化铝,氧化铝的熔点比铝的高,因此内部铝熔化被氧化铝包裏而不滴落,C错误;溶液加入NaOH溶液中,生成,待NaOH被完全反应后,再加入溶液,出现蓝色沉淀,即发生反应,,发生了沉淀的转化,说明的溶度积小于,D正确。
9.答案:C
解析:去除植物残渣是过滤操作,应使用普通漏斗,C错误。
10.答案:D
解析:同主族周期元素,从左至右,原子半径逐渐减小,则Z、W原子半径大小为,A错误;电负性:(同周期主族元素的电负性从左至右递增)(同主族元素的电负性从上至下递减),综合可知电负性:,B错误;由电负性可知非金属性:,所以稳定性:,C错误;常温下浓硫酸可以使Al钝化,Al表面易被氧化成致密的氧化膜,所以可用铝制容器盛放冷浓硫酸,D正确。
11.答案:D
解析:溶液中和分子中都含有键,所以题给溶液中含有的键数目大于,A错误;标准状况下,中氯原子的数目为,但题中的温度不符合标准状况,B错误;0的质子数是8,所以中含有1.6 mol质子,数目为,C错误;该反应中Cl元素化合价由0价降为-1价,且无其他化合价降低的元素,所以每消耗将转移1 mol电子,数目为,D正确。
12.答案:C
解析:
A.标准状况下,水为液态不是气体,故A选项错误;
B.为0.1mol,1个分子中有4对共用电子对,因此4.4g中含有的共用电了对的数日为,故B选项错误;
C.标准状况下,56L气体为0.25mol,一个与,分子分别有3个原子,则混合气体中原子为0.75mol,因此组成的混合气体中原子总数为,故C选项正确;
D.溶液体积未知不能计算,故D选项错误;
故选C选项。
13.答案:D
解析:
14.答案:C
解析:A. 在强碱性溶液中不能大量存在、且为紫红色,故A错误;
B.与、不共存,故B错误;
C.酸或碱溶液中、、、这四种离子均不反应,且离子均为无色,大量共存,故C正确;
D.在酸性和强碱性溶液中都不能大量存在,故D错误;
故答案选C。
15.答案:(1)
(2)
(3) +3;C
(4)增大的溶解度使其充分反应,防止温度过高使分解
解析:(1)反应①的化学方程式为:,是氧化剂,是还原剂,则该反应的还原产物是。
(2)由解题思路可知,反应在生成的同时,还有生成,则□对应的产物为,依据得失电子守恒的原则,的化学计量数分别为2、1,、的化学计量数分别为2、1,再利用质量守恒,便可配平的化学计量数。在反应中,中的O元素失电子,转移给中的Cl元素,转化电子数为。从而得出配平的离子方程式,然后用单线桥法解题思路此化学反应为:。
(3)中,Na显+1价,O显-2价,则Cl的化合价为+3,中O显-1价,反应②中既能作氧化剂也能作还原剂,故选C。
(4)实验室采用马蒂逊法制备,装置A用于制取,装置B用于收集,装置C中发生反应制取。
由于的热稳定性差,则C中将装置浸入冰水浴中的目的是:增大的溶解度使其充分反应,防止温度过高使分解。
16.答案:(1)阴
(2)还原
(3)
(4);、
(5)复分解反应
解析:电解溶液生成、氢气和氯气,电解熔融得到和氯气,氯气和溶液反应生成,次氯酸钠与氯化铁反应生成,加入KOH转化为,钠和氧气加热反应生成过氧化钠。
(1)电解熔融得到和氯气,钠元素化合价降低,发生得电子反应,则反应②中单质在阴极产生;
(2)反应④中金属与氧气反应生成过氧化钠钠做还原剂,体现还原性;
(3)中为+1价,0为-2价,根据化合价规则元素的化合价为+6;
(4)反应⑥中铁元素化合价从+2升高+6价,为还原剂,中氧元素为-1价,氧元素从-1降低至-2价过程中,做氧化剂,生成氧气过程中氧元素由-1价0价化合价升高,是氧化产物,铁元素化合价从+2+6价化合价升高,也是氧化产物;
(5)反应⑦是在饱和溶液中加入KOH溶液,能够得到固体,同时生成,是两种化合物成分互换,反应类型是复分解反应,该反应能发生的主要原因是: 相同温度下,的溶解度小于。
17.答案:(1)有颜色;
(2)
(3)、;、;、
(4)取少许试样溶液于试管中,加入足量,静置后向上层清液中加入溶液,有白色沉淀,证明有
解析:(1)有颜色,不用实验就能根据无色判断;白色沉淀为;
(2)生成白色沉淀2的离子反应为;
(3)由题意,溶液中一定存在、,可能有、,一定没有、、;
(4)先取试样溶液少许,在加入足量溶液,再加入溶液,若有白色沉淀,证明有。
18.答案:(1);HCl
(2)
(3)B
(4)
(5)淡黄;
(6)先逐渐减小至接近于零,后又逐渐增大
解析:(1)根据离子组成和a、b、c、d四种溶液之间反应的产物,判断出a是、b是、c是、d是HCl。
(2)在水中的电离方程式为。
(3)氢氧化铁胶体的制备方法是将少量饱和溶液滴入沸水中,煮沸至液体呈红褐色
(4)与HCl反应的离子方程式为。
(5)为淡黄色固体,与反应的化学方程式为,可作供氧剂
(6)向溶液中逐滴加入稀硫酸,发生反应:,溶液中的离子浓度减小,溶液的导电能力减弱至接近于零,稀硫酸过量时,溶液中的离子浓度增大,溶液的导电能力增强
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
