2024-2025学年高二化学鲁科版(2019)上学期期末教学质量模拟检测(一)(含解析)
文档属性
| 名称 | 2024-2025学年高二化学鲁科版(2019)上学期期末教学质量模拟检测(一)(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-15 18:49:18 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2024-2025学年高二化学鲁科版(2019)上学期期末教学质量模拟检测(一)(含解析)
注意事项:
1.答题前,考生先将自己的姓名准考证号码填写清楚,将条形码准确粘贴在考生信息条形码粘贴区。
2.选择题必须使用2B铅笔填涂;非选择题必须使用0.5毫米黑色字迹的签字笔书写,字体工整、笔迹清楚。
3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试卷上答题无效。
4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。
5.保持卡面清洁,不要折叠,不要弄破、异皱,不准使用涂改液、修正带、刮纸刀。
可能用到的相对原子质量:
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项符合题目要求。
1.西大附中高二化学兴趣小组调查生活中一些食品和常见物品的pH(形成一定浓度的水溶液时的近似pH)如图:
下列说法不正确的是( )
A.胃酸过多的人不宜多吃苹果 B.纯碱溶液可使酚酞溶液变红
C.可将洁厕灵与84消毒液混用 D.牛奶中的浓度比酱油中的小
2.向如图装置的试管中加入下列试剂,不能使小车向左移动的是( )
A.铜和浓硫酸 B.生石灰和浓氨水
C.碳酸氢钠和硫酸铝溶液 D.过氧化钠和水
3.化学反应伴随能量变化,下列叙述正确的是( )
A.吸热反应一定需要加热才能发生,放热反应在常温下就能迅速发生
B.CO的燃烧热为,则
C.在稀溶液中,,若将含1mol醋酸的溶液与含的溶液混合,放出热量为
D.相同条件下,等质量的硫蒸气和硫固体分别完全燃烧,其前者放热更多
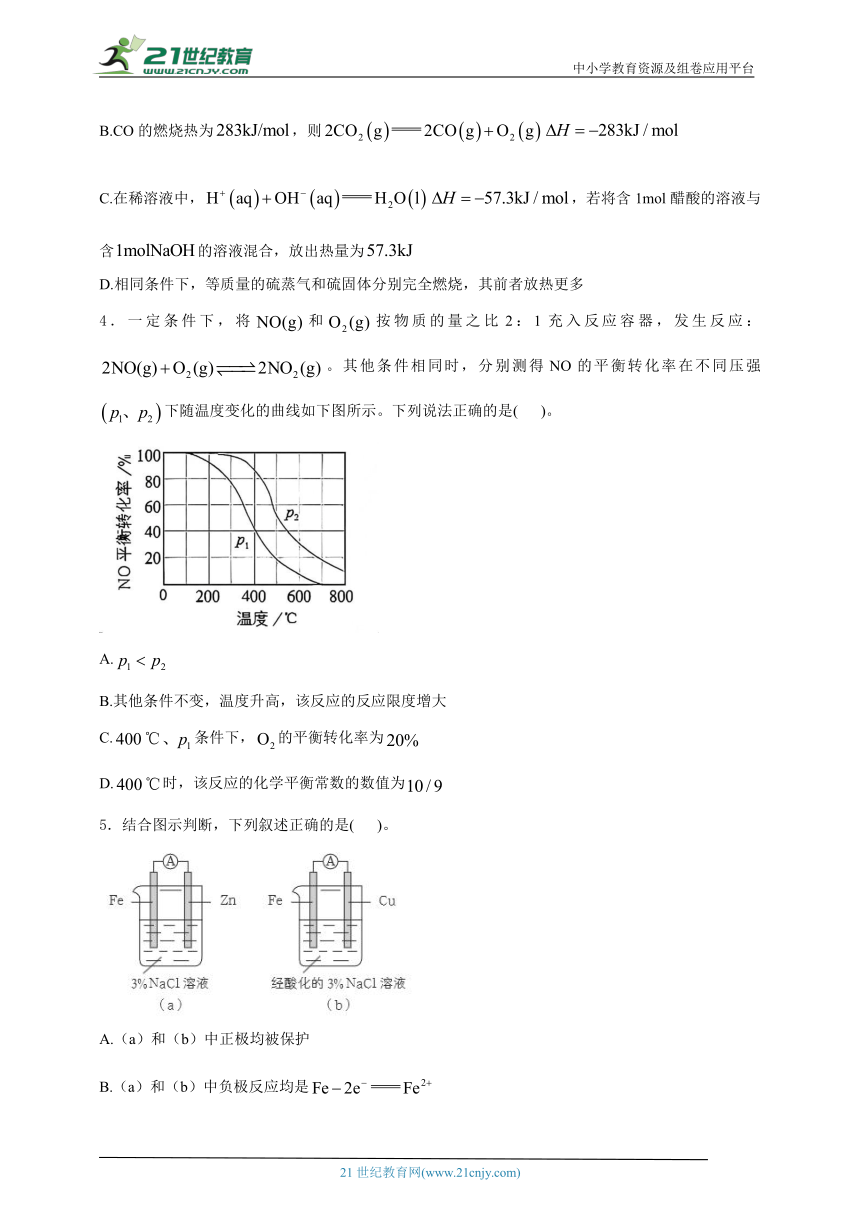
4.一定条件下,将和按物质的量之比2:1充入反应容器,发生反应:。其他条件相同时,分别测得NO的平衡转化率在不同压强下随温度变化的曲线如下图所示。下列说法正确的是( )。
A.
B.其他条件不变,温度升高,该反应的反应限度增大
C.条件下,的平衡转化率为
D.时,该反应的化学平衡常数的数值为
5.结合图示判断,下列叙述正确的是( )。
A.(a)和(b)中正极均被保护
B.(a)和(b)中负极反应均是
C.(a)和(b)中正极反应均是
D.(a)和(b)中均向铁电极方向移动
6.把铁钉和石墨棒用导线连接起来后浸入食盐溶液中,可能出现的现象是( )。
A.石墨棒上放出氯气 B.石墨棒上放出氧气
C.铁钉上放出氢气 D.铁钉锈蚀
7.热激活电池(又称热电池)可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiC1-KC1混合物一旦受热熔融,电池瞬间即可输出电能。该电池总反应为:
关于该电池的下列说法中,正确的是( )。
A.负极的电极反应:
B.放电过程中,向钙电极移动
C.正极反应物为LiCl
D.常温时,在正、负极之间连上检流计,指针不偏转
8.下列关于反应的说法中,正确的是( )。
A.时,反应释放能量 B.时,反应释放能量
C. D.
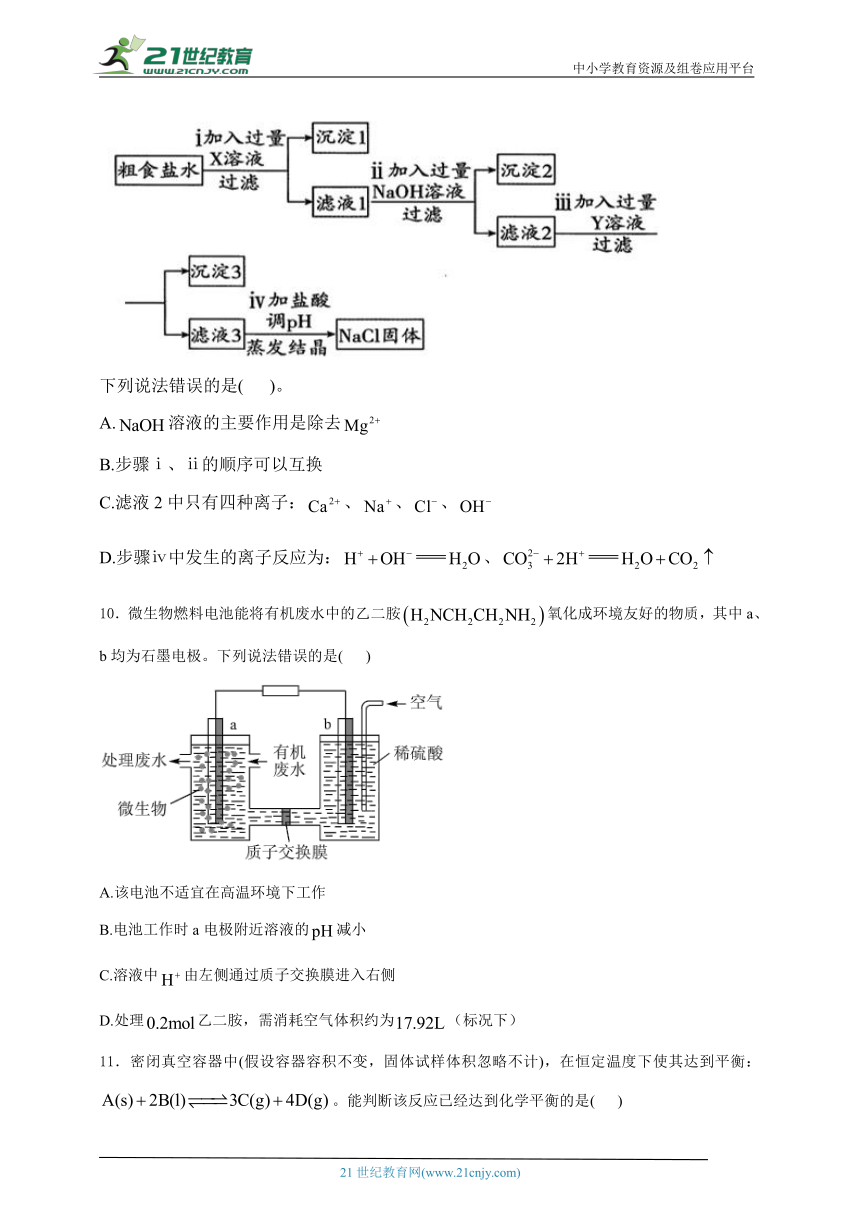
9.为除去粗盐水中含有的杂质、和,得到精制食盐,设计了如下实验流程:
下列说法错误的是( )。
A.溶液的主要作用是除去
B.步骤ⅰ、ⅱ的顺序可以互换
C.滤液2中只有四种离子:、、、
D.步骤ⅳ中发生的离子反应为:、
10.微生物燃料电池能将有机废水中的乙二胺氧化成环境友好的物质,其中a、b均为石墨电极。下列说法错误的是( )
A.该电池不适宜在高温环境下工作
B.电池工作时a电极附近溶液的减小
C.溶液中由左侧通过质子交换膜进入右侧
D.处理乙二胺,需消耗空气体积约为(标况下)
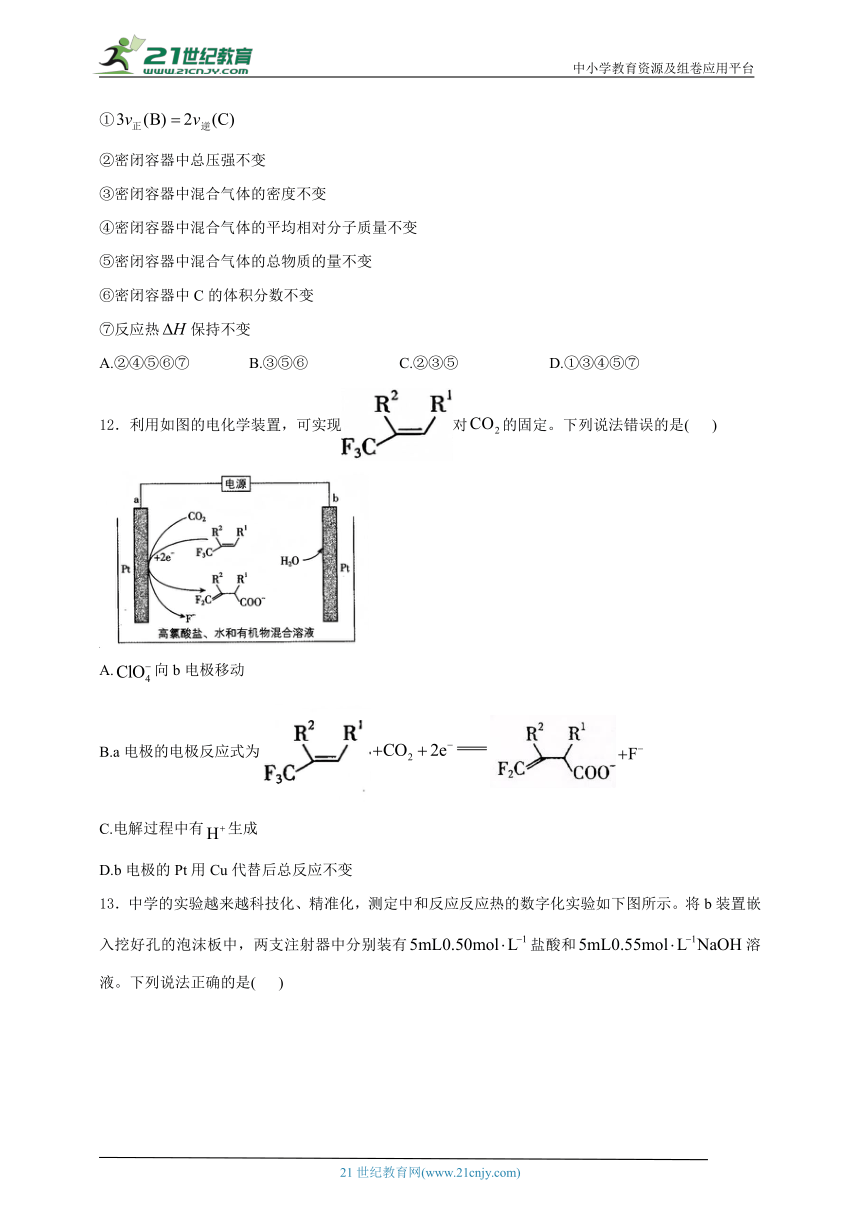
11.密闭真空容器中(假设容器容积不变,固体试样体积忽略不计),在恒定温度下使其达到平衡:。能判断该反应已经达到化学平衡的是( )
①
②密闭容器中总压强不变
③密闭容器中混合气体的密度不变
④密闭容器中混合气体的平均相对分子质量不变
⑤密闭容器中混合气体的总物质的量不变
⑥密闭容器中C的体积分数不变
⑦反应热保持不变
A.②④⑤⑥⑦ B.③⑤⑥ C.②③⑤ D.①③④⑤⑦
12.利用如图的电化学装置,可实现对的固定。下列说法错误的是( )
A.向b电极移动
B.a电极的电极反应式为
C.电解过程中有生成
D.b电极的Pt用Cu代替后总反应不变
13.中学的实验越来越科技化、精准化,测定中和反应反应热的数字化实验如下图所示。将b装置嵌入挖好孔的泡沫板中,两支注射器中分别装有盐酸和溶液。下列说法正确的是( )
A.由于实验实行数字化,搅拌器可为铜丝或塑料
B.泡沫板只是起到支撑稳固仪器的作用
C.数字温度计测量盐酸的温度后,可直接测量溶液的温度
D.应快速将注射器中的溶液注入烧杯中并转动搅拌器,记录温度最大值
14.我国科学工作者以海水为氯源高效电合成了,二氯酮,以纳米雉为催化剂抑制氧析出和氯析出副反应的发生,装置如图,催化电极上反应为自由基机理。已知:。下列说法错误的是( )
A.电合成时,装置将太阳能最终转化为化学能
B.b极电极反应为
C.若在反应体系中加入自由基捕获剂,,二氯酮产率降低
D.若法拉第效率为,通过4mol电子时,产生,二氯酮
二、非选择题:本题共4小题,共58分。
15.填空。
(1)下列反应中,属于放热反应的是_____,属于吸热反应的是_____。(填序号)
①物质燃烧
②石灰石在高温下的分解反应
③酸碱中和反应
④二氧化碳通过炽热的炭
⑤食物因氧化而腐败
⑥与反应
⑦氧化钙与水反应
工业上用CO生产燃料甲醇,一定条件下发生反应:,反应过程中的能量变化情况如图所示。
(2)曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。该反应是_____(填“吸热”或“放热”)反应。
(3)推测反应是_____(填“吸热”或“放热”)反应。
(4)断开键、键、键分别需要吸收能量为436kJ、391kJ、946kJ,则与足量反应生成需_____(填“吸收”或“放出”)能量_____kJ。(小数点后保留两位数字)。
(5)与反应生成和氢气。在25℃、101kPa下,已知每消耗放热108kJ,写出该反应热化学方程式是_____。
16.若反应在密闭容器内达到化学平衡以后,升高温度或增大压强都会使平衡混合物中C的质量分数降低,那么:
(1)正反应是反应_________(填“吸热”或“放热”)。
(2)化学方程式中反应物与反应产物化学式前的系数关系是a+b_________c+d(填“>”“=”或“<”)。
(3)为了提高A的转化率,可以采用什么方法?
17.在一定条件下,反应达到化学平衡状态且其他条件不变时:
(1)如果升高温度,平衡混合物的颜色_________(填“变深”“变浅”或“不变”)。
(2)如果在容积固定的容器中加入一定量的氢气,化学平衡移动_________(填“向左”“向右”或“不变”)。
18.反应为可逆反应。
(1)该反应的化学平衡常数表达式为___________。
(2)增大压强(如压缩容器容积为原来的一半),平衡向正反应方向移动,请利用K、Q的关系说明理由:_____________。
参考答案
1.答案:C
解析:A.苹果显酸性,故胃酸过多不宜多吃苹果,A正确;
B.纯碱溶液的pH>9显碱性,故纯碱溶液可使酚酞溶液变红,B正确;
C.可将洁厕灵与84消毒液混用混合产生毒性氯气,C错误;
D.牛奶的pH大于酱油,故牛奶中的浓度比酱油中的小,D正确;
故选C。
2.答案:A
解析:A.铜和浓硫酸需要在加热条件下才能发生反应生成SO2,A符合题意;
B.生石灰和浓氨水反应生成氮气,B不符合题意;
C.碳酸氢钠和硫酸铝溶液会发生双水解反应生成氢氧化铁和二氧化碳,C不符合题意;
D.过氧化钠和水反应生成氢氧化钠和氧气,D不符合题意;
故选A。
3.答案:D
解析:A.某些吸热反应也可以自发进行,依据分析,常温下可以,如氢氧化钡晶体和氯化铵反应,是吸热反应,常温下可以自发进行,故A错误;
B.在101kPa时,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量叫作该物质的燃烧热,二氧化碳分解反应吸热,,B错误;
C.中和热是指在稀溶液中强酸和强碱发生中和反应生成1mol水所释放的热量,醋酸是弱酸,电离过程吸热,放热数值少,,C错误;
D.硫蒸汽的能量比固体硫的能量高,完全燃烧放出的热量更高,D正确;答案选D。
4.答案:A
解析:在相同温度下,条件下比条件下NO的平衡转化率高,根据反应特点可知,增大压强,平衡右移,NO的平衡转化率升高,故,A项正确;在相同压强下,升高温度,NO的平衡转化率降低,说明该反应的限度减小,B项错误;在条件下,NO的平衡转化率为,且NO和按化学方程式中的系数比投料,则二者的平衡转化率相等,C项错误;设容器的容积为1 L,起始时投入NO和的物质的量分别为,根据化学方程式,列“三段式”得:
平衡常数,D项错误。
5.答案:A
解析:题给装置(a)、(b)都是原电池,活泼金属做负极,被腐蚀,相对不活泼的金属做正极,被保护,A项正确;(a)中负极反应为,(b)中负极反应为,B项错误;(a)中电解质溶液显中性,正极反应为,而(b)中电解质溶液显酸性,正极反应为,C项错误;原电池中阳离子移向正极,故(a)中向铁电极方向移动,(b)中向铜电极方向移动,D项错误。
6.答案:D
解析:铁钉、石墨棒、食盐溶液构成原电池,因为食盐溶液显中性,所以发生铁的吸氧腐蚀,铁是负极,电极反应式为;石墨棒是正极,电极反应式为,总反应为,铁钉锈蚀,D项正确。
7.答案:D
解析:根据该电池的总反应可知,电极为正极,钙电极为负极,负极发生氧化反应,电极反应为,A项错误;放电过程中,阳离子向正极移动,即向电极移动,B项错误;正极得到电子发生还原反应生成Pb,即为正极反应物,C项错误;常温时,电解质不熔融,未形成闭合回路,不能构成原电池,检流计指针不偏转,D项正确。
8.答案:B
解析:时,反应吸收能量,时,反应释放能量,A项错误,B项正确;如果反应过程中体系没有做功,则,C项错误;在等压反应中,可能伴随着反应体系体积的改变而有体积功存在,因此反应热不一定等于反应体系内能的变化,D项错误。
9.答案:答案:C
解析:粗食盐水中加入过量氯化钡溶液,除去硫酸根离子;过滤后向滤液1中加入过量氢氧化钠溶液,除去镁离子;过滤后向滤液2中加入过量碳酸钠溶液,除去钙离子和过量的钡离子;过滤后向滤液3中加入盐酸,调pH,除去过量的氢氧根离子和过量的碳酸根离子,最后蒸发结晶,得到氯化钠固体。滤液2中主要有五种离子:、、、和,C符合题意,A、B、D不符合题意。
10.答案:D
解析:
11.答案:C
解析:①由题干方程式可知,B为液体,通常不用固体和液体的浓度改变来计算反应速率,①不合题意;
②由题干方程式可知,密闭容器中总压强一直改变,故总压强不变能够说明反应达到化学平衡,②符合题意;
③由题干方程式可知,密闭容器中混合气体的质量一直在变即混合气体的密度一直在变,则密闭容器中混合气体的密度不变,说明反应达到化学平衡了,③符合题意;
④由题干方程式可知,密闭容器中只有C、D两种气体,且物质的量始终保持3:4,则混合气体的平均相对分子质量始终保持不变,即混合气体的平均相对分子质量不变不能说明反应达到化学平衡,④不合题意;
⑤由题干方程式可知,反应过程中密闭容器中混合气体的总物质的量一直在改变,则密闭容器中混合气体的总物质的量不变,说明反应达到化学平衡,⑤符合题意;
⑥由题干方程式可知,密闭容器中只有C、D两种气体,且物质的量始终保持3:4,即密闭容器中C的体积分数始终保持不变,则密闭容器中C的体积分数不变不能说明反应达到化学平衡,⑥不合题意;
⑦已知反应热()是指1mol反应完全进行时的热效应,与反应的可逆与否和进行程度无关,则反应热()保持不变不能说明反应达到化学平衡,⑦不合题意;
综上分析可知,②③⑤符合题意,故答案为:C。
12.答案:D
解析:(阴离子)向阳极(b电极)移动,A正确;若将b电极的Pt换为Cu,由于Cu是活性电极,所以电极反应为,则总反应会发生变化,D错误。
13.答案:D
解析:A.铜丝或塑料的传热率都比玻璃大,会导致反应中的热量损失大,测量不准确引起误差,A错误;
B.泡沫板具有良好的隔热性能,除了起到支撑稳固仪器的作用,还有保温效果,减小实验误差,B错误;
C.数字温度计测量盐酸的温度后,如果不洗涤,直接测量溶液的温度,会因残留的盐酸与反应导致测量的溶液温度偏高产生误差,C错误;
D.在中和热的测定中,温度最大值就是恰好完全中和时放出的最大热量,此时计算的数据最准确,D正确;故答案为:D。
14.答案:B
解析:电合成时,能量转化形式是太阳能最终转化为化学能,A正确;
b极电极反应式为,B错误;
催化电极上反应为自由基机理,若向体系中加入自由基捕获剂,则得到的产物会减少,产率降低,C正确;
根据催化电极上电极反应可知,若法拉第效率为,通过4mol电子时,产生-二氯酮,D正确。
15.答案:(1)①③⑤⑦;②④⑥
(2)放热
(3)吸热
(4)放出;30.67
(5)+2+4(g)=-216kJ/mol
解析:(1)①物质燃烧放出热量,属于放热反应;②石灰石在高温下的分解反应需要吸收热量,属于吸热反应;③酸碱中和反应放出热量,为放热反应;④二氧化碳通过炽热的炭为吸热反应;⑤食物因氧化而腐败是缓慢氧化的过程,过程中放出热量,属于放热反应;⑥与反应吸收热量属于吸热反应;⑦氧化钙与水反应放出大量的热属于放热反应;综上,属于放热反应的是①③⑤⑦,属于吸热反应的是②④⑥。
(2)根据图像可知,该反应的生成物的总能量低于反应物的总能量,属于放热反应。
(3)由(1)可知,反应放热,则其逆反应吸热。
(4)已知断开1molH-H键、1molN-H键、1mol键分别需要吸收能量为436kJ、391kJ、946kJ,则生成1molN-H键需要释放391kJ能量,又,则与反应生,吸收的能量为,放出的能量为会,因此与足量反应生成放出能量782kJ-751.33kJ=30.67kJ。
(5)与反应生成和氢气,方程式为+2+4(g),已知每消耗0.5mol放热108kJ,则消耗1mol放热216kJ,热化学方程式为+2+4(g)=-216kJ/mol。
16.答案:(1)放热
(2)<
(3)增大B的浓度、减小C或D的浓度、降低温度、减小压强等。
解析:(1)升高温度,平衡混合物中C的质量分数降低,平衡向左移动,说明逆反应吸热,正反应放热。
(2)增大压强,平衡混合物中C的质量分数降低,平衡向左移动,说明逆反应是气态物质化学式前系数减小的反应,故a+b(3)为了提高A的转化率,可以增大B的浓度、减小C或D的浓度,也可以降低温度、减小压强等。
17.答案:(1)变深
(2)向左
解析:(1)正反应吸热,升高温度,平衡向右移动,平衡混合物的颜色变深。(2)恒容条件下加入,反应产物的浓度增大,平衡向左移动。
18.答案:(1)
(2)增大压强,,平衡向化学方程式中气态物质化学式前系数减小的方向移动,即平衡向正反应方向移动
解析:(1)根据化学方程式,水是液态,不需要写入平衡常数表达式中,故。
(2)将容器容积压缩为原来的一半,则各物质的浓度增大为原来的2倍,则,平衡向化学方程式中气态物质化学式前系数减小的方向移动,即平衡向正反应方向移动。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
2024-2025学年高二化学鲁科版(2019)上学期期末教学质量模拟检测(一)(含解析)
注意事项:
1.答题前,考生先将自己的姓名准考证号码填写清楚,将条形码准确粘贴在考生信息条形码粘贴区。
2.选择题必须使用2B铅笔填涂;非选择题必须使用0.5毫米黑色字迹的签字笔书写,字体工整、笔迹清楚。
3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试卷上答题无效。
4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。
5.保持卡面清洁,不要折叠,不要弄破、异皱,不准使用涂改液、修正带、刮纸刀。
可能用到的相对原子质量:
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项符合题目要求。
1.西大附中高二化学兴趣小组调查生活中一些食品和常见物品的pH(形成一定浓度的水溶液时的近似pH)如图:
下列说法不正确的是( )
A.胃酸过多的人不宜多吃苹果 B.纯碱溶液可使酚酞溶液变红
C.可将洁厕灵与84消毒液混用 D.牛奶中的浓度比酱油中的小
2.向如图装置的试管中加入下列试剂,不能使小车向左移动的是( )
A.铜和浓硫酸 B.生石灰和浓氨水
C.碳酸氢钠和硫酸铝溶液 D.过氧化钠和水
3.化学反应伴随能量变化,下列叙述正确的是( )
A.吸热反应一定需要加热才能发生,放热反应在常温下就能迅速发生
B.CO的燃烧热为,则
C.在稀溶液中,,若将含1mol醋酸的溶液与含的溶液混合,放出热量为
D.相同条件下,等质量的硫蒸气和硫固体分别完全燃烧,其前者放热更多
4.一定条件下,将和按物质的量之比2:1充入反应容器,发生反应:。其他条件相同时,分别测得NO的平衡转化率在不同压强下随温度变化的曲线如下图所示。下列说法正确的是( )。
A.
B.其他条件不变,温度升高,该反应的反应限度增大
C.条件下,的平衡转化率为
D.时,该反应的化学平衡常数的数值为
5.结合图示判断,下列叙述正确的是( )。
A.(a)和(b)中正极均被保护
B.(a)和(b)中负极反应均是
C.(a)和(b)中正极反应均是
D.(a)和(b)中均向铁电极方向移动
6.把铁钉和石墨棒用导线连接起来后浸入食盐溶液中,可能出现的现象是( )。
A.石墨棒上放出氯气 B.石墨棒上放出氧气
C.铁钉上放出氢气 D.铁钉锈蚀
7.热激活电池(又称热电池)可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiC1-KC1混合物一旦受热熔融,电池瞬间即可输出电能。该电池总反应为:
关于该电池的下列说法中,正确的是( )。
A.负极的电极反应:
B.放电过程中,向钙电极移动
C.正极反应物为LiCl
D.常温时,在正、负极之间连上检流计,指针不偏转
8.下列关于反应的说法中,正确的是( )。
A.时,反应释放能量 B.时,反应释放能量
C. D.
9.为除去粗盐水中含有的杂质、和,得到精制食盐,设计了如下实验流程:
下列说法错误的是( )。
A.溶液的主要作用是除去
B.步骤ⅰ、ⅱ的顺序可以互换
C.滤液2中只有四种离子:、、、
D.步骤ⅳ中发生的离子反应为:、
10.微生物燃料电池能将有机废水中的乙二胺氧化成环境友好的物质,其中a、b均为石墨电极。下列说法错误的是( )
A.该电池不适宜在高温环境下工作
B.电池工作时a电极附近溶液的减小
C.溶液中由左侧通过质子交换膜进入右侧
D.处理乙二胺,需消耗空气体积约为(标况下)
11.密闭真空容器中(假设容器容积不变,固体试样体积忽略不计),在恒定温度下使其达到平衡:。能判断该反应已经达到化学平衡的是( )
①
②密闭容器中总压强不变
③密闭容器中混合气体的密度不变
④密闭容器中混合气体的平均相对分子质量不变
⑤密闭容器中混合气体的总物质的量不变
⑥密闭容器中C的体积分数不变
⑦反应热保持不变
A.②④⑤⑥⑦ B.③⑤⑥ C.②③⑤ D.①③④⑤⑦
12.利用如图的电化学装置,可实现对的固定。下列说法错误的是( )
A.向b电极移动
B.a电极的电极反应式为
C.电解过程中有生成
D.b电极的Pt用Cu代替后总反应不变
13.中学的实验越来越科技化、精准化,测定中和反应反应热的数字化实验如下图所示。将b装置嵌入挖好孔的泡沫板中,两支注射器中分别装有盐酸和溶液。下列说法正确的是( )
A.由于实验实行数字化,搅拌器可为铜丝或塑料
B.泡沫板只是起到支撑稳固仪器的作用
C.数字温度计测量盐酸的温度后,可直接测量溶液的温度
D.应快速将注射器中的溶液注入烧杯中并转动搅拌器,记录温度最大值
14.我国科学工作者以海水为氯源高效电合成了,二氯酮,以纳米雉为催化剂抑制氧析出和氯析出副反应的发生,装置如图,催化电极上反应为自由基机理。已知:。下列说法错误的是( )
A.电合成时,装置将太阳能最终转化为化学能
B.b极电极反应为
C.若在反应体系中加入自由基捕获剂,,二氯酮产率降低
D.若法拉第效率为,通过4mol电子时,产生,二氯酮
二、非选择题:本题共4小题,共58分。
15.填空。
(1)下列反应中,属于放热反应的是_____,属于吸热反应的是_____。(填序号)
①物质燃烧
②石灰石在高温下的分解反应
③酸碱中和反应
④二氧化碳通过炽热的炭
⑤食物因氧化而腐败
⑥与反应
⑦氧化钙与水反应
工业上用CO生产燃料甲醇,一定条件下发生反应:,反应过程中的能量变化情况如图所示。
(2)曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。该反应是_____(填“吸热”或“放热”)反应。
(3)推测反应是_____(填“吸热”或“放热”)反应。
(4)断开键、键、键分别需要吸收能量为436kJ、391kJ、946kJ,则与足量反应生成需_____(填“吸收”或“放出”)能量_____kJ。(小数点后保留两位数字)。
(5)与反应生成和氢气。在25℃、101kPa下,已知每消耗放热108kJ,写出该反应热化学方程式是_____。
16.若反应在密闭容器内达到化学平衡以后,升高温度或增大压强都会使平衡混合物中C的质量分数降低,那么:
(1)正反应是反应_________(填“吸热”或“放热”)。
(2)化学方程式中反应物与反应产物化学式前的系数关系是a+b_________c+d(填“>”“=”或“<”)。
(3)为了提高A的转化率,可以采用什么方法?
17.在一定条件下,反应达到化学平衡状态且其他条件不变时:
(1)如果升高温度,平衡混合物的颜色_________(填“变深”“变浅”或“不变”)。
(2)如果在容积固定的容器中加入一定量的氢气,化学平衡移动_________(填“向左”“向右”或“不变”)。
18.反应为可逆反应。
(1)该反应的化学平衡常数表达式为___________。
(2)增大压强(如压缩容器容积为原来的一半),平衡向正反应方向移动,请利用K、Q的关系说明理由:_____________。
参考答案
1.答案:C
解析:A.苹果显酸性,故胃酸过多不宜多吃苹果,A正确;
B.纯碱溶液的pH>9显碱性,故纯碱溶液可使酚酞溶液变红,B正确;
C.可将洁厕灵与84消毒液混用混合产生毒性氯气,C错误;
D.牛奶的pH大于酱油,故牛奶中的浓度比酱油中的小,D正确;
故选C。
2.答案:A
解析:A.铜和浓硫酸需要在加热条件下才能发生反应生成SO2,A符合题意;
B.生石灰和浓氨水反应生成氮气,B不符合题意;
C.碳酸氢钠和硫酸铝溶液会发生双水解反应生成氢氧化铁和二氧化碳,C不符合题意;
D.过氧化钠和水反应生成氢氧化钠和氧气,D不符合题意;
故选A。
3.答案:D
解析:A.某些吸热反应也可以自发进行,依据分析,常温下可以,如氢氧化钡晶体和氯化铵反应,是吸热反应,常温下可以自发进行,故A错误;
B.在101kPa时,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量叫作该物质的燃烧热,二氧化碳分解反应吸热,,B错误;
C.中和热是指在稀溶液中强酸和强碱发生中和反应生成1mol水所释放的热量,醋酸是弱酸,电离过程吸热,放热数值少,,C错误;
D.硫蒸汽的能量比固体硫的能量高,完全燃烧放出的热量更高,D正确;答案选D。
4.答案:A
解析:在相同温度下,条件下比条件下NO的平衡转化率高,根据反应特点可知,增大压强,平衡右移,NO的平衡转化率升高,故,A项正确;在相同压强下,升高温度,NO的平衡转化率降低,说明该反应的限度减小,B项错误;在条件下,NO的平衡转化率为,且NO和按化学方程式中的系数比投料,则二者的平衡转化率相等,C项错误;设容器的容积为1 L,起始时投入NO和的物质的量分别为,根据化学方程式,列“三段式”得:
平衡常数,D项错误。
5.答案:A
解析:题给装置(a)、(b)都是原电池,活泼金属做负极,被腐蚀,相对不活泼的金属做正极,被保护,A项正确;(a)中负极反应为,(b)中负极反应为,B项错误;(a)中电解质溶液显中性,正极反应为,而(b)中电解质溶液显酸性,正极反应为,C项错误;原电池中阳离子移向正极,故(a)中向铁电极方向移动,(b)中向铜电极方向移动,D项错误。
6.答案:D
解析:铁钉、石墨棒、食盐溶液构成原电池,因为食盐溶液显中性,所以发生铁的吸氧腐蚀,铁是负极,电极反应式为;石墨棒是正极,电极反应式为,总反应为,铁钉锈蚀,D项正确。
7.答案:D
解析:根据该电池的总反应可知,电极为正极,钙电极为负极,负极发生氧化反应,电极反应为,A项错误;放电过程中,阳离子向正极移动,即向电极移动,B项错误;正极得到电子发生还原反应生成Pb,即为正极反应物,C项错误;常温时,电解质不熔融,未形成闭合回路,不能构成原电池,检流计指针不偏转,D项正确。
8.答案:B
解析:时,反应吸收能量,时,反应释放能量,A项错误,B项正确;如果反应过程中体系没有做功,则,C项错误;在等压反应中,可能伴随着反应体系体积的改变而有体积功存在,因此反应热不一定等于反应体系内能的变化,D项错误。
9.答案:答案:C
解析:粗食盐水中加入过量氯化钡溶液,除去硫酸根离子;过滤后向滤液1中加入过量氢氧化钠溶液,除去镁离子;过滤后向滤液2中加入过量碳酸钠溶液,除去钙离子和过量的钡离子;过滤后向滤液3中加入盐酸,调pH,除去过量的氢氧根离子和过量的碳酸根离子,最后蒸发结晶,得到氯化钠固体。滤液2中主要有五种离子:、、、和,C符合题意,A、B、D不符合题意。
10.答案:D
解析:
11.答案:C
解析:①由题干方程式可知,B为液体,通常不用固体和液体的浓度改变来计算反应速率,①不合题意;
②由题干方程式可知,密闭容器中总压强一直改变,故总压强不变能够说明反应达到化学平衡,②符合题意;
③由题干方程式可知,密闭容器中混合气体的质量一直在变即混合气体的密度一直在变,则密闭容器中混合气体的密度不变,说明反应达到化学平衡了,③符合题意;
④由题干方程式可知,密闭容器中只有C、D两种气体,且物质的量始终保持3:4,则混合气体的平均相对分子质量始终保持不变,即混合气体的平均相对分子质量不变不能说明反应达到化学平衡,④不合题意;
⑤由题干方程式可知,反应过程中密闭容器中混合气体的总物质的量一直在改变,则密闭容器中混合气体的总物质的量不变,说明反应达到化学平衡,⑤符合题意;
⑥由题干方程式可知,密闭容器中只有C、D两种气体,且物质的量始终保持3:4,即密闭容器中C的体积分数始终保持不变,则密闭容器中C的体积分数不变不能说明反应达到化学平衡,⑥不合题意;
⑦已知反应热()是指1mol反应完全进行时的热效应,与反应的可逆与否和进行程度无关,则反应热()保持不变不能说明反应达到化学平衡,⑦不合题意;
综上分析可知,②③⑤符合题意,故答案为:C。
12.答案:D
解析:(阴离子)向阳极(b电极)移动,A正确;若将b电极的Pt换为Cu,由于Cu是活性电极,所以电极反应为,则总反应会发生变化,D错误。
13.答案:D
解析:A.铜丝或塑料的传热率都比玻璃大,会导致反应中的热量损失大,测量不准确引起误差,A错误;
B.泡沫板具有良好的隔热性能,除了起到支撑稳固仪器的作用,还有保温效果,减小实验误差,B错误;
C.数字温度计测量盐酸的温度后,如果不洗涤,直接测量溶液的温度,会因残留的盐酸与反应导致测量的溶液温度偏高产生误差,C错误;
D.在中和热的测定中,温度最大值就是恰好完全中和时放出的最大热量,此时计算的数据最准确,D正确;故答案为:D。
14.答案:B
解析:电合成时,能量转化形式是太阳能最终转化为化学能,A正确;
b极电极反应式为,B错误;
催化电极上反应为自由基机理,若向体系中加入自由基捕获剂,则得到的产物会减少,产率降低,C正确;
根据催化电极上电极反应可知,若法拉第效率为,通过4mol电子时,产生-二氯酮,D正确。
15.答案:(1)①③⑤⑦;②④⑥
(2)放热
(3)吸热
(4)放出;30.67
(5)+2+4(g)=-216kJ/mol
解析:(1)①物质燃烧放出热量,属于放热反应;②石灰石在高温下的分解反应需要吸收热量,属于吸热反应;③酸碱中和反应放出热量,为放热反应;④二氧化碳通过炽热的炭为吸热反应;⑤食物因氧化而腐败是缓慢氧化的过程,过程中放出热量,属于放热反应;⑥与反应吸收热量属于吸热反应;⑦氧化钙与水反应放出大量的热属于放热反应;综上,属于放热反应的是①③⑤⑦,属于吸热反应的是②④⑥。
(2)根据图像可知,该反应的生成物的总能量低于反应物的总能量,属于放热反应。
(3)由(1)可知,反应放热,则其逆反应吸热。
(4)已知断开1molH-H键、1molN-H键、1mol键分别需要吸收能量为436kJ、391kJ、946kJ,则生成1molN-H键需要释放391kJ能量,又,则与反应生,吸收的能量为,放出的能量为会,因此与足量反应生成放出能量782kJ-751.33kJ=30.67kJ。
(5)与反应生成和氢气,方程式为+2+4(g),已知每消耗0.5mol放热108kJ,则消耗1mol放热216kJ,热化学方程式为+2+4(g)=-216kJ/mol。
16.答案:(1)放热
(2)<
(3)增大B的浓度、减小C或D的浓度、降低温度、减小压强等。
解析:(1)升高温度,平衡混合物中C的质量分数降低,平衡向左移动,说明逆反应吸热,正反应放热。
(2)增大压强,平衡混合物中C的质量分数降低,平衡向左移动,说明逆反应是气态物质化学式前系数减小的反应,故a+b
17.答案:(1)变深
(2)向左
解析:(1)正反应吸热,升高温度,平衡向右移动,平衡混合物的颜色变深。(2)恒容条件下加入,反应产物的浓度增大,平衡向左移动。
18.答案:(1)
(2)增大压强,,平衡向化学方程式中气态物质化学式前系数减小的方向移动,即平衡向正反应方向移动
解析:(1)根据化学方程式,水是液态,不需要写入平衡常数表达式中,故。
(2)将容器容积压缩为原来的一半,则各物质的浓度增大为原来的2倍,则,平衡向化学方程式中气态物质化学式前系数减小的方向移动,即平衡向正反应方向移动。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
